乙酰化酶基因OsGCN5在调控水稻抗旱和根发育中的应用的制作方法
本发明属于植物基因工程技术领域。具体涉及乙酰化酶基因osgcn5在调控水稻抗旱和根的发育中的应用。乙酰转移酶基因osgcn5属于水稻gnat亚家族蛋白基因,申请人通过体外酶活的方法鉴定了该基因的酶活特性,利用转基因的方法对该基因在水稻抗旱中的功能(包括对水稻抗旱反应的调节和与干旱相关的根发育调控)进行了分析,并提出其在农业生产上潜在的应用价值。
背景技术:
表观遗传学是上世纪末逐渐兴起的一门学科,是研究与经典的孟德尔遗传学法则不相符合的生命现象中逐渐发展起来的。表观遗传学是指不依赖于dna改变的可遗传的变异(bonasioetal.,selectiverecognitionofmethylatedlysine9onhistoneh3bythehplchromodomain.nature,2001,410:120-124)。它的物质基础是dna缠绕着核小体八聚体形成的染色体空间结构,核小体八聚体分别为两个拷贝的组蛋白h3、h4、h2a和h2b组成,其中h3和h4蛋白的n端赖氨酸残基上可以进行多种甲基化和乙酰化等修饰(bhaumiketal.,covalentmodificationsofhistonesduringdevelopmentanddiseasepathogenesis,2007.natstructmolbiol,14(11):1008-1016),赖氨酸乙酰化修饰可以松弛核小体对dna的缠绕作用,进而有利于促进转录因子的结合而促进转录(zupkovitzetal.,negativeandpositiveregulationofgeneexpressionbymousehistonedeacetylase1.molcellbiol,2006,26(21):7913-7928.verdoneetal.,roleofhistoneacetylationinthecontrolofgeneexpression.biochemcellbiol,2005,83(3):344-353)。迄今为止,各种各样带有乙酰转移酶活性的蛋白被发现,其中包括gcn5、p/caf、esa1、cbp/p300和rtt109。其中gcn5蛋白属于gnat亚家族(gcn5相关的n端乙酰转移酶亚家族),是一类广谱的乙酰化酶,可以乙酰化h3k9、h3k14、h3k27等多个位点(patricketal.,expandedlysineacetylationspecificityofgcn5innativecomplexes.thejournalofbiologicalchemistry,1999,274:5895-5900)。在后续的研究过程中,人们逐渐发现组蛋白乙酰化酶不仅可以修饰组蛋白也可以修饰非组蛋白,例如酵母中发现gcn5可以调控转录因子ifh1的乙酰化水平进而调控其对基因表达的调控(downeyetal.,gcn5andsirtuinsregulateacetylationoftheribosomalproteintranscriptionfactorifh1.currentbiology,2013,23:1638-1648)。这说明gcn5具有除组蛋白外的更广泛的乙酰化活性功能。除此之外,gcn5还参与了转录起始复合物的形成,其乙酰化作用可以松弛转录起始位点dna和核小体的缠绕作用,使rnapolⅱ复合物(rna聚合酶复合物)更容易结合在dna上从而促进转录(featherstone,coactivatorsintranscriptioninitiation:hereareyourorders.curropingenetdev.2002,12(2):149-155)。目前为止,人们对于拟南芥中gcn5基因的生物学功能已经进行了广泛地研究。gcn5突变体植株地下地上部分的生长均变弱,花器官发育异常(vlachonasiosetal.,disruptionmutationsofada2bandgcn5transcriptionaladaptorgenesdramaticallyaffectarabidopsisgrowth,development,andgeneexpression.plantcell,2003,15:626-638)。同年bertrandetal.(bertrandetal.,arabidopsishistoneacetyltransferaseatgcn5regulatesthefloralmeristemactivitythroughthewuschel/agamouspathway.thejounalofbiologicalchemistry,2003,278:28246-28251)的研究结果进一步表明atgcn5可以通过wuschel/agamous途径调控花器官的发育。atgcn5通过plt途径调控拟南芥根干细胞的多少,从而影响根发育(kornetetal.,membersofthegcn5histoneacetyltransferasecomplexregulateplethora-mediatedrootstemcellnichemaintenanceandtransitamplifyingcellproliferationinarabidopsis.plantcell,2009,21(4):1070-1079)。atgcn5还可以和开花途径中的hd1、taf1/haf2相互作用影响拟南芥光应答基因的表达(benhamedetal.,arabidopsisgcn5,hd1,andtaf1/haf2interacttoregulatehistoneacetylationrequiredforlight-responsivegeneexpression.plantcell,2006,18:2893-2903)。所有这些结果都表明gcn5参与了拟南芥各个发育时期和环境的应答反应过程中,具有非常广泛的生物学功能。
水稻(oryzasatival.)作为人类主要的粮食作物之一,其产量不仅与生长发育相关而且与在发育过程中应对各种逆境的能力相关。逆境分为生物逆境和非生物逆境,其中非生物逆境包括如干旱、高温、低温、盐胁迫等。其中干旱是威胁水稻产量的主要因素之一。在长期的进化过程中水稻进化出了一套自己的干旱应答反应机制,其中包括由信号分子介导的干旱信号传导、逆境相关基因的激活和各种功能蛋白合成等。其中已经鉴定到的参加干旱反应的蛋白主要包括:分子伴侣、渗透压调节蛋白(tamuraetal.,osmoticstresstoleranceoftransgenictobaccoexpressingageneencodingamembrane-locatedreceptor-likeproteinfromtobaccoplants.plantphysiol,2003,131:454-462)、离子通道(wardetal.,calcium-activatedk+channelsandcalcium-inducedcalciumreleasebyslowvacuolarionchannelsinguardcellvacuolesimplicatedinthecontrolofstomatalclosure.plantcell,1994,6:669-683)、转运蛋白(kleinetal.,disruptionofatmrp4,aguardcellplasmamembraneabcc-typeabctransporter,leadstoderegulationofstomatalopeningandincreaseddroughtsusceptibility.plantjournal,2004,39:219-236)和抗氧化或细胞解毒蛋白(bartelsetal.,targetingdetoxificationpathways:anefficientapproachtoobtainplantswithmultiplestresstolerance.trendsplantsci,2001,6:284-286)。在水稻遭受逆境胁迫时细胞内会产生大量的活性氧(reactiveoxygenspecies,ros)而对细胞机能造成负面影响,ros清除蛋白在这个过程中发挥了重要作用,其中过氧化物酶(prx)和谷胱甘肽s基转移酶(gstu)是参与这个过程的重要酶类(rezaeietal.,glutathiones-transferase(gst)familyinbarley:identificationofmembers,enzymeactivity,andgeneexpressionpattern.jplantphysiol,2013,170(14):1277-1284.shankeretal.,droughtstressresponsesincrops.functintegrgenomics,2014,14(1):11-22)。而这些下游基因的应答反应绝大部分是受到特异性转录因子调控的。其中bzip是一类由基本氨基酸构成核心区域毗邻一个亮氨酸拉链的而构成的一类转录因子家族,它通过识别aba应答原件参与到了aba介导的基因表达调控过程中。据报道,水稻中osbzip46参与了水稻的抗旱反应,超表达该基因水稻表现出干旱敏感的表型(tangetal.,constitutiveactivationoftranscriptionfactorosbzip46improvesdroughttoleranceinrice.plantphysiology,2012,158:1755-1768)。同时osbzip23同时参与了水稻的抗盐和抗旱反应(xiangetal.,characterizationofosbzip23asakeyplayerofthebasicleucinezippertranscriptionfactorfamilyforconferringabscisicacidsensitivityandsalinityanddroughttoleranceinrice.plantphysiology,2008,148:1938-1952)。abi是另外一类受aba诱导并参与逆境应答的转录因子家族。
表观修饰作为一种新型的基因调控机制,也参与到了逆境应答反应当中,拟南芥已经报道多种与表观相关的酶参与植物的逆境反应。ros1作为一种全新的dna去甲基化酶是在刷选调控激活rd29a启动子(一个拟南芥逆境应答基因的启动子)的实验中被刷选出来的,即ros1可以去除rd29a基因启动子上面的dna甲基化进而促进下游该基因的表达,ros1突变体表现出对双氧水的敏感效应(gongetal.,ros1,arepressoroftranscriptionalgenesilencinginarabidopsis,encodesadnaglycosylase/lyase.cell,2002,111(6):803-814)。hda9作为一个组蛋白去乙酰化酶参与了拟南芥盐胁迫和旱胁迫中基因沉默效应(zhengetal.,histonedeacetylasehda9negativelyregulatessaltanddroughtstressresponsivenessinarabidopsis.jexpbot,2016)。拟南芥中的gcn5复合物和冷诱导转录因子cbf1互作,同时根据vlachonasiosetal.(vlachonasiosetal.,disruptionmutationsofada2bandgcn5transcriptionaladaptorgenesdramaticallyaffectarabidopsisgrowth,development,andgeneexpression.plantcell,2003,15:626-638)的研究表明gcn5和ada2b的突变体中cor基因在冷诱导过程中上调表达相较于野生型要慢。这些结果说明了gcn5可能直接参与调控了冷应答基因的表达。
作为粮食作物和对干旱特别敏感的水稻中,表观修饰特别是乙酰化修饰是如何参与到干旱响应过程中的目前报道还很少。我们利用水稻数据库(http://rice.plantbiology.msu.edu/index.shtml)筛选到了与拟南芥atgcn5同源的基因,命名为osgcn5,并利用该数据库中提供的信息在水稻的cdna中扩增到了该基因的全长序列。构建酵母表达载体表达了该基因的全长蛋白,体外酶活显示该蛋白是一个广谱的乙酰化酶基因,利用转基因的方法我们获得了该基因的抑制表达材料,并发现该基因抑制表达后降低了水稻的抗旱能力,失水率相较于野生型有所提高。rt-pcr的结果显示该基因的下降会影响部分逆境应答基因的表达,同时对抑制表达材料的形态学进一步观察后发现其冠根的数目显著下降。以上结果表明osgcn5可以同时通过调控逆境响应基因的表达和水稻根的发育来影响水稻的抗旱反应。
技术实现要素:
本发明的目的在于克服现有技术的缺陷,提供一种乙酰化酶基因osgcn5在调控水稻抗旱和根发育中的应用,即鉴定一个参与水稻抗旱反应和根(例如冠根)发育的广谱乙酰化酶基因osgcn5并分析了其在水稻生产上的应用价值。osgcn5基因是一个广谱乙酰化酶基因,在各个组织中均有表达,抑制该基因的表达后植株表现出对干旱敏感和冠根(crownroot,cr)数目变少的表型;分子生物学的结果表明该基因参与调控了部分抗旱基因的表达。
本发明通过以下技术方案实现:
从水稻数据库(http://rice.plantbiology.msu.edu/index.shtml)筛选与拟南芥atgcn5同源的水稻基因(利用蛋白质序列同源比对),我们将该个基因命名为osgcn5,其核苷酸序列为seqidno:1所示,序列长度为1536bp;其中序列的1-1536位也是其编码区(即cds),共编码511个氨基酸,其蛋白质序列如seqidno:2所示。
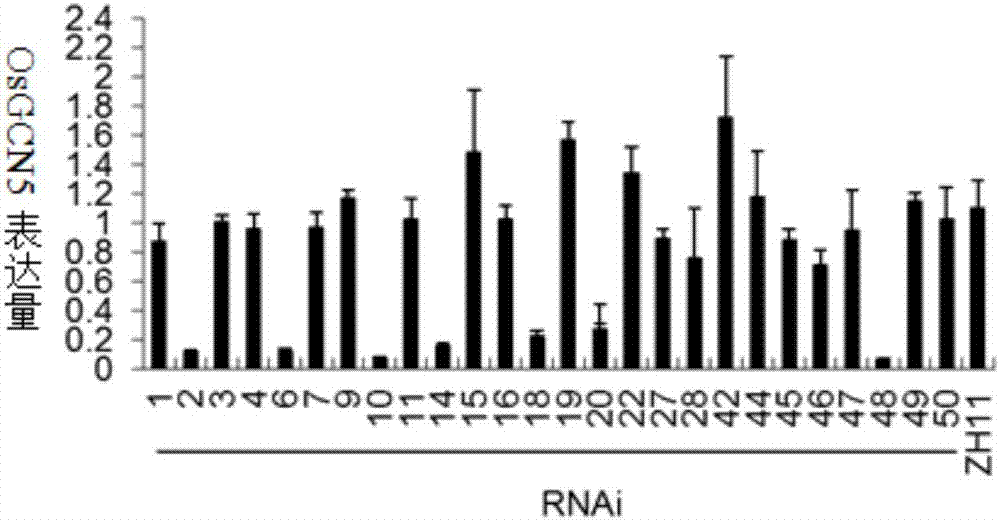
扩增了该蛋白的两个结构域(乙酰化功能结构域和bromodomain结构域)之间的一段非保守的区域,连接到抑制特异基因表达的载体pds1301(图1)上,然后转化水稻粳稻品种中花11,得到转基因水稻抑制材料,提取转基因家系mrna,并反转录成cdna后检测osgcn5在各个家系中的表达量,发现7个转基因家系中osgcn5的表达量被明显抑制了(图2)。利用水稻叶片cdna扩增获得osgcn5的全长cdna,并将其克隆到pgex6p-1的载体上(图3),电转化大肠杆菌蛋白原核表达菌株,用iptg诱导表达osgcn5-gst的融合蛋白。并利用gstbeads纯化,获得纯化后的gst蛋白和osgcn5-gst的融合蛋白(图3)。利用体外酶活体系将osgcn5-gst融合蛋白和组蛋白h3或h4进行孵育反应,并利用westernblot技术用各种乙酰化抗体进行杂交,结果发现osgcn5可以直接乙酰化h3的k9、k27、k4、k14和h4的k5等位点(图4),进一步证明了osgcn5是一个广谱乙酰化酶。同时用水稻不同时期组织材料的rna进行反转录,通过qrt-pcr的方法检测osgcn5基因表达的组织特异性,结果表明osgcn5在各个组织中均有表达(图5)。将获得的osgcn5rnai家系和对照野生型中花11进行小红桶干旱处理(植株生长到一个月时状态一致时处理),发现osgcn5rnai家系表现出干旱敏感的表型(图6a),通过失水率实验发现osgcn5rnai家系失水速率更快(图6b)。同时取干旱处理7天的叶片,抽提mrna并进行反转录,利用qrt-pcr的方法检测逆境应答相关基因的表达,结果发现部分逆境应答基因在osgcn5rnai家系中表达量明显地下降了(图7)。研究表明根在植物抗旱反应起到了非常重要的作用(janiaketal.,geneexpressionregulationinrootsunderdrought.2015,jexpbot,67(4):1003-1014),于是我们对osgcn5rnai各家系和野生型中花11材料中根的表型进行了进一步观察统计,结果发现osgcn5表达量被抑制后,转基因植株冠根的数目和根长均显著地减少(图8)。以上结果说明osgcn5基因可能同时通过影响水稻根的数目和逆境相关基因的表达来参与水稻的抗旱反应。
可以归纳的本发明的发明要点如下:
1、广谱乙酰化酶基因osgcn5在调控水稻抗旱反应中的应用,该基因的核苷酸序列如seqidno:1所示。
2、osgcn5基因的应用方式为:其编码的蛋白质中的乙酰化酶酶活通过正调控下游基因的表达,在水稻叶片抗旱逆境响应过程中正向调控了部分逆境应答基因的表达,进而促进水稻的抗旱反应。
3、广谱乙酰化酶基因osgcn5在调控水稻根发育过程中的应用,该基因的核苷酸序列如seqidno:1所示,该基因编码的蛋白质为一个广谱乙酰化酶,通过正向调控水稻根的发育。
4、所述的正向调控水稻根的发育包括水稻冠根数目和根长度调控的应用。
本发明的具体操作步骤如下:
(1)通过在ricegenome网站(http://rice.plantbiology.msu.edu/index.shtml)查找与拟南芥atgcn5基因同源的水稻的osgcn5基因(loc_os10g28040)。根据网站公布的序列设计相关载体的引物,以水稻叶片cdna为模板,扩增其全长cdna序列(翻译起始位点至下游1536个碱基),测序发现我们扩增到的cdna序列与上述网站公布cdna序列完全一致,如seqidno:1所示。扩增所用引物序列如下:
osgcn5-f:5’-ggggtaccatggacgggctcgcggcgcc-3’,
osgcn5-r:5’-cgggatcctcagttcttcgttgaggcttgggc-3’
(2)根据osgcn5基因序列信息,利用smart网站(http://smart.embl-heidelberg.de/)分析其蛋白质序列(seqidno:2),发现该蛋白序列存在两个保守的结构域,分别为乙酰化功能结构域(211位氨基酸到287位氨基酸)和bromodomain结构域(396位氨基酸到505位氨基酸),在两个保守结构域中间的序列是该基因的特异序列,据此我们设计双链抑制引物(dsrnai引物),并利用步骤1)中的全长cdna为模板,通过pcr扩增得到双链抑制区段特异的dna,扩增序列如seqidno:3所示,扩增所用的引物序列如下:
osgcn5-rnai-f:5’-gggactagtggtaccggacaaagaaagatggcaagg-3’,
osgcn5-rnai-r:5’-ggggagctcggatccgttgcctgtaagtactgtaatcagg-3’
(3)将步骤2)中扩增得到的片段用限制性内切酶酶切并连接载体的方法将双链抑制区段dna构建到载体pds1301上,获得转化载体osgcn5-pds1301。利用农杆菌(eha105)介导的转基因方法(hieiet.al.,1994.efficienttransformationofrice(oryzasatival.)mediatedbyagrobacteriumandsequenceanalysisoftheboundariesofthet-dna.plantjournal.6:271-282)将所述的转化载体osgcn5-pds1301导入水稻受体品种中花11,获得转化植株osgcn5-rnai(将转化植株依次命名为osgcn5-rnai-n,n=0,1,2,3……)。
(4)抽提转基因各个家系的基因组dna并利用pcr方法检测阳性植株;然后抽提阳性植株的mrna,反转录成cdna,利用荧光定量pcr的方法检测各个家系中osgcn5基因的表达量,获得osgcn5被抑制表达的转基因植株。
(5)以步骤(1)中涉及的osgcn5基因的全长cdna为模板扩增osgcn5的全长dna并构建到pgex-6p载体上(gehealthcarelifescience),获得osgcn5-pgex-6p载体,电转化表达菌株bl21并表达osgcn5-gst融合蛋白。利用gstbeads(glutathionesepharose4fastflow,gehealthcare,17-5132-01)纯化回收表达的蛋白质(包括gst蛋白和osgcn5-gst融合蛋白),sds-page蛋白胶跑胶检测。构建该载体所用的扩增引物序列如下:
osgcn5-6p-f:5’-ggatccatggacgggctcgcggc-3’,
osgcn5-6p-r:5’-gtcgacctcagttcttcgttgaggcttgg-3’
(6)利用步骤(5)中纯化回收的osgcn5-gst融合蛋白和组蛋白h3或h4进行孵育反应(gst蛋白为对照),利用westernblot技术检测反应后的组蛋白上的各种乙酰化修饰。
(7)抽提水稻各个组织部位的rna,反转录成cdna,利用荧光定量pcr检测osgcn5在各个组织中的表达量。
(8)将osgcn5各抑制家系和野生型对照中花11种植在小红桶中,生长到一个月时进行干旱处理,并观察表型。干旱处理7天后,取osgcn5抑制家系和野生型的叶片,抽提mrna,反转录成cdna,利用荧光定量pcr检测逆境应答相关基因在两种材料中的表达量。
(9)在含有生根培养基的方皿上发芽osgcn5各抑制家系和野生型对照中花11,观察其根部表型并进行统计分析。
与现有技术相比,本发明具有如下优点:
水稻是人类的主要粮食作物之一,对保障粮食安全起到了非常重要的作用。如何提高水稻产量和品质是一项重要的科学问题。然而相对缺乏的淡水资源往往严重影响了水稻的产量,随着我国人口持续增长,水资源紧缺将成为现阶段粮食安全的瓶颈。而解决这一问题的一个重要途径就是改良水稻的抗旱性(都浩,水稻中激素和肌醇磷酸代谢相关基因的抗逆功能研究,2013,华中农业大学博士学位论文)。水稻在抗旱方面的机制研究已经比较多,但乙酰化酶介导的组蛋白乙酰化是如何参与水稻的抗旱反应的还不是很清楚。本发明中所涉及到的广谱乙酰化酶基因osgcn5,发现其在水稻的逆境应答中起到了非常重要的作用。本发明通过体外酶活实验证明osgcn5是一个广谱乙酰化酶(图3、图4)。遗传转化该基因双链抑制rnai载体,获得相应的转基因植株。干旱逆境处理发现,抑制该基因的表达后水稻的抗旱性明显减弱,荧光定量检测发现部分抗旱基因的表达在转基因植株中受到了影响(图7),说明gcn5蛋白影响了部分抗旱基因的表达。同时通过发芽表型观察发现osgcn5抑制材料冠根数目变少(图8)。以上结果说明gcn5蛋白可能同时通过影响水稻根的数目和逆境基因的表达来影响水稻的抗旱反应。
对本发明的详细描述参见《具体实施方式》内容。
附图说明
序列表seqidno:1是本发明克隆的广谱乙酰化酶基因osgcn5的核苷酸序列。序列长度为1536bp(含结尾处的终止密码子tga),编码511个氨基酸。
序列表seqidno:2是广谱乙酰化酶基因osgcn5的蛋白质序列。
序列表seqidno:3是本发明构建的的双链抑制rnai载体(或称之为转化载体osgcn5-pds1301)的核苷酸序列。序列长度为329bp。
图1:是本发明的转化载体osgcn5-rnai(或称之为转化载体osgcn5-pds1301)构建示意图。其中上图为该转基因植株所用抑制表达载体pds1301的结构示意图,下图为该基因被抑制的特异片段位置示意图(抑制区段位置:876-1204bp,黄色方框标注)。
图2:转基因植株osgcn5-rnai阳性家系中osgcn5表达量检测。纵坐标为相对于actin(水稻内的一个表达量非常稳定的激动蛋白基因,登录号为loc_os11g06390)的相对表达量值。
图3:osgcn5-gst融合蛋白表达。图3a是本发明所用的表达载体pgex-6p的图谱。图3b左边为大肠杆菌表达osgcn5-gst融合蛋白sds-page蛋白胶检测图。附图标记说明:从左至右泳道分别为诱导表达0小时、1小时、3小时、5小时大肠杆菌取样样品和超声波处理后沉淀和上清样品,“*”指示融合蛋白表达出来的位置。图3b右边为gstbeads(glutathionesepharose4fastflow,gehealthcare,17-5132-01)纯化回收表达的蛋白质sds-page蛋白胶检测图。
图4:osgcn5体外酶活试验结果。用westernblot检测和osgcn5-gst融合蛋白孵育后的组蛋白h3和h4多种乙酰化修饰状态,gst蛋白孵育作为对照。试验重复两次。
图5:osgcn5基因在根(发芽10天苗)、幼茎(正在伸长茎杆)、幼苗(发芽5天)、幼穗(0.2cm-1cm)、叶片(2个月水稻成熟叶)中mrna水平表达量检测结果。附图标记说明:纵坐标为相对于actin的表达量。
图6:osgcn5-rnai材料和野生型材料干旱处理及干旱应答基因检测。图6a为小红桶干旱处理试验,分别为处理前和干旱处理14天后复水一个星期表型。图6b为各材料失水速率调查统计结果。
图7:osgcn5-rnai材料和野生型材料干旱处理7天叶片中干旱应答基因在osgcn5-rnai材料和野生型中相对表达量检测。
图8:osgcn5-rnai材料和野生型材料初生根(pr),冠根(cr)和地上部分的形态学差异。附图标记说明:图8中的左图为形态学观察照片,图8中的右图为试验统计数据。
具体实施方式
实施例1:osgcn5基因的克隆
本发明的基因osgcn5的克隆(登陆号loc_os10g28040)主要通过rt-pcr(反转录产物pcr扩增)的方法获得(方法参见:j.萨姆布鲁克,ef弗里奇,t曼尼阿蒂斯著,黄培堂,王嘉玺等译,分子克隆实验指南(第三版),北京,科学出版社,2002版)。具体操作步骤如下:
(1)抽提水稻品种“中花11”(中国农业科学院作物科学研究所)成熟叶片mrna,mrna抽提后用invitrogen公司的trizol抽提试剂盒(具体操作步骤见该试剂盒的说明书);
(2)rt-pcr反转录合成cdna第一链的步骤如下:①配制混合液1:抽提的总rna4μg,dnasei1μl(2u/μl),10×dnaseibuffer1μl,加不含rna酶的双蒸水(0.01%depc处理过的双蒸水,depc又名焦碳酸二乙酯,rna酶的强烈抑制剂)3μl,混匀后将混合液1在37℃放置15分钟以除去dna,②15分钟后将混合液1置于65℃水浴中温浴变性10分钟以使dnasei失活,然后置于冰上5分钟,③向混合液1中分别加入1μl500μg/ml的oligo(dt)和1μl10mm/l的dntp的并充分混匀,④将混合液1立即置于65℃水浴中温浴10分钟,然后置于冰上5分钟,使mrna彻底变性并让oligo(dt)结合在mrna3’末端,⑤配制混合液2:5×firststrandbuffer4μl,0.1mdtt(巯基乙醇)2μl,rrⅰ,反转录酶ssⅲ1μl,混匀后将混合液2置于42℃水浴锅内温浴1.5小时,⑥反应结束后将混合液2置于90℃干浴10分钟变性,⑦-20℃保存最终反应产物,反应中用到的试剂全部购自于invitrogen公司。
(3)然后根据ricegenome数据库(http://rice.plantbiology.msu.edu/index.shtml)提供的osgcn5基因的全长cdna序列设计引物利用pcr扩增全长。pcr体系具体为:反转录cdna产物1μl,10×pcrbuffer2μl,10mm/ldntp2μl,正向引物(f)和反向引物(r)各0.4μl,la-taq酶0.2μl,补双蒸水12μl(所用到的pcrbuffer、dntp、taq酶等均购自takara公司)。pcr反应程序如下:①94℃5分钟,②94℃30秒,③56℃30秒,④72℃120秒,⑤从②-④循环30次,⑥72℃7分钟,⑦4℃保存。用来克隆osgcn5全长的引物为:
osgcn5-f:5’-ggggtaccatggacgggctcgcggcgcc-3’,
osgcn5-r:5’-cgggatcctcagttcttcgttgaggcttgggc-3’
最终扩增得到的osgcn5全长连接
t7:5’-attatgctgagtgatatccc-3’,
sp6:5’-taaatccactgtgatatctt-3’,
实施例2:双链抑制dsrnai载体的构建
根据ricegenome数据库(http://rice.plantbiology.msu.edu/index.shtml)公布的osgcn5基因的全长cdna序列,利用smart网站(http://smart.embl-heidelberg.de/)分析其编码的蛋白质序列(seqidno:2)存在两个保守的结构域,分别为乙酰化功能结构域(211位氨基酸到287位氨基酸)和bromodomain结构域(396位氨基酸到505位氨基酸),在两个保守结构域中间非保守区域设计双链抑制引物(dsrnai引物),并利用实施例1中克隆到的基因全长为模板pcr扩增得到双链抑制区段dna,设计引物时在上游引物5’端添加spei和kpni限制性内切酶位点,在下游引物5’端依序添加saci和bamhi限制性内切酶位点。pcr扩增出该目的序列后,扩增产物通过t/a克隆连接到
(1)将带有osgcn5的rnai片段的t/a克隆质粒用kpni和bamhi限制性内切酶酶切,回收目标条带,与经kpni和bamhi酶切的载体质粒pds1301(由华中农业大学作物遗传改良国家重点实验室已毕业博士储昭辉改造而成;该质粒的图谱见图1;参见文献:chu等,promotermutationsofanessentialgeneforpollendevelopmentresultindiseaseresistanceinrice.genesdevelopment,2006,20:1250-1255.)进行16℃、6小时连接反应(所使用的内切酶均购于宝生物工程大连有限公司,按照该公司提供的产品说明书操作;连接酶购自promega公司);
(2)将连接产物电转化大肠杆菌(dh10b菌株)感受态中,并挑取单克隆进行后续的测序验证,获得pds1301连有第一链的克隆质粒。
(3)用spei和saci酶切相同的带有osgcn5的rnai片段的克隆质粒,并利用spei和saci酶切2)中构建好的载体,利用上述连接反应连接外源片段和载体、转化到大肠杆菌感受态中用载体引物测序验证。用来构建双链抑制dsrnai载体的引物为:
osgcn5-rnai-f:5’-gggactagtggtaccggacaaagaaagatggcaagg-3’,
osgcn5-rnai-r:5’-ggggagctcggatccgttgcctgtaagtactgtaatcagg-3’
最终得到的osgcn5基因双链抑制rnai载体(或称之为表达载体osgcn5-pds1301)。
实施例3.osgcn5体外酶活验证
(1)以实施例1中涉及的osgcn5全长载体为模板设计引物并扩增osgcn5基因全长,左端引物(osgcn5-6p-f)和右端引物(osgcn5-6p-r)的5’端分别添加bamhi和sali酶切位点,扩增片段连接
osgcn5-6p-f:5’-ggatccatggacgggctcgcggc-3’,
osgcn5-6p-r:5’-gtcgacctcagttcttcgttgaggcttgg-3’
(2)将构建好的osgcn5-pgex-6p载体利用电转化将其导入到大肠杆菌表达菌株(bl21菌株)中,挑选单克隆,扩大培养,当菌株摇到od值=0.5时加入iptg(异丙基硫代半乳糖苷,上海生工
(3)将步骤(2)表达的上清利用gstbeads(glutathionesepharose4fastflow,gehealthcare,17-5132-01)进行纯化回收,具体步骤如下:将gstbeads用缓冲液洗两天,500g离心去上清,加入2)中上清液,beads和上清混匀4℃过夜,500g离心去上清,利用缓冲液重悬beads,混匀4℃摇10分钟,离心去上清,如此清洗6遍。将上清去尽。加100μlgst溶解缓冲液(15.366mg-30.732mgglutathionereduced(上海生工
(4)利用步骤(3)中纯化回收的蛋白,和组蛋白h3或h4进行孵育反应,并利用westernblot技术检测组蛋白乙酰化修饰状态(方法参考:tieetal.,2009.cbp-mediatedacetylationofhistoneh3lysine27antagonizesdrosophilapolycombsilending.development.136(18):3131-3141)。孵育反应如下:40mm/ltris-hclph=8.0,0.1m/lnacl,10%glycerol,0.1mm/ledta,1mm/ldtt,1mm/lpmsf,5mm/l丁酸钠,0.1mm/lacetyl-coa(sigma公司),10μl组蛋白h3或h4(sigma公司)。30℃孵育4小时。westernblot技术如下:转膜使用bio-rad公司的minitrans-blotcell转印槽系统,按照其说明书,将组蛋白转至amersham公司的hybond-ppvdf膜上,含有2%小牛血清蛋白(bsa)的pbs缓冲液(nacl137mmol/l,kcl2.7mmol/l,na2hpo44.3mmol/l,kh2po41.4mmol/l,ph7.5)室温进行封闭2小时,以体积比1:10000加入不同的抗体(如后所示)室温孵育1.5个小时左右。所用抗体分别为:h3(ab1791,abcom公司)、h3k9ace(07-352,millipore公司)、h3k27ace(07-360,millipore公司)、h3k4ace(07-539,millipore公司)、h3k14ace(04-1044,millipore公司)、h4k16ace(07-329,millipore公司)、h4k5ace(04-118,millipore公司)、h4(ab70701,abcom公司)。将一抗溶液回收,用pbs缓冲液洗膜六次,每次10分钟,再加入按体积比1:10000稀释的hrp标记的羊抗兔二抗或抗鼠二抗(购自southernbiotech公司,得博生物科技有限公司(北京)代理),室温孵育1.5小时,然后用pbs缓冲液洗膜六次,每次10分钟,使用supersingnalpico(购自pierce公司)试剂盒按说明书操作方法进行x光片显影,并用扫描仪记录图片。结果图4所示,说明osgcn5可以直接乙酰化h3k9、k27、k4、k14和h4k5等位点,为一个广谱的乙酰化酶。
实施例4.osgcn5在调控水稻抗旱反应中的功能验证
1、双元ti质粒载体的转化及转基因植株阳性和表达量检测:
(1)用实施例2中获得的转化载体pds1301-osgcn5转化水稻受体品种“中花11”,转化方法按照华中农业大学作物遗传改良国家重点实验室的标准方法(例如:专利号zl2011100940899,发明的名称:组蛋白去甲基化酶基因osj5在提高水稻抗性中的应用;专利公开号:cn102732535;专利授权日:2013年08月28日的专利文献)进行。所获得的t0代转基因植株命名为osgcn5-rnai(依次命名为osgcn5-rnai-n,n=0,1,2,3……)。
(2)取田间种植的t0代转化植株叶片并抽提总dna。dna抽提方法为ctab法(zhang等,geneticdiversityanddifferentiationofindicaanjaponicaricedetectedbyrflpanalysis,1992,theoreticalandappliedgenetics,83,495-499)。用pcr方法对双链抑制t0代转化植株用载体第二链引物(pmcg2f和pmcg2r)进行阳性检测。所用pcr载体引物如下:
pmcg2f:5’-ggctcaccaaaccttaaacaa-3’,
pmcg2r:5’-ctgagctacacatgctcaggtt-3’。
(以上引物均由上海生工
pcr反应体系配方为:模板2μl(约100ng),10×pcrbuffer2μl,10mm/ldntp2μl,正向引物(pmcg2f)和反向引物(pmcg2r)各0.4μl,r-taq酶0.2μl,补双蒸水12μl(所用到的pcrbuffer、dntp、taq酶等均购自takara公司)。pcr反应条件如下:①94℃4分钟,②94℃30秒,③56℃30秒,④72℃1分钟,⑤从②-④循环32次,⑥72℃7分钟,⑦4℃保存。pcr产物在1%(质量/体积)的tbe琼脂糖凝胶上电泳检测。载体第二链引物(pmcg2f和pmcg2r)扩增片段为转基因植株特有,野生型植株中扩增不出相应片段。对t0代阳性植株收种子(称为t1代),为t1代的植株性状调查做准备。(3)为了检测pds1301-osgcn5转基因植株中目标基因的表达量,申请人通过荧光定量pcr的方法对转基因t0代植株进行了表达分析。抽提t0代转基因阳性植株的总mrna并进行反转录,抽提用试剂为invitrogen公司的trizol抽提试剂盒(按试剂盒说明书操作),rt-pcr中反转录合成cdna第一链的步骤如下:
①配制混合液1:抽提的总rna4μg,dnasei1μl(2u/μl),10×dnaseibuffer1μl,加不含rna酶的双蒸水(0.01%depc处理过的双蒸水,depc又名焦碳酸二乙酯,rna酶的强烈抑制剂)3μl,混匀后将混合液1在37℃放置15分钟以除去dna;
②15分钟后将混合液1置于65℃水浴中温浴变性10分钟以使dnasei失活,然后置于冰上5分钟;
③向混合液1中分别加入1μl500μg/ml的oligo(dt)和1μl10mm/l的dntp的并充分混匀;
④将混合液1立即置于65℃水浴中温浴10分钟,然后置于冰上5分钟,使mrna彻底变性并让oligo(dt)结合在mrna3’末端;
⑤配制混合液2:5×firststrandbuffer4μl,0.1mdtt(巯基乙醇)2μl,rrⅰ,反转录酶mlv1μl,混匀后将混合液2置于42℃水浴锅内温浴1.5小时;
⑥反应结束后将混合液2置于90℃干浴10分钟变性;
⑦-20℃保存最终反应产物,反应中用到的试剂全部购自于invitrogen公司。
得到产物后用实时荧光定量pcr的方法检测osgcn5的表达量。试剂购自宝生物工程大连有限公司,反应体系参见说明书。pcr仪为美国abi公司的7500,pcr参数为95℃预变性10秒,进入循环后95℃变性5秒,60℃退火延伸40秒,45个循环。real-timepcr所用引物序列为:
osgcn5realtime-f:5'-cagataacaatgccgttggct-3’
osgcn5realtime-r:5'-tgacgcctaatcatcgttgc-3’
osgcn5表达量结果整理如图2所示,其中osgcn5基因表达量抑制比较好的家系为2、6、10、14、18、20、48。
2、t2代转基因植株性状调查和表达分析:
(1)osgcn5基因在不同组织部位的表达
对水稻品种中花11的不同组织部分进行取材,并利用invitrogen公司的trizol抽提试剂盒(具体操作步骤见该试剂盒的说明书)抽提mrna,反转录后利用荧光定量pcr检测osgcn5基因在根根(发芽10天苗)、幼茎(正在伸长茎杆)、幼苗(发芽5天)、幼穗(0.2cm-1cm)、叶片(2个月水稻成熟叶)中的表达量,结果如图5所示。由图可知
分别取水稻品种中花11不同生长时期的不同组织,用invitrogen公司的trizol抽提试剂盒(具体操作步骤见该试剂盒的说明书)抽提rna,反转录后用荧光定量pcr仪检测osgcn5基因在根(发芽10天苗)、幼茎(正在伸长茎杆)、幼苗(发芽5天)、幼穗(0.2cm-1cm)、叶片(2个月水稻成熟叶)中的表达量,结果如图5,由图可知,该基因各个组织和器官中均有表达,但是在叶片组织中表达量最高,这说明osgcn5是一个组织器官组成性表达的基因。
(2)osgcn5基因在水稻抗逆中的作用检测
将发芽10天的osgcn5各抑制家系和野生型对照中花11种植在小红桶中(一半种植osgcn5抑制家系;一半种植野生型中花11),当二者生长到一个月时,水稻植株大小和生长状态基本一致。将桶中明水倒掉并保持持续不浇水的状态使土壤慢慢失去水分,干旱处理14天后植株出现非常明显的干旱表型,主要表现为叶片卷曲并慢慢枯萎,此时开始复水让植株重新获得水分并观察表型(小红桶干旱试验参照:tangetal.,constitutiveactivationoftranscriptionfactorosbzip46improvesdroughttoleranceinrice,2012,plantphysiology,155,1755-1768.),如图6a所示。为了进一步确认上述观察表型,我们取同样条件下生长一个月的osgcn5抑制家系和野生型中花11为对照材料,测试离体叶片失水率。具体做法:将一个月水稻植株的叶片用剪刀于基部剪下,并立即称取鲜重(g0h),然后每隔一个小时称取材料重量(gxh),x小时对应的失水率为(gxh-g0h)/g0h(方法参考:tangetal.,constitutiveactivationoftranscriptionfactorosbzip46improvesdroughttoleranceinrice.plantphysiology,2012,158:1755-1768)。结果统计如图6b所示,osgcn5抑制家系失水效率高于对照野生型中花11。同时为了寻找osgcn5可能影响的下游基因,我们取干旱处理7天后的osgcn5抑制家系和野生型中花11的叶片,抽提mrna,反转录成cdna,利用荧光定量pcr检测逆境应答基因在两种材料中的表达量,发现部分逆境应答基因如过氧化物酶(prx)和谷胱甘肽s基转移酶(gstu)等参与逆境ros(活性氧)清除的基因和部分与逆境相关的转录因子基因如abi和bzip类基因在osgcn5抑制家系相对于野生型下调表达。说明在水稻的干旱胁迫过程中osgcn5参与调控了部分逆境应答基因的表达(图7)。检测用的引物序列如下:
loc_os11g10460-f:5'-ctggggtctcagaagatggaa-3’
loc_os11g10460-r:5'-cagtttcactcggcaacaaatc-3’,
loc_os02g14430-f:5'-tgtgagattaccatggcttcga-3’
loc_os02g14430-r:5'-ggaggaagaaggccagcaa-3’,
loc_os03g04240-f:5'-gcgacaagactcttgttgattca-3’
loc_os03g04240-r:5'-cccgtcgtctgggaactg-3’,
loc_os10g38540-f:5'-gtcactgctttgggcctttg-3’
loc_os10g38540-r:5'-tgacccggaagaacatcaca-3’,
loc_os01g68370-f:5'-ggatgatatttgatcagtaacccgtagt-3’
loc_os01g68370-r:5'-caacgatgaacaaccaaaccat-3’,
loc_os03g19370-f:5'-gccacagatcgagatgctgtac-3’
loc_os03g19370-f:5'-cgtagccctgcagcatactg-3’,
(3)osgcn5基因在水稻冠根发育过程中的表型观察
由于水稻根系与水稻的抗旱反应密切相关,于是我们考察了osgcn5抑制家系中冠根的发育状况。具体如下,在含有生根培养基的方皿上发芽osgcn5各抑制家系和对照野生型中花11,7天后观察表型,并对地上部分高度,地下部分长度和冠根数目进行统计,发现osgcn5抑制家系地下部分明显变弱,特别冠根数目有显著减少(图8),说明osgcn5可能通过影响水稻根的发育来参与水稻的干旱反应。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种药物中间体2-芳酰基吲哚衍生物的合成方法
- 双重hdac/brd4抑制剂及其制备方法和应用
- 含有色氨酸基本骨架的邻苯二胺类选择性组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 一种生产贝利司他中间体的工艺方法
- 组蛋白去乙酰化酶抑制剂治疗β亚科疱疹病毒的新用图
- 一种含有苯甘氨酸的肉桂酰胺类组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基)-n-羟基乙酰胺作为组蛋白去 ...的制作方法
- 一种组蛋白去乙酰酶抑制剂2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基-n ...的制作方法
- 一种组蛋白去乙酰酶抑制剂(e)-3-(2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚 ...的制作方法
- 小麦组蛋白去乙酰化酶基因TaHD2C及其应用