用于鉴别伪狂犬病病毒株的三重荧光定量PCR的引物、探针和试剂盒的制作方法
本发明涉及用于鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR的引物和探针,还涉及一种鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR检测试剂盒,属于伪狂犬病病毒不同毒株的检测鉴别领域。
背景技术:
伪狂犬病(Pseudorabies,PR)又称奥耶茨基氏病,是由伪狂犬病病毒(Pseudorabies virus,PRV)感染引起的家畜及野生动物的急性传染病,是引起世界养猪业重大经济损失的病原之一。猪是该病的储存宿主和主要传染源,临床症状以发热、神经系统和呼吸障碍为主要特征。哺乳期仔猪和幼猪对该病毒最为敏感,感染后,体重和食欲下降,死亡率为50-100%。PRV也称作猪疱疹病毒1型,属疱疹病毒科。PRV是双链DNA病毒,长度约为143kb,可编码70-100种蛋白(Mettenleiter TC.2000.Aujeszky’s disease(Pseudorabies)virus:the virus and molecular pathogenesis–state of the art.Vet Res 31:99–115.)。
从2011年底开始,中国多个省份的养猪场陆续爆发伪狂犬病新疫情,即使免疫过Bartha-K61弱毒疫苗,仍然无法有效抵御新的疫情。一些研究显示,此次疫情是由PRV变异株引起。同PRV经典株相比,变异株多个基因出现有规律的插入和缺失,如gE、gI和gB基因。这些变异株在进化上形成了一个新的分支(An TQ,et al.,2013.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012.Emerg Infect Dis 19:1749–1755;Luo Y,et al.,2014.Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China.Vet Microbiol 174:107–115.)。目前,Bartha-K61疫苗株已不能对PRV变异株提供充分的保护,因而PRV变异株对中国养猪业构成严重威胁。
经典的PRV检测方法为病毒分离和免疫荧光分析(Pensaert MB,Kluge JP.1989.Pseudorabies virus(Aujeszky’s disease),p 39–65.In:Pensaert MB(ed),Virus Infections of Porcines.Elsevier,Amsterdam;Ducatelle R,Coussement W,Hoorens J.1982.Immunoperoxidase study of Aujeszky’s disease virus in pigs.Res Vet Sci 32:294–302.),但是这两种方法实验周期长,实验消耗大。目前,已建立多种PRV检测方法,如聚合酶链扩增反应(PRV)、环介导等温扩增反应(Loop-mediated isothermal amplification,LAMP)、基于胶体金的电化学反应、免疫层析试纸、酶联免疫吸附试验(ELISA)和荧光定量PCR(Zanella EL,et al.,2012.Evaluation of a real-time polymerase chain reaction assay for Pseudorabies virus surveillance purposes.J Vet Diagn Invest 24:739–745.)。然而,这些方法不能鉴别区分PRV经典株和变异株。虽然病毒分离结合DNA测序可用于鉴别区分不同毒株,但是这种方法费时费力。
因此,建立一种能够快速区别检测PRV经典株、变异株和Bartha-K61疫苗株的新的三重荧光定量PCR检测方法,对于PRV毒株的区别检测以及应对日益严重的PR疫情将具有重要的意义和应用价值。
技术实现要素:
本发明所要解决的技术问题是提供一种用于鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR的引物和探针;
本发明所要解决的另一个技术问题是提供一种用于鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR检测试剂盒。
为解决上述技术问题,本发明所采取的技术方案是:
本发明通过分析伪狂犬病病毒(PRV)不同毒株基因序列,在Bartha-K61疫苗株(Bartha-K61疫苗株是gE/gI缺失株)基因缺失部位设计多组PRV经典株和变异株公用引物对和探针,在Bartha-K61疫苗株序列上设计多组引物对及探针。具体的,本发明用于鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR的引物包括:SEQ ID No.8和SEQ ID No.9所示的核苷酸序列组成的引物对1、SEQ ID No.10和SEQ ID No.11所示的核苷酸序列组成的引物对2、SEQ ID No.12和SEQ ID No.13所示的核苷酸序列组成的引物对3中的任意一对(上述3对引物为经典株和变异株公用引物对),以及SEQ ID No.14和SEQ ID No.15所示的核苷酸序列组成的引物对4(为检测Bartha-K61疫苗株的引物对)。
所述探针包括:SEQ ID No.1、SEQ ID No.2或SEQ ID No.3所示核苷酸序列中的任意一种(上述3种探针用于检测伪狂犬病病毒经典株),SEQ ID No.4或SEQ ID No.5所示核苷酸序列中的任意一种(上述2种探针用于检测伪狂犬病病毒变异株),以及SEQ ID No.6或SEQ ID No.7所示核苷酸序列中的任意一种(上述2种探针用于检测Bartha-K61疫苗株)。其中,核苷酸序列为SEQ ID No.1、SEQ ID No.2或SEQ ID No.3所示的探针的5′端分别标记有FAM荧光报告基团,3′端分别标记有BHQ1荧光淬灭基团;核苷酸序列为SEQ ID No.4或SEQ ID No.5所示的探针的5′端分别标记有HEX荧光报告基团,3′端分别标记有BHQ1荧光淬灭基团;核苷酸序列为SEQ ID No.6或SEQ ID No.7所示的探针的5′端分别标记有Cy5荧光报告基团,3′端分别标记有BHQ3荧光淬灭基团。
本发明对上述引物及探针的不同组合进行优化,结果表明,应用SEQ ID No.1、SEQ ID No.4和SEQ ID No.6所示核苷酸序列的探针,以及由SEQ ID No.8和SEQ ID No.9所示核苷酸序列组成的引物对1、SEQ ID No.14和SEQ ID No.15所示核苷酸序列组成的引物对4组成的引物组可将伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株三种毒株同时检测并予以区分,同时CT值最低,检测限最低,敏感性最高;而其它引物及探针的组合不能同时检测和区分经典株、变异株和Bartha-K61疫苗株。
通过本发明引物及探针的设计和优化可见,由于同一病毒不同毒株的基因组序列极其相近,尤其PRV经典株和变异株的氨基酸结构基本相同,主要基因只有个别的氨基酸的插入和缺失,同源性极高,因此同时鉴别PRV三种及三种以上不同毒株的探针较难设计。本发明策略性的在Bartha-K61疫苗株基因缺失部位设计两个探针(SEQ ID No.1、SEQ ID No.4所示),区分经典株和变异株;同时在Bartha-K61缺失部位的连接位置设计第三个探针(SEQ ID No.6所示),用于检测疫苗株。本发明利用上述三种探针,建立了一种三重荧光定量PCR方法用以鉴别检测PRV经典株、变异株和Bartha-K61疫苗株。
基于三种标记不同荧光信号的TaqMan探针(FAM(对经典株特异)、HEX(对变异株特异)和Cy5(对疫苗株特异)),本发明三重荧光定量PCR方法可以同时区分PRV经典株(SC株)、变异株(TJ株)和Bartha-K61疫苗株。该方法特异性强,对CSFV、PCV2、PPV和PRRSV未检测到荧光信号。本发明三重荧光定量PCR方法对SC株、TJ株和Bartha-K61的检测限分别为0.5TCID50、0.2TCID50和0.05TCID50。组内和组间的重复性试验表明,该方法的变异系数小于3%。
应用本发明三重荧光定量PCR方法可以准确的对PRV不同毒株进行鉴别,鉴别结果与测序结果相同。同时,在PRV SC株、TJ株和Bartha-K61疫苗株两两混合或三种混合的情况下,该方法也可以准确的鉴别病毒混合物中的毒株类型。本发明三重荧光定量PCR方法与病毒分离方法对经典株、变异株和疫苗株的检测符合率分别为100%、99.5%和100%。另外,猪体各种器官中不同PRV的病毒载量同样可以用该方法进行检测。
本发明所述伪狂犬病病毒经典株包括但不限于:伪狂犬病病毒SC株或Min-A株;所述变异株包括但不限于:伪狂犬病病毒TJ株、HLJMDJ2013株、HeBLP2014株或BJKJZ2015株。
本发明所述的引物及探针能够应用于制备鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的试剂或材料。
本发明进一步公开了一种鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR检测试剂盒,包括:引物、探针、Premix Ex Taq Probe qPCR和双蒸水;其中所述引物由SEQ ID No.8和SEQ ID No.9所示的核苷酸序列组成的引物对1,SEQ ID No.14和SEQ ID No.15所示的核苷酸序列组成的引物对4组成;所述探针为SEQ ID No.1、SEQ ID No.4和SEQ ID No.6所示的核苷酸序列。其中,核苷酸序列为SEQ ID No.1所示的探针的5′端标记有FAM荧光报告基团,3′端标记有BHQ1荧光淬灭基团;核苷酸序列为SEQ ID No.4所示的探针的5′端标记有HEX荧光报告基团,3′端标记有BHQ1荧光淬灭基团;核苷酸序列为SEQ ID No.6所示的探针的5′端标记有Cy5荧光报告基团,3′端标记有BHQ3荧光淬灭基团。
本发明所述三重荧光定量PCR检测试剂盒中还包括二甲基亚砜(DMSO)。其中,所述二甲基亚砜的用量为由引物、探针、Premix Ex Taq Probe qPCR、双蒸水、待测基因组DNA和二甲基亚砜组成的三重荧光定量PCR反应体系总体积的0%-10%,优选为2.5%-10%,最优选为5%。
已有文献报道,在普通PCR反应体系中加入DMSO可以增加反应的灵敏性。但是荧光定量PCR本身便是一种灵敏性较高的检测方法,同时DMSO的加入可能会影响荧光信号的读取。伪狂犬病病毒双链DNA结合较为紧密,在95℃变性时,双链不能完全打开,引物和探针不能与双链DNA接合并扩增,降低了探针与引物对反应的识别和鉴别能力。本发明在三重荧光定量PCR反应体系中加入DMSO,增强了探针的鉴别能力,显著提高该方法的敏感性;当DMSO的添加量为5%(v/v)时,CT值最低,敏感性最高,区分的准确率达到100%。
本发明技术方案与现有技术相比,具有以下有益效果:
本发明策略性的在Bartha-K61疫苗株基因缺失部位设计两个探针,区分经典株和变异株,同时在Bartha-K61缺失部位的连接位置,设计第三个探针,用于检测疫苗株。本发明利用所设计的三种探针,建立了一种鉴别伪狂犬病病毒经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR方法。另外,本发明在三重荧光定量PCR反应体系中加入DMSO,大大提高该方法的敏感性。基于三种标记不同荧光信号的TaqMan探针,本发明三重荧光定量PCR方法可以鉴别PRV经典株、变异株和Bartha-K61疫苗株,具有良好的敏感性和特异性,而且耗时短,成本低,准确率高,可以应用于PRV毒株的区别检测以及应对日益严重的PR疫情。
附图说明
图1为三重荧光定量PCR引物和探针的选择;A-F分别为方案1-方案6的扩增曲线;
图2为扩增PRV经典株和变异株的特异性引物和探针;其中,虚框中为PRV经典株和变异株的引物和探针设计位置;实框中毒株为PRV变异株,其他毒株为经典株;相同序列用(.)表示;
图3为扩增Bartha-K61疫苗株的特异性引物和探针设计位置;
图4为DMSO浓度的选择;
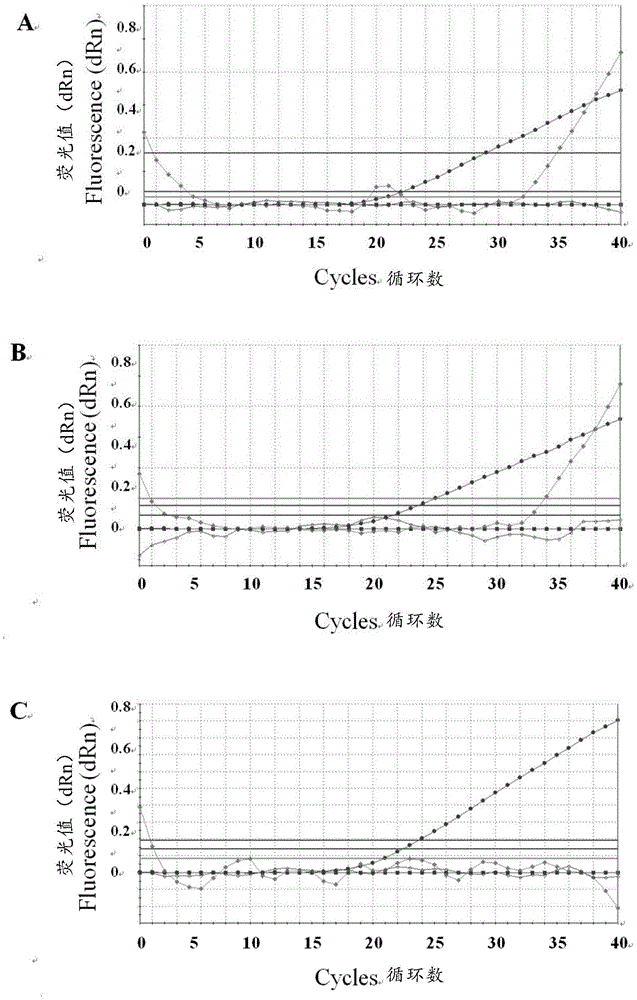
图5为三重荧光定量PCR的扩增曲线;其中,A为SC株扩增曲线;B为TJ株扩增曲线;C为Bartha-K61扩增曲线;
图6为三重荧光定量PCR的标准曲线;以标准品浓度的对数为横坐标,CT值为纵坐标;其中,A为SC株标准曲线;B为TJ株标准曲线;C为Bartha-K61标准曲线;
图7为三重荧光定量PCR的特异性。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
实施例1鉴别检测PRV经典株、变异株和Bartha-K61疫苗株的三重荧光定量PCR方法的建立
1、材料和方法
1.1病毒
猪瘟病毒(Classical swine fever virus,CSFV)石门株、猪细小病毒(Porcine parvovirus,PPV)Z株、猪圆环病毒2型(Porcine circovirus type2,PCV2)JXL株、猪繁殖与呼吸综合征病毒(Porcine reproductive and porcine respiratory syndrome virus,PRRSV)HuN4株、PRV SC株、TJ株、HLJMDJ2013株、HeBLP2014株、BJKJZ2015株(变异株)和Bartha-K61(疫苗株)由本发明人保存(其中伪狂犬病病毒TJ株、HLJMDJ2013株、HeBLP2014株和BJKJZ2015株,由本发明人分离、鉴定、保存,其部分序列同时上传至GenBank,序列登录号分别为KJ789182、KU670431、KU670430和KU937306);Min-A株(经典株)购自中国兽医药品监察所。
1.2病毒基因组提取
组织匀浆和培养细胞中的病毒DNA,在-80℃反复冻融三次后,用DNA提取试剂盒(Omega,USA)进行提取。
1.3引物和探针的选择
NCBI网站Blast分析PRV不同毒株基因序列,在Bartha-K61疫苗株基因缺失部位设计多组PRV经典株和变异株公用引物对和探针,在Bartha-K61疫苗株序列上设计多组引物对及探针(表1、表2)。同时,设计6种组合方案(表3),对探针和引物进行优化。实验条件如下:探针(10μM)各0.5μL;引物(10μM)各1μL;经典株、变异株和Bartha-K61基因组DNA各1.5μL;Premix Ex Taq Probe qPCR(TaKaRa,Japan)10μL;每管加水至20μL。三重荧光定量PCR反应程序设置如下:起始变性温度,95℃,5min;变性温度95℃,35s,退火和延伸温度60℃,35s,40个循环;每个循环结束后,检测荧光信号。通过检测荧光信号,对实验方案进行选择。CT值定义为扩增曲线达到阈值时所经历的循环数。将选择的引物和探针应用到后续实验中。
表1三重荧光定量PCR探针设计序列
表2三重荧光定量PCR引物设计序列
表3三重荧光定量PCR的引物和探针组合方案
注:a加号(+)表示探针或引物在实验方案中被添加。
2、三重荧光定量PCR引物和探针的选择结果
引物和探针的选择结果表明,方案1~4不能同时检测和区分经典株、变异株和Bartha-K61疫苗株,而应用方案5可将三种毒株同时检测并予以区分,同时CT值最低,检测限最低,敏感性最高(图1、表4)。因此,本发明将方案5中的探针和引物(FAM-PRV-Cla(SEQ ID No.1所示)、HEX-PRV-Var(SEQ ID No.4所示)、Cy5-PRV-Bar(SEQ ID No.6所示)、PRV-F1(SEQ ID No.8所示)、PRV-R1(SEQ ID No.9所示)、PRV-F2(SEQ ID No.14所示)和PRV-R2(SEQ ID No.15所示))用于后续实验中(图2、图3)。
表4采用不同组合方案的三重荧光定量PCR的检测效果比较
实施例2三重荧光定量PCR方法条件的优化
本发明在实施例1建立的三重荧光定量PCR方法基础上,进一步对三重荧光定量PCR条件进行优化。
1、实验方法
三重荧光定量PCR实验应用Mx3005p仪器(Stratagene,USA)进行,引物和探针的浓度通过荧光信号(ΔRn)数值进行优化。实验条件如下:PCR反应总体积为20μL,FAM-PRV-Cla(SEQ ID No.1所示)、HEX-PRV-Var(SEQ ID No.4所示)和Cy5-PRV-Bar(SEQ ID No.6所示)(10μM)各0.5μL;PRV-F1(SEQ ID No.8所示)、PRV-R1(SEQ ID No.9所示)、PRV-F2(SEQ ID No.14所示)和PRV-R2(SEQ ID No.15所示)(10μM)各1μL;基因组DNA 2μL;Premix Ex Taq Probe qPCR(TaKaRa,Japan)10μL;同时,在PCR反应体系中分别加入0%、2.5%、5%和10%(v/v)二甲基亚砜(DMSO),以筛选DMSO的最适浓度。三重荧光定量PCR反应程序设置如下:起始变性温度,95℃,5min;变性温度95℃,35s,退火和延伸温度60℃,35s,45个循环;每个循环结束后,检测荧光信号。样品的CT值超过限定值,需要重新检验。将优化后的实验条件和程序设置应用至后续实验中。
2、实验结果
DMSO条件优化的结果显示,DMSO的加入可以显著提高该方法的敏感性。同未添加DMSO的对照组相比,当DMSO的添加量为5%(v/v)时,CT值最低,敏感性最高(图4、表5)。
表5DMSO浓度的优化
实施例3三重荧光定量PCR方法的特异性、敏感性和重复性试验
应用实施例2优化后的三重荧光定量PCR的实验条件和程序设置。1、实验方法
1.1标准曲线建立
用引物PRV-F1/PRV-R1对PRV经典株和变异株分别进行扩增,用引物PRV-F2/PRV-R2对Bartha-K61疫苗株进行扩增,将扩增产物分别克隆至pUC-19T载体中,构建pUC-19T-SC、pUC-19T-TJ和pUC-19T-Bartha重组质粒,作为三重荧光定量PCR的检测标准品。三个重组质粒分别进行10倍梯度稀释,从5×108至5拷贝/μL,-20℃储存备用。
应用实施例2优化后的三重荧光定量PCR检测方法对标准品进行检测。
1.2特异性、敏感性和重复性试验
用PRV SC株、TJ株和Bartha-K61疫苗株分别感染PK-15细胞,提取病毒基因组,应用实施例2优化后的三重荧光定量PCR进行检测。同时对CSFV、PCV2、PPV和PRRSV进行试验,检测该方法的特异性。随后,PRV SC株、TJ株和Bartha-K61疫苗株分别感染PK-15细胞后,进行十倍梯度稀释,检测该方法的敏感性。对PRV SC株、TJ株和Bartha-K61疫苗株进行三个不同滴度的重复试验,包括组内重复和组间重复,检测该方法的重复性。
1.3三重荧光定量PCR方法对PRV不同毒株进行鉴别
三重荧光定量PCR方法对PRV不同毒株进行鉴别,同时对毒株进行测序。SC株、TJ株和Bartha-K61疫苗株进行两两混合或三种混合,应用建立的方法对病毒混合存在情况进行检测。
1.4病毒分离实验验证三重荧光定量PCR方法
三重荧光定量PCR方法对234份来自不同省份的样品进行检测。所有样品均用病毒分离实验和免疫荧光实验进行复检,同时对阳性样品进行DNA测序。
2、实验结果
2.1三重荧光定量PCR标准曲线建立
应用本发明建立的三重荧光定量PCR检测方法对标准品进行检测(图5A-C)。标准品浓度的对数为横坐标,CT值为纵坐标,建立三重荧光定量PCR标准曲线。结果显示,SC株和TJ株的标准曲线在5×108至5×101个拷贝的范围内,呈线性关系,Bartha-K61株的标准曲线在5×107至5个拷贝的范围内,呈线性关系(图6A-C)。SC株、TJ株和Bartha-K61株的线性回归方程分别为y=-3.436×log(x)+45.84,(R2=0.995);y=-3.434×log(x)+43.93(R2=0.997);y=-3.054×log(x)+40.7,(R2=0.995)。基于该方法的检测范围,SC株、TJ株和Bartha-K61株的限定值分别为39.0、38.1和38.5。
2.2三重荧光定量PCR方法的特异性、敏感性和重复性
通过检测FAM(对经典株特异)、HEX(对变异株特异)和Cy5(对疫苗株特异)三种荧光信号,该方法可以同时区分SC株、TJ株和Bartha-K61株。本发明建立的检测方法对CSFV、PCV2、PPV和PRRSV进行试验,未检测到荧光信号,表明该方法特异性强(图7)。三重荧光定量PCR方法对SC株、TJ株和Bartha-K61的检测限分别为0.5TCID50、0.2TCID50和0.05TCID50。组内和组间的重复性试验表明,该方法的变异系数小于3%。
2.3三重荧光定量PCR方法对PRV不同毒株进行鉴别
应用三重荧光定量PCR方法对PRV不同毒株进行检测,结果显示,该方法可以准确的对不同毒株进行鉴别,鉴别结果与测序结果相同。同时,在PRV SC株、TJ株和Bartha-K61疫苗株两两混合或三种混合的情况下,该方法也可以准确的鉴别病毒混合物中的毒株类型(表6)。
表6三重荧光定量PCR鉴别PRV毒株
注:a加号(+)表示该通道检测结果为阳性;
b减号(-)表示该通道检测结果为阴性。
2.4用病毒分离验证三重荧光定量PCR方法
应用三重荧光定量PCR方法对234份样品进行检测,结果显示,有8份样品含有PRV经典株;34份样品含有变异株;6份样品含有Bartha-K61株。病毒分离结果显示,有8份样品含有PRV经典株;35份样品含有变异株;6份样品含有Bartha-K61株。两种方法对经典株、变异株和疫苗株的检测符合率分别为100%、99.5%和100%(表7)。阳性样品的DNA测序结果表明,三重荧光定量PCR方法可以准确鉴别PRV不同毒株。
表7三重荧光定量PCR与病毒分离的符合性
- 还没有人留言评论。精彩留言会获得点赞!