一种脂肪间充质干细胞的分离培养方法及其应用与流程
本发明涉及细胞的分离培养方法及其应用,特别是涉及一种脂肪间充质干细胞的分离和体外扩增培养方法。
背景技术:
干细胞是一种具有自我更新能力且在适合微环境下具有多系分化潜能的原始细胞。在个体发育过程中,存在各种形式的干细胞例如胚胎干细胞,能够分化成人体各种类型的细胞,多能干细胞以及各种组织中的定向干细胞如造血干细胞、神经干细胞、肌肉干细胞等。目前,已有利用干细胞治疗心肌梗塞、先天性骨发育不全、类风湿性关节炎、神经损伤的实验报道。
成体干细胞是存在于人体组织中具有多系分化潜能的一种亚全能干细胞群,在特定环境下可诱导分化成多种组织细胞。脂肪来源的间充质干细胞就是一类亚全能干细胞群。
早在20世纪60年代,rodbell首次报道了分离脂肪细胞的方法1[1.rodellmetal.jbiolchem1964;239:375-80],包括将脂肪组织剪碎,胶原酶消化,梯度离心,来得到上层悬浮的成熟脂肪细胞,而血细胞、纤维母细胞、内皮细胞以及脂肪祖细胞等均位于细胞沉淀中。随后,许多研究者对这一方法进行了改进,将吸脂术所得组织作为脂肪组织的来源2-6[2.deslexsetal.intjobes1986;10:19-27;3.haunerhetal.j.clin.invest.1989;84:1663-1670;4.vanlrandroncariak.celltissres1977;181:197-203;5.lalikosjfetal.jsurgres1997;70:95-100;6.moorejetal.aestheticplastsurg1995;19,335-339]。吸出的脂肪用无菌的pbs平衡盐溶液冲洗以去除血细胞和局麻药,然后用ⅰ型胶原酶消化,37℃,30分钟以去除细胞外基质,然后用含10%胎牛血清(fbs)的dmem(dulbecco’smodifiedeaglemedium)完全培养基终止胶原酶的作用,1200g离心10分钟,去除上清,用含10%胎牛血清的dmem重悬细胞沉淀,然后用0.16mol/l的nh4cl溶解剩余的红细胞,离心洗涤后用含10%fbs的dmem重悬细胞,接种后置入 37℃,5%co2的培养箱中培养,12小时后用pbs冲洗,去除未贴壁的细胞,此后每三天半量换液,细胞达到80%融合时,用胰酶-edta(乙二胺四乙酸二钠盐)消化,传代7-12[7.zukpaetal.tissueeng,2001,7:211-228;8.zukpaetal.molbiolcell,2002,13:4279-4295;9.gronthossetal.jcellphysiol,2001,189:54-63;10.deugartedaetal.immunollett,2003,89:267-270;11.mizunohetal.plastreconstrsurg,1999,109:199-209;12.uspatno.6,777,231]。培养的脂肪来源的mscs呈纤维细胞样生长。
技术实现要素:
本发明的目的旨在提供一种脂肪间充质干细胞的分离培养方法和由此获得的脂肪间充质干细胞的新的医药用途。
本发明的问世是基于这样一个发现:具有cd11a-、cd31-、cd34-、cd45-和hla-dr-,且cd44+或flk-1+的表型的脂肪间充质干细胞可诱导分化为造血细胞、血管内皮细胞、成骨细胞、成软骨细胞、神经细胞和上皮细胞。
本发明的技术方案为:
一种脂肪间充质干细胞分离和体外扩增培养方法,它包括取人体脂肪组织,用胶原酶消化,经梯度离心、过滤,随后在体外培养体系中进行扩增培养。所述体外培养体系含有dmem/f12、efg和fcs;较佳地,所述体外培养体系含有90%-99%dmem/f12、10-30ng/mlefg和1-10%fcs;优选含有95%dmem/f12、5%fcs、20ng/mlegf的培养体系。
另一方面,本发明还提供了一种脂肪间充质干细胞,所述脂肪间充质干细胞具有cd11a-、cd31-、cd34-、cd45-和hla-dr-,且cd44+或flk-1+的表型。所述脂肪间充质干细胞可由上述方法获得。更佳地,所述脂肪间充质干细胞还具有cd29+、cd105+和/或cd166+的表型。
另一方面,本发明还提供了上述脂肪间充质干细胞在制备可诱导分化为造血细胞、血管内皮细胞、成骨细胞、成软骨细胞、神经细胞、上皮细胞的药物中的用途。
此外,本发明还提供了上述脂肪间充质干细胞在制备可用于人体其它组织工程、组织再生、修复的药物中的用途。
本发明提供了一种脂肪间充质干细胞分离和体外扩增培养的方法,操作简单可行;本发明还公开了人脂肪来源的间充质干细胞新的医药用途。此类细胞经移植体内可分化为多种组织特异的细胞,参与机体多种组织的损伤修复,其优势在于脂肪取材方便,给患者带来的痛苦较小,而且不容易受到恶性肿瘤的侵犯,更容易进行体外净化,对恶性血液病和实体肿瘤的患者可以预先储备脂肪来源的干细胞亚群,在大剂量放疗和化疗后可以用于重建造血。这就为组织工程、再生医学中的种子细胞来源以及为成体干细胞群的应用提供了新的选择。
附图说明:
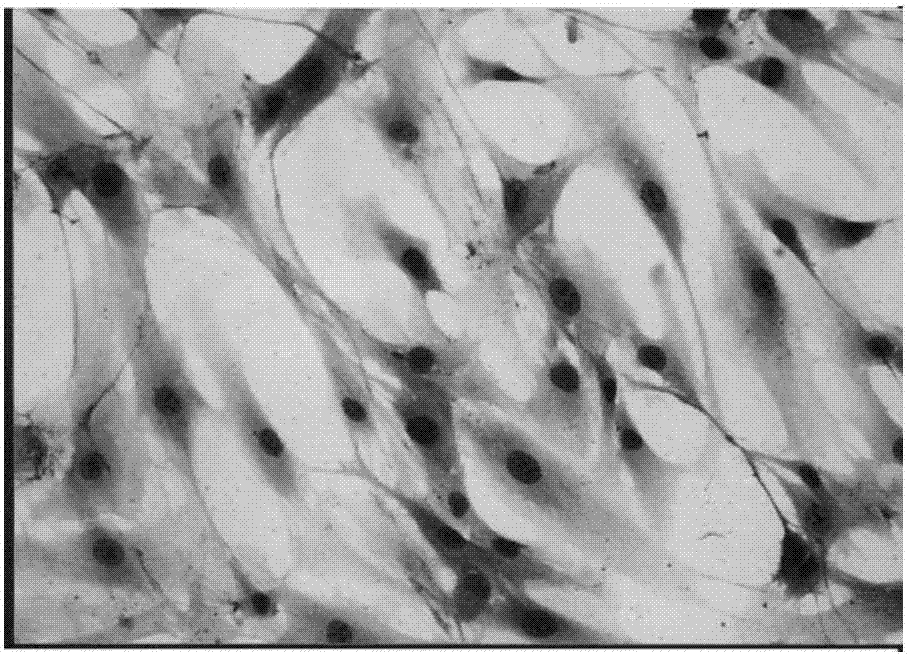
图1脂肪间充质干细胞的形态学观察和瑞士染色
图2脂肪间充质干细胞生长曲线
图3脂肪间充质干细胞免疫表型流式细胞议结果
图4脂肪间充质干细胞向成骨细胞分化示钙化小结
(a)实验组第四天(b)实验组第八天(c)对照组
图5脂肪间充质干细胞向脂肪细胞分化油红-o染色
(a)实验组为红色呈阳性(b)对照组阴性
图6脂肪间充质干细胞向神经细胞分化
(a)诱导4小时后细胞形态(b)nf阳性(c)nse阳性(d)gfap阴性
图7脂肪干细胞亚群向内皮细胞分化
(a)诱导14天后细胞形态(b)实验组cd31阳性(c)对照组cd31阴性
(d)实验组vwf阳性(e)对照组vwf阴性
(f)westernblot证实vwf(g)免疫电镜证实vwf
图8脂肪干细胞亚群向肝上皮样细胞分化
(a)诱导前细胞形态(b)实验组alb单抗绿色荧光(c)alb对照组
(d)实验组ck18单抗红色荧光(e)ck18对照组
(f)b和d结合的alb+ck18+(g)rt-pcr验证alb和ck18
图9干细胞亚群参与受体小鼠血管的新生
荧光显示鼠vwf蓝色,人vwf绿色,人cd45红色
(a)小肠(b)肝脏(c)肺(d)修复的创伤 图10干细胞亚群参与受体小鼠呼吸道上皮细胞损伤的修复
(a)支气管中人特异抗体pan-ck染色
(b)小鼠支气管局部显示人pan-ck蓝色,人cd45红色,人y-染色体dna探针绿色(箭头指示)
(c)rt-pcr证实支气管中有供体来源的上皮细胞
(d)肺中人特异抗体sp-b染色
(e)小鼠肺局部显示人sp-b蓝色,人cd45红色,人y-染色体dna探针绿色(箭头指示)
(f)rt-pcr证实肺中有供体来源的上皮细胞
(g)westernblot证实供体来源的上皮细胞
图11干细胞亚群参与受体小鼠消化道上皮细胞损伤的修复
(a)小肠中人特异抗体pan-ck染色
(b)小鼠小肠局部显示人pan-ck蓝色,人cd45红色,人y-染色体dna探针绿色(箭头指示)
(c)胃中人特异抗体pan-ck染色
(d)小鼠胃局部显示人pan-ck蓝色,人cd45红色,人y-染色体dna探针绿色(箭头指示)
(e)和(f)rt-pcr证实受体鼠内脏中有供体来源的上皮细胞
图12干细胞亚群参与受体小鼠肝上皮细胞损伤的修复
(a)人特异抗体alb染色
(b)小鼠肝脏局部显示人alb蓝色,人cd45红色,人y-染色体dna探针绿色(箭头指示)
(c)rt-pcr证实受体鼠肝脏中有供体来源的alb+上皮细胞
(d)westernblot证实有功能的供体来源肝上皮细胞
具体实施方式
本发明涉及一种脂肪间充质干细胞及其分离和体外扩增培养的方法及由该方法获得的脂肪间充质干细胞。本发明还涉及所述脂肪间充质干细胞在制备可诱导分化为造血细胞、血管内皮细胞、成骨细胞、成软骨细胞、神经细胞、上皮细 胞的药物中的用途。
具体地说,本发明的方法可包括如下步骤:取人脂肪组织,用胶原酶消化,经梯度离心、过滤,随后在体外培养体系中进行扩增培养,其中所述体外培养体系含有dmem/f12、efg和fcs;较佳地,所述体外培养体系含有90%-99%dmem/f12、10-30ng/mlefg和1-10%fcs;优选含有95%dmem/f12、5%fcs:20ng/mlegf的培养体系。此外,在所述培养体系中还可以加入100u/ml青霉素、100ug/ml链霉素等,本领域的普通技术人员应知如何选择合适的成分、配比以使所述培养体系达到最佳效果。
细胞形态学观察和生长特点
取上述1、3、6代脂肪间充质干细胞亚群,置于有小玻片的3.5cm直径平皿中,37℃,饱和湿度,5%co2培养12天后取出空气风干,瑞士染色,油镜下观察细胞形态。倒置显微镜下,培养细胞大部分于24小时内即贴壁,细胞成圆形,有小的胞浆突起。72小时后,大多数细胞有胞浆突起。一周后以梭形细胞为主,胞浆丰富,核大,核染色质细,核仁明显。瑞士染色后,于光镜下可见成纤维样细胞形态,细胞成平行排列生长或漩涡状生长(图1)。种入96孔板的单个细胞呈克隆样生长。
细胞生长曲线的测定:取各代细胞,消化计数,接种于24孔板内(5×103细胞/孔),37℃,饱和湿度,5%co2培养,每天取两孔细胞进行计数,计算均值,绘制生长曲线(图2)。在细胞生长的对数期,脂肪干细胞亚群倍增时间为25小时。
流式细胞仪鉴定脂肪间充质干细胞的表型、细胞周期以及免疫组化分析
细胞表型测定:用间接免疫荧光法检测。一抗为小鼠抗人的单克隆抗体cd105、cd11a、cd29、cd34、cd31、cd44、cd166、cd45。为检测细胞内抗原flk1,细胞与一抗孵育之前,用2%多聚甲醛4℃固定15min,并在室温下用0.1%的皂角素透膜1h。细胞用洗液pbs洗过后,加入fitc标记的二抗4℃孵育30min。细胞洗两次,并悬浮在500ul的pbs中,置于冰上待流式细胞仪检测。结果表明:细胞表面cd11a、cd31、cd34、cd45、hla-dr为阴性,流式结果基本在1%以下;cd29、cd44、cd105、cd166、flk-1为阳性,流式结果在98%以上(图3)。
细胞周期分析:用流式细胞仪(facsvantage型)检测,modfit软件分析结果,发现超过80%的细胞都处于g0/g1期。
免疫组化分析:采用sa法检测i型胶原的表达为阳性、vwf因子的表达为阴性。
体外向三个胚层多系诱导分化
取上述所得的单克隆来源扩增细胞,以5×103/cm2接种于25cm2培养瓶和6cm直径的培养皿。
1.成骨分化体系
含10-7m地塞米松、10mmβ-磷酸甘油、0.05mm维生素c和10%fcs的imdm;在第4天、第8天、第12天和第16天分别vonkossa染色法检测钙化小结及骨钙蛋白基因的表达检测。结果显示:成骨培养中细胞形态由原来的梭形变成了立方形,随着细胞生长密度的增长形成多层的结节结构,而对照中细胞仍是梭形且呈单层生长;vonkossa染色发现第四天细胞分泌的钙化基质,在第八天有明显的钙化基质沉积,而对照中未见到此现象(图4);rt-pcr分析表明干细胞亚群经诱导分化培养后表达骨钙蛋白基因。说明干细胞亚群可在体外诱导分化为成骨细胞。
2.脂肪分化体系
含10-6m地塞米松、0.5mm3-isobutyl-1-methylxanthine(ibmx)、0.1mm维生素c和10%fcs的imdm。在第4天、第8天、第12天和第16天分别油红-o染色及脂蛋白脂酶基因的表达检测。结果显示:培养8天可见到折光度增加的液泡充满整个细胞;油红-o染色发现培养中约90%细胞富含脂肪滴,而对照体系中的细胞脂肪滴很少(图5);rt-pcr分析表明经诱导分化培养后表达脂蛋白脂酶基因,而对照体系不表达或只有微量表达。说明干细胞亚群可在体外诱导分化成脂肪细胞。
3.成软骨分化体系
含dmem-hg、mcdb、2%fcs、地塞米松10-7m、tgf-β10ng/ml的imdm。在第4天、第8天、第12天和第16天分别阿尔新蓝染色,免疫组化法检测ⅱ型胶原,rt-pcr法检测ⅱ型胶原基因表达。结果显示:培养四天即可通过免疫组化检测到ⅱ型胶原的表达,而对照组中阳性细胞较少;rt-pcr分析表明细胞经软 骨诱导分化培养后表达ⅱ型胶原基因,而对照体系不表达或只有微量表达;培养八天后,通过阿尔新蓝染色可检测到蛋白多糖,对照组只有微量表达。从而鉴定干细胞亚群成软骨分化潜能。
4.成神经诱导分化体系
用含有1mm巯基乙醇和20%fcs的dmem培养液预诱导24小时,再用含有10mm巯基乙醇的dmem培养液诱导5小时。免疫组化法检测nse(神经特异烯醇化酶),nf(神经丝蛋白),gfap(神经胶质蛋白)。结果显示:预诱导过程中细胞形态无明显变化,诱导4小时后,细胞形态明显改变。一部分细胞呈神经样,所有的诱导后细胞nf,nse阳性,gfap阴性(图6)。
5.内皮细胞诱导分化体系
含30ng/mlvegf,10ng/mlbfgf的内皮诱导培养基。向内皮诱导的分化情况用免疫荧光、免疫电镜及免疫印迹鉴定。定向诱导14天后,未加内皮诱导培养基的对照组细胞倒置显微镜下未见有形态上的变化,而实验组细胞则见形成典型的鹅卵石样的细胞区(见图7a),免疫组化显示实验组细胞表达cd31(见图7b、c)及vwf(见图7d、e),免疫电镜及免疫印迹结果进一步证实上述结果(图7f、g)。
6.上皮细胞诱导分化体系
扩增培养基中不含egf,培养12小时后,将培养基改为含30ng/mlhgf,20ng/mlbfgf的上皮细胞诱导培养基。向上皮样细胞诱导的结果用免疫荧光、免疫印迹及rt-pcr鉴定。向肝上皮样细胞定向诱导14天后,免疫荧光检测结果显示实验组细胞alb及ck18阳性,rt-pcr进一步证实上述结果(图8)。
体内多向分化研究,治疗机体多组织损伤
1.干细胞亚群体内移植
以接受亚致死量照射的非肥胖型糖尿病及严重联合免疫缺陷(nod/scid)小鼠为损伤模型,将受体雌性nod/scid小鼠(6-8周鼠龄)预先经铯源全身照射300cgy后在4小时内从尾静脉输入脂肪来源干细胞亚群细胞,对照组小鼠则注射等体积rpmi1640。
2.血管新生模型建立
雌性nod/scid小鼠(6-8周鼠龄),移植细胞4小时前,剪去背部毛发(直 径约6cm),碘酒消毒,使用微型打孔机在此区域造成一创伤,使该皮肤创伤的伤口深达真皮层。移植细胞(106/只)后7天,在麻醉状态下活检创伤部位,三色免疫荧光法检测细胞参与受体小鼠皮肤受损部位血管新生的情况。
3.细胞体内植入及分化检测结果
于移植后2月,取受体小鼠的骨髓及脾细胞,应用人特异性抗体,通过流式细胞术、免疫组化和rt-pcr的方法,检测受体小鼠中人造血细胞表面标志(cd34,cd45,cd2,cd7,cd10,cd13,cd14,cd19,cd33,cd38等)的表达情况;取受体小鼠的各种组织(受损皮肤愈合部位,气管,肺,肝,小肠,胃等)制备切片,利用抗人角蛋白(pan-cytokeratin,pan-ck)、白蛋白(alb)或表面活性物质b(surfactantb,sp-b)的特异性抗体,通过组化、免疫荧光以及y染色体荧光原位杂交(y-fish)、rt-pcr和westernblot等方法检测受体小鼠不同组织中人源细胞的植入及分化情况。取受体小鼠血清,用抗人alb特异性抗体行westernblot检测;为了解供体来源细胞在受体鼠体内是否也能够向血管内皮分化并避免与人源造血细胞相混淆,我们利用不同颜色荧光标记的抗鼠vwf多克隆抗体(cy5)、抗人vwf单抗(fitc)和抗人cd45单抗(pe)对组织切片进行了三色免疫荧光组化。
研究结果表明:
①脂肪来源干细胞亚群参与受体小鼠的造血重建。接受移植后2月,在受体nod/scid小鼠体内即可检测到高水平的、表达人造血细胞表面标志的细胞。流式细胞术显示受体骨髓中人cd45+细胞比例可高达40%,其中既有淋巴细胞,也含有髓系细胞。rt-pcr证实受体鼠骨髓中有人特异性基因的表达(人gadph及cd45、cd34、cd19、cd33)。另外,免疫荧光显示受体鼠脾中存在人cd45+和cd19+细胞,而未接受细胞移植的对照鼠脾细胞,染色则为阴性。因此,正是植入的人脂肪来源干细胞亚群参与了受体小鼠的造血重建;
②向血管内皮分化。通过三色免疫荧光组化发现,如图9所示,在大多数(高达80%)受体鼠体内(小肠、肝、肺及皮肤损伤模型等组织),都能检测到表达人内皮细胞表面标志vwf的细胞,它们参与受体照射后微血管损伤的修复;在血管新生模型中,也可检测到人源内皮细胞参与血管新生。通过对人cd45染色,证实这些人vwf+细胞并不表达cd45,从而排除了是造血细胞的可能;
③皮肤组织再生。在受体鼠皮肤受损部位明显可见创伤愈合,生成正常皮肤组织和毛发,免疫组化检测到供体来源的皮肤细胞(pan-ck+cd45-y-chromosome+),rt-pcr和westernblot均证实再生的皮肤组织来源于人脂肪来源的干细胞亚群,从而证明了该干细胞亚群在体内可分化为有功能的正常皮肤组织。
④供体来源的上皮细胞。在受体鼠的气管、肺、消化道和肝中,检测到供体来源的上皮细胞(pan-ck+cd45-y-chromosome+或sp-b+cd45-y-chromosome+)或肝细胞(alb+cd45-y-chromosome+),而未接受细胞移植的对照鼠则为阴性。这一结果亦得到rt-pcr的证实。westernblot示受体小鼠血清中含有人alb,rt-pcr证实其肝脏中有人albmrna表达。这些都说明,移植的细胞能够在受体体内分化为消化道上皮细胞及有功能的肝细胞(图10,11,12)。
⑤二次移植。取已移植成功(rt-pcr、facs及免疫荧光证实)的首次移植小鼠(3只)的骨髓细胞,以2×107/只尾静脉输注给另三只预先经铯源全身照射300cgy的雌性nod/scid小鼠(6-8周鼠龄),二次移植3个月后,在受体小鼠的骨髓、脾、气管、肺、肝和消化道中,同样也检测到人源细胞,分布与第一次移植相似,分别表达造血、内皮、上皮以及肝细胞的特征性表型(表1)。更进一步提示人脂肪来源干细胞亚群属于一类亚全能干细胞群体,很可能成为一种理想的种子细胞,可作为造血干细胞移植中cd34+造血干细胞的替代品及用于治疗一些遗传及退行性疾病。
表1脂肪间充质干细胞在受体鼠内分化为造血细胞
以下结合具体实施例对本发明做进一步说明。但并不意味着本发明仅限于此。
实施例1人脂肪来源的间充质干细胞(msc)的分离和体外扩增培养
取人脂肪组织,用d-hank’s液冲洗,剪碎,0.2%ⅱ型胶原酶37℃消化2小时,用d-hank’s液洗涤中止ⅱ型胶原酶的作用,离心1000r/m,10min后,用200目的滤网过滤,并用移液管反复吹打,使之成为单细胞悬液,在体外培养体系(含95%dmem/f12、5%fcs:20ng/mlegf、100u/ml青霉素和100ug/ml链霉素)。中置37℃,5%co2培养箱培养,1天后换液,弃去非贴壁细胞,以后每三天半量换液。第一代细胞以0.6细胞/孔的密度种入96孔板,24小时后显微镜下挑选并记录只有一个细胞的孔,当细胞达80-90%融合时,0.25%胰酶常规消化传代,做单克隆细胞培养。
实施例2人脂肪来源的间充质干细胞体内重建造血
1.干细胞亚群体内移植
nod/scid鼠8-10周,预先经cs137全身照射300rad随机分为2组,每组4只,照射后4小时内从尾静脉输入细胞。①对照组输入0.4ml/只生理盐水;②输入2×106/0.4ml/只人脂肪来源的干细胞亚群(实施例1制备)。输入的干细胞亚群预先经pkh26染色,染色步骤按照sigma的说明书进行。移植24小时后实验组和对照组nod/scid鼠皮下注射g-csf2400ng/只。对照组小鼠在经cs137全身 照射后在7-14天死亡,实验组小鼠全部存活1个月以上。
2.受体小鼠骨髓和脾脏的细胞的流式细胞仪分析
nod/scid小鼠移植一个月和两个月后,分别断颈处死,收集骨髓和脾脏细胞,用0.016m的nh4cl溶解红细胞,d-hanks液洗涤中止,用含0.5%的牛血清白蛋白的pbs冲洗,加入一抗4℃孵育30min,一抗为人特异性的fitc标记的cd3,cd14,cd19,cd33,cd34,cd45。细胞洗两次,并悬浮在500ul的pbs中,置于冰上待流式细胞仪检测。移植后的小鼠在一个月的时候,流式细胞仪分析小鼠骨髓pkh26阳性的细胞为22.6%,脾脏pkh26阳性的细胞为21.5%。移植后的小鼠在两个月的时候,流式细胞仪分析小鼠骨髓和脾脏人血液细胞特异性抗体阳性的细胞,骨髓cd344.14%,cd1444.36%,cd1941.32%,cd3351.08%,cd3444.66%,cd4541.84%;脾脏cd314.84%,cd1428.99%,cd1914.82%,cd3320.23%,cd3417.30%,cd4513.31%。
3.受体小鼠骨髓和脾脏细胞rt-pcr分析
nod/scid小鼠移植两个月后,断颈处死,收集骨髓和脾脏细胞,检测人源干细胞亚群分化为cd19,cd33,cd34,cd45阳性的细胞。小鼠骨髓和脾脏细胞用dynabeadsmrnadirectkit(dynal,oslo,norway)提取总rna,逆转录为cdna.。引物序列为cd19(594bp),5'-cgagttctatgagaacgactc-3'and5'-actggaagtgtcactggcatg-3';cd34(647bp),5'-gtcttgacaacaacggtactgc-3'and5'-caagaccagcagtagacactga-3';cd45(418bp),5'-caggcatggtttccacattc-3'and5'-ctacaaatattggttcgctgc-3';cd33(640bp),5'-aaccttacctgctctgtgtcctgggc-3'and5'-gcctgatgctcttgagggttcctcac-3';pcr的反应条件是96℃变性5min后,94℃变性1min,58℃退火50sec,72℃延伸1min共35个循环,最后72℃延伸10min。rt-pcr分析结果为:cd19,cd33,cd34,cd45人特异性片段的表达均为阳性,而对照组则均为阴性。
4.受体小鼠和对照组小鼠cfu-cm培养的比较分析
取实验组和阴性对照组nod/scid小鼠骨髓组织制成单细胞悬液,用白细胞稀释液计数有核细胞数量。正常成人的骨髓5ml,用ficoll(1.077g/cm3)分 离液分离单个核细胞,1200r/m离心20min,取白环以上的细胞1000r/m离心10min,计数。在含30%胎牛血清,40ng/mlgm-csf(分别为人和小鼠的)和0.3%琼脂的imdm培养基的六空板中接种5×104个单个核细胞,培养皿置于37℃,5%co2的饱和湿箱中培养10天,在倒置光学显微镜下计数含有多于50个细胞的集落的数目。实验结果见表2,实验组小鼠有cfu-gm,cfu-g,cfu-m的生长,而未移植的小鼠则没有集落生长,从而证实人脂肪来源的间充质干细胞具有重建造血的能力,并可以分化为成熟的粒细胞,单核细胞和淋巴细胞。
表2受体小鼠和对照组小鼠cfu-cm培养的比较分析
实施例3人脂肪来源的间充质干细胞体内分化为血管内皮细胞
我们设计了以下实验:先损伤nod/scid小鼠的皮肤,然后再经尾静脉注射pkh26染色的细胞,7-9天后在肉芽肿最明显的时候手术切除肉芽肿组织,荧光显微镜下观察pkh26阳性的细胞的分布,并用人特异性血管内皮抗体免疫荧光染色。nod/scid小鼠在损伤后第8天左右,肉芽肿最明显,切下的肉芽肿组织经冰冻切片,免疫荧光染色,荧光显微镜下可以见到(图9):
(1)冰冻切片可见到pkh26的红色荧光,证明存在人源性的细胞存在;
(2)cd31,vwf的冰冻切片中可见到fitc的绿色荧光,证明为人来源的血管内皮细胞;
(3)比较红色荧光和绿色荧光的照片,可以见到有些细胞同时有红色荧光,和绿色荧光,证明其为人脂肪来源的msc在nod/scid小鼠的损伤部位分化为血管内皮细胞。
本发明所涉及的多个方面已做如上阐述。然而,应理解的是,在不偏离本发 明精神之前提下,本领域技术人员可对其进行等同变换和修饰。它们的范围也包括在所附的权利要求中。
- 还没有人留言评论。精彩留言会获得点赞!