早实枳PtFCA1基因的分离及在植物成花调控中的应用的制作方法
本发明属于植物基因工程技术领域。具体涉及早实枳ptfca1基因的分离及在植物成花调控中的应用。早实枳ptfca1基因的核苷酸序列见序列表seqidno:1所示,序列长度为2260bp。遗传转化fca‐1型拟南芥后,可以明显互补fca‐1型拟南芥晚花的表型,并可以恢复根系的生长。因此ptfca1基因可提早植物的成花时间,对于缩短多年生果树的童期及作物的遗传改良有重要意义。
背景技术:
柑橘是我国南方重要的果树,且在亚热带地区的国家均有栽培。柑橘一般需要经历较长时间的童期才能开花结实,部分柑橘的童期长达10年。柑橘分为柑橘属、金柑属和枳属。枳属花芽分化在春季开始,中间经历一段时间休眠,经低温诱导后,在次年春季开花。同一个属不同种在花芽分化及开花次数之间也存在差异。以普通枳和早实枳为例,普通枳一年开花一次,早实枳一年开花2‐3次。早实枳春梢和夏梢的部分花芽(非休眠型花芽)不需要经过休眠及低温诱导就可以迅速发育并在当年开花,而早实枳春梢、夏梢一部分花芽跟普通枳的花芽(休眠型花芽)相似,需要休眠后经过低温诱导次年春季开花。在对早实枳和普通枳花芽分化的研究中发现,自剪后具有成花能力的枝条会由营养生长转入生殖生长阶段,表明自剪对柑橘的花芽分化具有重要的作用,是具有成花能力的枝条发生成花转变的标志。
除了响应外界环境调控开花时间外,植物随自身的发育状况也自主控制着开花的进程,当植物从营养分生组织、花序分生组织、花分生组织进行顺序转换时,其正常的开花程序即被启动(srikanthetal.2011),这种调控途径叫做自主途径(simpsonetal.2002)。在拟南芥中,通过对缺失突变体的研究,分离鉴定得到一系列参与自主途径的基因,包括ld、fca、fy、fpa、fld、fve、flk和ref6s等,这些基因主要通过间接抑制flc的表达来促进成花(marquardtetal.2006)。遗传学研究表明,fca和fld属于同一条遗传途径,fca上位作用于fld调控成花(liuetal.2009)。fca蛋白含有2个rrm结构域和1个ww结构域,rrm结构域主要结合rna分子,表明fca可能参与转录后调控过程(macknightetal.1997)。fca蛋白通过ww结构域与一系列蛋白互作,其中fca与fy的互作在植物中具有保守性,fca与fy互作后影响许多转录本的选择性多聚腺苷磷酸化,如介导产生flc反义转录本(simpsonetal.2010),同时fca/fy复合体与位于flc编码区第6个外显子和flc反义转录本近端的多聚腺苷酸化位点结合,抑制flc的表达(liuetal.2008)。fy是酵母聚腺苷酸化因子pfs2p的同源基因,是一个高度保守的rna3’端的剪切因子,fca也依赖fy激活前体mrna内部的多聚腺苷酸化位点负调控自身的表达。fpa和fca在调控rna介导的flc沉默过程中出现功能冗余的现象(
综上所述,fca参与自主成花调控途径及温度途径。同时结合本研究前期通过转录组测序发现了成花自主调控基因fca在普通枳和早实枳成花转变阶段存在差异表达(aietal.2012),并发现ptfca在早实枳夏梢(具有成花能力)和普通枳夏梢(不具有成花能力)发育阶段中表达模式差异明显。该基因在拟南芥中的同源基因与温度调控开花有关,推测可能与早实枳夏梢在环境温度较高(不经过低温春化)的条件下成花相关;其次,由于在木本植物种中自主成花途径和环境温度途径研究较少,本发明针对ptfca基因生物学功能及调控机理进行了较深入的研究。在借鉴一年生模式植物研究多年生植物成花调控的同时,也应进一步深入研究这些调控网络在多年生植物童期或者季节性成花中发挥的作用。
技术实现要素:
本发明的目的就是从早实枳(本领域中另称为枳壳)中分离出拟南芥fca(geneid为at4g16280.1)的同源基因,并对其同源序列进行蛋白质序列的比对、聚类分析、时空表达模式、亚细胞定位、异位表达等进行分析。证实了该基因在早实枳成花转变过程中充当重要角色,为进一步缩短柑橘的童期及揭示柑橘及多年生植物的早花机制奠定了一定基础。
申请人将分离克隆的基因命名为ptfca1基因(geneid为orange1.1g005357m),早实枳中ptfca1基因的核苷酸序列如seqidno:1所示,序列长度为2260bp。在拟南芥中,将其遗传转化fca‐1型拟南芥后,可以明显互补fca‐1型拟南芥晚花的表型,并可以恢复根系的生长。因此ptfca1基因可提早植物的成花时间,对于缩短多年生果树的童期及作物的遗传改良有重要意义。
具体地,本发明通过以下技术方案实现:
申请人通过基因克隆技术从早实枳中分离得到fca的同源基因ptfca1(其核苷酸序列如seqidno:1所示)。聚类分析显示fca基因在双子叶植物和单子叶植物的进化中出现了明显的分支,其中ptfca1和拟南芥fca亲缘关系较近。同源序列的比对显示除了fca蛋白的一些共性外,ptfca1还有其独特的特点。亚细胞定位显示ptfca1蛋白主要定位于细胞核中,表明ptfca1基因是作为转录因子起作用的。rt‐pcr显示ptfca1基因在早实枳春梢和夏梢的表达模式一致,都是在自剪后表达升高,表明ptfca1基因参与到早实枳的成花转变过程中;同时又检测ptfca1基因在早实枳童期向成年期转变过程中,表达是逐渐升高的,表明ptfca1基因可维持植物的生殖生长;同时ptfca1基因在根中的表达高于在其它部位的表达,表明ptfca1基因参与到根系的发育过程中。通过在fca‐1型拟南芥中超表达该基因发现,可以部分互补fca‐1型拟南芥的晚花且恢复根长,表明ptfca1基因参与到植物的成花及根的发育过程中。
申请人提供了一种ptfca1基因超表达在调控植物成花或调控植物根系发育中的应用,包括下列步骤:
(1)参考柑橘因组搜索fca的同源基因,获得ptfca1基因的序列,其核苷酸序列如seqidno:1所示;
(2)通过荧光定量pcr检测ptfca1基因在早实枳春梢和夏梢自剪前、自剪中和自剪后的表达;
(3)通过荧光定量pcr检测ptfca1基因在早实枳童期、转变期和成年期中的表达;
(4)通过荧光定量pcr检测ptfca1基因在早实枳不同部位的表达;
(5)利用ptfca1基因的生物信息学分析‐聚类分析和蛋白同源性进行比较分析;
(6)融合gfp蛋白对洋葱表皮细胞进行瞬时表达转化;
(7)构建ptfca1超表达载体转化植物(优选例子是拟南芥);所述的ptfca1超表达载体含有seqidno:1所示的核苷酸序列;
(8)对转基因植物(优选例子是拟南芥)进行抗性筛选,并移栽。
(9)对获得的超表达阳性植株进行表型观察及数据统计,对ptfca1基因在调控植物成花期性状或调控植物根系发育性状进行关联分析。
对上述步骤中专业术语“自剪”的解释:柑橘类植物和枳(枳壳)枝条从抽梢到停止生长出现一种特有的生物学现象即发生顶芽脱落的特征在果树栽培学中称为“自剪”,“自剪”现象发生的时间称之为“自剪期”(zhangetal.2014)。
本发明的有益效果在于:
本发明得到可使植物早花的ptfca1基因,利用该基因构建了超表达载体pcambia1301+ptfca1,该表达载体上含有seqidno:1所示的核苷酸序列。通过转化fca‐1型拟南芥,获得了转ptfca1基因的超表达转化植株35s::ptfca1/fca‐1,并恢复根系的生长。从侧面证明该ptfca1基因不仅可用于调控植物的开花,而且还可促进根系的发育。
附图说明
序列表seqidno:1是本发明分离克隆的ptfca1基因的核苷酸序列。序列长度为2260bp。其中该序列的137‐2239碱基处所述的序列是该基因的编码框(cds)。
序列表seqidno:2是ptfca1基因编码的蛋白序列。序列长度为700aa。
图1:是本发明的技术路线图。
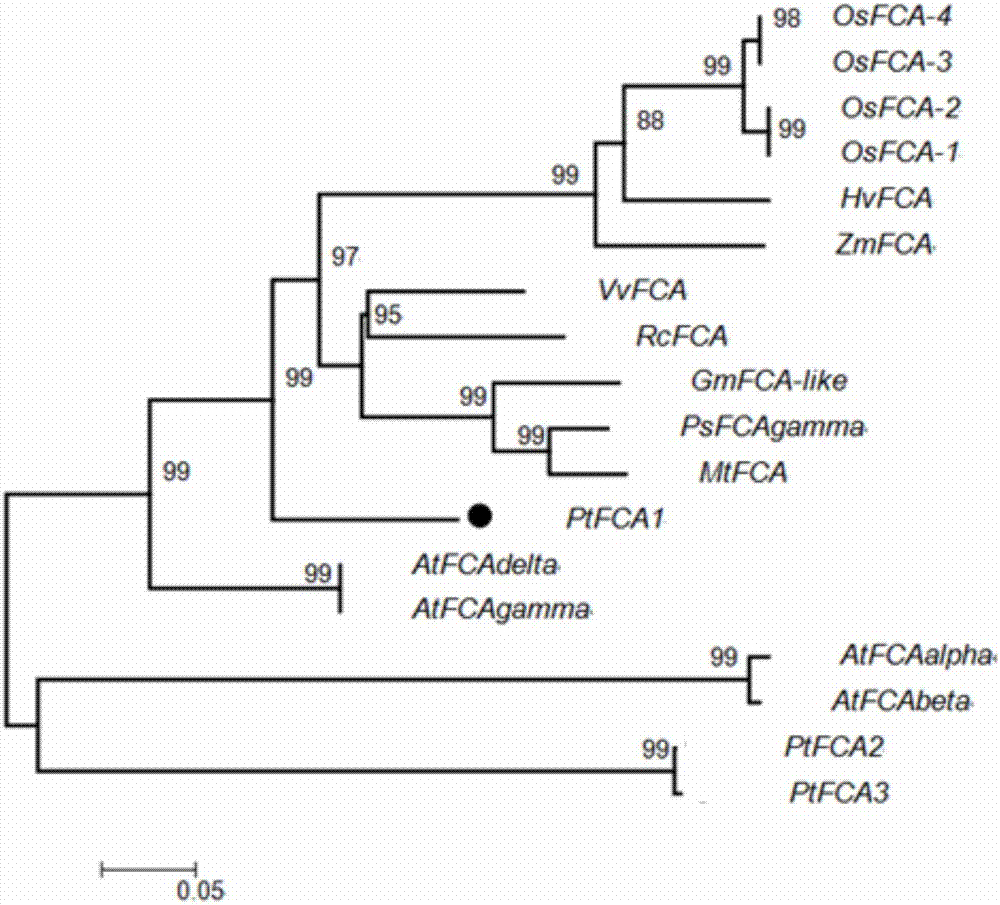
图2:是ptfca1和其他物种中fca的聚类分析。附图标记说明:黑色圆点标记的是本发明克隆得到的ptfca1基因的核苷酸序列。
图3:是fca蛋白序列比对的结果。附图标记说明:图3中的fca不同的保守结构域在序列上方用横线标注。
图4:是ptfca1蛋白在洋葱表皮细胞中的亚细胞定位分析结果。附图标记说明:图4中的a图是阳性对照即35s::gfp的荧光;图4中的a图是图4中a图的明场;图4中的b图是ptfca1融合gfp的荧光;图4中的b图是图4中b图的明场。标尺为50um。
图5:是ptfca1基因在早实枳春梢和夏稍自剪前后的表达模式。附图标记说明:图5中横坐标中的1为自剪前15天取的顶芽;图5中横坐标中的2为自剪过程中取的顶芽;图5中横坐标中的3为自剪后20天取的顶芽。
图6:是ptfca1基因在早实枳不同发育阶段的表达模式。
图7:是ptfca1基因在早实枳不同部位的表达模式。
图8:是ptfca1基因在fca‐1型拟南芥中异位超表达表型。附图标记说明:图8中的a图是ler型、fca‐1型和ptfca1转fca‐1型拟南芥开花时间的差异;图8中的b图是ler型、fca‐1型和ptfca1转fca‐1型拟南芥根系生长情况;图8中的c图是ler型、fca‐1型和ptfca1转fca‐1型拟南芥根尖区域的显微镜观察结果。
图9:是原始载体pcambia1302的图谱和本发明构建的重组载体pcambia1302+ptfca1‐gfp的图谱。附图标记说明:图9中的a图是原始载体pcambia1302的图谱;图9中的b图是本发明构建的重组载体pcambia1302+ptfca1‐gfp的图谱。
图10:是原始载体pcambia1301图谱和本发明构建的重组载体pcambia1301+ptfca1的图谱。附图标记说明:图10中的a图是原始载体pcambia1301的图谱;图10中的b图是构建的重组载体pcambia1301+ptfca1的图谱。
具体实施方式
实施例1早实枳ptfca1基因的分离与序列分析
为了获得柑橘中fca的同源基因,本实施例利用拟南芥fca基因(geneid为at4g16280.1)的cds序列在甜橙的数据库(https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=org_csinensis)中进行blast搜索,获得同源性最高的序列即为柑橘中ptfca1基因(geneid为orange1.1g005357m)的核苷酸序列,并用primer5.0软件按照一般设计引物的原则在该基因的5'‐utr区和3'‐utr区设计引物进行全长cdna序列的扩增。
以早实枳(取材于华中农业大学标本园,文献来源:梁遂权等,1999;zhangetal.2011)为材料抽提rna及反转录,所得的第一链cdna用于扩增ptfca1基因的全长。rna的抽提使用trizol试剂盒(购自invitrogen公司,按照该试剂盒提供的操作说明书操作)。抽提的3μg总rna样品经1u的dnasei(购自invitrogen公司)室温处理15min后,加入1μledta(25mm),于65℃温育10min。第一链cdna的合成用mbi反转录试剂盒(购自fermentas公司,按照试剂盒说明书操作)。扩增基因ptfca1引物对为:正向引物:5'‐atttaatcgttgccgtagtcc‐3';反向引物:5'‐acctggctccacattttca‐3'。25μl的反应体系中包括100ngcdna,1×缓冲液,2.5mmmgcl2,0.25mmdntp,0.5utaq聚合酶(前述缓冲液和taq聚合酶均购自fermentas公司),加0.5μm上述的正向和反向引物。pcr反应在abi9700(appliedbiosystem)扩增仪上按以下程序完成:94℃,5min;94℃变性30s,60℃退火50s,72℃延伸90s,35个循环;循环完成后72℃延伸15min。产生一条单一pcr条带产物,经1%的琼脂糖凝胶电泳后,用
采用ncbi数据库中的orffinder通过对该基因的编码序列进行预测分析,发现其开放阅读框包含2103bp(如序列表seqidno:1中所示),编码700个氨基酸(如序列表seqidno:2所示)。用mega4.0对已知单子叶和双子叶植物中的fca蛋白序列(所选基因的id号见表1)进行了聚类分析。如图2所示,单子叶植物和双子叶植物在fca基因的进化上出现了明显的分支,其中ptfca1和拟南芥fca亲缘关系较近。
同时用genedoc软件对ptfca1与其它物种的同源基因进行比对分析,并在motifscan(http://myhits.isb‐sib.ch/cgi‐bin/motif_scan)中分析蛋白序列的保守结构域,结果如图3所示,该蛋白含有2个rrm结构域、1个ww结构域及核定位信号。ptfca预测蛋白序列和拟南芥同源性为53%,较水稻(43%)高,然而保守结构域rrms和ww区域序列相似性较高,和拟南芥相比为83%和79%,和水稻相比为83%和72%。单子叶植物fca核苷酸序列的5’端含有gc‐rich区域及蛋白序列的n端含有一个glycine‐rich区域,而在双子叶植物拟南芥中则没有该区域。本发明的ptfca1蛋白也没有glycine‐rich区域,但是在rrms结构域后面有一个proline‐rich区域,在所呈现的其他物种的fca均没有该区域,前人研究表明proline‐rich区域可与ww结构域竞争互作蛋白(gaoetal.2014)。在ptfca蛋白序列的n端存在一个polyq区域,不同物种中polyq长度出现变异,ptfca蛋白的长度较拟南芥长。
表1fca聚类分析时所选的核酸序列。
实施例2基因枪介导的ptfca1蛋白的亚细胞定位
(1)载体的准备:通过使用psort程序预测到ptfca1蛋白可能定位于细胞核中,为验证这一预测结果,构建了ptfca1的编码序列与gfp蛋白融合的载体。根据pcambia1302载体(购自澳大利亚的cambia实验室)的多克隆位点和ptfca1基因的序列,用primerpremier5.0软件按照一般设计引物的原则设计出扩增ptfca1基因的引物,由于是做融合基因,所以去掉ptfca1的终止密码子进行融合。在正向引物和反向引物的5'端分别加入ncoi和spei的酶切位点。引物序列为:
正向引物:5'‐ccatggatttaatcgttgccgtagtcc‐3';
反向引物:5'‐actagtagtccctgatggcttattct‐3'(注:小写字母为加入的酶切位点)。
以实施例1获取的ptfca1连pmd18‐t载体(购自宝生物工程大连有限公司)的菌液为模板进行ptfca1基因的扩增。pcr反应条件为:95℃,5min;95℃,30s;56℃,30s;72℃,90s;72℃,10min。35个循环。扩增的片段重新连接pmd18‐t并提取质粒。对载体pcambia1302和片段连接pmd18‐t的质粒分别进行酶切,酶切体系:反应总体积为20μl,其中含有pcr的纯化产物10μl,10×k缓冲液(购自mbi公司)2μl,bsa2ul,内切酶ncoi和spei各1μl,双蒸水4μl。在37℃酶切3h后分别纯化回收。连接反应体系中插入ptfca1的片段与载体pcambia1302的摩尔比为3:1,反应总体积为10μl,其中含有10×buffer1μl,t4dna连接酶1μl,ptfca1的双酶切回收产物4μl,pcambia1302载体的双酶切回收产物2μl,双蒸水2μl。在16℃反应14‐16h。连接产物转化大肠杆菌菌株dh5α,在含有50mg/l卡那霉素的lb固体平板中筛选阳性克隆,抽提质粒进行酶切及pcr鉴定,测序确定没有突变,获得含有插入目的片段的中间载体,将其命名为中间载体pcambia1302+ptfca1‐gfp,提取质粒并置于‐20℃备用。
(2)洋葱表达材料的制备:将新鲜洋葱的鳞茎切成1cm2左右的小块,用75%酒精消毒8‐10min,取出后在灭菌超纯水中清洗2‐3次,用镊子小心撕下内表皮,置于ms固体培养基上暗培养,备用。
(3)金粉处理及微弹的制备:称取60mg金粉置于1.5ml离心管中,加入1ml75%酒精振荡悬浮两次,高速离心后弃去酒精,用灭菌超纯水清洗2‐3次,并悬浮于灭菌水中;取10μl金粉悬浮液,向其中加入1‐2μg目的中间载体pcambia1302+ptfca1‐gfp,混匀后再依次加入2.5mcacl210μl、0.1m亚精胺4μl,振荡混匀后冰上静置5min,短暂离心后弃净上清;加入60μl预冷的无水乙醇,振荡悬浮后离心并弃上清;最后加入10‐20μl无水乙醇,充分悬浮备用。
(4)基因枪介导的转化及荧光检测:轰击前首先对基因枪阻挡网、微弹载体等装置进行灭菌处理,并开机预热;将包被质粒的金粉悬浮液均匀点布于微弹载体上,并在超净台上晾干;将载有洋葱表皮的培养皿置于样品室内,调整射程并抽真空;当压力达到一定值时进行轰击;排气后取出样品,封皿。转化后的表皮细胞置于ms固体培养基上,25℃暗培养24h,即可在荧光显微镜下观察gfp的表达情况。观察时,准备好干净载玻片,用胶头滴管滴上一滴蒸馏水,用镊子夹取洋葱表皮放置于载玻片上,多余的水分用滤纸吸掉。
结果分析:fca是一个rna结合蛋白,在拟南芥和大麦中,fca蛋白定位在细胞核中(kumar,jiangetal.2011;macknightetal.2002)。图3中对于ptfca1蛋白保守结构域的分析显示,ptfca1的蛋白质序列发现在293aa位置含有krprp核定位信号(nls),图4的试验结果表明含有核定位信号的pcambia1302+ptfca1‐gfp定位在细胞核中,而空载对照gfp信号则在细胞质个细胞核中都存在。这表明ptfca1基因可能具有转录因子的特性。
实施例3ptfca1基因的表达分析
(1)ptfca1基因在早实枳春梢和夏梢成花转变过程中的表达分析:根据本申请人所在的作物遗传改良国家重点实验室前期对早实枳开花习性的研究,“自剪”期(对“自剪期”的解释参见《发明内容》)是早实枳春梢和夏梢成花转变的关键时期。早实枳的春梢和夏梢都是具有成花能力的。为检测ptfca1在成花发育时期的动态表达,我们分别采集了早实枳成年树体的春梢和夏梢“自剪”前15d、“自剪”中及“自剪”后20d的枝条作为定量检测ptfca1基因表达的材料。rna的提取及反转录见实施例1。定量检测的引物序列为:正向引物:5'‐tcttctacagcactaccaactcc‐3';反向引物:5'‐tgacagcatctgcgctaact‐3'。为进行实时荧光定量检测(为常规方法),取2‐3μg总rna进行反转录,然后按照体积比为1:5的比例对pcr产物稀释,取1μl作为模板,采用lightcycletm480荧光定量pcr仪进行定量分析,每个样品作4个重复,所有结果用β‐actin(ciclev10025866m)进行内参校正。
图5的结果显示ptfca1基因在早实枳的春、夏梢花发育过程中的表达模式一致,ptfca1基因在早实枳夏梢中各个时期的表达量都比春梢高。ptfca1基因在自剪前(营养生长)表达量较高,自剪中(成花转变)的表达量降低,自剪后(生殖生长或叶芽分化)的表达量又升高,这个结果表明ptfca1基因与早实枳的成花发育阶段密切相关。
(2)ptfca1基因在早实枳童期向成年期(果树栽培学上通常将形成花芽的生物学阶段称为开花期,不形成花芽的阶段称之为“童期”,即纯营养生长期)转变过程中的表达模式:选取3个月龄的早实枳实生苗的顶端5个芽作为童期的材料;采集早实枳12个月大(即将开花)春梢前5个芽作为转变期的材料;采集7年树龄的早实枳春梢前5个芽作为成年期的材料。上述取样后置于液氮中速冻并在‐80℃条件下保存备用。rna的提取及反转录见实施例1。结果如图6所示,ptfca1基因在早实枳成年期中的表达量比童期高并且在由童期到成年期发育阶段表达水平呈上升的趋势。结果表明,ptfca1基因可能参与早实枳的童期到成年期的转变过程。ptfca1基因的富集可能维持生殖生长但是不直接导致发育时期的转变。
(3)ptfca1基因在早实枳不同部位的表达:采集成年期的早实枳根、茎、叶、花和果实进行rna的提取及反转录。图7的结果显示,ptfca1基因在早实枳的各个部位都有表达,但是在根中表达量最高,在果中几乎检测不到ptfca1基因的表达。在拟南芥中,fca影响根的长度及侧根的发育(macknight,2002)。表明ptfca1基因在早实枳中也可能参与根的发育。
实施例4ptfca1基因对拟南芥进行遗传转化
(1)载体的构建:为了揭示ptfca1基因在植物生长和发育过程中的生物学功能,本发明将该基因在fca‐1型拟南芥中进行了异位表达分析,确定其是否能够互补突变体晚花的表型。载体的构建同实施例2所示,不同之处是所用的表达载体是pcambia1301(购自澳大利亚的cambia实验室),酶切位点为ncoi和bsteii。把构建好的重组载体命名为pcambia1301+ptfca1。应用冻融法将重组载体pcambia1301+ptfca1导入农杆菌菌株eha105,并将农杆菌菌液置于‐80℃下保存备用,以便应用于后续的转化。
(2)拟南芥的遗传转化:播种前将灭菌的营养土和蛭石按体积比为3:1进行混合拌土,用营养液(营养液的配制按常规方法,例如常用的霍格兰氏营养培养液或改良的霍格兰氏营养培养液)泡湿并分装于营养钵(为本领域常用方法)中。将打破休眠的col(请将第一次出现该基因名称的时候请注明基因登陆号,后面不用注释)拟南芥种子用枪头点播在营养土上面,每角点播2‐3个种子,同时用薄膜进行覆盖保湿。3‐4d后揭膜后,在正常长日照条件(16h光照/8h黑暗)培养,室温23℃左右。拟南芥植株的转化采用花序浸染法(zhangetal.2006),在主枝抽苔4‐5cm时剪去主枝顶端,促进更多侧枝的生长且生长一致,约4‐5d后可进行转化,在转化的前一天浇足水。将保存的农杆菌(eha105)菌种进行活化,28℃,250r/min摇24h。再将活化的菌种接种到50ml含有50mg/l的卡那霉素和25mg/l的利福平的lb液体培养基中,28℃,250r/min过夜,至菌液为金黄色时取出。5000r/min离心10min弃上清,收集细胞,加入5%蔗糖溶液悬浮菌体使od600=0.8~1.0,再向菌液中加入0.05%sliwetl‐77以提高转化的效率,混匀后开放的花序在菌液中浸泡30s‐1min。将转化后的拟南芥植株浇少量水,并置于黑暗条件下培养24h,后转入正常条件下。之后再用上述同样的方法浸染2‐3次,待种子成熟后37℃烘干,并4℃保存。
(3)转基因拟南芥的抗性筛选:将转基因的拟南芥种子在4℃下放置3d后即可筛选,拟南芥种子先用75%酒精进行表面消毒3min,再用2%次氯酸钠溶液消毒8min,无菌水冲洗3次,最后一次用无菌水浸泡种子1‐2小时以促进种子的萌发。然后用灭菌的0.1%的琼脂糖溶液悬浮种子,使种子均匀的铺在含有50mg/l羧苄霉素和25mg/l潮霉素的1/2ms液体(本领域常用配方,不含琼脂类物质)培养基平板上筛选。当幼苗长到15天左右时即可看到筛选出来的苗子,长势好、健壮且根系发达的一般是阳性苗。当幼苗长出4‐5片叶子时,用清水洗掉根上的培养基并移栽于培养土中,待苗子长到一定大小时,对t1代苗进行pcr鉴定。t1代种子会由于染色体的自由组合出现性状分离,故用相同的筛选方法筛选t2代可去除非抗性苗,再对t2代苗进行dna和rna水平上的验证,最后用t3代阳性苗进行表型观察及统计。同时播种ler型、fca‐1型和t2代转基因拟南芥种子,选取其中3个转基因株系各15个单株进行表型观察与分析。
(4)结果分析:
时间的统计是在转基因植株花苔高约为1cm的时候,记录植株的莲座叶与开花时间。根系的观察是ler型、fca‐1型和t2代转基因拟南芥种子点播在1/2ms固体培养基(本领域常用配方,含琼脂类物质)上,生长15d后统计根长并用显微镜观察根尖生长状况。fca‐1型拟南芥是明显晚花(见图8中的a图)且根长较ler型拟南芥短(见表2或见图8中的b图),
表235s::ptfca1在fca‐1拟南芥中的表型统计
当ptfca1基因在fca‐1型拟南芥中超表达后能部分互补fca‐1型拟南芥晚花的表型及根长较短的表型。同时又对ler型、fca‐1型和t2代转基因拟南芥株系的根尖进行了观察和分析(结果见图8中的c图),发现它们的根尖分生区和伸长区存在差异。fca‐1型拟南芥的伸长区较ler型拟南芥有较多的根毛,而且根冠脱落;而ptfca1基因在fca‐1型拟南芥中超表达后,可以互补由fca基因突变产生的这些差异。这些结果从侧面表明ptfca1能促进植物的开花及根系的发育。
主要参考文献
1、aix‐y,ling,sunl‐m,huc‐g,guow‐w,dengx‐xandzhangj‐z.aglobalviewofgeneactivityatthefloweringtransitionphaseinprecocioustrifoliateorangeanditswild‐type[poncirustrifoliata(l.)raf.]bytranscriptomeandproteomeanalysis.gene,2012,510(1):47‐58.
2、
3、gaoy‐g,yangh,zhaoj,jiangy‐jandhuh‐y.autoinhibitorystructureofthewwdomainofhypb/setd2regulatesitsinteractionwiththeproline‐richregionofhuntingtin.structure,2014,22(3):378‐386.
4、kumars,jiangs,jamiskandhillrd.cloningandcharacterizationofbarleycaryopsisfca.physiologiaplantarum,2011,143(1):93‐106.
5、leej,ohm,parkhandleei.soc1translocatedtothenucleusbyinteractionwithagl24directlyregulatesleafy.theplantjournal,2008,55(5):832‐843.
6、liuc,xiw,shenl,tancandyuh.regulationoffloralpatterningbyfloweringtimegenes.developmentalcell,2009,16(5):711‐722.
7、liuc,chenh,erhl,soohm,kumarpp,hanj‐h,liouycandyuh.directinteractionofagl24andsoc1integratesfloweringsignalsinarabidopsis.development,2008,135(8):1481‐1491.
8、macknightr,durouxm,laurier,dijkwelp,simpsonganddeanc.functionalsignificanceofthealternativetranscriptprocessingofthearabidopsisfloralpromoterfca.theplantcell,2002,14(4):877‐888.
9、macknightr,bancrofti,paget,listerc,schmidtr,lovek,westphall,murphyg,shersonsandcobbettc.fca,agenecontrollingfloweringtimeinarabidopsis,encodesaproteincontainingrna‐bindingdomains.cell,1997,89(5):737‐745.
10、marquardts,bossp,hadfieldjanddeanc.additionaltargetsofthearabidopsisautonomouspathwaymembers,fcaandfy.journalofexperimentalbotany,2006,57(13):3379‐3386.
11、sambrookj,fritscheandmaniatist(1989).molecularcloning:alaboratorymanual+coldspringharbor,newyork:coldspringharborlaboratorypress.
12、simpsongganddeanc.arabidopsis,therosettastoneoffloweringtimescience,2002,296(5566):285‐289.
13、simpsongg,lauriere,dijkwelpp,quesadav,stockwellpa,deancandmacknightrc.noncanonicaltranslationinitiationofthearabidopsisfloweringtimeandalternativepolyadenylationregulatorfca.theplantcell,2010,22(11):3764‐3777.
14、srikanthaandschmidm.regulationoffloweringtime:allroadsleadtorome.cellularandmolecularlifesciences,2011,68(12):2013‐2037.
15、zhangx,henriquesr,lins‐s,niuq‐wandchuan‐h.agrobacterium‐mediatedtransformationofarabidopsisthalianausingthefloraldipmethod.natureprotocols,2006,1(2):641‐646.
16、zhangj‐z,aix‐y,sunl‐m,zhangd‐l,guow‐w,dengx‐xandhuc‐g.transcriptomeprofileanalysisoffloweringmolecularprocessesofearlyfloweringtrifoliateorangemutantandthewild‐type[poncirustrifoliata(l.)raf.]bymassivelyparallelsignaturesequencing.bmcgenomics,2011,12(1):63.
17、zhangj‐z,zhaok,aix‐yandhuc‐g.involvementsofpcdandchangesingeneexpressionprofileduringself‐pruningofspringshootsinsweetorange(citrussinensis).bmcgenomics,2014,15:892.
18、梁遂权,王学炷,万同香.早实枳生物学特性及其砧木试验.浙江柑橘,1999,16(3):2。
- 还没有人留言评论。精彩留言会获得点赞!