吡仑帕奈晶型及其制备方法和用途与流程
本发明涉及一种化合物的结晶型,尤其涉及一种吡仑帕奈结晶型,以及其制取该结晶型的方法和在制备α-氨基-3-羟基-5-甲基-4-异唑丙酸受体拮抗剂药物中的应用。
背景技术:
吡仑帕奈是由日本卫材公司(eisai)研发,于2012年12月22日获得fda批准用于年龄12岁和以上癫痫患者部分性发作的辅助治疗。吡仑帕奈是α-氨基-3-羟基-5-甲基-4-异唑丙酸(ampa)受体拮抗剂,它通过抑制突触后ampa受体谷氨酸活性,减少神经元过度兴奋。这是fda批准的首个具有该作用机理的抗癫痫药物。
wo2007072868公开了吡仑帕奈的无水晶型iv,其x射线粉末衍射图在2θ值为15.4°±0.2°、16.6°±0.2°、24.3°±0.2°处具有特征峰。
us2010/324297公开了吡仑帕奈的水合物晶型,其x射线粉末衍射图在2θ值为8.7°±0.2°和12.5°±0.2°处具有特征峰。
us7803818公开了吡仑帕奈的一种无定型。
us7718807公开了吡仑帕奈的盐酸盐、氢溴酸盐、硫酸盐、甲磺酸盐、对本甲磺酸盐、苯磺酸盐、富马酸盐、酒石酸盐、琥珀酸盐和安息香酸盐。
wo2013102897a1公开了吡仑帕奈的无水晶型i、无水晶型iii、无水晶型v、无水晶型vii。无水晶型i的x射线粉末衍射图在2θ值为7.840°、16.139°、9.537°、19.101°、10.301°、15.100°、20.460°、14.260°、24.238°具有特征峰。无水晶型iii的x射线粉末衍射图在2θ值为4.7°±0.1°、7.8°±0.1°、8.7°±0.1°、9.5°±0.1°、10.3°±0.1°、11.7°±0.1°、12.5°±0.1°、14.2°±0.1°、15.1°±0.1°、16.1°±0.1°、17.6°±0.1°、19.1°±0.1°、20.0°±0.1°、20.5°±0.1°、21.1°±0.1°、21.4°±0.1°、22.4°±0.1°、23.3°±0.1°、24.2°±0.1°、25.3°±0.1°、26.4°±0.1°、27.2°±0.1°和28.7°±0.1°处具有特征峰。无水晶型v的x射线粉末衍射图在2θ值为4.5°±0.1°、8.8°±0.1°、11.9°±0.1°、14.9°±0.1°、15.8°±0.1°、17.9°±0.1°、20.2°±0.1°、21.1°±0.1°、23.4°±0.1°、24.6°±0.1°、26.0°±0.1°、27.5°±0.1°和34.0°±0.1°处具有特征峰。 无水晶型vii的x射线粉末衍射图在2θ值为4.5°±0.1°、7.7°±0.1°、8.7°±0.1°、9.4°±0.1°、11.6°±0.1°、12.4°±0.1°、15.0°±0.1°、16.0°±0.1°、17.5°±0.1°、17.8°±0.1°、19.9°±0.1°、20.9°±0.1°、21.4°±0.1°、23.3°±0.1°、24.1°±0.1°、24.4°±0.1°、25.5°±0.1°、27.2°±0.1°、27.6°±0.1°和28.7°±0.1°处具有特征峰。
技术实现要素:
本发明的一个目的在于提供一种吡仑帕奈晶型。
本发明的另一个目的在于提供一种制备吡仑帕奈晶型的方法。
本发明的再一个目的在于提供一种吡仑帕奈晶型在制备α-氨基-3-羟基-5-甲基-4-异唑丙酸(ampa)受体拮抗剂药物中的应用。
本发明所称的“预防”是指在未被临床标准认定的疾病前,各种用于防止疾病发生或发展的手段或措施,包括医学、物理或化学的方法,以阻止和降低疾病各种症状的发生或发展。
本发明所称的“治疗”是指为了阻止和降低疾病的发生或发展,使疾病病程的发展或加重得以抑制、遏制、减轻、改善、减缓、停止、延迟或反转,所描述的保持或用药时的疾病的、紊乱的或病理学状态的各种指标包括减轻或减少症状或并发症,或治愈或消除疾病、紊乱或状况。
本发明所称的“制剂”是指含有本发明提供的各种植物及其提取物和活性部位有利于给药的剂型,如:但不仅限于,水溶液注射剂、粉针剂、丸剂、散剂、片剂、贴剂、栓剂、乳剂、霜剂、凝胶剂、颗粒剂、胶囊剂、气雾剂、喷雾剂、粉雾剂、缓释剂和控释剂等。这些药用辅料既可以是各种制剂中常规使用的,如:但不仅限于,等渗剂、缓冲液、矫味剂、赋形剂、填充剂、粘合剂、崩解剂和润滑剂等;也可以是为了与所述物质相适应而选择使用的,如:乳化剂、增溶剂、抑菌剂、止痛剂和抗氧剂等,这类辅料能有效提高组合物所含化合物的稳定性和溶解性或改变化合物的释放速率和吸收速率等,从而改善本发明化合物在生物体内的代谢,进而增强给药效果。此外,还可以为实现特定的给药目的或方式,如:缓释给药、控释给药和脉冲给药等,而使用的辅料,如:但不仅限于,明胶、白蛋白、壳聚糖、聚醚和聚酯类高分子材料,如:但不仅限于,聚乙二醇、聚氨酯、聚碳酸酯及其共聚物等。所称的“有利于给药”的主要表现有:但不仅限于提高治疗效果、提高生物利用度、降低毒副作用和提高患者顺应性等。
本发明提供的一种吡仑帕奈晶型,命名为晶型b,其在x射线粉末衍射图谱中具有以下2θ测定的特征峰:7.8°±0.2°、9.1°±0.2°、15.0°±0.2°、16.0°±0.2°和17.1°±0.2°。
本发明提供的另一种吡仑帕奈晶型b,其在x射线粉末衍射图谱中具有以下2θ测定的特征峰:4.6°±0.2°、8.6°±0.2°、9.9°±0.2°、11.4°±0.2°、13.1°±0.2°、13.6°±0.2°、18.0°±0.2°、19.6°±0.2°、21.3°±0.2°、22.7°±0.2°和24.5°±0.2°。
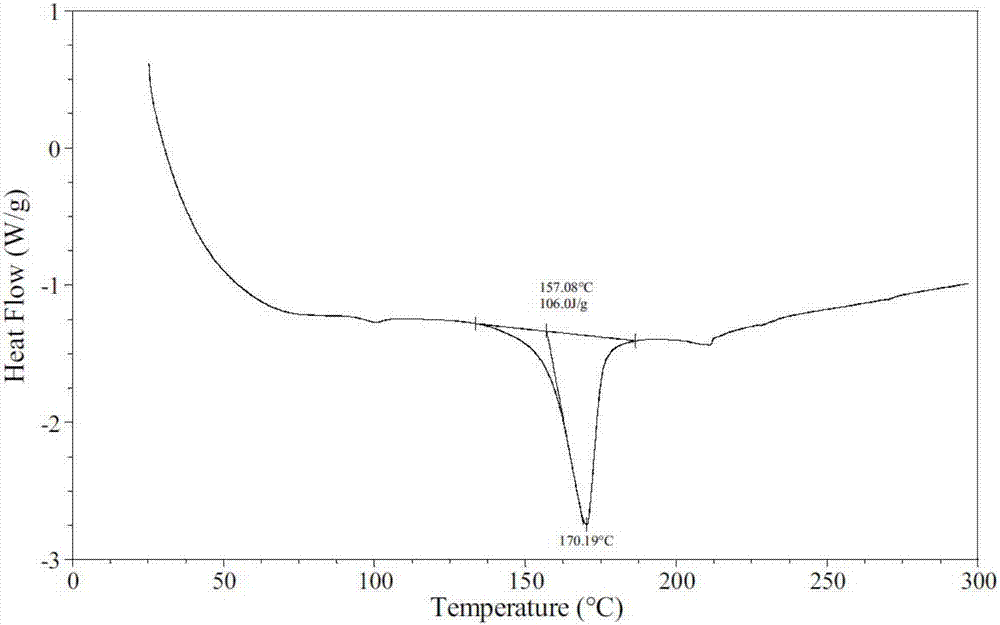
本发明提供的各种吡仑帕奈的晶型b,其差示扫描量热(dsc)分析在加热至170.2℃±0.5℃出现吸热峰。
本发明提供的一种制备各种吡仑帕奈晶型b的方法,将吡仑帕奈的固体与二甲基四氢呋喃配制混悬液,室温下旋转平衡10天~14天即得。
本发明提供的各种吡仑帕奈的晶型b在制备α-氨基-3-羟基-5-甲基-4-异唑丙酸受体拮抗剂药物中的应用,如:以本发明提供的各种吡仑帕奈的晶型b或其药学上可接受的盐为活性成分制成组合物。
本发明技术方案实现的有益效果:
本发明提供的各种吡仑帕奈的晶型b,存储稳定,便于在制备过程中过滤及后续转化。
附图说明
图1为本发明吡仑帕奈的晶型b的x射线粉末衍射图;
图2为本发明吡仑帕奈的晶型b的差示扫描量热图;
图3为本发明吡仑帕奈的晶型b的热重分析图。
具体实施方式
以下详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
实施例1
将1.0g吡仑帕奈的粉末加入到10ml二甲基四氢呋喃配制成混悬液,25℃搅拌14天,再将体系过滤得到固体,即为吡仑帕奈晶型b,其xrpd、dsc和tga谱图与符合图1、 图2和图3所示的特征。
实施例2
将1.0g吡仑帕奈的粉末加入到20ml二甲基四氢呋喃配制成混悬液,30℃搅拌14天,再将体系过滤得到固体,即为吡仑帕奈晶型b,其xrpd、dsc和tga谱图符合图1、图2和图3所示的特征。
实施例3
将1.0g吡仑帕奈的粉末加入到10ml二甲基四氢呋喃配制成混悬液,30℃搅拌10天,再将体系过滤得到固体,即为吡仑帕奈晶型b,其xrpd、dsc和tga谱图符合图1、图2和图3所示的特征。
实施例4吡仑帕奈晶型b的x射线粉末衍射
本实施例所称的x射线粉末衍射图谱是在布鲁克公司d8advance型x射线粉末衍射上采集,本实施例所称的x射线粉末衍射的方法参数如下:
x射线反射参数:cuk
电压:40kv;
电流:40ma;
扫描模式:连续扫描;
扫描范围:4°~40°;
取样步长:0.05°;
每步检测时间:1秒/步。
吡仑帕奈晶型b的x射线粉末衍射如图1所示,其具体数据如表1所示:
表1
由表1可见,吡仑帕奈晶型b在x射线粉末衍射图谱中具有以下2θ测定的特征峰:4.6°、8.6°、9.9°、11.4°、13.1°、13.7°、18.0°、19.5°、21.3°、22.7°和24.5°处具有特征峰。
实施例5吡仑帕奈晶型b的差示扫描量热分析
本实施例所称的差示扫描量热(dsc)分析图在ta公司q2000型仪器采集,参数如下:
温度范围:25℃~300℃;
扫描速率:10℃/min;
保护气体:氮气50.0ml/min。
吡仑帕奈的晶型b在加热至170.2℃附近出现吸热峰,参加图2。
实施例6吡仑帕奈晶型b的热重分析
本实施例所称的热重分析(tga)ta公司q500型的仪器上采集,参数如下:
温度范围:25℃~300℃;
扫描速率:10℃/min;
保护气体:氮气。
吡仑帕奈晶型b加热到50℃时,具有0.45%的重量损失梯度,在加热到150℃时,具有7.65%的重量损失梯度,参见图3。
- 还没有人留言评论。精彩留言会获得点赞!