一种快速检测细菌整合子的LAMP试剂盒及其应用的制作方法
本发明属于分子生物学领域,具体涉及一种快速检测细菌整合子的LAMP试剂盒及其应用。
背景技术:
近年来由于抗生素的广泛应用及不合理的使用,导致细菌的耐药问题越来越严重,多重耐药现象也日益普遍。细菌有多种耐药机制,大量研究表明整合子对细菌多重耐药性具有重要影响。整合子是一种可移动基因元件,包括位点特异性重组功能的基因决定簇,在整合酶的作用下能捕获外来耐药基因,在整合子中可形成多种耐药基因的组合、排列。在抗生素广泛应用背景下,整合子通过捕获各种耐药基因,使耐药性在细菌之间广泛传播,临床中出现的多重耐药细菌与整合子对耐药基因的积累具有密切关联。
整合子根据其整合酶基因序列的不同而分类。其中,I类整合子在多重耐药细菌中最为常见,它与Tn21转座子家族相关;II类整合子以Tn7及其家族为代表,与I类整合子有46%的同源性;III类整合子与I类整合子有61%的同源性,目前只发现碳青霉烯耐药基因位于该整合子上。鉴于整合子在细菌获得耐药性中所起的重要作用,开展整合子检测与分类对于进一步探究细菌耐药性与耐药机制具有重要意义。目前对细菌整合子的检测主要使用常规的PCR方法,该方法不仅需要复杂的仪器设备,且扩增产物需通过琼脂糖凝胶电泳与测序分析,费时较长,成本高,不适合进行批量化快速检测。因此亟需研发操作简便、准确快速的检测技术。
环介导等温扩增技术(LAMP)是一种新型的分子检测方法,其特点是利用链置换型DNA聚合酶在等温条件下可以特异地大量扩增靶序列。此外,LAMP扩增产物可通过荧光染料实现可视化判定。因此,LAMP技术具有灵敏性高、特异性好、反应时间短、判定结果方便、不需要昂贵仪器等诸多优势。为快速、准确检测细菌整合子提供了新方法。
技术实现要素:
针对现有技术中的不足,本发明进行了深入研究,提供了一种快速检测细菌整合子的LAMP试剂盒及其应用。
本发明另一目的在于提供一种用于检测细菌整合子的LAMP引物组。
本发明具体通过以下技术方案实现:
一种快速检测细菌整合子的LAMP试剂盒,包括:10×LAMP缓冲液;10mM dNTPs;50μM钙黄绿素;8000U/mLBstDNA聚合酶;外引物组(1-F3、1-B3;2-F3、2-B3;3-F3、3-B3);内引物组(1-FIP、1-BIP;2-FIP、2-BIP;3-FIP、3-BIP);无菌去离子水。
所述的10×LAMP缓冲液含有200mM Tris-HCl(pH 8.8,25℃)、100mM氯化钾、100mM硫酸铵、20mM硫酸镁、8M甜菜碱和体积百分浓度为1%的曲拉通X-100。
所述的LAMP检测引物序列如下所示,其中外引物和内引物的摩尔浓度比为1:8。
本发明LAMP反应条件为:65℃恒温反应50min,并在80℃持续10min。
本发明的结果判定方法为:反应结束后用肉眼观察,阳性菌株颜色变为绿色,阴性菌株颜色为橙色。
本发明所述的整合子为I类整合子、II类整合子和III类整合子。
相比于现有技术,本发明的有益效果为:
本研究提供了一种针对细菌整合子的LAMP检测试剂盒及其检测方法。该试剂盒及检测方法可用于细菌整合子的快速检测与分型。本发明试剂盒具有简便快速、特异性强、灵敏度高的优点,此外本发明试剂盒实现了结果判定可视化,根据反应结束后颜色的差异,即可判定结果,非常适合现场快速检测。
附图说明
图1为细菌整合子LAMP检测电泳图。图中,泳道M为DL-5000DNAMarker;泳道1为I类整合子阳性菌株沙门氏菌SAL;泳道2为II类整合子阳性菌株大肠杆菌EC;泳道3为III类整合子阳性菌株粘质沙雷氏菌SM;泳道4为阴性对照。
图2(A)为LAMP方法I类整合子敏感性试验电泳图。图中,泳道M为DL-5000DNAMarke,泳道1-7分别表示DNA量为6.6×104pg/反应,6.6×103pg/反应,6.6×102pg/反应,6.6×101pg/反应,6.6×100pg/反应,6.6×10-1pg/反应,6.6×10-2pg/反应,泳道8为阴性对照。
图2(B)为LAMP方法II类整合子敏感性试验电泳图。图中,泳道M为DL-5000DNAMarke,泳道1-7分别表示DNA量为4.3×104pg/反应,4.3×103pg/反应,4.3×102pg/反应,4.3×101pg/反应,4.3×100pg/反应,4.3×10-1pg/反应,4.3×10-2pg/反应,泳道8为阴性对照。
图2(C)为LAMP方法III类整合子敏感性试验电泳图。图中,泳道M为DL-5000DNAMarke,泳道1-7分别表示DNA量为9.2×104pg/反应,9.2×103pg/反应,9.2×102pg/反应,9.2×101pg/反应,9.2×100pg/反应,9.2×10-1pg/反应,9.2×10-2pg/反应,泳道8为阴性对照。
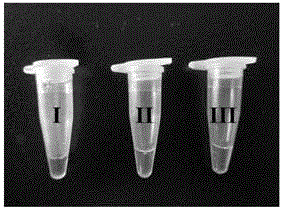
图3(A)为目视法判定I类整合子阳性结果的示意图。
图3(B)为目视法判定II类整合子阳性结果的示意图。
图3(C)为目视法判定III类整合子阳性结果的示意图。
图3(D)为目视法判定I、II、III类整合子均为阴性结果的示意图。
具体实施方式
下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均在本发明的保护范围内。
实施例1细菌整合子三重LAMP检测方法的建立
1、供试菌株
整合子阳性菌株沙门氏菌SAL(含I类整合子)、大肠杆菌EC(含II类整合子)和粘质沙雷氏菌SM(含III类整合子)均由江苏省家禽科学研究所保存提供。
2、LAMP引物组设计
根据GenBank中的细菌整合子(I、II、III)基因序列,通过分析后按照LAMP反应原理进行引物组的设计,结果优化得到6对引物,其中1-F3和1-B3为I类整合子LAMP检测外引物,1-FIP和1-BIP为I类整合子LAMP检测内引物;2-F3和2-B3为II类整合子LAMP检测外引物,2-FIP和2-BIP为II类整合子LAMP检测内引物;3-F3和3-B3为III类整合子LAMP检测外引物,3-FIP和3-BIP为III类整合子LAMP检测内引物。具体序列如表1所示。
表1 细菌整合子LAMP检测引物序列
3、LAMP扩增模板制备
采用煮沸法提取细菌DNA:取过夜培养菌液1mL,12000rpm离心3min,弃去上清;加入1mL 1×PBS缓冲液,12000rpm离心3min,尽量弃净上清液;重复以上步骤一遍;向管底加入100μL无菌超纯水,剧烈涡旋混匀,100℃加热10min,然后迅速冷却(置于冰箱-20℃环境中)10min;8000rpm离心5min,将上清液转移至新的离心管中,置于-20℃保存备用。
4、LAMP检测试剂的配制
(1)10×LAMP缓冲液:包含200mM Tris-HCl(pH 8.8,25℃)、100mM氯化钾、100mM硫酸铵、20mM硫酸镁、8M甜菜碱和体积百分浓度为1%的曲拉通X-100。
(2)10mM dNTPs;
(3)50μM钙黄绿素试剂;
(4)8000U/mL Bst DNA聚合酶;
(5)LAMP引物(外引物浓度均为5pmol/μL,内引物浓度均为40pmol/μL);
(6)阳性对照:含有整合子的细菌模板DNA;
(7)阴性对照:灭菌双蒸水。
5、三重LAMP检测体系
经反复筛选与优化后,得到细菌整合子三重LAMP检测体系(如表2所示)。
表2:三重LAMP反应体系
6、LAMP反应条件与结果的判定
将LAMP反应体系配制于PCR管中,充分混匀后置于恒温环境(65℃)反应50min,并在80℃维持10min,取出。反应结束后使用2%浓度琼脂糖凝胶电泳检测,阳性则可呈现特异的梯状条带(如图1,不同类型整合子电泳检测图),阴性则无此现象。也可用肉眼观察,阳性菌株颜色变为绿色,阴性菌株颜色为橙色。
实施例2特异性评价
选取整合子阳性菌株沙门氏菌SAL(含I类整合子)、大肠杆菌EC(含II类整合子)和粘质沙雷氏菌SM(含III类整合子),以及整合子阴性菌株大肠杆菌ATCC25922、金黄色葡萄球菌ATCC25923、铜绿假单胞菌ATCC27853、鼠伤寒沙门氏菌ATCC14028、肠炎沙门氏菌ATCC13076(均由江苏省家禽科学研究所保存提供),用实施例1的方法进行本发明LAMP检测方法的特异性评价,结果所有整合子阳性细菌的检测结果均为阳性,所有整合子阴性细菌的检测结果均为阴性(表3)。
表3 特异性评价实验结果
注:表格结果栏中:“+”表示阳性;“-”表示阴性。
进一步将I、II、III类整合子扩增产物送华大基因公司进行DNA测序,结果序列如下:
I类整合子:
ATGCCCGTTCCATACAGAAGCTGGGCGAACAAACGATGCTCGCCTTCCAGAAAACCGAGGATGCGAACCACTTCATCCGGGGTCAGCACCACCGGCAAGCGCCGCGACGGCCGAGGTCTTCCGATCTCCTGAAGCCAGGGCAGATCCGTGCACAGCACCTTGCCGTAGAAGAACAGCAAGGCCGCCAATGCCTGACGATGCG
II类整合子:
TAACAGAGGGTAGCCGTCTAGGCTTGCTTGCAGGGATATAATCAATATCGCCCAACGGCTGTTGTAAAAACCTGTTGTACAAAAAAGCTAGGGCATTTAAAGCGATTTTCTGC GTGTTTATGGCTACATGTCTGCTGTTTGCTAAGCTGGATAAAAACAGCCTGACCTCTTCACTGCCCATGGTCTGAGGATGACGTTTTTTGTGAAACAGAATAAAACGCT
III类整合子:
TGAGTGGCGCAGGGTGTGGACAGATACGTGTTTGGCAATGCCAGCCTGAACTACCGCTTTTTTTAGTTGCCGGTTCAGTCTTTCCTCAAACAAGTGGTGGCGGCGCTCAACGCCGGTTTGTGGGTCCACAGACAGCTTGGCCGATGGAAACACCCAGAACCAGGCCCAGCTCTCGCCCGCCCTGGGGTACTTGCGCTCCAGTGCATGAGGCAGATACACGCC
将上述测序结果通过NCBI网站中BLAST进行序列同源性比较,结果显示本发明方法克隆得到的序列和已登陆的整合子基因序列的核苷酸序列同源性均超过99%,表明本发明方法克隆得到的基因分别是I、II、III类整合子基因片段,因此本发明方法具有很好的特异性。
实施例3敏感性评价
分别选取整合子阳性菌株沙门氏菌SAL(含I类整合子)、大肠杆菌EC(含II类整合子)和粘质沙雷氏菌SM(含III类整合子),制备敏感性试验模板。经核酸浓度测算后,将模板DNA进行10倍梯度稀释,以每个稀释度的基因组DNA作为模板,分别进行LAMP敏感性试验。
从图2的LAMP敏感性试验电泳检测结果可以看出,针对不同类型整合子的LAMP敏感性试验,在第6条泳道均可出现较清晰的条带(所对应DNA浓度分别为0.66pg/反应、0.43pg/反应和0.92pg/反应),而在第7条泳道开始未出现特异性扩增条带。因此,本发明建立的LAMP检测方法的灵敏度分别为0.66pg/反应(I类整合子)、0.43pg/反应(II类整合子)和0.92pg/反应(III类整合子)。
实施例4一种快速检测细菌整合子的LAMP试剂盒的组装
使用下列成分组成用于检测细菌整合子的LAMP试剂盒:LAMP检测引物组(根据表1中序列合成引物,用灭菌双蒸水稀释混合,其中外引物浓度为5pmol/μL,内引物浓度为40pmol/μL);10×LAMP buffer(其组分包括200mM Tris-HCl、100mM氯化钾、100mM硫酸铵、20mM硫酸镁、8M甜菜碱和体积百分浓度为1%的曲拉通X-100);8000U/mL Bst DNA聚合酶;10mM dNTPs;50μM钙黄绿素试剂;灭菌双蒸水。
将以上所涉试剂和产品共同包装,再配以产品使用说明书(包括保存条件、反应程序和结果判定方法等),组装成本发明所述的一种快速检测细菌整合子的LAMP试剂盒。
实施实例5临床分离菌株整合子的筛查
对临床分离自畜禽病料、饲料、食品和环境的358株细菌(含185株沙门氏菌,94株大肠杆菌,36株变形杆菌,21株肺炎克雷伯菌,12株铜绿假单胞菌,6株志贺氏菌和4株粘质沙雷氏菌),应用本发明试剂盒先进行整合子的筛查。具体步骤包括,按实施例1的方法配制三重LAMP反应体系,将反应体系混匀后置于PCR反应仪中,65℃反应50min,并在80℃持续10min后取出,通过观察颜色判定结果(如颜色变为绿色,则说明样品中含有整合子;颜色仍为橙色,说明样品不含整合子)。对筛查含有整合子的菌株进一步进行整合子的分型研究,分别按表4、表5和表6中的组分配制I类整合子、II类整合子、III类整合子的单重LAMP检测体系进一步检测(反应条件与结果判定方法均与三重LAMP相同)。选取沙门氏菌SAL(含I类整合子)、大肠杆菌EC(含II类整合子)和粘质沙雷氏菌SM(含III类整合子)作为阳性对照,大肠杆菌ATCC25922、金黄色葡萄球菌ATCC25923、铜绿假单胞菌ATCC27853、鼠伤寒沙门氏菌ATCC14028、肠炎沙门氏菌ATCC13076作为阴性对照(如图3,目视法检测示意图)。
表4 I类整合子LAMP反应体系
表5 II类整合子LAMP反应体系
表6 III类整合子LAMP反应体系
检测结果见表7,在358株细菌中共有192株检测到整合子,其中I类整合子阳性菌株数最高,达187株;II类整合子阳性菌株数仅5株(仅出现于大肠杆菌、肺炎克雷伯菌和铜绿假单胞菌);未检测到III类整合子阳性菌株;也未发现I类整合子和II类整合子均为阳性的菌株。针对不同种属细菌而言,粘质沙雷氏菌整合子阳性率最高(100%),其次是铜绿假单胞菌(75.0%)和大肠杆菌(67.0%),阳性率最低的是变形杆菌(33.3%)。
表7 细菌整合子LAMP检测结果
以上所述实施例只是本发明的较佳实例,而没有限制本发明的实施范围。因此,凡是根据本发明内容的实质所作出的等效修改,都应属于在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!