血管瘤集落形成细胞的制作方法
发明领域
本发明总的涉及产生和扩增人血管瘤集落形成细胞的方法。本发明更特别涉及利用两步处理法体外产生和扩增人血管瘤集落形成细胞的方法,第一步,在存在至少一种足够将人胚胎干细胞诱导分化成胚状体的量的生长因子的情况下,在无血清培养基中培养所述胚胎衍生干细胞;第二步,在存在至少一种足够使人血管瘤集落形成细胞在含胚状体的培养基中扩增的量的生长因子的情况下,在无血清培养基中培养所述胚状体。本发明还涉及人血管瘤集落形成细胞的制备。本发明还涉及使人血管瘤集落形成单位沿着造血细胞或内皮细胞谱系分化的方法,以及制备部分或完全分化自血管瘤集落形成细胞的细胞类型的方法。血管瘤集落形成细胞及由其分化出的细胞具有各种体内外用途。能够在体外如此大批量地产生扩增的人血管瘤集落形成细胞,首次揭示了可大量衍化人血管瘤集落形成衍生细胞类型的潜力,所述人血管瘤集落形成衍生细胞类型例如人造血干细胞、或内皮细胞、分化的造血细胞(例如红细胞和血小板),它们将具有多种治疗用途。此外,可将通过本发明衍生出的大量人血管瘤集落形成细胞以全新的治疗策略用于治疗造血细胞和内皮细胞紊乱或用于血液库存。
发明背景
造血干细胞(HSC)能够自我更新,并能产生全部血细胞谱系。这些细胞位于骨髓,构成成人造血系统的基础。这些细胞的移植代表着现在临床上最常见的基于细胞的治疗。
HSC移植被用于治疗患急性或慢性白血病,再生障碍性贫血和多种免疫缺陷综合症,以及多种非血液恶性肿瘤和自身免疫紊乱的患者。对于患血液恶性肿瘤的患者,HSC移植可以拯救患者免于治疗导致的发育不全(可以发生在高剂量化学疗法和/或放射疗法后)。
尽管HSC移植被普遍应用于临床,但HSC的三种主要来源(人骨髓、外周血和脐带血)有限,因为需要成体HSC移植的患者中的三分之二缺乏良好匹配的供者。例如,对于任何一个特定的患者,其兄弟姐妹的人类白细胞抗原(HLA)与其相匹配的机会只有25%。
HLAs是位于细胞表面的蛋白,它帮助免疫系统识别哪些细胞是自我的(属于自身),哪些细胞是非我的(外源或来自于体外)。HLA蛋白由基因簇编码,所述基因簇形成位于人6号染色体的被称为主要组织相容性复合体(或MHC)的区域,由MHC基因座编码的这些蛋白在移植排斥中发挥重要作用。因此,也将HLA蛋白称为MHC蛋白。虽然使移植物的MHC分子与受者的MHC分子匹配能显著提高临床移植的成功率,但它不能杜绝排斥,即使移植发生在HLA相同的兄弟姐妹之间。这样的排斥可能由次要组织相容性抗原之间的差异触发。这些多态性抗原通常是与位于移植组织细胞上的MHC分子结合的"非我"的肽,而除非使用免疫抑制药物,即便MHC抗原匹配,次要组织相容性抗原的差异也常会导致移植受者的免疫系统最终排斥移植物。
各有三种类型的I型HLA和II型HLA。将I型和II型HLA匹配者(一般是兄弟姐妹)称为相关供者。存活率升高与受者和供者间I型HLA-A、HLA-B、HLA-C以及II型HLA-DRB1和HLA-DQB1的匹配程度相关(Morishima等,2002Blood(99):4200-6)。对于没有相匹配的相关供者的患者而言,可通过搜索供者库来提供具有HLA类型匹配的人。然而需要细胞或组织移植(例如HSC移植)的人数远远大于现存的适合于移植的细胞和组织供应。在这种情况下,常常不可能获得受者MHC蛋白和移植物的MHC蛋白之间的良好匹配便不奇怪了。所以,许多移植受者必需等待MHC匹配的移植物可获得,或者接受MHC不匹配的移植物,忍受更大剂量的免疫抑制药物,却仍然要冒排斥的风险。因此能够产生和操作HSC,和/或诱导受者对移植物的耐受,将会大大利于人类疾病的治疗和处理。
根据在鸟胚胎,以及随后在蛙和哺乳动物中的研究工作,已证明血液和内皮的发育程序紧密相关。例如内皮细胞和造血细胞同时形成,在卵黄囊血岛中相距很近。所述卵黄囊血岛衍生自定居于卵黄囊的中胚层细胞的聚集物。这些聚集物的中心生成胚胎造血细胞,而外周群分化为内皮细胞,它形成围绕内部血细胞的血管系统。这些观察结果支持内皮细胞和造血细胞具有共同祖先的观点。
另外,在斑马鱼和小鼠胚胎中,内皮谱系和造血谱系共享某些基因的表达,例如FIk1、Flt1、Tie1、Tie2、CD34、Sc1和Runx1(Fina等,1990Blood(75):2417-2426;Millauer等,1993Cell(72):835-846;Yamaguchi等,1993Development(118):489-498;Anagnostou等,1994PNAS USA(91):3974-3978;Kallianpur等,1994Blood(83):1200-12081;Young等,1995Blood(85):96-105,Asahara等,1997Science(275):964-967;Kabrun等,1997Development(124):2039-2048)。同样,某些基因突变影响内皮细胞和造血细胞的发育(Shalaby等,1995Nature(376):62-66;Robb等,1995PNAS USA(92):7075-7079;Shivdasani等,1995Nature(373):432-434,Stainier等,1995Development(121):3141-3150;Bollerot等,2005APMIS(113):790-803)。而且,Flk1或者Flt1的缺失(它们两个都是血管内皮生长因子(VEGF)的受体)导致破坏小鼠胚胎的造血和内皮发育。
已有文献报导从小鼠胚胎干细胞体外生成小鼠成血管细胞(Choi等,1998Development 125:727-732)。而且已从人ES细胞衍生出能产生造血和内皮两种细胞的人前体细胞(Wang等,2004Immunity(21):31-41和Wang等,J Exp Med(201):1603-1614),但是量少,最多数百个细胞。此外,尚无体外扩增成血管细胞前体细胞的方法或条件。
因此需要一种方法产生和扩增大量人成血管细胞以及成血管细胞衍生细胞类型(即造血细胞和内皮细胞),还需要所有含有所述量的成血管细胞或其衍生细胞类型的溶液/混合物。所述方法能增加细胞移植的有效性,也能用于各种其他治疗,例如诱导免疫耐受性。
另一个急需用途是用于输血的血液。红十字会及其他血液供应单位报道几乎经常血液短缺。这种情况在血型独特的患者,Rh+患者,或者事故或灾难导致的大量伤亡中尤甚。另外,战时军队急需用于治疗战争相关的创伤的可用血液。本发明提供用于血液库存和输血的分化的造血细胞。本发明的细胞和方法将更安全可靠,优点在于无需传统的对献血者的依赖,并将有助于预防可用血液的严重短缺。
发明概述
本发明通过提供体外产生和扩增人成血管细胞或血管瘤集落形成细胞的方法来克服了上述问题。根据本文公开的新方法扩增人成血管细胞或血管瘤集落形成细胞的能力允许产生可被用于各种治疗用途的细胞。另外,本发明提供产生可用于治疗用途的人成血管细胞或血管瘤集落形成谱系细胞(即,造血细胞和内皮细胞)的方法。本发明的方法还被用于产生大量可以商业规模应用的人成血管细胞或血管瘤集落形成细胞以及造血细胞和内皮细胞,及其分化细胞。
本发明提供体外产生和扩增人血管瘤集落形成细胞的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,在无血清培养基中培养包含所述胚胎衍生干细胞的细胞培养物;和
(b)向所述含胚状体的培养物中加入至少一种生长因子,并继续在无血清培养基中培养所述培养物,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增,
其中在所述方法步骤(a)和(b)的整个过程中使所述干细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
本发明也提供体外产生和扩增人血管瘤集落形成细胞的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,在无血清培养基中培养包含所述胚胎衍生细胞的细胞培养物;
(b)向所述含胚状体的培养物中加入至少一种生长因子,并继续在无血清培养基中培养所述培养物,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增,
(c)将所述胚状体解聚为单细胞;
(d)向所述含所述单细胞的培养物中加入至少一种生长因子,并继续在无血清培养基中培养所述培养物,其中所述生长因子的量足够使人血管瘤集落形成细胞在含所述单细胞的培养物中扩增,
其中在所述方法步骤(a)-(d)的整个过程中使所述干细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
在本发明的某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。
在本发明的产生和扩增人血管瘤集落形成细胞的方法的某些实施方案中,所述生长因子是包含同源异型盒蛋白,或功能变体,或其活性片段的蛋白。在某些实施方案中,所述同源异型盒蛋白是包括HOXB4,或其功能变体,或活性片段的蛋白。HOXB4可以是哺乳动物HOXB4,包括小鼠和人HOXB4。所述HOXB4蛋白可以是全长HOXB4蛋白。再一个实施方案中,所述HOXB4包括SEQ ID NO:1或SEQ ID NO:4的氨基酸序列。
在本发明的产生和扩增人血管瘤集落形成细胞的方法的某些实施方案中,所述包括HOXB4的生长因子是包括HOXB4和蛋白转导域(PTD)的融合蛋白。再一个实施方案中,通过接头连接所述PTD和HOXB4。再一个实施方案中,所述PTD是TAT蛋白,其功能变体或活性片段(包括TAT多肽)。在某些实施方案中,所述TAT蛋白包括SEQ ID NO:14的氨基酸序列。再一个实施方案中,所述PTD包括如SEQ ID NO:14所示的TAT多肽的一个或多个拷贝。在某些实施方案中,所述PTD是SEQ ID NO:15。
在本发明的产生和扩增人血管瘤集落形成细胞的方法的某些实施方案中,所述生长因子选自血管内皮生长因子(VEGF)、骨形态生成蛋白(BMP)、干细胞因子(SCF)、Flt-3L(FL)促血小板生成素(TPO)和促红细胞生成素(EPO)。再一个实施方案中,在培养含有hES细胞的细胞培养物的0-48小时内将血管内皮生长因子(VEGF)或骨形态生成蛋白(BMP),或两者加入到培养步骤(a)。又一个实施方案中,从开始步骤(a)的48-72小时内将所述干细胞因子(SCF)、Flt-3L(FL)或促血小板生成素(TPO),或它们的任何组合加入到含有hES细胞的细胞培养物中。
在本发明的产生和扩增人血管瘤集落形成细胞的方法的某些实施方案中,将包含HOXB4蛋白或其功能变体或活性片段(或结构域)的生长因子加入到步骤(s),其中加入所述蛋白数次,例如每日一次或隔日一次。
在本发明的产生和扩增人血管瘤集落形成细胞的方法的某些实施方案中,从开始步骤(a)的48-72小时内将所述包含同源异型盒蛋白的生长因子加入到步骤(b)。在本发明的方法的某些实施方案中,从开始步骤(a)的48-72小时内将所述H0XB4蛋白或其功能变体或活性片段加入到步骤(b)。
在某些实施方案中,本发明的产生和扩增人血管瘤集落形成细胞的方法还包括向步骤(b)中加入促红细胞生成素(EPO)的步骤。在某些实施方案中,在0016段描述的本发明的方法还包括向步骤(b)和(d)中加入促红细胞生成素(EPO)的步骤。
在某些实施方案中,本发明的产生和扩增人血管瘤集落形成细胞的方法还包括纯化和/或分离人血管瘤集落形成细胞的步骤(s)。可用带抗CD71抗体的免疫亲和柱层析纯化所述血管瘤集落形成细胞。可按大小和/或形态分离所述血管瘤集落形成细胞。
在本发明的产生和扩增人血管瘤集落形成细胞的方法的某些实施方案中,所述包含人胚胎衍生细胞的细胞培养物来源于人胚胎干细胞文库,其中所述人胚胎干细胞库包括干细胞,每个都是人群中至少一种MHC等位基因的半合子或纯合子,其中所述干细胞文库的每个成员都是相对于所述库中其他成员有不同的一套MHC等位基因的半合子或纯合子。再一个实施方案中,所述人胚胎干细胞文库包括干细胞,所述干细胞是人群中所有MHC等位基因的半合子或纯合子。这些方法产生人血管瘤集落形成细胞文库,每个都是人群中至少一种MHC等位基因的半合子或纯合子,其中所述干细胞文库的每个成员豆是相对于所述库中其他成员不同的一套MHC等位基因的半合子或纯合子。再一个实施方案中,这些方法产生人血管瘤集落形成细胞文库,所述人血管瘤集落形成细胞是人群中所有MHC等位基因的半合子或纯合子。因此,本发明也提供通过这些方法产生的人血管瘤集落形成细胞文库。可如下使用所述文库。
本发明提供方法处理需要治疗的患者,涉及将人造血干细胞或人内皮细胞施用给所述患者,包括步骤:
(a)选择所述患者;
(b)鉴定在所述患者细胞表面表达的MHC蛋白;
(c)提供之前的0024段描述的人血管瘤集落形成细胞文库;
(d)从所述文库中筛选与所述患者细胞上的所述患者MHC蛋白匹配的人血管瘤集落形成细胞;
(e)将步骤(d)中鉴定的所述人血管瘤集落形成细胞根据需求分化成人造血干细胞、内皮细胞或两者;
(f)将从步骤(e)中得到的所述人造血干细胞、内皮细胞或两者施用给所述患者。可以在区域中心实施此方法,所述区域中心例如医院或医疗中心,或任何其他适当机构。
在某些实施方案中,本发明的产生和扩增人血管瘤集落形成细胞的方法还包括使所述人血管瘤集落形成细胞在适于将所述人血管瘤集落形成细胞诱导分化成人造血干细胞的条件下生长的步骤。
在某些实施方案中,本发明的产生和扩增人血管瘤集落形成细胞的方法还包括使所述人血管瘤集落形成细胞在适于将所述人血管瘤集落形成细胞诱导分化成人内皮细胞的条件下生长的步骤。再一个实施方案中,所述适于将所述人血管瘤集落形成细胞诱导分化成人内皮细胞的条件包括让所述人血管瘤集落形成细胞在平板接种纤维连接蛋白的培养平板上生长。
本发明的某些实施方案中,所述产生和扩增人血管瘤集落形成细胞的方法产生至少10,000个人血管瘤集落形成细胞,至少50,000个人血管瘤集落形成细胞,至少100,000个人血管瘤集落形成细胞,至少500,000个人血管瘤集落形成细胞,至少1×106个人血管瘤集落形成细胞,至少2×106个人血管瘤集落形成细胞,至少3×106个人血管瘤集落形成细胞,或至少4×106个人血管瘤集落形成细胞。这些方法产生可以包含10,000到4百万个人血管瘤集落形成细胞的细胞溶液。
因此,本发明也提供包含至少10,000个人血管瘤集落形成细胞,至少50,000个人血管瘤集落形成细胞,至少100,000个人血管瘤集落形成细胞,至少500,000个人血管瘤集落形成细胞,至少1×106个人血管瘤集落形成细胞,至少2×106个人血管瘤集落形成细胞,至少3×106个人血管瘤集落形成细胞,或至少4×106个人血管瘤集落形成细胞的人血管瘤集落形成细胞(可在无血清培养基中生长)的溶液。可将这些溶液注射给受试者。这些溶液可适用于冷冻。这些溶液可以不含血清。这些溶液中的人血管瘤集落形成细胞至少能够分化成造血细胞和内皮细胞,但也具有分化成其他细胞类型的更大的发育潜力。本发明也提供这些溶液在制备用于治疗可通过施用血管瘤集落形成细胞、造血细胞或内皮细胞来治疗的疾病的药物中的用途。
本发明也提供产生适于注射给患者的人血管瘤集落形成细胞溶液的方法,包括分离如前所述的细胞溶液的步骤,和将所述细胞置于适合注射给患者的溶液的步骤。本发明也提供产生适于冷冻的人血管瘤集落形成细胞溶液的方法,包括分离如前所述的细胞溶液的步骤,和将所述细胞置于适合冷冻的溶液的步骤。
本发明也提供将人造血干细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供由本发明方法产生和扩增的人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人造血干细胞;和
(d)将所有所述人造血干细胞中的一些施用给患者。
本发明也提供将人造血干细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人造血干细胞;和
(d)将一些或所有所述人造血干细胞施用给所述患者。
本发明也提供将人内皮细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供由本发明方法产生和扩增的人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞;和
(d)将一些或所有所述人内皮细胞施用给所述患者。
本发明也提供将人内皮细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞;和
(d)将一些或所有所述人内皮细胞施用给所述患者。
在某些实施方案中,所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
本发明也提供治疗需要治疗的患者的内皮细胞紊乱的方法,包括步骤:
(a)选择有此需要的患者,
(b)提供由上述方法产生和扩增的人血管瘤集落形成细胞,
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞,和
(d)将一些或所有所述人内皮细胞施用给所述患者。
本发明也提供治疗需要治疗的患者的内皮细胞紊乱的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞;和
(d)将一些或所有所述人内皮细胞施用给所述患者。
在某些实施方案中,所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
有待用这些方法治疗的内皮细胞紊乱包括心肌梗塞、中风、动脉粥样硬化和缺血。所述缺血可发生在脑、四肢、心脏、肺、皮肤和眼。
本发明提供体外产生人造血干细胞的方法,包括步骤:
(a)提供由本发明方法产生和扩增的人血管瘤集落形成细胞;和
(b)使所述人血管瘤集落形成细胞在适于将所述人血管瘤集落形成细胞诱导分化成人造血干细胞的条件下生长。
本发明提供体外产生人内皮细胞的方法,包括步骤:
(a)提供由本发明方法产生和扩增的人血管瘤集落形成细胞;和
(b)使所述人血管瘤集落形成细胞在适于将所述人血管瘤集落形成细胞诱导分化成人内皮细胞的条件下生长。
本发明也提供扩增血管瘤集落形成细胞的方法,包括在存在足够支持所述血管瘤集落形成细胞增殖的量的包括同源异型盒蛋白(例如HOXB4)或其功能等效物或其活性片段的蛋白的情况下,使哺乳动物血管瘤集落形成细胞在无血清培养基中生长。所述待扩增的血管瘤集落形成细胞可以从脐带血、外周血或骨髓富集、纯化,或者分离。所述血管瘤集落形成细胞可以是人血管瘤集落形成细胞。所述方法可以产生包含10,000到4×106个,或者更多的人血管瘤集落形成细胞的溶液。本方法使用的HOXB4蛋白可以是适用于本发明的产生和扩增人血管瘤集落形成细胞的方法的任何蛋白。
本发明也提供利用由本发明方法产生和扩增,或扩增的人血管瘤集落形成细胞诱导免疫耐受性的方法。筛选与同种异体移植物共享组织相容性标记物的耐受性人血管瘤集落形成细胞,并可将所述耐受性人血管瘤集落形成细胞于同种异体移植或细胞处理(再生患者需要的细胞功能)前,或与同种异体移植或细胞处理同时施用给人受者。产生的免疫耐受性随即降低对同种异体移植物或细胞治疗的急性或慢性排斥的风险。
由本文公开的方法产生的大量血管瘤集落形成细胞能够除去耐受方案中的毒性预处理步骤。可在植入移植物,或植入与供者血管瘤集落形成细胞匹配的器官、组织或细胞前给人受者施用供者的人血管瘤集落形成细胞。可从同一供者获得所述人血管瘤集落形成细胞和移植物。所述移植物可以来源于分化的供者人血管瘤集落形成细胞。也可从不同供者获得所述人血管瘤集落形成细胞和移植物,其中所述供者之间相匹配。可将所述人血管瘤集落形成细胞施用给人受者,以在有此需要的受者中诱导耐受性。
在某些实施方案中,本发明涉及诱导人受者对供者同种异体移植物的耐受性的方法,其中所述方法包括步骤(a)给受者施用抑制T细胞共刺激的制剂(b)将由本文描述的方法产生和扩增,或扩增的人血管瘤集落形成细胞导入所述受者,和(c)将所述同种异体移植物移植给受者。所述人血管瘤集落形成细胞(供者细胞)促进所述受者接受所述同种异体移植物。在某些实施方案中,抑制T细胞共刺激的制剂是抑制或阻断CD40配体-CD40共刺激相互作用的制剂。所述方法还可包括施用抑制CD28-B7相互作用的制剂。所述方法可包括或不包括胸腺照射和/或T细胞耗尽或灭活。上述方法也可在没有全身照射产生的造血空间(hematopoietic space)的情况下产生混合嵌合现象。
本发明也提供促进人受者对供者同种异体移植物的耐受性的方法,其中所述方法包括步骤:(a)在所述受者中制造胸腺空间(thymic space);(b)在所述受者中耗尽或灭活供者反应性T细胞;(c)将所述供者人血管瘤集落形成细胞或与所述供者匹配的人血管瘤集落形成细胞导入受者;和(d)将所述同种异体移植物移植给受者,其中所述供者血管瘤集落形成细胞诱导对所述同种异体移植物的耐受性。在某些实施方案中,所述方法不包括制造造血空间的照射。所述方法可包括通过给受者施用至少一种选自胸腺照射、类固醇、皮质激素、布喹那(brequinar)、或免疫抑制剂或药物来制造胸腺空间。
本发明也提供产生适用于输血的细胞的方法。例如本发明提供产生适用于输血的红细胞的方法。照这样,本发明提供溶液,以帮助缓解献血量的长期不足。
在某些实施方案中,本发明提供将人血管瘤集落形成细胞体外分化成造血细胞的方法,所述方法包括步骤:
(a)提供人血管瘤集落形成细胞;和
(b)将所述血管瘤集落形成细胞分化成分化的造血细胞。
在某些实施方案中,本发明提供用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)提供人血管瘤集落形成细胞;
(b)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(c)用所述分化的造血细胞进行输血。
在某些实施方案中,所述血管瘤集落形成细胞恢复自冷冻培养物。
在某些实施方案中,本发明提供用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,培养包含所述胚胎衍生细胞的细胞培养物;
(b)向所述含胚状体的培养物中加入至少一种生长因子,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增;
(c)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(d)用所述分化的造血细胞进行输血。
在某些实施方案中,在所述方法步骤(a)的整个过程中使所述胚胎衍生细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
在某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。
在某些实施方案中,本发明提供用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,培养包含所述胚胎衍生细胞的细胞培养物;
(b)向所述含胚状体的培养物中加入至少一种生长因子,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增;
(c)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(d)用所述分化的造血细胞进行输血。
在某些实施方案中,在所述方法步骤(a)和(b)的整个过程中使所述干细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
在本发明的某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。
在某些实施方案中,所述血管瘤集落形成细胞恢复自冷冻培养物。
在某些实施方案中,本发明提供用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,培养包含所述胚胎衍生细胞的细胞培养物;
(b)向所述含胚状体的培养物中加入至少一种生长因子,其中所述生长因子的量足够使血管瘤集落形成细胞在所述胚状体培养物中扩增;
(c)将所述胚状体解聚成单细胞;
(d)向所述含所述单细胞的培养物中加入至少一种生长因子,其中生长因子的量足够使人血管瘤集落形成细胞在所述含所述单细胞的细胞培养物中扩增;
(e)将血管瘤集落形成细胞分化成分化的造血细胞;和
(f)用所述分化的造血细胞进行输血。
在某些实施方案中,在所述方法步骤(a)-(b)的整个过程中使所述干细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
在本发明的某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。
在某些实施方案中,所述生长因子是包括同源异型盒蛋白,或其功能变体,或其活性片段的蛋白质。在某些实施方案中,所述同源异型盒蛋白包括HOXB4蛋白,或其功能变体,或其活性变体。
在某些实施方案中,所述分化的造血细胞以单个细胞类型产生。在某些实施方案中,所述单个细胞类型选自:红细胞、血小板或吞噬细胞。在某些实施方案中,所述吞噬细胞选自:粒细胞:嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、淋巴细胞或单核细胞。在某些实施方案中,其中所述红细胞表达血红蛋白F。在某些实施方案中,以约等于见于血液中的分化的细胞类型的比例混合所述单个细胞类型,其中所述见于血液中的分化的细胞类型的比例是96%的红细胞、1%的血小板和3%的吞噬细胞。
在某些实施方案中,在同一步骤中产生多种分化的造血细胞类型。在某些实施方案中,所述多种分化的造血细胞类型选自:红细胞、血小板或吞噬细胞。在某些实施方案中,所述吞噬细胞选自:粒细胞:嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、淋巴细胞或单核细胞。在某些实施方案中,红细胞表达血红蛋白F。在某些实施方案中,产生的以约等于见于血液中的分化的造血细胞类型的比例产生所述多种分化的造血细胞类型,其中所述见于血液中的分化的细胞类型的比例是96%的红造血造血细胞、1%的血小板和3%的吞噬细胞。
在某些实施方案中,在输血前向所述分化的造血细胞中加入血浆。
在某些实施方案中,所述血管瘤集落形成细胞与患者匹配,以保证能产生患者自身血型的分化的造血细胞。在某些实施方案中,所述血管瘤集落形成细胞对抗原因子A、B、Rh或它们的任意组合呈阴性。在某些实施方案中,所述分化的造血细胞是红细胞,且其中分化所述红细胞的步骤包括促红细胞生成素(EPO)。
本发明也提供人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞或内皮细胞类型,其中所述人血管瘤集落形成细胞与其他人血管瘤集落形成细胞松散粘连。
在某些实施方案中,本发明也提供人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞与其他人血管瘤集落形成细胞松散粘连。
在某些实施方案中,本发明提供人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞与其他人血管瘤集落形成细胞松散粘连,且其中所述人血管瘤集落形成细胞不表达CD34蛋白。
在某些实施方案中,本发明提供人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞不表达下列任何一种蛋白:CD34、CD31、KDR和CD133。
在某些实施方案中,本发明提供包含人血管瘤集落形成细胞的细胞培养物,所述细胞至少能分化产生造血细胞或内皮细胞类型,其中所述人血管瘤集落形成细胞相互松散粘连。
在某些实施方案中,本发明提供包含人血管瘤集落形成细胞的细胞培养物,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞相互松散粘连。
在某些实施方案中,本发明提供包含基本纯化的人血管瘤集落形成细胞群的细胞培养物,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞相互松散粘连,并且其中所述人血管瘤集落形成细胞不表达CD34蛋白。
在某些实施方案中,本发明提供包含分化自胚胎衍生细胞的人血管瘤集落形成细胞的细胞培养物,其中所述人血管瘤集落形成细胞相互松散粘连。
在某些实施方案中,所述细胞培养物包含至少1×106个人血管瘤集落形成细胞。在某些实施方案中,所述细胞培养物包含至少5×106个人血管瘤集落形成细胞。
在某些实施方案中,所述胚胎衍生细胞是胚胎干细胞系。在某些实施方案中,所述胚胎衍生细胞选自胚胎、卵裂球、胚泡或内细胞团。
在某些实施方案中,本发明提供包含人血管瘤集落形成细胞的药物制剂,所述细胞至少能分化产生造血细胞或内皮细胞类型,其中所述人血管瘤集落形成细胞相互松散粘连。
在某些实施方案中,本发明提供包含人血管瘤集落形成细胞的药物制剂,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞相互松散粘连。
在某些实施方案中,本发明提供包含人血管瘤集落形成细胞的药物制剂,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述血管瘤集落形成细胞不表达下列任何一种蛋白:CD34、CD31、KDR和CD133。
在某些实施方案中,所述药物制剂包含至少1×106个人血管瘤集落形成细胞。在某些实施方案中,所述制剂包含至少5×106个人血管瘤集落形成细胞。
在某些实施方案中,所述包含血管瘤集落形成细胞的药物制剂分化自胚胎衍生细胞。在某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。在某些实施方案中,所述胚胎衍生细胞选自胚胎、卵裂球、胚泡或内细胞团。
在某些实施方案中,本发明提供之前任何一段所述血管瘤集落形成细胞的冷藏制剂。
在某些实施方案中,本发明提供含至少1×106个人血管瘤集落形成细胞的冷藏制剂,其中所述血管瘤集落形成细胞不表达下列任何一种蛋白:CD34、CD31、KDR和CD133。
在某些实施方案中,所述冷藏制剂包含至少5×106个人血管瘤集落形成细胞。
在某些实施方案中,所述含有人血管瘤集落形成细胞的冷藏制剂不表达CD34蛋白。在某些实施方案中,所述含有人血管瘤集落形成细胞的冷藏制剂不表达CD34、CD31、CD133和KDR蛋白。在某些实施方案中,所述含有人血管瘤集落形成细胞的冷藏制剂表达LMO2和GATA2蛋白。
在某些实施方案中,本发明提供含有分化自前述血管瘤集落形成细胞的造血细胞的培养物。
在某些实施方案中,本发明提供含有分化自前述血管瘤集落形成细胞的内皮细胞的培养物。
在某些实施方案中,本发明提供含有分化自前述血管瘤集落形成细胞的平滑肌细胞的培养物。
在某些实施方案中,本发明提供含有分化自前述血管瘤集落形成细胞的心肌细胞的培养物。
在某些实施方案中,本发明提供上述人血管瘤集落形成细胞在制备用于治疗有此需要的患者病况的药物中的用途。
在某些实施方案中,本发明提供上述细胞培养物在制备用于治疗有此需要的患者病况的药物中的用途。
在某些实施方案中,本发明提供上述药物制剂在制备用于治疗有此需要的患者病况的药物中的用途。
本发明涵盖前述本发明的任何方面和实施方案的组合。
附图简述
图1显示衍生自成血管细胞的造血CFU,所述成血管细胞产生自H1-GFP ES细胞。
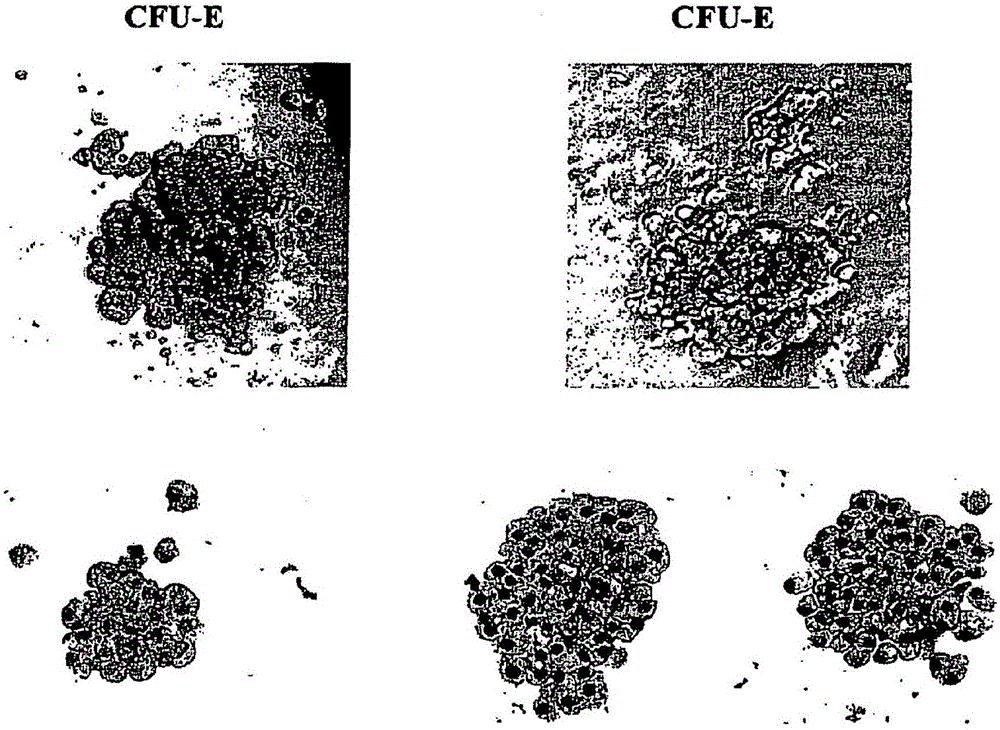
图2显示培养于无血清(干细胞系)培养基中的红细胞系集落形成单位(CFU-E)的细胞形态。
图3显示培养于无血清(干细胞系)培养基中的多能集落形成单位(CFU-GEMM/Mix)的细胞形态。
图4显示培养于无血清(干细胞系)培养基中的多能集落形成单位(CFU-GEMM/Mix)的细胞形态。
图5显示培养于无血清(干细胞系)培养基中的粒细胞集落形成单位(CFU-G)和巨噬细胞集落形成单位(CFU-M)的细胞形态。
图6显示培养于无血清(干细胞系)培养基中的粒细胞/巨噬细胞集落形成单位(CFU-GM)和巨核细胞巨噬细胞集落形成单位(CFU-Mk)的细胞形态。
图7显示通过将衍生自(a)H9ES细胞和(b)ACT30ES细胞的成血管细胞重接种于基于基质胶的培养基中而形成管-索结构。
图8显示由如实施例2所述培养于包被有纤维连接蛋白的培养皿中的EGM-2培养基中后,再培养于基质胶培养基中的H1-GFP ES细胞产生的成血管细胞管-索结构。图8也显示当如实施例2所述将细胞与Alexa fluor标记的Ac-LDL温育时对Ac-LDL的吸收。中图上和右图上显示相差图。
图9显示由如实施例2所述培养于包被有纤维连接蛋白的培养皿中的EGM-2培养基中的H1-GFP ES细胞产生的成血管细胞中von Willebrand因子(vWF)(浅灰色染色)的表达。
图10显示如实施例4所述注射到SCID小鼠中的经苏木精和曙红(H&E)染色的基质胶填料横切片中的血管形成。
图11显示如实施例4所述针对人特异核抗体的阳性染色(浅灰色染色)表明,基质胶填料横切片中的血管是衍生自人成血管细胞的细胞。
图12显示人HOXB4(登录号NM_024015.4;GI:85376187)(SEQ ID NO:2)的mRNA序列。
图13显示人HOXB4(登录号NP_076920.1;GI:13273315)(SEQ ID NO:1)的氨基酸序列。
图14显示人HOXB4(登录号BC049204.1;GI:29351567)(SEQ ID NO:4)的mRNA序列。
图15显示人HOXB4(登录号AAH49204.1;GI:29351568)(SEQ ID NO:3)的氨基酸序列。
图16显示如实施例1和2所述衍生自人ES细胞的成血管细胞(BL-CFC)的表型特征:(a)成血管细胞集落或胚细胞集落(BL-CFC或BC,×400);(b)次级EB(×400);(c)经赖-吉染色的胚细胞(hES-BC细胞)(×1000);(d-f):GATA-1染色;(d)用GATA-1染色的胚细胞(×600)和(e)用GATA-1和DAPI染色的胚细胞;(f)用GATA-1和DAPI染色的BM细胞(×400)。(g-i):LMO2染色;(g)用LMO2染色的胚细胞(×600)和(h)用LMO2和DAPI染色的胚细胞(×600);(i)用LMO2和DAPI染色的K562细胞(×1000);(j-m):CD71染色(亮灰色或浅灰色);(j)用CD71染色的胚细胞(×600)和(k)用CD71和DAPI染色的胚细胞(×600);(m)用CD71和DAPI染色的BM细胞(×1000);(n-p):CXCR-4染色(亮灰色或浅灰色);(n)用CXCR-4染色的胚细胞(×600)和(o)用CXCR-和DAPI染色的胚细胞(×600);(p)用CXCR-4和DAPI染色的BM细胞(×600);(q-s)Epo受体染色(中灰色);(q)用Epo受体染色的胚细胞(×600)和(r)用Epo受体和DAPI染色的胚细胞(×600);(s)用Epo受体和DAPI染色的BM细胞(×600);(t-v)Tpo受体染色(中灰色);(t)用Tpo受体染色的胚细胞(×600)和(u)用Tpo受体和DAPI染色的胚细胞(×600);(v)用Tpo受体和DAPI染色的BM细胞(×l000)。注意:将本图(d)和(n)中的hES-BC(成血管细胞)细胞用GATA-1和CXCR-4抗体进行双重染色,但分别呈现;也将本图(q)和(t)中的hES-BC(成血管细胞)细胞用Epo-受体和Tpo-受体抗体进行双重染色,并分别呈现。
图17显示体外衍生自人ES细胞的成血管细胞(BL-CFC或胚细胞)的功能特征:(a-d)衍生自经纯化的成血管细胞的造血CFU:(a)CFU-红细胞系(×100);(b)CFU-粒细胞(×100);(c)CFU-巨噬细胞;和(d)CFU-多谱系(混合,×l00);(e-h)CFU-细胞的Wright-Giemsa染色:(e)红细胞系(×1000);(f)粒细胞(×1000);(g)巨噬细胞(×400)和(h),混合(×1000)。(i-k):CFU细胞的免疫染色:(i)用CD235a染色的CFU-红细胞(箭标,×1000);(j)用CD13染色的CFU-粒细胞(箭标,×1000)和(k)用CD45染色的CFU-混合细胞(箭标,×1000)。(m-p和v-y)混合的CFU细胞的FACS分析:(m)小鼠IgG同种型对照;(n)CD45;(o)CD13和(p)CD235;(v)小鼠IgG同种型对照;(w)CD45和CD235a;(x)CD13和CD45;和(y)CD13和CD235a。(q-u和z-cc)衍生自经纯化的成血管细胞的内皮细胞,或胚细胞或hES-BC细胞:(q)将衍生自成血管细胞的粘连细胞平板接种后在基质胶上形成的毛细管样结构(×100);(r)衍生自成血管细胞的内皮细胞的Ac-LDL吸收(灰色)(×200);(s)衍生自成血管细胞的内皮细胞的vWF表达(箭标),用DAPI染色核(×600);(t)在衍生自成血管细胞的内皮细胞中定位PEC AMI(亮色染色),用DAPI染色核(图中的圆形)(×200);(u)在衍生自成血管细胞的内皮细胞中定位VE-该粘蛋白(箭标),用DAPI染色核(圆形)(×200)。(z)最新的Ac-LDL(箭头)和vWF表达(箭标,×600);aa)Ac-LDL吸收(箭头)和VE–该粘蛋白的表达(箭标,×600);(bb)vWF(箭标)和CD31(箭头,×600)的表达;(cc)VE-该粘蛋白(箭标)和CD31(箭头,×600)的表达。见实施例2。
图18显示衍生自hES细胞的胚细胞集落的集落生成。(a-c):胚细胞集落的集落生成,(a)和(b),在WA01-GFP和MA01EB的混合物中形成的两个胚细胞集落,它们证明了所述胚细胞集落的克隆起源;(a)相位图象(×100);(b)GFP图像(×100);(c)从单个细胞形成的胚细胞集落(×400)。(d)和(e):在液体培养中扩增单个胚细胞集落,观察造血和内皮两种谱系(×200)。(d),×200(e),×400;(f-h):衍生自单个BC的内皮细胞:(f)在基质胶上平板接种衍生自单个BC的粘附细胞后形成的毛细管样结构(×100);(g)衍生自单个BC的内皮细胞对Ac-LDL的吸收(箭标),用DAPI染色核(×400);(h)在单个BC衍生内皮细胞中vWF的表达(箭标),用DAPI染色核(×400)。(i-m):衍生自单个BC的造血CFU:(i)CFU-红细胞系(×100);(j)CFU-粒细胞(×100);(k)CFU-巨噬细胞(×100);和(m)CFU-多谱系(混合,×100)。凝胶电泳图显示对衍生自WA01-GFP+和MA01-GFP细胞的平板接种混合物的GFP+和GFP-hES-BC(成血管细胞)中GFP序列的PCR分析。泳道:WA01-GFP+,亲本WA01/GFP+hES细胞;MA01GFP,亲本MA01hES细胞;H2O,水阴性对照;BC-GFP+,来自细胞混合接种物的GFP阳性BC;1-10,来自细胞混合接种物的GFP阴性BC。将肌形成蛋白基因用作PCR反应对照。见实施例2。
图19提供tPTD-HOXB4融合蛋白的特征。(A)融合了6xHis的tPTD-HOXB4重组蛋白在大肠杆菌中表达,用镍ProBand树脂对其进行纯化。通过SDS-PAGE凝胶电泳检验两批(命名为(1)和(2))经脱盐的tPTD-HOXB4蛋白的纯度和浓度。(B)tPTD-HOXB4蛋白在含5%FBS的培养基中不稳定,但是(C)在含活ES细胞的无血清培养基中保持完整(N=仅StemlineII培养基;h=小时)。
图20显示全身注射hES-衍生成血管细胞后缺血视网膜血管系统的稳健修复。通过对小鼠眼前房施加2小时流体静压来诱导视网膜缺血。七天后玻璃体内或者静脉内注射经荧光标记的(GFP+)成血管细胞。一天后对动物实施安乐死。将眼摘出、解剖,并将视网膜展平,用激光扫描共聚焦显微术成像,或进行切片用于成像,(a)来自典型对照(未受伤害的)眼的拼接图象,显示典型的视网膜血管解剖学没有绿色荧光背景;也各自显示了GFP+通道(下插图)和GFP-通道(上插图);(b)来自同一动物的经处理的眼的拼接图象,显示经荧光标记的(GFP+)成血管细胞衍生细胞(血管系统的明亮区域)掺入缺血的血管系统;也各自显示了绿色细胞(GFP+成血管细胞,下插图)和未标记细胞(上插图),如实施例5所述。(c)未受损伤的对照的拼接图象(没有GFP荧光(亮灰或浅灰)),(d)和(e)是全身注射成血管细胞2天后(d)和7天后(e)缺血眼的拼接图象(GFP+细胞显示亮灰或浅灰)。(f,×600,共聚焦),荧光免疫细胞化学共定位成血管细胞(hES-BC)细胞-衍生的内皮细胞存在于经历了I/R损伤的小鼠眼横切片的受损伤的血管系统中;相邻内界膜的神经节细胞层中的血管腔的高倍放大视图显示所述血管腔被内皮细胞(箭头,CD31)和衍生自成血管细胞(hES-BC)的成熟内皮细胞围绕(箭标,人核抗原)。上插图和中插图各自是用来制造合成图象的人核抗原和CD31通道。下插图是同一区域的低倍放大视图,其中方框显示全图(all panels)描绘的区域。V=玻璃体;IPL=内丛状层;RPE=视网膜色素上皮细胞层;Ch=脉络膜。见实施例5。
图21显示成血管细胞、或胚细胞或hES-BC细胞掺入糖尿病大鼠的视网膜血管系统。(a)和(b)显示向玻璃体内施用成血管细胞2天后,糖尿病大鼠的融合的视网膜血管系统图像,显示成血管细胞大范围掺入大小血管(明亮区域或浅灰色区域);(c),施用成血管细胞2天后,对照大鼠(非糖尿病大鼠)的融合,显示成血管细胞(或成血管细胞衍生细胞)并为掺入血管系统而形成位于视网膜顶部的层(浅灰色层)。(d,×100),向非糖尿病对照大鼠玻璃体内注射胚细胞2天后得到的切片,它对人核抗原染色呈阴性,但对内皮明显呈阳性(CD31,箭标)。(e,×100)和(f,×600,共聚焦)是向糖尿病大鼠玻璃体内注射成血管细胞2天后得到的大鼠眼切片,并用CD31和人核抗原抗体进行染色,清楚地显示用CD31和人核抗原的染色共定位于视网膜神经节细胞层的血管腔中内衬的细胞中,刚好位于将神经视网膜从玻璃体中分离的内界膜后(箭标表示明亮区域)。见实施例6。
图22显示注射成血管细胞后缺血后肢肌肉和梗塞心脏中的内皮分化。a、b、h和i:梗塞心脏中成血管细胞或hES-BC细胞的分化。(a(200×)),用人特异性vWF抗体免疫染色的对照小鼠的梗塞心肌切片,显示没有人vWF着色;(b,200×)和(i,×600共聚焦),注射成血管细胞4周后的用人特异性vWF抗体免疫染色((b)和(i)的浅灰色或明亮区域)的梗塞心肌切片;(h)经假手术(sham operation)、对照培养基和成血管细胞处理的小鼠的存活曲线。c-g:在缺血后肢肌肉中的成血管细胞分化,(c,50×),用人特异性vWF抗体免疫染色的对照小鼠的后肢肌肉切片,显示没有人vWF着色;(d,50×)和(e,600×,共聚焦),注射成血管细胞4周后的用人特异性vWF抗体免疫染色(浅灰色)的缺血后肢肌肉切片;(f)通过手术诱导的缺血四肢中的血流恢复。将接受6×105个成血管细胞的小鼠和仅仅接受培养基的小鼠结扎后的3-30天连续监控后肢血流。通过缺血肢和非缺血肢之间的流量比计算血流;(g),激光多普勒血流图像。对照(培养基)图像和注射BC细胞的缺血动物图像(每组n=6)。见实施例7和8。
图23显示GFP(最浅或最亮的区域)和cTnl(中灰)在心肌梗塞(MI)小鼠的心脏组织切片上的免疫染色(放大200×)。见实施例8。箭标指出衍生自注射的成血管细胞(hES-BC)的双阳性着色细胞。
图24显示成血管细胞(hES-BC)分化成平滑肌细胞。对分离自成血管细胞(hES-BC)的RNA进行PCR测定得知,成血管细胞表达平滑肌特异基因。成血管细胞(hES-BC)也体外分化成平滑肌细胞。钙调理蛋白(calponin)和α-SMA的免疫染色显示分化的细胞表达这两种平滑肌细胞标记物。
发明的详细说明
为有助于完全理解本发明,提供以下详细说明。
除非另有定义,本文所用的全部技术和科学术语的含义与本发明所述领域技术人员通常所理解的一致。尽管可将与本文描述类似或等同的方法和材料用于本发明或测试本发明,下面描述适当的方法和材料。仅将这些材料、方法和实施例用于说明,而非意在限制本发明的范围。
将本文提到的所有出版物、专利、专利公开和申请及其他文献通过引用整体并入本文。
可将说明书中通篇使用的术语“包含”理解为包含一定的整数或整数群的意思,但并不排除任何其他整数或整数群。
为了进一步定义本发明,提供下列术语和定义。
本文使用的术语"人胚胎干细胞"(hES细胞)与本领域使用的一样。所述术语包括衍生自人胚泡或桑椹胚的内细胞团的可以作为细胞系连续传代的细胞。所述hES细胞可源于卵细胞与精子或DNA的受精,核移植,单性生殖,或通过使HLA区域纯合的方法产生hES细胞。人ES细胞也源于合子,卵裂球,或胚泡阶段的哺乳动物胚胎,可通过精子和卵细胞融合,核移植,单性生殖,或染色质重编程及随后将所述重编程的染色质融合到质膜而产生细胞来产生所述人ES细胞。本发明的人胚胎干细胞可以包括但不限于ACT-4、No.3、H1、H7、H9、H14和ACT30胚胎干细胞。
术语“蛋白转导域”(“PTD”)指可穿过细胞膜进入细胞,或者可协调或增加例如有PTD附着的另一个分子(例如蛋白结构域)穿过细胞膜进入细胞的速度的任何氨基酸序列。所述蛋白转导域可以是天然存在的大蛋白的一部分(例如病毒蛋白(例如HIV TAT)的PTD)的结构域或序列,或者是合成或人造的氨基酸序列。
概述
本发明提供产生和扩增源自人胚胎衍生细胞的人血管瘤集落形成细胞的方法,含人血管瘤集落形成细胞的制剂和组合物,产生从血管瘤集落形成细胞部分或终端分化的多种细胞类型的方法,治疗性应用血管瘤集落形成细胞的方法,和治疗性应用从血管瘤集落形成细胞部分或终端分化的多种细胞类型的方法。
术语“成血管细胞”和“血管瘤集落形成细胞”在本申请中可互换使用。这些细胞可以基于多种结构和功能特征进行描述,包括但不限于,一种或多种标记物的表达(RNA或蛋白)或不表达(RNA或蛋白)。血管瘤集落形成细胞至少能够分化成造血细胞类型或内皮细胞类型。血管瘤集落形成细胞优选有双重潜能,至少能够分化成造血细胞类型和内皮细胞类型。同样地,本发明的血管瘤集落形成细胞至少有一种潜能,优选有双重潜能。然而此外,血管瘤集落形成细胞可具有更大程度的发育潜力,并在某些实施方案中,可分化形成其他谱系的细胞类型。在某些实施方案中,所述血管瘤集落形成细胞能够分化形成其他中胚层衍生物,如心脏细胞(例如心肌细胞)和/或平滑肌细胞。
本发明也提供扩增从任何来源或通过本领域已知的任何其他方法获得的哺乳动物血管瘤集落形成细胞的方法,所述任何来源的哺乳动物血管瘤集落形成细胞包括ES细胞,胚泡或卵裂球,胎盘或脐带组织的脐带血,外周血,骨髓,或其他组织。人血管瘤集落形成细胞还可以产生自人胚胎衍生细胞。人胚胎衍生细胞可以是基本上同质种群的细胞,异质种群细胞,或胚胎组织的全部或部分。作为可用于本发明方法的胚胎衍生细胞的例子的人血管瘤集落形成细胞可以产生自人胚胎干细胞。这样的胚胎干细胞包括胚胎干细胞,来源于或利用如无论是否由受精、体细胞核移植(SCNT)、单性生殖、雄核发育、或其他有性或无性方法产生的胚泡,平板培养的ICMs,一个或多个卵裂球,或其他前移植阶段的胚胎或胚胎样结构部分。
在某些实施方案中,成血管细胞还可分化成造血细胞,包括但不限于血小板和红细胞。这样的细胞可用于输血。能够产生大量用于输血的细胞将缓解全国血库和医院的血液长期存储不足。在某些实施方案中,本发明的方法使产生用于输血的通用细胞。具体可容易得到O型和Rh-型红细胞,并可以将它们作为输血的通用血液来源。
本发明的方法使体外大量扩增成血管细胞,用于各种商业和临床应用。成血管细胞的体外扩增指成血管细胞的增殖。当本发明的方法能将人成血管细胞细胞扩增到商业上有用的数量时,本发明也涉及大量的成血管细胞和包含大量人成血管细胞(例如至少10,000、100,000或500,000个细胞)的细胞制剂。在某些实施方案中,所述细胞制剂包含至少1×106个细胞。在其他实施方案中,所述细胞制剂包含至少2×106个人成血管细胞,再一个实施方案中至少3×106个人成血管细胞。仍在其他的实施方案中,所述细胞制剂包含至少4×106个人成血管细胞。
本发明涉及包含10,000到4百万或更多哺乳动物(例如人)成血管细胞的溶液,制剂,以及组合物。在所述溶液、制剂和组合物中的成血管细胞数目可以是10,000到4百万,或以上中的任意值。所述数目可以是,例如20,000、50,000、100,000、500,000、1百万等等。
类似地,本发明涉及人成血管细胞后代细胞(例如人造血细胞,包括人造血干细胞和内皮细胞)的制剂。本发明还涉及产生、贮存和分配成血管细胞和/或成血管细胞谱系细胞的方法。
本发明也提供适于给人或动物患者输血的方法和溶液。在特定实施方案中,本发明提供制备红细胞和/或血小板,和/或其他用于输血的造血细胞类型的方法。在某些实施方案中,本发明适用于向血库和医院提供用于在外伤或在血液相关疾病和病症的治疗中输血的血液。在某些实施方案中,本发明提供通用供血细胞红细胞。在某些实施方案中,所述红细胞在输血之前有功能,且表达血红蛋白F。
本发明也提供人血管瘤集落形成细胞,含基本上纯化的人血管瘤集落形成细胞群的细胞培养物,含人血管瘤集落形成细胞的药物制剂和所述血管瘤集落形成细胞的冷藏制剂。在某些实施方案中,本发明提供所述人血管瘤集落形成细胞在制备用于治疗有此需要的患者病况的药物中的用途。此外,本发明也提供所述细胞培养物在制备用于治疗有此需要的患者病况的药物中的用途。本发明也提供所述药物制剂在制备用于治疗有此需要的患者病况的药物中的用途。
可以根据所述血管瘤集落形成细胞的结构特性对其进行识别和表征。在某些实施方案中,这些细胞具体是独特的,因为它们相互之间松散粘连(与其他的血管瘤集落形成细胞松散粘连)。因为这些细胞仅仅相互松散粘连,可以只利用机械解离技术(而无需酶解技术)即可将血管瘤集落形成细胞的培养物或集落解离成单细胞。这些细胞相互粘连足够松散,仅仅只需要机械解离(而非酶解或者机械和酶解结合)就足以将培养物或集落解聚,基本上无损于细胞活力。换句话说,相比用酶解细胞团块后观察到的实质损伤和死亡,机械解离不需要可导致细胞实质损伤和死亡的力度。
此外,可以通过一种或多种标记物的表达或不表达(在基因或蛋白水平上估计)识别或表征血管瘤集落形成细胞。例如在某些实施方案中,可以根据一种或多种下列细胞表面标记物的不表达(例如可以根据至少一种,至少两种,至少三种或四种下列标记物不表达来表征所述细胞)来识别或表征血管瘤集落形成细胞:CD34、KDR、CD133或CD31。此外,也可以根据GATA2和/或LMO2的表达来识别或表征血管瘤集落形成细胞。此外,也可以通过一种或多种标记物(分析于表2)的表达或不表达来识别或表征(在基因或蛋白水平上估计)血管瘤集落形成细胞。
可以根据这些结构或功能特点中的一点或任意组合识别或表征本发明的血管瘤集落形成细胞。需知,虽然这些细胞可以有任意种来源,例如胚胎组织、产前组织、围产期组织,所述术语"血管瘤集落形成细胞"适用于至少能够分化形成造血细胞类型和/或内皮细胞类型,并且具有一种或多种前述结构或功能特点的无论任何的来源的细胞。
体外分化人胚胎干细胞以获得胚状体和成血管细胞
本发明提供产生和扩增衍生自人胚胎干细胞,或人胚泡或卵裂球的人成血管细胞的方法。可纯化和/或分离如此产生的所述成血管细胞。
人血管瘤集落形成细胞还可以产生自人胚胎衍生细胞。人胚胎衍生细胞可以是基本上同质种群的细胞,异质种群细胞,或胚胎组织的全部或部分。作为可用于本发明方法的胚胎衍生细胞的例子的人血管瘤集落形成细胞可以产生自人胚胎干细胞。这样的胚胎干细胞包括衍生自或利用无论是否由受精、体细胞核移植(SCNT)、单性生殖、雄核发育、或其他有性或无性方法产生的如胚泡,培养ICMs,一个或多个卵裂球,或其他前移植阶段的胚胎或胚胎样结构部分的胚胎干细胞。
此外,血管瘤集落形成细胞还可以产生自其他胚胎衍生细胞。例如,血管瘤集落形成细胞可以产生自(无需经历胚胎干细胞衍化步骤)或利用无论是否由受精、体细胞核移植(SCNT)、单性生殖、雄核发育、或其他有性或无性方法产生的平板培养的胚胎,ICMs,胚泡,滋养层/滋养外胚层细胞,一个或多个卵裂球,滋养层干细胞,胚胎生殖细胞,或移植前阶段的胚胎或胚胎样结构的其他部分。血管瘤集落形成细胞还可以类似利用部分分化自胚胎衍生细胞的细胞或细胞系产生。例如如果将人胚胎干细胞系用于产生比血管瘤集落形成细胞处于更早发育阶段的的细胞,根据发展潜力和可塑性,则可将这样的胚胎衍生细胞用于产生血管瘤集落形成细胞。
此外,血管瘤集落形成细胞也可产生自其他产前或出生前后来源,包括但不限于脐带、脐带血、羊水、羊膜干细胞和胎盘。
注意,当血管瘤集落形成细胞产生自人胚胎组织时,可能需要形成胚状体的步骤。然而,假设胚状体的形成至少部分有助于重演发育早期胚层的三维空间相互作用,当胚胎衍生细胞已经具有实现与胚状体形成步骤实质上相同目的的结构或组织时,这一步骤不是必需的。举例来说,当血管瘤集落形成细胞产生自平板培养的胚泡时,所述胚泡的细胞中间已经存在三维空间组织水平。同样地,无需胚状体形成步骤来提供细胞间的信号,诱导的线索,或三维结构。
可将本发明的方法和用途用于产生源于胚胎衍生细胞的血管瘤集落形成细胞。在某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。在某些其他实施方案中,所述胚胎衍生细胞是平板培养的胚胎,ICMs,胚泡,滋养层/滋养外胚层细胞,一个或多个卵裂球,滋养层干细胞,或早期移植前胚胎的其他部分。对于任何前述事项,所述胚胎衍生细胞可以来自由受精,体细胞核移植(SCNT),单性生殖,雄核发育,或其他有性或无性方式产生的胚胎。
在本申请中,当描述具体涉及从胚胎干细胞产生血管瘤集落形成细胞的方法时,本发明类似预期产生来自或使用其他胚胎细胞的血管瘤集落形成细胞,,以及利用产生的细胞实施任何相同的治疗用途。
在本发明的某些方面,所述人胚胎干细胞可以是本方法的起始材料。可以用本领域已知的任何方法培养所述胚胎干细胞,例如在有无饲养细胞的情况下。
胚胎干细胞可以在含血清培养基中形成悬浮的胚状体("EB")(Wang等,2005J Exp Med(201):1603-1614;Wang等,2004Immunity(21):31-41;Chadwick等,2003Blood(102):906-915)。然而血清的加入引入一些挑战,包括实验的可变性,成本,潜在感染物和有限的供应。进一步,对于临床和某些商业应用,血清的使用需要额外遵照美国政府和国际社会的关于生物制品的规定。
本发明提供不使用血清从胚胎干细胞产生和扩增人成血管细胞的方法。相对于需要血清的条件,所述无血清条件更有助于在好的生产工艺(GMP)指导下进行规模化生产。此外,无血清条件延长加入到培养基的某些因子的半衰期(例如无血清培养基中蛋白质(包括生长因子、细胞因子和HOXB4)的半衰期增加)。在某些实施方案中,在本发明的所有方法中使用无血清培养基产生和扩增人成血管细胞。
产生和扩增人成血管细胞的方法的第一步中,使人干细胞在无血清培养基中生长,并将其诱导分化成胚状体。为了诱导胚状体形成,可将胚胎干细胞沉淀并重悬浮在无血清培养基(例如,在Stemline I或II培养基(Sigma TM),培养基中补充有一种或多种形态因子和细胞因子,然后平板接种于附着性差(例如附着性超差)的培养皿上。形态因子和细胞因子可以包括但不限于,骨形态生成蛋白(例如BMP2、BMP-4、BMP-7,但非BMP-3)和VEGF、SCF和FL。可将骨形态生成蛋白和VEGF单独使用,或与其他因子联合使用。可在细胞培养的0-48小时内将形态因子和细胞因子加入到培养基。于这些条件下在存在早期造血扩增细胞因子(包括但不限于促血小板生成素(TPO)、Flt-3配体和干细胞因子(SCF))的情况下进行温育,使所述平板培养的ES细胞形成EB。除TPO、Flt-3配体和SCF外,还可将VEGF、BMP-4和HoxB4加入到培养基。在一个实施方案中,使人ES细胞首先在BMP-4和VEGF165(例如25-100ng/ml)存在的条件下生长,然后在BMP-4、VEGF16S、SCF、TPO和FLT3配体(例如10-50ng/ml)和HoxB4(例如1.5-5μg/ml的本文公开的三重蛋白质转导域-HoxB4融合蛋白)存在的条件下生长。可以在平板接种后48-72小时时加入所述额外因子。
在本发明的方法中,人成血管细胞分离自早期胚状体(“EB”)。从早期EB分离成血管细胞支持这些细胞的体外扩增。对于人细胞,可以从生长短于10天的EB中获得成血管细胞。在本发明的某些实施方案中,成血管细胞细胞出现在生长2-6天的人EB中。根据一个实施方案,可从生长4-6天的人EB中鉴定和分离成血管细胞。在其他的实施方案中,使人EB生长2-5天,然后分离成血管细胞。在某些实施方案中,使人EB生长3-4.5天,然后分离成血管细胞。
在某些实施方案中,洗脱并解离早期EB(例如,使用胰蛋白酶/EDTA或胶原酶B)。将选定数量的细胞(例如2-5×105个细胞)随后与优化成适于成血管细胞生长的无血清甲基纤维素培养基(例如BL-CFU培养基,如干细胞技术目录H4436,或成血管细胞细胞扩增培养基(HGM),或含1.0%甲基纤维素于MDM,1-2%牛血清白蛋白,0.1mM 2-巯基乙醇,10μg/ml rh-胰岛素,200μg/ml饱和铁人转铁蛋白,20ng/ml rh-GM-CSF,20ng/ml rh-IL-3,20ng/ml rh-IL-6,20ng/ml rh-G-CSF("rh"代表"重组的人~")的任何培养基)混合。可向所述培养基补充早期细胞因子(包括但不限于,EPO、TPO、SCF、FL、FLt-3、VEGF、BMP(例如BMP2、BMP4和BMP7,但不是BMP3))和HOXB4(或另一个同源异型盒蛋白)。在某些实施方案中,将促红细胞生成素(EPO)加入到培养基。再一个实施方案中,将EPO、SCF、VEGF、BMP-4和HoxB4加入到培养基。在另一个实施方案中,使所述细胞在EPO、TPO和FL存在的条件下生长。在某些H9是起始人ES细胞系的实施方案中,将EPO、TPO和FL加入到培养基。除EPO、TPO和FL外,源于H9或其他ES细胞的细胞培养基还可包含VEGF、BMP-4和HoxB4。
将通过所述方法获得的细胞(细胞可能在BL-CFU培养基中)(包括成血管细胞)平板接种于附着性超差的培养皿上,并在CO2恒温箱中温育直到长出成血管细胞集落。一些细胞可能形成次级EB。大约3-6天(且在一些情况下是3-4.5天)后观察到成血管细胞集落。可根据成血管细胞集落特殊的葡萄状形态和/或小尺寸将其与其他细胞如(如次级EB)区分开。另外,可通过某些标记物的表达(例如,早期造血细胞和内皮细胞标记物的表达),以及至少能分化成造血细胞和内皮细胞的能力(见下文,衍生成成血管细胞谱系细胞)鉴定成血管细胞。例如当成血管细胞缺乏成熟内皮细胞或造血细胞的某些特征时,可通过某些标记物的存在(例如CD71+)和其他标记物的不存在(例如CD34-)鉴定这些细胞。成血管细胞也可表达GATA-1和GATA-2蛋白,CXCR-4和TPO和EPO受体。另外,成血管细胞可通过其他标记物(例如CD31、CD34、KDR或其他粘附分子)不表达或低表达来表征。而且,成血管细胞的可通过某些基因(例如与成血管细胞和早期成红血细胞发育相关的基因(如SCL、LMO2、FLT-1、胚胎胎儿球蛋白基因、NF-E2、GATA-1、EKLF、ICAM-4、血型糖蛋白(glycophoriuns)和EPO受体)的表达进行表征。
因此,成血管细胞可按大小分离(小于其他细胞)或用抗CD71+抗体纯化,例如通过免疫亲合柱层析。
成血管细胞细胞可以按大小和/或形态分离,过程如下。生长6到7天后,细胞混合物包含EB(圆形且呈多细胞团)盒成血管细胞(葡萄状,小于EB,且是单细胞)。因此,成血管细胞可根据它们的形态和大小进行分离。成血管细胞可以人工挑选,例如当在显微镜下观察细胞混合物的时候。所述细胞接着可以生长成集落,每个集落具有100-150个细胞。
可挑选如上所述衍生的人成血管细胞集落,并重平板接种于甲基纤维素CFU培养基上,以形成造血CFU。在某些实施方案中,CFU培养基包括StemCell Technologies H4436。再一个实施方案中,将成血管细胞平板接种于补充有细胞因子及其他因子的Stemline II培养基上。例如可以人工挑选单个BL-CFC集落,并将其转移到平板接种有纤维连接蛋白的含Stemline II和重组人SCF(例如20ng/ml)、TPO(例如20ng/ml)、FL(例如20ng/ml)、IL-3(例如20ng/ml)、VEGF(例如20ng/ml)、G-CSF(例如20ng/ml)、BMP-4(例如15ng/ml)、IL-6(例如10ng/ml)、IGF-1(例如10ng/ml)、内皮细胞生长补充因子(ECGS,例如100μg/ml)、Epo(例如3U/ml)的培养皿上。体外生长一周后,可通过温和移液移走非粘连的造血细胞,并直接用于造血CFU试验。移去非粘附细胞后,可使粘附的细胞群在EGM-2内皮细胞培养基(Cambrex TM)中再生长一周,然后检验vWF的表达。
成血管细胞的体外扩增
本发明的某些方面涉及成血管细胞的体外扩增。在某些实施方案中,如上所述,通过本发明方法扩增的成血管细胞获自源于人胚胎干细胞的早期胚状体。
除了来自人胚胎干细胞(hES细胞)的衍生成血管细胞以外,待扩增的成血管细胞液可以分离自其他哺乳动物来源,例如哺乳动物胚胎(Ogawa等,2001lnt Rev Immunol(20):21-44,美国专利公开号2004/0052771),胎盘和脐带组织的脐带血(Pelosi等,2002Blood(100):3203-3208;Cogle等,2004Blood(103):133-5),外周血和骨髓(Pelosi等,2002Hematopoiesis(100):3203-3208)。在某些实施方案中,待扩增的非人成血管细胞可产生自非人(例如小鼠和非人灵长类)胚胎干细胞。在某些实施方案中,可通过例如磁珠阳性筛选或纯化技术(例如MACS柱)等方法从脐带血(UCB)或骨髓获得成血管细胞。细胞可基于它们的CD71+进行筛选,及通过CD34-进行确认。而且还可以测试分离的成血管细胞产生造血细胞和内皮细胞谱系的潜力。在某些实施方案中,分离或纯化及任选富集自胚胎、脐带血、外周血、骨髓或其他组织的成血管细胞被的纯度超过95%。
骨髓衍生细胞可获自供者个体的任何发育阶段,包括出生以前的(例如胚胎或胎儿)、婴儿(例如人类从出生到大约三岁),儿童(例如人类从大约三岁到大约13岁),青少年(例如人类从大约13岁到大约18岁),青年(例如人类从大约18岁到大约35岁),成人(人类从大约35岁到大约55岁)或老年(例如人类从大约55岁及以上)。
例如,人骨髓可刮自手术中的患者的分裂的胸骨。然后将骨髓保存在0.1到1mm3体积的组织块中,并随即使其在小鼠胚胎滋养层(例如经丝裂霉素C处理或照射过的滋养层)上生长。骨髓细胞将附着在培养皿上,经过1-2周的培养,可根据形态特征和/或细胞标记物鉴定及分离成血管细胞(参见美国专利公开号2004/0052771)。接着可以按照本文公开的方法,在无血清培养基中培养和扩增细胞。
另外,可以分级分离骨髓细胞和来自血液或其他组织的细胞,以获得成血管细胞。本领域已知分级分离的方法,通常涉及阳性选择(即根据特性保留细胞)和阴性选择(即根据特性除去细胞)。分级分离和富集骨髓衍生细胞的方法最佳表征了人和小鼠细胞。
本领域已知多种方法用于分级分离和富集骨髓衍生细胞或其他细胞。可以使用阳性选择法,如富集表达CD71的细胞。阴性选择法除去或减少表达CD3、CD10、CD11b、CD14、CD16、CD15、CD16、CD19、CD20、CD32、CD45、CD45R/B220或Ly6G的细胞,阴性选择法可单独使用,也可同阳性选择技术联合使用。就骨髓细胞而言,如果供者骨髓衍生细胞不是自体同源的,可以对细胞制剂进行阴性选择以减少或除去分化的T细胞。
通常,用于衍生骨髓、血液或其他细胞的筛选/富集方法将用到免疫亲合技术,尽管也会用到密度离心方法。如本领域众所周知,免疫亲合技术可以有多种形式,但通常利用一种抗体或抗体衍生物,结合一些分离技术。分离技术通常导致结合有抗体的细胞和未结合有抗体的细胞之间的物理分离,尽管在有些情况下分离技术会杀死结合有抗体的细胞,可用于阴性选择。
可使用任何适当的免疫亲合技术从衍生骨髓、血液或其他细胞中筛选/富集成血管细胞,所述技术包括荧光激活细胞分选术(FACS)、淘洗(panning)、免疫磁性测定分离、免疫亲合层析、抗体介导的补体结合、免疫毒素、密度梯度分离,等等。免疫亲合步骤之后,收集需要的细胞(阳性选择下结合免疫亲合剂的细胞,阴性选择下没有结合免疫亲合剂的细胞),并可使其经过下一论免疫亲合筛选/富集。
一般通过温育包含骨髓衍生细胞和抗体或衍生自抗体的亲合剂(例如特定表面标记的特异性抗体)的细胞制剂进行免疫亲合筛选/富集,然后利用所述结合亲合剂筛选结合有或未结合抗体的细胞。筛选步骤通常涉及物理分离,如可根据结合亲合剂(FACS)的有无,利用结合(直接或间接)到固相底物(淘洗、免疫亲合层析)的抗体,或利用磁场收集经由亲合剂结合到磁颗粒上的细胞(免疫磁性分离),而将含单个细胞的小滴导入不同的容器。此外,也可利用将细胞毒素损伤导向结合有亲合剂的细胞的亲合剂从骨髓衍生细胞制剂中除去不需要的细胞。细胞毒素损伤可由亲合剂激活(例如补体结合),或由亲合剂定位于靶细胞(例如,免疫毒素如蓖麻毒B链)。
虽然上述方法涉及从骨髓衍生细胞制剂或血细胞制剂中富集细胞,本领域技术人员将认识到相似的阳性和阴性选择技术可以用于来自其他组织的细胞制剂。
本发明的某些方面涉及成血管细胞的体外扩增。在某些实施方案中,如上所述,用本发明方法扩增的成血管细胞获自源于人胚胎干细胞的早期胚状体。在其他实施方案中,所述成血管细胞分离或富集自人组织(例如胎盘或脐带血、外周血、骨髓等等)。
在某些实施方案中,在同源结构域蛋白(本文也称为同源异型盒蛋白)存在的情况下扩增所述成血管细胞。再一个实施方案中,在HOXB4的存在下扩增所述成血管细胞。在某些实施方案中,在扩增成血管细胞的整个方法中向所述成血管细胞中加入HOXB4。
HOXB4是同源结构域转录因子(也称为HOX2F、HOX2、HOX-2.6,在大鼠中是HOXA5),它在体内表达于骨髓的干细胞部分,然后在分化期间被负调控。HOXB4基因的表达与初始干细胞表型的维持相关联(Sauvageau等,1995Genes Dev 9:1753-1765;Buske等,2002Blood 100:862-868;Thorsteinsdottir等,1999Blood 94:2605-2612;Antonchuk等,2001Exp Hematol 29:1125-1134)。
本发明的产生和扩增成血管细胞的方法中用到的HOXB4包括但不限于,全长HOXB4(例如HOXB4多肽,具体为公共登录号GI:13273315,GI:29351568,以及其任何功能变体和活性片段。野生型HOXB4蛋白可由氨基酸序列SEQ ID NO:1,SEQ ID NO:3或这种蛋白的任何其它可选等位基因形式编码。所述序列可得自公用数据库,例如Genbank。HOXB4也可以在细胞内异位表达,或在培养基中提供。可将异位表达的HOXB4可操作连接到可诱导启动子。在培养基中提供的HOXB4可由另一种细胞类型(例如滋养层)分泌,或直接加入到培养基。
本发明也涉及包含HOXB4的融合蛋白(包括含全长HOXB4或HOXB4功能变体或活性片段的融合蛋白)。除HOXB4外,所述融合蛋白也可包含任何附加蛋白、蛋白结构域或肽。在某些实施方案中,可将HOXB4连接到蛋白转导域(PTD),以使所述蛋白从培养基转位到细胞中,并随后进入到核区域。融合蛋白可以包含或不包含一种或多种位于蛋白结构域之间的接头序列。
HOXB4的功能变体包括HOXB4突变体和等位基因变体,及其活性片段。HOXB4的功能变体包括任何能按照本发明的方法扩增成血管细胞的HOXB4多肽及其活性片段。HOXB4功能变体也包括转录活性强于天然HOXB4蛋白的HOXB4多肽。HOXB4变体包括具有涉及野生型HOXB4的一个或多个氨基酸取代、添加、和/或缺失的蛋白。HOXB4变体也包括但不限于与SEQ ID NO:1或SEQ ID NO:3序列至少75%类似的多肽。相应的,HOXB4变体包括与SEQ ID NO:1或SEQ ID NO:3氨基酸序列80%、85%、90%、95%、和99%类似的多肽。
HOXB4变体也包括由与编码其互补体(例如,野生型HOXB4蛋白可由核酸序列SEQ ID NO:2(GI:85376187)或SEQ ID NO:4(GI:29351567)编码)的核酸序列至少80%一致的核酸序列编码的多肽。因此,HOXB4变体包括由与SEQ ID NO:2或SEQ ID NO:4或其互补体的序列具有85%、90%、95%和99%的一致性的核酸序列编码的HOXB4多肽。
编码HOXB4的核酸序列也包括,但是不限于,任何能在严格条件下与核酸序列SEQ ID NO:2或SEQ ID NO:4,或它们的互补体,或它们的片段杂交的核酸序列。同样地,与SEQ ID NO:2或SEQ ID NO:4由于遗传密码的简并性而不同的核酸序列也在本发明的范畴内。HOXB4变体多肽也包括剪接变体或其他天然发生的HOXB4蛋白或核酸序列。
HOXB4的活性片段包括,但不限于能按照本发明的方法维持成血管细胞的全长HOXB4多肽的任何片段。因此,在一个实施方案中,本发明的HOXB4蛋白是缺少部分N-末端(如全长HOXB4的N-末端31、32或33个氨基酸)的HOXB4蛋白如。
任何HOXB4蛋白可以融合其他蛋白或蛋白结构域。例如可将HOXB4与蛋白转导域(PTD)连接。
蛋白转导域与HOXB4共价或非共价相连,使HOXB4横跨细胞膜,最终到达细胞的核区域。
同HOXB4蛋白融合的PTD包括HIV反式活化蛋白(TAT)(Tat47-57)(Schwarze和Dowdy,2000Trends Pharmacol.Sci.21:45-48;Krosl等,2003Nature Medicine(9):1428-1432)的PTD。对于HIV TAT蛋白而言,具有转膜功能的氨基酸序列相应在残基47-57(YGRKKRRQRRR,SEQ ID NO:5)(Ho等,2001,Cancer Research 61:473-477;Vives等,1997,J.Biol.Chem.272:16010-16017)。单独的这个序列能赋予蛋白转位活性。TAT PTD也可以是九个氨基酸肽序列RKKRRQRRR(SEQ ID NO:6)(Park等,MoI Cells 2002(30):202-8)。TAT PTD序列可以是任何公开在Ho等,2001,Cancer Research 61:473-477(通过引用并入本文)的包括YARKARRQARR(SEQ ID NO:7)、YARAAARQARA(SEQ ID NO:8)、YARAARRAARR(SEQ ID NO:9)和RARAARRAARA(SEQ ID NO:10)的肽序列。
包含能与本发明的HOXB4蛋白融合的PTD的其他蛋白包括单纯疱疹病毒1(HSV-1)DNA结合蛋白VP22和果蝇控制触角基因(Antp)同源异型转录因子(Schwarze等,2000Trends Cell Biol.(10):290-295)。对于Antp而言,43-58位氨基酸(RQIKIWFQNRRMKWKK,SEQ ID NO:11)表示蛋白转导域,而对于HSV VP22而言,PTD表示为残基DAATATRGRSAASRPTERPRAPARSASRPRRPVE(SEQ ID NO:12)。此外,也可将HeptaARG(RRRRRRR,SEQ ID NO:13)或赋予转导活性的人工肽用于本发明的PTD。
在另一个实施方案中,PTD可以是二聚或多聚的PTD肽。在某些实施方案中,所述PTD是一个或多个TAT PTD肽YARAAARQARA(SEQ ID NO:14)。在某些实施方案中,所述PTD是由三个TAT PTD肽YARAAARQARA(SEQ ID NO:15)构成的多聚物。与多聚PTD融合或连接的HOXB4蛋白(例如三重合成蛋白转导域(tPTD))可以在细胞中表现出不稳定性降低和稳定性升高。这样的HOXB4构建体也能在存在hES细胞的无血清培养基中稳定。
制备编码融合蛋白的融合基因的技术在本领域众所周知。基本上,编码不同多肽序列的多种DNA片段的连接按照常规方法进行。在另一个实施方案中,融合基因可通过常规方法合成,包括自动DNA合成仪。此外,也可使用能在连续的基因片段之间形成互补突起的锚定引物进行基因片段的PCR扩增,然后退火产生嵌合基因序列(参见例如Current Protocols in Molecular Biology,eds.Ausubel等,John Wiley&Sons:1992)。
在某些实施方案中,融合基因编码纯化的前导顺序,如多(His)序列,融合基因可以连接到HOXB4多肽或HOXB4融合蛋白需要部分的N-末端,使融合蛋白可使用Ni2+金属树脂通过亲和层析而纯化。接着通过肠激酶处理,除去纯化的前导顺序,从而提供纯化的HOXB4多肽(例如参见Hochuli等,(1987)J.Chromatography 411:177;和Janknecht等,PNAS USA 88:8972)。
在某些实施方案中,HOXB4蛋白或其功能变体或活性结构域连接到第二个蛋白或蛋白结构域的C-末端或N-末端(例如PTD),有或没有插入的接头序列。接头的确切长度和序列,以及相对于连接的序列的方向可以变化。接头可以包含,例如2、10、20、30个或以上的氨基酸,可以基于需要的特性(如溶解度、长度、空间距离等)进行筛选。在特定实施方案中,所述接头可以包含用于所述融合蛋白的纯化、检测或修饰的功能序列。在某些实施方案中,所述接头包括含有两个或更多甘氨酸的多肽。
可通过修饰蛋白结构域和/或融合这些结构域的接头来改变HOXB4的功效、稳定性和/或功能特征。
在某些实施方案中,HOXB4在成血管细胞内异位表达,或在培养基中提供。将异位表达的HOXB4可操作连接到调控序列。调控序列是本领域公知的,它们被选来指导HOXB4多肽的表达。
在培养基中提供的HOXB4可以由另一种细胞类型分泌。另一种细胞类型可以是滋养层,如转导以表达可分泌的HOXB4的小鼠间质细胞层。例如HOXB4可以进行融合或构建成包含信号肽,或能促进所述蛋白的排出和分泌疏水序列。此外,也可直接将HOXB4(如共价或非共价连接到PTD的融合蛋白)加入到培养基。另外,HOXB4可附在病毒载体上,例如逆转录病毒载体或腺病毒载体。可用所述载体转导培养中的成血管细胞或其他细胞。
根据使用的HOXB4,在特定实施方案中,在成血管细胞扩增期间,将HOXB4在选定时间加入到培养基。因为在无血清培养基中扩增所述成血管细胞,HOXB4相对稳定。因此,在某些实施方案中,将HOXB4蛋白或融合蛋白每日加入到人成血管细胞中。在其他实施方案中,隔日加入HOXB4蛋白或融合蛋白,而在其他实施方案中,每2日加入HOXB4蛋白或融合蛋白。在一个实施方案中,每2日将HOXB4融合蛋白、HOXB4-PTD加入到培养基。
在某些实施方案中,可以在存在足以扩增成血管细胞的量的任何其他生长因子或蛋白存在的条件下扩增所述细胞。
任何来源的成血管细胞,包括人或非人ES细胞、骨髓、胎盘或脐带血、外周血或其他组织,可按上述方法进行扩增。因此,在某些实施方案中,将筛选的一定量的纯化成血管细胞或富集细胞与无血清甲基纤维素培养基混合,培养基进行优化以适合成血管细胞生长(例如BL-CFU培养基,见实施例1和2)。培养基可以补充有早期细胞因子(包括但不限于EPO、TPO、FL、VGF、BMP(如BMP2、BMP4和BMP7,但不是BMP3))和HOXB4。在某些实施方案中,将促红细胞生成素(EPO)加入到培养基。在某些实施方案中,将EPO、TPO和FL加入到培养基。随后将这些细胞平板接种于附着性超差的培养皿上,并使在CO2恒温箱中生长。如上所述,成血管细胞集落显示特殊的葡萄状形态,并较其他细胞小,因此可以同其他细胞类型区别开。也可检测成血管细胞的标记物,以及其进一步分化成造血细胞或者内皮细胞谱系的能力。接着分离成血管细胞,并进行体外扩增。用于扩增的培养基包括无血清甲基纤维素培养基,所述培养基经优化以适合成血管细胞生长(例如BL-CFU),它还补充有早期细胞因子和HOXB4。早期细胞因子包括但不限于EPO、TPO、FL、VEGF、BMP(如BMP2、BMP4和BMP7,但不是BMP3)。在某些实施方案中,将促红细胞生成素(EPO)加入到培养基。再一个实施方案中,将EPO、TPO和FL加入到培养基。
因此,扩增成血管细胞的培养基可以包含VEGF、SCF、EPO、BMP-4和HoxB4;在某些实施方案中,培养基还可以包含TPO和FL。例如收集从培养约3.5天的EB培养物中制备的单个细胞,并用0.05%胰蛋白酶-0.53mM EDTA(Invitrogen)解离2-5分钟,使通过22G针3-5次而制备单细胞悬液。通过在1,000rpm,5分钟,离心收集细胞。将细胞沉淀重悬于50-200μl的Stemline I培养基中。为了扩增成血管细胞,将衍生自2×105-5×105个hES细胞分化的单细胞悬液与2ml成血管细胞扩增培养基(HGM)混合,所述培养基包含1.0%甲基纤维素于Isocve MDM,1-2%牛血清白蛋白,0.1mM 2-巯基乙醇,10μg/ml rh-胰岛素,200μg/ml饱和铁人转铁蛋白,20ng/ml rh-GM-CSF,20ng/ml rh-IL-3,20ng/ml rh-IL-6,20ng/ml rh-G-CSF),3到6个单位/ml rh-Epo,50ng/ml rh-SCF,50ng/ml rh-VEGF和50ng/ml rh-BMP-4,和1.5μg/ml tPTD-HoxB4,含有或不含有50ng/ml Tpo和FL。将所述细胞混合物平板接种于附着性超差的培养皿上,并于37℃,5%CO2中培养4-6天。
在某些情况,需要从患者或患者亲属处获得成血管细胞,并体外扩增所述成血管细胞。这样的情况包括,例如一个患者计划开始化学疗法或放射疗法,或者其他可以使用自体同源HSC移植(利用患者自身的干细胞)的情况。因此,本发明提供治疗需要细胞治疗的患者的方法(例如患者需要造血细胞再生或治疗,或者血管生长或治疗血管伤害,包括缺血,见下文),所述方法使用本发明的扩增的成血管细胞或成血管细胞谱系细胞,其中所述成血管细胞获自患者或其亲属的骨髓、血液或其他组织。因此,在某些实施方案中,治疗需要成血管细胞(或成血管细胞谱系细胞)的患者的方法可以包括从患者或其亲属分离成血管细胞的步骤。可以根据本发明的方法体外扩增分离自患者或患者亲属的成血管细胞,并随后施用给患者。此外,也可在治疗患者之前进一步培养扩增的成血管细胞以产生造血细胞或内皮细胞。
也可以通过本领域已知的任何方法(例如体细胞核移植)从患者处获得人ES细胞。然后可以使用本发明的方法,从患者自身的ES细胞中产生和扩增他的成血管细胞。可将这些成血管细胞或谱系衍生物施用给患者或其亲属。
使用本发明的方法扩增的人成血管细胞能到达商业批量,然后在多种治疗和临床上应用。此外,还可进一步分化通过本文公开的方法获得的成血管细胞以产生供临床应用的造血细胞或内皮细胞谱系。
通过本发明的产生和扩增人成血管细胞的方法从人ES细胞获得的成血管细胞至少有潜能分化成内皮细胞或造血细胞(即它们至少是双重潜能的)。其他的成血管细胞也可能是双重潜能的。然而其他的成血管细胞也许能分化成除造血细胞和内皮细胞以外的其他细胞(即它们是多重潜能的)。
在人胚胎干细胞中加工MHC基因以获得复合性降低(reduced-complexity)的成血管细胞
用作本发明的产生和扩增人成血管细胞的方法的起始的人胚胎干细胞也可以源于人胚胎干细胞库,每个都是人群中至少一种MHC等位基因的半合子或纯合子。在某些实施方案中,所述干细胞库的每个成员是与文库中其余成员相比具有不同的MHC等位基因的半合子或纯合子。在某些实施方案中,干细胞库是人群中所有MHC等位基因的半合子或纯合子。本发明中,一种或多种组织相容性抗原基因纯合的干细胞包括一种或多种(在一些实施方案是所有)所述基因缺合的(nullizygous)的细胞。基因位点缺合(nullizygous)指基因在该位点无效,即所述基因的两个等位基因缺失或失活。可通过本领域已知的方法(例如基因靶向和/或杂合性丢失(LOH))产生所有MHC基因缺合的干细胞。参见例如美国专利出版物US 20040091936,US 20030217374和US 20030232430,以及美国临时申请号60/729,173,将它们全部的公开内容均通过引用并入本文。
因此,本发明涉及获得成血管细胞的方法,包括MHC复合性降低的成血管细胞文库。MHC复合性降低的成血管细胞和成血管细胞谱系细胞会增加用于治疗的细胞的供应量,因为它将会消除涉及患者匹配的困难。这样的细胞可来源于经加工为MHC复合物基因是半合子或纯合子的干细胞。
人ES细胞可以包括对细胞MHC复合物的姐妹染色体的一个等位基因进行修饰。可使用各种产生基因修饰的方法修饰MHC复合物中的基因,例如基因定靶。进一步地,可将经修饰的细胞MHC复合物等位基因进一步加工成纯合子,使得姐妹染色体存在相同的等位基因。可使用例如杂合性丢失(LOH)的方法加工细胞,使所述细胞的MHC复合物中具有纯合的等位基因。例如,可定靶来自亲本等位基因的一组MHC基因中的一种或多种基因,以产生半合子的细胞。可通过基因定靶或LOH除去另一组MHC基因,以制造空线(null line)。还可将这个空线用作胚细胞线,以除去一系列HLA基因或个体基因,从而制造具有另一种统一遗传背景的半合子或纯合子文库。
一方面,ES细胞系文库的每个成员是至少一个HLA基因的纯合子,按照本发明的方法,将所述文库用于衍生成血管细胞。另一个方面,本发明提供成血管细胞文库(和/或成血管细胞谱系细胞),其中筛选ES细胞的几个谱系,并分化为成血管细胞。可将这些成血管细胞和/或成血管细胞谱系细胞用于需要细胞治疗的患者。
因此,本发明的某些实施方案有关向有需要的患者施用来源于复合性降低的胚胎干细胞的人成血管细胞、造血干细胞或人内皮细胞的方法。在某些实施方案中,所述方法包括步骤:(a)鉴定需要涉及向患者施用人成血管细胞、造血干细胞或人内皮细胞的治疗的患者;(b)鉴定在所述患者细胞表面表达的MHC蛋白;(c)提供根据本发明的体外产生和扩增人成血管细胞方法制得的MHC复合性降低的人成血管细胞细胞文库;(d)从文库中筛选匹配患者细胞上的MHC蛋白的人成血管细胞;(e)将步骤(d)中鉴定的人成血管细胞任选分化成人造血干细胞、内皮细胞或两者,或根据需要将这两个谱系中的任一个或两者进一步分化的细胞;(f)将步骤(d)和/或(e)中得到的任何细胞施用给所述患者。本方法可以在区域中心实施,例如医院、诊所、医师室,以及其他卫生机构。进一步地,经筛选匹配所述患者的成血管细胞如果以少量细胞数量保存,可以在治疗患者之前扩增。
人血管瘤集落形成细胞/成血管细胞
在某些方面,本发明提供人血管瘤集落形成细胞。这种细胞是独特的原始细胞类型,具有多种治疗及其他用途。并且,这种细胞类型至少为研究造血和/或内皮谱系的发育提供了重要工具。同样的,本发明关注含有血管瘤集落形成细胞的不同制剂(包括药物制剂)和组合物,以及含一种或多种从血管瘤集落形成细胞部分或最终分化而来细胞类型的制剂(包括药物制剂)和组合物。
术语“成血管细胞”和“血管瘤集落形成细胞”在本申请通篇可互换使用。这些细胞可以依据众多结构和功能特征进行描述,包括但不限于,一种或多种标记物的表达(RNA或蛋白)或缺乏表达(RNA或蛋白)。血管瘤集落形成细胞至少可分化产生造血细胞类型或内皮细胞类型。血管瘤集落形成细胞优选具有双潜能,至少可分化产生造血细胞类型或内皮细胞类型。同样的,本发明的血管瘤集落形成细胞至少是单潜能的,优选双潜能的。但是,血管瘤集落形成细胞可以有更大的分化潜能,在特定的实施方案中,可分化产生其它谱系细胞类型。在某些实施方案中,所述血管瘤集落形成细胞能分化成其它中胚层衍生物,诸如心脏细胞(如,心肌细胞)和/或平滑肌细胞。
可根据结构特征进一步鉴别和表征血管瘤集落形成细胞。在特定的实施方案中,这些细胞尤其是独特的,因为它们只是松散的相互粘连(松散粘连到其它血管瘤集落形成细胞)。因为这些细胞只是松散的相互粘连,只要使用机械解离技术而不必使用酶解技术就可使血管瘤集落形成细胞的培养物或集落解离成单细胞。所述细胞足够松散的相互粘连以至仅机械解离而不用酶解或机械和酶联合解离就足以在不实质上削弱细胞生存能力的情况下解聚培养物或集落。也就是说,当与酶解细胞聚合物之后观察的结果相比,机械解离不需要可导致细胞实质损伤或死亡的力度。
并且,血管瘤集落形成细胞可根据一种或多种标记物的表达或缺乏表达(在基因或蛋白水平评价)来鉴定或表征。例如,在某实施方案中,血管瘤集落形成细胞可根据一种或多种(如,细胞可根据至少一种,至少两种,至少三种或至少四种如下的标记物的缺乏表达来表征)如下细胞表面标记物的缺乏表达来鉴定或表征:CD34,KDR,CD133,或CD31。另外,血管瘤集落形成细胞也可根据GATA2和/或LMO2的表达来鉴定或表征。此外,血管瘤集落形成细胞可通过表2中分析的一种或多种标记物的表达或缺乏表达(在基因或蛋白水平评价)来鉴定或表征。
本发明的血管瘤集落形成细胞可根据这些结构或功能特征的一种或任意组合来鉴定或表征。注意到虽然这些细胞可从许多来源中获得,例如,胚胎组织,产前组织,产期组织,术语“血管瘤集落形成细胞”可表示任何来源的可分化成至少造血细胞类型和/或内皮细胞类型以及具有一种或多种上述结构或功能特征的细胞。
例如,本发明的人血管瘤集落形成细胞具有至少一种如下结构特征:(a)可至少分化成造血细胞类型或内皮细胞类型;(b)可分化成至少造血细胞类型和内皮细胞类型;(c)松散的相互粘连(与其它血管瘤集落形成细胞);(d)不表达CD34蛋白;(e)不表达CD31蛋白;(f)不表达KDR蛋白;(g)不表达CD133蛋白;(h)表达GATA2蛋白;(i)表达LMO2蛋白。在某些实施方案中,人血管瘤集落形成细胞有至少二种,三种,四种,五种,六种,七种,八种或至少九种本文详述的结构或功能特征。
本发明提供人血管瘤集落形成细胞。所述细胞可分化而产生至少造血细胞和/或内皮细胞类型。在某些实施方案中,所述细胞的特征是松散粘连于其它人血管瘤集落形成细胞。此外,这些细胞也可根据特定标记物的表达或缺乏表达来描述。例如,这些细胞也可根据缺乏表达至少一种下列蛋白来描述:CD34,KDR,CD133,和CD31。
如上所述,人血管瘤集落形成细胞的一种有意思的性是它们松散的相互粘连。由于这些细胞只是松散的相互粘连,血管瘤集落形成细胞的培养物或集落可以仅用机械解离使之解离成单细胞,而不必使用酶解技术。这些细胞相互间足够松散以至仅用机械解离而不用酶解或两者的组合就足以在不实质上削弱细胞生存能力的情况下使培养物或集落解聚。也就是说,机械解离不需要可导致细胞实质损伤或死亡的力度。
这种性质不只用于描述细胞,从表型上区分它们和其它细胞类型,它也具有重大的治疗意义。例如,可将相对大量(大于1×106或甚至大于1×107或甚至大于1×108)的血管瘤集落形成细胞注射入人或其它动物,其基本上减小引起血块、血栓或肺部梗阻的危险。这是细胞疗法的重大进步。安全递送相对大量的细胞的能力使有效治疗逐渐增加的疾病和病况的细胞疗法更具实用性和可能性。
术语“松散粘连”已在上文作了定性描述,是指人血管瘤集落形成细胞相互之间的行为。可以仅用机械解离技术而不必用酶解技术将人血管瘤集落形成细胞的培养物或集落解离为单细胞。这些细胞足够松散的相互粘连,以至只用机械解离,而不用酶解或两者的组合,就足以在不实质性削弱细胞生存能力的情况下使培养物或集落解聚。也就是说,机械解离不需要可导致细胞实质性损伤或死亡的力度。
所述术语也可以更量化的描述。例如在某些实施方案中,术语“松散粘连”用于指培养物中至少50%的细胞只用机械解离技术而不必用酶解技术即可解离为单细胞的人血管瘤集落形成细胞的培养物或集落。在另外的实施方案中,所述术语指培养物中至少60%,65%,70%或75%的细胞只用机械解离技术而不必用酶解技术即可解离为单细胞的培养物。再一个实施方案中,所述术语指培养物中至少80%,85%,90%,95%,96%,97%,98%,99%,或甚至100%的细胞只用机械解离技术而不必用酶解技术即可解离为单细胞的培养物。
可依据机械解离后的细胞的健康和生存能力进一步定量只用机械解离技术而不必用酶解技术解离血管瘤集落形成细胞的能力。也就是说,如果不使用酶解技术的解离需要大至可破坏或杀死非常大量的细胞的机械力,则如本文定义,细胞未松散粘连。例如在某些实施方案中,术语“松散粘连”指与使用酶解技术解离细胞时观察到的结果相比,只用机械解离技术而不必用酶解技术就可在不实质性削弱所述细胞的健康或生存能力的情况下将其解离成单细胞的细胞培养物。例如,与使用酶解技术解离细胞时观察到的结果相比,所述细胞的健康或生存能力下降少于15%,10%,9%,8%,7%,6%,5%,4%,3%,2%,或甚至少于1%。
酶解技术的例子包括,但不限于,用胰蛋白酶,胶原酶或其它破坏细胞间或细胞与基质间相互作用的酶进行处理。机械解离技术的例子包括但不限于,用移液管抽吸转移一次或数次。
通过结构和功能定义本发明的人血管瘤集落形成细胞。所述细胞能产自多种来源中的任一种,包括来自胚胎组织,产前组织,产期组织,和甚至来自成人组织。作为实例,人血管瘤集落形成细胞可以产生自人胚胎干细胞,其它胚胎衍生细胞(胚泡、卵裂球、内细胞团、胚胎、滋养层/滋养外胚层细胞、滋养层干细胞、原始生殖细胞、胚胎生殖细胞等),羊水、羊膜干细胞、胎盘、胎盘干细胞和脐带血。
本发明提供人血管瘤集落形成细胞,包含人血管瘤集落形成细胞的组合物和包含人血管瘤集落形成细胞的制剂(包括药物制剂)。以下详细描述本发明的这些方面的某些特征。本发明涉及本发明任意下述方面和实施方案的组合。
本发明一方面提供人血管瘤集落形成细胞。所述细胞可分化产生至少造血和/或内皮细胞类型。在某些实施方案中,所述细胞与其它人血管瘤集落形成细胞松散粘连。在某些实施方案中,所述细胞不表达CD34蛋白。在某些其它实施方案中,所述细胞不表达一种或多种(例如,细胞不表达至少一种,至少两种,至少三种,至少四种下列蛋白)下列蛋白:CD34,CD31,CD133,KDR。在某些其它实施方案中,所述细胞表达GATA2和/或LMO2蛋白。在某些其它实施方案中,细胞表达或不表达一种或多种(例如,至少一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2中提供的标记物。在某些其它实施方案中,所述细胞具有如表2所描述的表达谱。
本发明另一方面提供人血管瘤集落形成细胞。所述细胞可分化产生至少造血细胞和/或内皮细胞类型,且所述细胞不表达任何下列蛋白:CD34,CD31,KDR和CD133。在某些实施方案中,所述细胞松散粘连于其它人血管瘤集落形成细胞。在其它实施方案中,所述细胞表达GATA2和/或LMO2蛋白。在某些其它实施方案中,所述细胞表达或不表达一种或多种(例如,至少一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2提供的标记物。在某些其它实施方案中,所述细胞具有如表2所描述的表达谱。
本发明另一方面提供包含基本纯化的人血管瘤集落形成细胞群的细胞培养物。所述细胞可分化产生至少造血细胞和内皮细胞类型,且所述细胞相互松散粘连。在某些实施方案中,所述细胞不表达CD34蛋白。在某些其它实施方案中,所述细胞不表达一种或多种(例如,所述细胞不表达至少一种、至少两种、至少三种或至少四种下列蛋白)下列蛋白:CD34,CD31,CD133,KDR。在某些其它实施方案中,所述细胞表达GATA2和/或LMO2蛋白。在某些其它实施方案中,所述细胞表达或不表达一种或多种(一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2提供的标记物。在某些其它的实施方案中,所述细胞具有如表2所描述的表达谱。
本发明另一方面提供包含由胚胎组织分化而来的人血管瘤集落形成细胞的细胞培养物。在某些实施方案中,所述血管瘤集落形成细胞相互松散粘连。在某些实施方案中,所述细胞可分化产生至少造血细胞和/或内皮细胞类型,且所述细胞相互松散粘连。在某些实施方案中,所述细胞不表达CD34蛋白。在某些其它实施方案中,所述细胞不表达一种或多种(例如,所述细胞不表达至少一种、至少两种、至少三种或至少四种下列蛋白)下列蛋白:CD34,CD31,CD133,KDR。在其它某些实施方案中,所述细胞表达GATA2和/或LMO2蛋白。在某些其它实施方案中,所述细胞表达或不表达一种或多种(一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2提供的标记物。在某些其它实施方案中,所述细胞具有如表2所描述的表达谱。
本发明另一方面提供包含人血管瘤集落形成细胞的细胞培养物,其细胞可分化产生至少造血细胞和/或内皮细胞类型。在某些实施方案中,所述细胞相互松散粘连。在某些实施方案中,所述细胞不表达CD34蛋白。在某些其它实施方案中,所述细胞不表达一种或多种(例如,所述细胞不表达至少一种、至少两种、至少三种或至少四种下列蛋白)下列蛋白:CD34,CD31,CD133,KDR。在某些其它实施方案中,所述细胞表达GATA2和/或LMO2蛋白。在某些其它实施方案中,所述细胞表达或不表达一种或多种(一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2提供的标记物。在其它某些实施方案中,所述细胞具有如表2所描述的表达谱。
本发明另一方面提供包含人血管瘤集落形成细胞的药物制剂,其细胞可分化产生至少造血细胞和/或内皮细胞类型。在某些实施方案中,所述血管瘤集落形成细胞相互松散粘连。在某些实施方案中,所述细胞不表达CD34蛋白。在其它某些实施方案中,所述细胞不表达一种或多种(例如,细胞不表达至少一种、至少两种、至少三种或至少四种下列蛋白)下列蛋白:CD34,CD31,CD133,KDR。在某些其它实施方案中,所述细胞不表达GATA2和/或LMO2蛋白。在某些其它实施方案中,所述细胞表达或不表达一种或多种(一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2提供的标记物。在某些其它实施方案中,所述细胞具有如表2所描述的表达谱。可用任何药学可接受的载体或赋形剂制备所述药物制剂。
本发明另一方面提供包含人血管瘤集落形成细胞的药物制剂,其中所述血管瘤集落形成细胞不表达任何下列蛋白:CD34,CD31,KDR和CD133。在某些实施方案中,所述血管瘤集落形成细胞可分化产生至少造血细胞和/或内皮细胞类型。在某些实施方案中,所述血管瘤集落形成细胞相互松散粘连。在某些其它实施方案中,所述细胞表达GATA2和/或LMO2蛋白。在某些其它实施方案中,所述细胞表达或不表达一种或多种(一种、两种、三种、四种、五种、六种、七种、八种、九种、十种等)表2提供的标记物。在某些其它实施方案中,所述细胞具有如表2所描述的表达谱。可用任何药学可接受的载体或赋形剂制备所述药物制剂。
在上述任意的某些实施方案中,所述组合物或药物制剂包含至少1×105个人血管瘤集落形成细胞。在上述任意的某些其他实施方案中,所述组合物或药物制剂包含至少1×106、至少5×106、至少1×107、或大于1×107个人血管瘤集落形成细胞。
另外的细胞、组合物核制剂包含由人血管瘤集落形成细胞部分或最终分化而来的细胞。例如,本发明涉及包含一种或多种分化自血管瘤集落形成细胞的造血细胞和/或内皮细胞类型的组合物和制剂。造血细胞类型的例子包括造血干细胞、血小板、红细胞、淋巴细胞、巨核细胞等等。更进一步的例子,本发明涉及包含一种或多种其它细胞类型的组合物或制剂,例如一种或多种由血管瘤形成细胞部分或最终分化而来的中胚层细胞类型。
在上述任意的某些实施方案中,本发明提供人血管瘤集落形成细胞或由其部分或最终分化而来的细胞的冷藏制剂。
在上述任意的某些实施方案中,本发明提供人血管瘤集落形成细胞或人血管瘤集落形成细胞的组合物或制剂的治疗性用途。这样的细胞和制剂可用于治疗说明书通篇详细描述的任何病况或疾病,也可以用于血库工业。并且,分化自人血管瘤集落形成细胞的细胞,或人血管瘤集成细胞的组合物或制剂可被用于治疗说明书通篇详述的任何病况或疾病,也可用于血库工业。
可治疗性使用本发明的人血管瘤集落形成细胞。此外,也可将人血管瘤集落形成细胞用于研究内皮细胞或造血细胞谱系的发育,或用于鉴定可被用于如下用途的因子的筛选试验,例如,(i)维持人血管瘤集落形成细胞,或(ii)促进人血管瘤集落形成细胞分化为一种或多种部分或最终分化的细胞类型。并且,人血管瘤集落形成细胞可被用于产生具有体外或体内用途的一种或多种部分或最终分化的细胞类型。
本发明的人血管瘤集落形成细胞可被用于本发明描述的任何方法或应用中,包括但不限于,本文描述的疾病或病况的治疗。
包含体外扩增的成血管细胞的细胞制剂
在本发明的某些实施方案中,将哺乳动物(包括人)成血管细胞扩增到商业数量并用于多种治疗或临床应用。在特定的实施方案中,将成血管细胞扩增达10,000到4百万(或更多)数量。可在起始制备的3-4天内达到这样的细胞数量。相应的,本发明涉及包含大量成血管细胞的制剂,所述制剂包含至少10,000、50,000、100,000、500,000、1百万、2百万、3百万或4百万的细胞。
本发明也提供了包含大量成血管细胞的溶液、组合物和制剂。所述溶液、所述组合物和所述制剂包含至少10,000、50,000、100,000、500,000、1百万、2百万、3百万或4百万个细胞。所述成血管细胞可以是人的。
本发明的其它方面涉及将通过本文公开的方法得到的成血管细胞分化成造血细胞或内皮细胞谱系,或分化成两者,并随后将其用于临床上。因此,本发明也涉及包含大量造血或内皮细胞的细胞制剂。本发明也涉及将通过本文公开的方法得到的成血管细胞分化成除造血或内皮细胞以外的其它细胞谱系。因此,本发明也涉及包含大量其它由成血管细胞衍生来的细胞的细胞制剂。
可通过扩增依上述方法得到的成血管细胞而得到包含大量(例如,数千或数百万)成血管细胞的组合物和制剂。相应的,本发明涉及包含大量通过扩增ES细胞(例如人ES细胞)得到的成血管细胞或由脐带血,外周血或骨髓的得到的成血管细胞的组合物和制剂。进一步的,由于所述扩增方法可用于,例如,小鼠、大鼠、牛或非人灵长类来源的成血管细胞,本发明也涉及包含大量人以外其它物种的成血管细胞的组合物或制剂。通过本发明的方法扩增得到的成血管细胞可以是双潜能的,例如,可以分化成内皮或造血干细胞两者之一。在某些实施方案中,产生并扩增自人ES细胞的人成血管细胞是双潜能的。血管瘤集落形成细胞能分化产生至少造血细胞类型或内皮细胞类型。血管瘤集落形成细胞优选是双潜能的,并能分化产生至少造血细胞类型或内皮细胞类型。因此,本发明的血管瘤集落形成细胞是至少单潜能的,且优选是双潜能的。但是,血管瘤集落形成细胞也可有更高程度的分化潜能,并在某些实施方案中能分化产生其它谱系细胞类型。在某些实施方案中,所述血管瘤集落形成细胞能分化产生其它中胚层衍生物,例如心细胞(如,心肌细胞)和/或平滑肌细胞。
哺乳动物成血管细胞标记物
如上所述,所述血管瘤集落形成细胞缺乏成熟内皮细胞或造血细胞的某些特征。但是,可以通过多种标记物鉴别这些血管瘤集落形成细胞或成血管细胞,例如,CD71+,GATA-1和GATA-2蛋白,CXCR-4,和TPO和EPO受体。在其它实施方案中,所述成血管细胞表达LMO-2。此外,也可以通过其它标记物的缺失或低表达来表征成血管细胞。相应的,成血管细胞可是CD34-、CD31-和KDR-。再一个实施方案中,所述成血管细胞可以是CD34-,CD31-,KDR-和CD133-。
相应的,在某些实施方案中,通过本发明的方法产生和扩增的成血管细胞的特征是存在或缺失一种或多种表2列举的标记物。例如,可检测到成血管细胞的任何一种或多种列于表2“BL-CFC”下被标记为“-”的标记物的表达呈阴性。相应的,在一些实施方案中,所述成血管细胞可呈CD34表达阴性。此外,所述细胞也可呈CD31,CD133,和/或KDR表达阴性。再一个实施方案中,所述成血管细胞可表达任何表2中被标记为“+”的标记物。例如,所述细胞可表达一种或多种标记物LMO-2和GATA-2。标记物的表达可通过任何方法评估,例如,免疫组织化学或免疫印迹检测蛋白表达,或mRNA分析检测RNA水平的表达。
衍生成血管细胞系细胞
本发明的方法或细胞制剂也涉及成血管细胞衍生细胞。通过本发明的方法产生和扩增的人成血管细胞和通过本发明的方法扩增的哺乳动物成血管细胞可被体外分化得到造血细胞(包括造血干细胞(HSC))或内皮细胞,也可得到由这两个谱系进一步分化的细胞。这些细胞随后可用于下述治疗或商业应用。
在某些实施方案中,通过在无血清BL-CFU中培养成血管细胞3-10天得到造血细胞。在其它实施方案中,培养hES-衍生BL-CFC细胞的单细胞悬液10-14天。就无血清环境有助于规模化生产、并符合规范及降低成本而言,保持无血清环境是最佳的。本发明的成血管细胞也可以在无血清Hem培养基(Bhatia等.1997J Exp Med(186):619-624)中生长,所述培养基可以维持人造血干细胞并包含BSA(如,1%BSA),胰岛素(如,5μg/ml人胰岛素),转铁蛋白培养基或转铁蛋白(如,100μg/ml人转铁蛋白),L-谷胺酰胺,β-巯基乙醇(如,10-4M),和生长因子。所述生长因子包括SCF(如,300ng/ml),粒细胞-集落-刺激因子(G-CSF)(如,50ng/ml),Flt-3(如,300ng/ml),IL-3(如,10ng/ml)和IL-6(如,10ng/ml)。其它用于由成血管细胞获得造血细胞的因子包括血小板生成素(TPO)和VEGF(如,见Wang等.2005Ann NY Acad Sex(1044):29-40)和BMP-4。成血管细胞也可以在补充了多谱系造血生长因子混合剂的无血清甲基纤维素培养基中生长。因此,所述成血管细胞可生长于Iscove改良的Dulbecco培养基(IMDM)的甲基纤维素中,所述培养基包含BSA、饱和人转铁蛋白、人LDL、并补充了早期作用生长因子(如,c-kit配体、flt3配体)、多谱系生长因子(如,IL-3,粒细胞巨噬细胞-CSF(GM-CSF))、和单谱系生长因子(如,G-CSF、M-CSF、EPO、TPO)、VEGF、和bFGF。另外,所述成血管细胞也可生长于包含单谱系生长因子来支持一种类型的造血细胞(如,红细胞、巨噬细胞或粒细胞)生长的培养基中。
在一个实施方案中,将成血管细胞集落重悬于Stemline I培养基中。随后将细胞与补入1.5μg/ml tPTD-HoxB4和0.5%EX-CYTE(Serologicals Proteins Inc.TM)的1ml无血清造血CFU培养基(H4436,Stem Cell TechnologiesTM)混合。然后将细胞混合物平板接种于未处理的平板上,并于37℃培养10-14天。可对初始平板接种后10-14天后出现的造血CFU可进行形态学表征,如,通过用Wright-Giemsa染料染色。
也可以利用其它本领域熟知的条件(如,在包含IMDM,30%肽牛血清(FCS),1%牛血清白蛋白(BSA),10-4M β-巯基乙醇和2mM L-谷胺酰胺)由成血管细胞衍生出造血细胞。而且,在其它实施方案中,也可使用碱性成纤维细胞生长因子促进EB内的两个BL-CFC频率和促进造血分化(Faloon等.2000Development(127):1931-1941)。在另外一些实施方案中,使用所述生长因子血管促血细胞生成素(HAPO)促进成血管细胞的生长和向造血细胞分化(Liu等.2004Blood(103):4449-4456)。例如,可用CD45状态(CD45+)和CFU测定评价向造血细胞的分化。
为形成造血细胞,可将人成血管细胞在CFU-培养基中培养3-10天,或任选培养更长时期(如,10-14天)。本发明的人成血管细胞能形成包含粒细胞、红细胞、巨噬细胞、巨核细胞(CFU-GEMM/mix)及只含有后者细胞类型中的一种的集落形成单位(如,CFU-G,CFU-E,CFU-M,和CFU-GM)的CFU或形成。在某些实施方案中,使hES-衍生BL-CFC细胞的单细胞悬液生长10-14天以衍生造血细胞,例如,红细胞、骨髓细胞、巨噬细胞和多谱系造血细胞。
本发明的其它方面涉及衍生自通过本文描述的方法得到并扩增的人成血管细胞或扩增的哺乳动物成血管细胞的内皮细胞。可使所述成血管细胞在有利于内皮细胞成熟的条件下生长。
在本发明的某些实施方案中,为获得内皮细胞,首先将成血管细胞首先被平板接种于包被有纤维连接蛋白的平板表面,3-5天(或在其它实施方案中3-7天)后,重新平板接种于一厚层基质胶上以支持向内皮细胞的分化。这些条件维持了成血管细胞发育过程中建立的无血清状态。可替换的,也可使成血管细胞在已知支持向内皮细胞分化的培养基中生长。这些条件包括,例如,包含20%胎牛血清(FBS),50ng/ml内皮细胞生长添加物(如,垂体提取物),10IU/ml肝素和5ng/ml人VEGF-A165(Terramani等.2000In Vitro Cell Dev Biol Anim(36):125-132)的内培养。其它本领域已知的条件包括补充了25%FCS/马血清,和在某些实施方案中补充了肝素(如,10U/ml),胰岛素样生长因子(IGF1)(如2ng),和EC生长添加物(ECGS,如100μg)的培养基。也可将生长因子VEGF和EGF与HAPO联合用于支持内皮细胞分化(Liu等.2004)。例如,也可将成血管细胞接种于包被有胶原和纤维连接蛋白的平板上,以促进向内皮细胞的分化。可以对细胞的von Willebrand因子(vWF)和内皮细胞一氧化氮合酶(eNOS)和体外形成内皮细胞网络的能力进行分析。
相应的,为形成内皮细胞,挑选通过上述方法衍生而来的成血管细胞集落,并重平板接种于包被有纤维连接蛋白的培养平板上作为最佳的向内皮细胞分化的第一步。可将细胞平板接种于EGM-2或EGM-2MV完全培养基(CambrexTM)中。3-5天后,在可替换的实施方案中3-7天后,将所述细胞重平板接种于支持内皮细胞分化的表面,例如一层基质胶。经过16-24小时的培养,分支管-索(如见图8)的形成揭示了典型的内皮细胞行为。也可将诸如LDL-吸收的内皮细胞特异性检测用于证实这些细胞本质上是内皮细胞。
在本发明的其它方面,可将依本发明的方法产生和扩增的人成血管细胞和依本发明的方法扩增的哺乳动物成血管细胞在体外分化而得到其它细胞,也可得到由这些细胞谱系进一步分化的细胞。这些更多的细胞谱系可源于依本发明的方法产生和扩增的人成血管细胞和依本发明的方法扩增的哺乳动物成血管细胞,因为所述成血管细胞可具有除分化成造血细胞和内皮细胞外的甚至更大程度的发育潜能。
人成血管细胞和成血管细胞谱系细胞的临床和商业实施方案
基于细胞的治疗
虽然人成血管细胞有体内分化成造血细胞或内皮细胞的潜能,可将它们用于基于细胞的治疗中,其中需要这两种细胞类型之任一,或用其可改善治疗。进一步,患者可接受包含成血管细胞谱系细胞(如造血细胞和/或内皮细胞)的任何治疗或处理。下面的部分描述利用依本发明的方法产生和扩增的或依本发明的方法扩增的本发明的人成血管细胞的方法。
在本发明的某些实施方案中涉及增加或处理造血细胞的方法或增加血管生长和/或促进血管修复的方法。相应的,在某些方面,本发明涉及治疗需要造血细胞或需要血管生长或修复的患者的方法和组合物。可将成血管细胞注射入受试者的血管或通过手术向血管给药。患者或受试者可以是人。
在本发明的某些实施方案中,人成血管细胞被用于移植,其中也可以另外采用HSC移植。例如,可以将这样的移植用于治疗患急性或慢性白血病、再生障碍性贫血和多种免疫缺陷综合症、多种非血液恶性肿瘤和自身免疫病变的患者的造血细胞重建中,并从高剂量化疗和/或放疗后治疗诱导的发育不全中挽救患者。这样的移植可在体内或离体完成(如骨髓移植)。
在本发明的其它实施方案中,人成血管细胞被用于治疗需要造血细胞重建或造血细胞治疗的患者。这样的患者包括,例如,患地中海贫血、镰状细胞性贫血、再生障碍性贫血(亦称再生不良性贫血)、血球减少、骨髓发育不良、血小板缺陷、诸如白血球过多症的造血恶性肿瘤、阵发性睡眠性血红蛋白尿症(PNH)和ADA(如脱氨酶(ADA)缺陷重度联合免疫缺陷症(SCID))的患者。
本发明特定实施方案涉及治疗需要利用本发明的成血管细胞进行造血细胞重建或造血细胞治疗的患者的方法。相应的,本发明涉及治疗需要进行造血细胞重建或治疗的患者的方法,所述治疗包括选择需要根据本发明的方法产生和扩增或扩增的人成血管细胞的患者,并将人成血管细胞施用于所述患者。另外,所述方法也可包括将产生和扩增或扩增的人成血管细胞分化成人造血细胞,并随后将所述造血细胞施用于患者。
替代性实施方案包括大规模生产人成血管细胞并在选择有此需要的患者前保存的方法。因此,本发明的其它实施方案涉及治疗需要造血细胞重建或治疗的患者的方法,所述治疗包括选择有需要的患者,定购已经根据上述方法分离和扩增的人成血管细胞,并将所述人成血管细胞施用于患者。同时,所述方法可包括将所述人成血管细胞分化为人造血细胞,并将所述造血细胞施用于患者。在另外的实施方案中,培养至少一种MHC等位基因半合子的或纯合子成血管细胞,优选培养至商业化数量,并优选通过商业实体贮存。当出现患者对这样的细胞或成血管细胞谱系细胞的需求时,临床医师或医院就定购这样的细胞。
由于本发明的人成血管细胞在血管原性的微环境下将扩增并分化成内皮细胞,所述人成血管细胞可被用于在患者受伤部位提供新血管或诱导受损血管修复的治疗手段。因此在某些方面,本发明涉及促进新血管生长或修复受损血管系统的方法。本发明的人成血管细胞可被用于治疗内皮细胞损伤,如心肌梗塞,中风和脑缺血,四肢缺血和包含四肢缺血的皮肤创伤和发生于糖尿病动物或患者的创伤,和视网膜缺血再灌注损伤。其它可用本发明的成血管细胞治疗的局部缺血病况包括肾缺血,肺缺血,缺血性心肌病。也可将成血管细胞用于在气囊血管成形术后或展开血管内支架后帮助修复损伤血管。另外,成血管细胞可被用于组织移植、外科手术还有放疗后。进一步的,成血管细胞可被用于治疗和/或阻止动脉粥样硬化的进程,也可用于修复系统性硬化病和雷诺氏现象(RP)(Blann等.1993J Rheumatol.(20):1325-30)中发生的内皮细胞损伤。
相应的,本发明提供涉及为有需要的患者提供血管生长或修复的多种方法。在一个实施例中,本发明提供在有需要的患者的缺血组织诱导新血管形成的方法,其包括将有效量的上述人成血管细胞的纯化制剂施用于所述患者以在所述缺血组织诱导新血管形成。因此本发明的某些方面提供在有需要的患者体内增强血管形成方法,其包括选择有需要的患者,分离上述人成血管细胞,并将所述成血管细胞施用于患者。在另一方面,本发明提供治疗有需要的患者的受损血管的方法,其包括选择有需要的患者,扩增或产生并扩增上述人成血管细胞,并将所述成血管细胞施用于患者。除上面提到的实施例外,可大规模生产所述成血管细胞,并在选择需要成血管细胞的患者之前贮存。再一个实施例中,培养至少一种MHC等位基因的半合子的或纯合子的成血管细胞,任选培养至商业化的数量,并任选在选择进行成血管细胞治疗的患者之前贮存。可将上面提到的任何成血管细胞或成血管细胞制剂直接施用于循环系统(静脉内)。在某些实施方案中,(如,需要进行眼部血管修复,如在视网膜局部缺血/再灌注损伤的治疗中),可通过玻璃体内注射施用所述成血管细胞或成血管细胞制剂。
可通过任何途径施用成血管细胞或其衍生细胞的溶液或制剂,并可根据具体病例决定。这些待施用的成血管细胞或其衍生细胞的溶液或制剂的有效量也是治疗上有效的量,且决定于具体病例。
再一个方面,成血管细胞谱系细胞被用于治疗应用,例如,包括用于上述适应症的治疗。相应的,将通过本文描述的方法产生和扩增的或扩增的成血管细胞先在体外分化成造血细胞和/或内皮细胞,然后得到由这两个谱系中进一步分化的细胞。这些细胞随后可被施用于受试者或患者以治疗造血病症或进行造血重建,或治疗诸如局部缺血或血管损伤。
使衍生自通过本文描述的方法获得的人成血管细胞的HSC进一步生长以扩增HSC和/或衍生出其它造血谱系细胞类型。本发明的某些方面涉及将衍生自成血管细胞的HSC用于移植。在另外的实施方案中,分化的造血细胞(如,粒细胞、红细胞、骨髓细胞、巨核细胞、血小板、巨噬细胞、肥大细胞和中性白细胞(Wiles and Keller 1991Development(111):259))被用于各种治疗,例如输血治疗或治疗感染。相应的,本发明的其它实施方案涉及对需要造血细胞重建或用HSC或衍生自本发明的成血管细胞的造血谱系细胞进行治疗的患者进行治疗的方法。
因此,在某些方面,本发明涉及对需要造血细胞或需要治疗的患者进行治疗的方法,所述治疗包括选择有需求的患者,根据本发明的方法扩增或分离和扩增人成血管细胞,将所述成血管细胞分化成造血干细胞和/或成熟造血细胞,并将所述造血细胞施用于患者。
在本发明的其它方面,根据本文公开的方法培养所述成血管细胞而产生内皮细胞。内皮细胞随后可被用于提供新血管或诱导患者受伤部位受损血管的修复。因此在某些实施方案中,本发明涉及促进新血管生长或修复受损血管系统的方法,其中衍生自成血管细胞的内皮细胞被用于治疗。所述内皮细胞可用于治疗内皮损伤,如心肌梗塞和肺缺血、中风和脑缺血、四肢缺血和包括四肢缺血的皮肤创伤和发生于糖尿病动物或患者的创伤、视网膜缺血性灌注损伤,肾缺血。内皮细胞也可以用于在气囊血管成形术或展开血管内支架后以及移植、手术时和放疗后帮助修复受损血管。进一步的,内皮细胞也可以用于治疗和/或防止动脉粥样硬化的进程以及修复发生于系统性硬化病和雷诺氏现象中的内皮细胞受损。
内皮细胞可进一步分化,并且如果合适的话,那些细胞可被用于治疗一种或多种“内皮细胞”疾病或病况,例如列于前述段落中的病况。
相应的,本发明的某些方面涉及治疗内皮细胞或血管受损或需要血管生长或修复的患者的方法,其包括选择有需求的患者,根据本发明的方法扩增或分离并扩增人成血管细胞,将所述成血管细胞分化为内皮细胞,并将所述内皮细胞施用于患者。
血库
本发明的另一方面提供产生适于输血的成血管细胞方法。虽然这样的细胞和方法有众多用途,尤其重要的用途在于提高输血用血液的有效性。在本发明的某些优选实施方案中,本发明提供由成血管细胞/血管瘤集落形成单位分化而来的红细胞。这样的分化的红细胞可用于输血。
本发明还的涉及从成血管细胞/血管瘤集落形成单位产生用于为需要者进行输血的分化的造血细胞的方法。在某些实施方案中,输入分化的造血细胞以治疗外伤,手术中失血,诸如贫血、镰状细胞性贫血、溶血性疾病或恶性的血液疾病。在某些实施方案中,红细胞输入体内以治疗外伤,手术中失血,诸如贫血、镰状细胞性贫血、溶血性疾病的血液疾病。在某些实施方案中,血小板被输入体内以治疗先天性血小板异常或恶性疾病。在某些实施方案中,用红细胞和血小板的混合群进行输血。
应该注意的是许多分化的造血细胞类型,尤其是红细胞,一般以混合群的形式存在于体内。尤其发现体内存在不同年龄和分化水平的循环的红细胞。并且,红细胞随时间而成熟使得其表达更少的胎儿血红蛋白和更多成人血红蛋白。本发明关注用纯化的红细胞群或具有不同年龄水平或分化水平的红细胞的混合群进行输血。在特定实施方案中,本发明关注用表达胎儿血红蛋白(血红蛋白F)的红细胞进行输血。
本发明提供由人血管瘤集落形成细胞在体外产生分化的造血细胞的方法,所述方法包括以下步骤:(a)提供人血管瘤集落形成细胞;和b)将所述血管瘤集落形成细胞分化成分化的造血细胞。
本发明也提供使用由人血管瘤集落形成细胞体外分化成的造血细胞进行输血的方法,所述方法包括以下步骤:
(a)提供人血管瘤集落形成细胞;
(b)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(c)用所述分化的造血细胞进行输血。
本发明也提供使用由人血管瘤集落形成细胞体外分化成的造血细胞进行输血的方法,所述方法包括以下步骤:
(a)在无血清培养基中,在存在至少一种足够将胚胎干细胞诱导分化成胚状体的的量的生长因子的情况下,培养包含所述人胚胎干细胞的细胞培养物;
(b)向所述包含胚状体的培养物中加入至少一种生长因子,并在无血清培养基中继续培养所述培养物,其中所述生长因子的量足以在所述胚状体培养物中扩增人血管瘤集落形成细胞;
(c)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(d)用所述的分化的造血细胞进行输血。
在某些实施方案中,在所述方法步骤(a)和(b)的整个过程中使所述干细胞,胚状体和血管瘤集落形成细胞在无血清培养基中生长。
本发明也提供使用由人血管瘤集落形成细胞体外分化成的造血细胞进行输血的方法,所述方法包括以下步骤:
(a)在无血清培养基中,在存在至少一种足够将胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,培养包含所述人胚胎衍生细胞的细胞培养物;
(b)向所述包含胚状体的培养物中加入至少一种生长因子,并在无血清培养基中继续培养所述培养物,其中所述生长因子的量足以在所述胚状体培养物中扩增人血管瘤集落形成细胞;
(c)将所述胚状体解聚为单细胞;
(d)向所述包含单细胞的培养物中加入至少一种生长因子,并在无血清培养基中继续培养所述培养物,其中所述生长因子的量足以在所述包含所述单细胞的培养物中扩增人血管瘤集落形成细胞;
(e)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(f)用所述分化的造血细胞进行输血。
在某些实施方案中,在所述方法步骤(a)-(d)的整个过程中使所述胚胎衍生细胞,胚状体,血管瘤集落形成细胞和单细胞在无血清培养基中生长。
在某些实施方案中,所述胚胎衍生细胞是胚胎干细胞。
在某些实施方案中,生长因子是包括同源异形盒蛋白,或其功能性变体或其活性片段的蛋白。在某些实施方案中,所述同源异形盒蛋白包括HOXB4蛋白,或其功能性变体或其活性片段。
在某些实施方案中,所述分化的造血细胞被作为诸如红细胞、血小板或吞噬细胞的单细胞类型产生。但值得注意的是,当产生单细胞类型时,所述细胞类型可在特定细胞类型的成熟和分化水平上是不同的。例如,分化的红细可在成熟水平和细胞年龄水平方面是不同的。不受理论束缚,这种红细胞的不同将是有益的,因为其模拟了体内发现的红细胞。
在某些实施方案中,以与血液中发现的分化细胞类型的比例相同的比例混合所述单细胞类型。在某些实施方案中,通过同样的步骤产生多种分化的造血细胞类型。在某些实施方案中,所述吞噬细胞选自:粒细胞、中性白细胞、嗜碱性粒细胞、嗜酸性粒细胞;淋巴细胞或单核细胞。在某些实施方案中,以与血液中发现的分化的造血细胞类型的比例(96%红细胞,1%血小板,和3%吞噬细胞)相同的比例产生所述造血细胞类型。在某些实施方案中,输血前将血浆加入分化的造血细胞。在某些实施方案中,在无血浆或基本无血浆的情况下输入浓集细胞(例如浓集红细胞)。
在某些实施方案中,依本申请的方法产生的分化的造血细胞是有功能的。在某些实施方案中,依本申请的方法产生的血小板是有功能的。在某些实施方案中,依本申请的方法产生的吞噬细胞是有功能的。在某些实施方案中,依本申请的方法产生的红细胞是有功能的。在某些实施方案中,所述红细胞在输血前表达血红蛋白F。在某些实施方案中,所述红细胞携带氧。在某些实施方案中,所述红细胞的寿命与天然来源的红细胞相同。在某些实施方案中,所述红细胞的寿命是天然来源红细胞的75%。在某些实施方案中,所述红细胞的寿命是天然来源红细胞的50%。在某些实施方案中,所述红细胞的寿命是天然来源红细胞的25%。
在某些实施方案中,本发明的方法每100mm培养皿产生1×106个细胞。在某些实施方案中,每100mm培养皿产生2×106个细胞。在某些实施方案中,每100mm培养皿产生3×106个细胞。在某些实施方案中,每100mm培养皿产生4×106个细胞。在某些实施方案中,每100mm培养皿产生5×106个细胞。在某些实施方案中,每100mm培养皿产生6×106个细胞。在某些实施方案中,每100mm培养皿产生7×106个细胞。在某些实施方案中,每100mm培养皿产生8×106个细胞。在某些实施方案中,每100mm培养皿产生9×106个细胞。在某些实施方案中,每100mm培养皿产生1×107个细胞。在某些实施方案中,每100mm培养皿产生5×107个细胞。在某些实施方案中,每100mm培养皿产生1×108个细胞。
在某些实施方案中,所述分化步骤通过上面讨论的本领域技术人员熟知的条件实施。在某些实施方案中,所述分化步骤通过专用于将细胞分化成红细胞的方法(见WO2005/118780,通过引用并入本文)实施。在某些实施方案中,所述分化步骤通过专用于将细胞分化成血小板的方法实施。在某些实施方案中,所述分化步骤通过专用于将细胞分化成白细胞的方法实施。
本发明可以使用的分化剂包括细胞因子,如α干扰素A,α干扰素A/D,β干扰素,γ干扰素,γ干扰素诱导蛋白-10,白细胞介素-1,白细胞介素-2,白细胞介素-3,白细胞介素-4,白细胞介素-5,白细胞介素-6,白细胞介素-7,白细胞介素-8,白细胞介素-9,白细胞介素-10,白细胞介素-1,白细胞介素-12,白细胞介素-13,白细胞介素-15,白细胞介素-17,角质化细胞生长因子,瘦素,白血病抑制因子,巨噬细胞集落刺激因子和巨噬细胞炎性蛋白-1α。
根据本发明的分化剂也包括生长因子,如6Ckine(重组),激活素A,αA-干扰素,α-干扰素,双向调节因子,血管生成素,B-内皮细胞生长因子,β动物纤维素,B-干扰素,脑源神经营养因子,Cl0(重组),心脏营养素-1,睫状神经营养因子,细胞因子诱导的嗜中性细胞化学引诱物-1,内皮细胞生长添加物,嗜酸细胞活化趋化因子,表皮生长因子,上皮嗜中性细胞激活肽-78,促红细胞生成素,雌激素受体-α,雌激素受体-β,成纤维细胞生长因子(酸性/碱性的,肝素稳定的,重组的),FLT-3/FLK-2配体(FLT-3配体),γ干扰素,胶质细胞系衍生神经营养因子,Gly-His-Lys,粒细胞集落刺激因子,粒细胞巨噬细胞集落刺激因子,GRO-α/MGSA,GRO-β,GRO-γ,HCC-1,肝素结合性表皮生长因子样生长因子,肝细胞生长因子,调蛋白-α(EGF域),胰岛素生长因子结合蛋白-1,胰岛素样生长因子结合蛋白-1/IGF-1混合物,胰岛素样生长因子,胰岛素样生长因子II,2.5S神经生长因子(NGF),7S-NGF,巨噬细胞炎性蛋白-1B,巨噬细胞炎性蛋白-2,巨噬细胞炎性蛋白-3α,巨噬细胞炎性蛋白-3B,单核细胞趋化蛋白-1,单核细胞趋化蛋白-2,单核细胞趋化蛋白-3,神经营养因子-3,神经营养因子-4,NGF-β(人或鼠的重组的),制瘤素M(人或鼠的重组的),垂体提取物,胎盘生长因子,血小板衍生内皮细胞生长因子,血小板衍生生长因子,多营养因子,rantes,干细胞因子,间质细胞衍生因子1B/前β细胞生长刺激因子,血小板生成素,转化生长因子α,转化生长因子B1,转化生长因子B2,转化生长因子B3,转化生长因子B5,肿瘤坏死因子(α和β)和血管内皮生长因子。
根据本发明的分化剂也包括激素和激素拮抗剂,如17B-雌二醇,促肾上腺皮质激素,肾上腺髓质激素,α-促黑素细胞激素,绒毛膜促性腺激素,皮质类固醇结合球蛋白,肾上腺酮,地塞米松,雌三醇,卵泡刺激激素,胃泌素1,胰高血糖素,促性腺素,氢化可的松,胰岛素,胰岛素样生长因子结合蛋白,L-3,3',5'-三碘甲状腺原氨酸,L-3,3',5-三碘甲状腺原氨酸,瘦素,黄体化激素,L-甲状腺素,退黑激素,MZ-4,催产素,甲状旁腺激素,PEC-60,垂体生长激素,孕酮,催乳素,肠促胰液素,性激素结合球蛋白,促甲状腺激素,促甲状腺激素释放因子,甲状腺结合球蛋白,和加压素。
此外,本发明的分化剂也包括细胞外基质成分,例如纤维连接蛋白,纤维连接蛋白的蛋白水解片段,层粘连蛋白,凝血酶敏感素,聚集蛋白聚糖,和syndezan。
本发明的分化剂也包括抗不同因子的抗体,如抗低密度脂蛋白受体抗体,抗孕酮受体内部抗体,抗α干扰素受体第2链抗体,抗c-c趋化因子受体1抗体,抗CD118抗体,抗CD119抗体,抗集落刺激因子-1抗体,抗CSF-1受体/c-fins抗体,抗表皮生长因子(AB-3)抗体,抗表皮生长因子受体抗体,抗表皮生长因子受体磷酸特异性抗体,抗表皮生长因子(AB-1)抗体,抗促红细胞生成素受体抗体,抗雌激素受体抗体,抗雌激素受体,C末端抗体,抗雌激素受体β抗体,抗成纤维细胞生长因子受体抗体,抗成纤维细胞生长因子碱性抗体,抗γ干扰素受体链抗体,抗γ干扰素人重组抗体,抗GFRα1C末端抗体,抗GFRα2C末端抗体,抗粒细胞集落刺激因子(AB-1)抗体,抗粒细胞集落刺激因子受体抗体,抗胰岛素受体抗体,抗胰岛素样生长因子-1受体抗体,抗白细胞介素-6人重组抗体,抗白细胞介素-1人重组抗体,抗白细胞介素-2人重组抗体,抗瘦素小鼠重组抗体,抗神经生长因子受体抗体,抗p60鸡抗体,抗甲状旁腺激素样蛋白抗体,抗血小板衍生生长因子受体抗体,抗血小板衍生生长因子受体β抗体,抗血小板衍生生长因子受体α抗体,抗孕酮受体抗体,抗视黄酸受体α抗体,抗甲状腺激素核受体抗体,抗甲状腺激素核受体α1/Bi抗体,抗转铁蛋白受体/CD71抗体,抗转化生长因子α抗体,抗转化生长因子B3抗体,抗肿瘤坏死因子α抗体,和抗血管内皮生长因子抗体。
本发明也提供上述给潜在的患者受者提供匹配的细胞的分化的造血细胞库。在某些实施方案中,冷藏所述细胞。相应的,在一个实施方案中,本发明提供进行制药的方法,包括提供至少一种组织相容性抗原纯合的分化造血细胞的制剂的步骤,其中细胞选自包含可用本文公开的方法扩增的人血管瘤集落形成细胞库,其中各人血管瘤集落形成细胞制剂是在人类种群中至少一种MHC等位基因半合子或纯合子,其中所述血管瘤集落形成细胞库包括相对于所述细胞库的其它成员来说就不同的一套MHC等位基因而言每个都是是半合子的或纯合子的细胞。如上所述,基因打靶或杂合性消失可用于产生用于衍生血管瘤集落形成细胞的MHC等位基因半合子的或纯合的干细胞。在某些实施方案中,所述库包括了所有血型的血管瘤集落形成细胞。在某些实施方案中,血管瘤集落形成细胞与患者匹配以保证产生出患者自身血型的分化的造血细胞。在某些实施方案中,血管瘤集落形成细胞对抗原因子A、B、Rh或它们的任意组合呈阴性。在某些实施方案中,所述分化造血细胞是通用供血者的细胞。例如,O型且Rh阴性的造血细胞能被普遍应用于输血。在某些实施方案中,本发明提供产生用于通用输血的O型、Rh阴性红细胞的方法。
在某些实施方案中,分化自血管瘤集落形成细胞的红细胞表达胎儿血红蛋白。使用表达胎儿血红蛋白的红细胞进行输血在治疗镰状细胞性贫血中特别有用。因此,本发明提供治疗镰状细胞性贫血的改进方法。
在一个实施方案中,在选定待适于患者的特定血管瘤集落形成细胞制剂后,然后对其进行扩增达到适于患者治疗的合适的量并在将细胞施用于受者前分化得到分化的造血细胞。进行制药的方法还可以包括建立用于分布代售制剂的分配系统,或可包括建立用于销售所述药物制剂的销售团体。
在上述任何一种情况中,血管瘤集落形成细胞可直接分化或可被冷冻备用。在某些实施方案中,本发明提供血管瘤集落形成细胞的冷冻培养物,其适于随后的解冻和扩增,也适于分化成造血细胞或内皮细胞谱系。
人血管瘤集落形成细胞可被用于产生实质量的可用于输血的造血细胞类型。例如,可由人血管瘤集落形成细胞产生实质量的相同或不同种群的RBC和/或血小板。血管瘤集落形成细胞和由其分化成的造血细胞类型可以被建库,正如目前用捐赠的血液制品建库,并用于输血和其它治疗。将这些产品建成库将有助于缓解关键性的捐赠血液制品短缺。此外,可以对血管瘤集落形成细胞和衍生产品进行体外遗传操作以提供通用的捐赠血液制品。
因此,在本发明的某些方面提供建立血库的方法。所述建立血库涉及血管瘤集落形成细胞和/或由其产生的造血细胞类型(如RBC,血小板,淋巴细胞等)的衍生和存储(长期或短期)。细胞可被冷藏实现长期保存,或在培养基中保存相对短的时间。细胞能通过与目前可得的血液制品分型方法一样的方法分型和交叉匹配,且细胞可根据类型被贮存。此外在某些实施方案中,细胞可被修饰并特异性产生A阴性和/或B阴性和/或Rh阴性细胞以产生对于给任何患者输血来说通用或几乎通用的细胞。
值得注意的是,血管瘤集落形成细胞和/或分化的造血细胞类型可通过本发明说明书通篇中详述的任何方法产生。
在建立血库的方法的某些实施方案中,所述细胞(血管瘤集落形成细胞和/或分化的造血细胞类型)在一个或更多中心机构中产生和贮存。细胞随后可被转移到,例如,医院或治疗机构用于治疗患者。在某些其它实施方案中,细胞被保存在冷冻状态并特异性的解冻,依据医院或其它医疗机构的指令制备以用于输血。这种指令可能是常规指令(如产生并提供特定量的特定单元数量的细胞)。
在某些实施方案中,所述方法包括对医院或保险公司关于血库中产品的费用进行记帐的系统。
在上述任何一种情况的某些实施方案中,细胞的分配可根据数量、体积或任何用户可用于量化施用于患者的剂量和/或可用于将这种剂量与在标准输血中施用的剂量相比的任何单元。
在某些实施方案中,细胞以混合细胞群的形式产生、贮存和施用。例如,所述制剂可包括不同发育阶段的细胞,以及不同的细胞类型。在其它实施方案中,细胞被作为单一细胞类型的基本纯化的制剂产生、贮存和/或施用。
在某些实施方案中,对所述细胞的制剂进行防止一种或多种传染性疾病的筛选。筛选可发生在产生或贮存之前或之后。例如,可以筛选细胞制剂来鉴定肝炎、HIV或其它可以通过这些产品传递给受者的血源性传染病。
诱导移植物受者的耐受
可将通过本发明的方法产生和扩增的或根据本发明的方法扩增的人成血管细胞用于诱导免疫耐受。免疫耐受是指抑制移植受者的免疫应答,其另外也可以由如向受者引入非自身的MHC抗原(如移植物和耐受性成血管细胞共有的抗原)而引发。因此,耐受是指抑制由特异性供者抗原引发的免疫应答,以区别于使用免疫抑制剂可以引发的广谱免疫抑制。耐受可包括体液的、细胞的或体液和细胞同时的反应。耐受可包括消除和/或灭活预先存在的成熟供者反应性T细胞以及长期(如终生)消除和/或灭活新发育成的供者反应性T细胞。
本发明描述的产生和扩增人成血管细胞的方法提供了诱导耐受的许多优势。本发明的方法可导致大量先前难以得到数量的人成血管细胞的产生。大量人成血管细胞使得通过具有较低毒性的预处理方案即可在移植受者内诱导耐受。进一步的,本发明的方法提供人成血管细胞库的产生,每个都是至少一个人群中的MHC等位基因是半合子的或纯合的,其中所述库里的每个成员相对于其它成员对于不同的一套MHC等位基因来说是半合子的或纯合的。这样的人成血管细胞库可用于筛选具有耐受能力的人成血管细胞以使细胞能被筛选以与任何可得到的供者移植物匹配。
在先前已显示骨髓移植和随后的造血或混合嵌合现象的建立诱导鼠和人模型中对源于造血干细胞的新组织类型的特异性耐受。造血或混合嵌合现象是指在受者内产生来源于供者或受者干细胞的造血细胞。因此,如果一个受者出现了造血嵌合现象,则所述受者将耐受供者特异性抗原。在许多诱导耐受的方案中,施用于受者的耐受供者细胞被植入所述受者的骨髓。为在受者骨髓内为供者细胞建立造血空间,一些方案需要建立造血空间的步骤(如通过全身照射),且这样的步骤是一般对受者有毒或有害的。但是,如果可以得到非常大量供者耐受细胞,来自啮齿动物模型的证据显示可以完全消除辐射,从而实现造血或混合嵌合现象,其好处是具有更少的毒性预处理措施。因此,例如可以使用特异性非清髓性的受者的调节来实现混合嵌合现象。
相应的,由于本文描述的新方法使大量产生人成血管细胞成为可能,本发明提供了使用较不严格的或毒性较低的预处理方案诱导免疫耐受的好处。例如,如果使用足够量的耐受供者细胞,则可除去建立造血空间的步骤。
相应的,在本发明的某些实施方案中,通过本文描述的方法产生和扩增或扩增的人成血管细胞可用于诱导免疫耐受。虽然不希望受任何机理方面的限制,所述人成血管细胞可通过寻靶至受者骨髓并植入受者骨髓以产生混合嵌合现象来诱导免疫耐受。
在某些实施方案中,供者人成血管细胞在将移植物植入或将来自供者的器官、组织或细胞移植入受者患者前被施用于患者受者(如通过静脉注射)。在某些实施方案中,施用人成血管细胞以诱导有需要的患者(如移植物或移植受者)的耐受。相应的,在某些实施方案中,诱导人受者患者的耐受的方法包括步骤:(a)选择需要移植或细胞治疗的患者;(b)将来源于供者或与供者相匹配的人成血管细胞施用于所述患者,其中所述成血管细胞根据本发明的方法产生和扩增或扩增;和(c)将供者器官、组织或细胞移植物移植入受者患者,其中所述成血管细胞诱导对供者抗原的耐受。在某些实施方案中,所述患者将接受器官、组织或细胞治疗,其中所述器官、组织或细胞得自供者或供者细胞源。例如,来自供者的成血管细胞能被(1)根据本文描述的方法扩增以产生大量供者耐受细胞,和(2)体外扩增和分化以获得随后可被植入受者患者的造血或内皮细胞或组织。在其它实施方案中,所述器官、组织或细胞治疗不是源自供者成血管细胞而是和供者成血管细胞匹配。
本文使用的术语“匹配”意指HLA分型在供者和受者(如移植物)之间的相似程度。在一个实施方案中,关于供者成血管细胞和移植物的术语“匹配”意指I类MHC和/或II类MHC等位基因匹配以不发生排斥现象的程度。在另一个实施方案中,关于供者成血管细胞和移植物的术语“匹配”意指I类MHC和/或II类MHC等位基因匹配以使供者移植物被其匹配的供者成血管细胞所耐受的程度。在另一个实施方案中,关于供者成血管细胞和移植物的术语“匹配”意指I类MHC和/或II类MHC等位基因匹配以致不需要免疫抑制的程度。
本文描述的诱导对同种异体抗原或同种异体移植物耐受的方法可被用在MHC位点或其它位点有一定程度的错配以致引起移植物排斥结果的供者和受者之间。相应的,例如,在某些实施方案中,至少一个MHC位点或至少一个介导识别和排斥的其它位点可以是错配的,如次要抗原位点。例如在某些实施方案中,受者和供者的HLA等位基因不匹配并导致产生一个或更多的错配抗原。对于I类和II类MHC位点,供者和受者可以是,例如:对I类匹配而对II类不匹配;对I类不匹配而对II类匹配;对I类不匹配并对II类不匹配;对I类匹配并对II类匹配。在任何这些组合中,其它控制识别和排斥的位点,如次要抗原位点,可以是匹配的或不匹配的。在I类MHC不匹配意味着一个或更多I类MHC位点不匹配,如HLA-A,HLA-B或HLA-C中的一个或更多不匹配。II类MHC不匹配意味着一个或更多II类MHC位点不匹配,如DPA、DPB、DQA、DQB、DRA或DRB中的一个或更多不匹配。例如,成血管细胞和移植物可在II类HLA-DRB1和DQB1等位基因上匹配。所述成血管细胞和移植物可还在I类HLA-A,B或C等位基因中的两个或更多上(在DRB1和DQB1等位基因已经匹配的基础上)匹配。
在其它实施方案中,所述耐受供者细胞是源自通过本文描述的方法产生和扩增的或扩增的成血管细胞。根据所述实施方案,供者人成血管细胞体外分化形成供者造血干细胞,供者造血干细胞随后被施用于受者患者以诱导耐受。在上述任何方法中,供者成血管细胞或源自其并施用于受者的造血干细胞通过在所述受者体内诱导耐受为受者患者准备了匹配的移植或移植物。
在其它实施方案中,诱导耐受的方法还包括建立造血空间(促进成血管细胞或源自其的造血干细胞的植入)的步骤。在另一个实施方案中,所述诱导耐受的方法还包括暂时抑制供者成血管细胞或源自其的造血干细胞的排斥的步骤,其通过例如消除和/或灭活先前存在的供者反应性T细胞实现。为建立造血空间,所述方法可包括照射(如全身的,淋巴的或选择性胸腺照射)。为阻止供者细胞的排斥,所述方法可还包括药物或抗体(如细胞增殖抑制剂、抗代谢物、抗T细胞或抗CD8或抗CD4抗体)的施用,和/或其它促进供者细胞生存和植入和促进混合嵌合现象的治疗(例如,向所述受试者施用间质细胞或生长因子、细胞因子等,或其他消除或灭活受者天然抗体的制剂)。在某些实施方案中,照射、抗体、药物、和/或其它经施用以建立造血空间和/或在受者体内促进供者细胞生存的制剂足够灭活受者体内的胸腺细胞和/或T细胞。例如,在将供者成血管细胞引入所述受者前,可以实施这样的建立造血空间和/或暂时抑制供者细胞排斥的步骤。另外,所述患者在接受供者耐受细胞的同时,也可接受阻断、消除或灭活T细胞的制剂。
在某些实施方案中,可以联合使用造血空间建立方法和免疫抑制方法。例如,受者可接受抗T细胞抗体并伴随低剂量全身照射和/或胸腺照射。在一个实施方案中,所述受者可接受抗CD4和抗CD8抗体,随后进行温和的非清髓性剂量的全身照射(如可消除一部分受者骨髓而不导致骨髓不可恢复的剂量)和选择性胸腺照射,或可替换的,额外剂量的T细胞灭活抗体或共刺激阻断剂(如CTLA4-Ig和/或抗CD40L抗体)。照射后,可将供者成血管细胞或源自其的造血干细胞施用于受者(如通过静脉注射)。在这个实施方案中,促进供者细胞植入的全身照射可被施用大量供者人成血管细胞或源自其的造血干细胞取代。获得如此大量的供者人细胞可通过本文描述的方法完成。
在另一个实施方案中,消除或灭活受者T细胞的处理方法有助于阻止移植物移入的抑制或促进所施用的供者耐受人成血管细胞的存活。在另一个实施方案中,所述方法包括受者患者内供者反应性T细胞克隆排除。例如,患者可接受温和剂量的全身照射,随后施用供者人成血管细胞和T细胞共刺激阻断剂。另外,患者也可接受T细胞共刺激阻断剂和施用大量供者人成血管细胞而不接受照射。
在另一个实施方案中,耐受的完成不需要对受者进行清髓处理。在一个实施方案中,受者接受供者人成血管细胞及抗CD40L以便于供者成血管细胞的植入。例如,受者接受大量供者成血管细胞及抗CD40L单克隆抗体,随后的几天中施加一定剂量的CTLA4-Ig。这样的方法消除了供者反应性T细胞并阻断CD40-CD40L相互作用。本文描述的体外产生和扩增人成血管细胞新方法使产生如此温和耐受的方案具有可行性。
受者调节和/或供者反应性T细胞的消除或阻断之后,通过本发明的方法产生的供者耐受人成血管细胞被施用于受者。供者人成血管细胞源自由供者组织或细胞源得到的成血管细胞。另外,供者人成血管细胞也得自不同的非供者的并与供者匹配的来源。
在某些实施方案中,通过多重给药的方式(如2、3、4或更多重供者细胞给药)施用供者人成血管细胞可诱导受者患者的耐受。相应的,可通过包含多重施用供者耐受细胞的方式诱导耐受,其中对受者进行多重给药在1周或更短的时间范围内进行。
在某些实施方案中,本发明的人成血管细胞诱导免疫耐受的能力可通过不同试验模型系统进行评价。例如,在SCID鼠中建立人免疫系统的能力被用于在实验模型中研究人免疫应答。以前的研究已显示,人胎肝和胸腺组织可用于在没有免疫活性的鼠受者内重建功能性人免疫系统。类似的,本发明的人成血管细胞的功能性可使用类似的实验模型系统进行评价。例如,可通过上述实验模型评价人成血管细胞在鼠中建立功能性人免疫系统的方面取代人胎肝的能力。并且,在具有人免疫系统的小鼠中(如人胎肝和胸腺组织用于在SCID鼠体内建立人免疫系统以产生人-SCID鼠),根据上述任何方法,将人“供者”成血管细胞(与用于建立人-SCID鼠的胎肝和胸腺组织不匹配)施用于人-SCID鼠,以实现混合嵌合现象。对供者抗原的耐受在随后根据与供者成血管细胞匹配的同种异体移植物向这些动物的植入进行检测。
在某些实施方案中,本发明涉及细胞组合物。有效的细胞组合物包括2种成分:第一种细胞类型用于诱导免疫耐受,第二种细胞类型用于再生需要的功能。两种细胞类型都通过本发明的方法产生并得自相同的供者。例如,来自供者的人成血管细胞可被用作耐受供者细胞。来自供者的细胞(如胚胎干细胞、多能干细胞或早期祖细胞或成血管细胞)也可用于产生,例如造血细胞或内皮细胞(如本文所述)、诸如少突胶质细胞的神经细胞、干细胞、心肌细胞或心肌细胞前体或成骨细胞及其祖细胞。相应的,供者人成血管细胞可用于在受者体内诱导耐受以使受者对来自所述供者成血管细胞或来自所述供者胚胎或多能干细胞的细胞或组织具有耐受。
在另一个实施方案中,本发明细胞组合的两种细胞成分得自不同来源或供者,其中所述两种来源或供者是匹配的。例如,成血管细胞产生于胚胎干细胞来源,而移植物细胞或组织可得自不同于产生所述人成血管细胞的胚胎干细胞来源的来源。在这些实施方案中,两种来源是匹配的。
对于任何本文描述的治疗目的,用作免疫耐受的人成血管细胞或源自其的造血细胞以药物组合物的形式提供,包括在充分无菌环境下制备的等渗赋形剂以用于向人类给药。
基因治疗中的成血管细胞
本发明的其它方面涉及成血管细胞、或源自其的造血细胞或内皮细胞或由这些细胞依次分化得到的细胞在基因治疗中的用途。本发明的哺乳动物成血管细胞制剂可用于将治疗性基因递送至患者,所述患者的病况适合使用治疗性基因的基因产品进行治疗。成血管细胞在递送治疗性基因方面是非常有用的,其中治疗性基因参与或影响血管发生(如在局部缺血的组织中诱导络脉形成的VEGF),血细胞生成(如诱导红细胞产生的促红细胞生成素),血管功能(如诱导血管平滑肌扩增以修复动脉瘤的生长因子)或血细胞功能(如减少出血的凝血因子)或编码如生长激素的分泌性蛋白。基因治疗的方法是本领域已知的。参见实例,Anderson等的美国专利No.5,399,346。Baetge等的PCT公开文献WO 95/05452描述了用于递送遗传物质的生物相容的胶囊。基因转移至骨髓来源的细胞的方法也曾经被报道过(参见Gordon等的美国专利No.6,410,015)。治疗性基因可以是任何具有临床用途的基因,如编码涉及疾病预防和治疗的基因产物或蛋白的基因,或在疾病预防和治疗中具有细胞调节作用的基因。基因产物可代替患者缺陷或缺失的基因产物,蛋白,或细胞调节作用,因而能够预防或治疗患者的疾病和病况。
相应的,本发明还提供向适用于基因治疗的患者递送治疗性基因的方法,包括,选择有需要的患者,修饰成血管细胞制剂以使细胞携带治疗性基因,将修饰后的制剂施用于患者。可用本领域熟知的技术修饰所述制剂。修饰可涉及在哺乳动物成血管细胞内插入编码基因产物的DNA或RNA片段,其中所述基因增强成血管细胞的治疗效果。所述基因以这样一种方式插入,以使修饰的成血管细胞产生治疗性基因产物或在患者体内具有期望的治疗效果。在一个实施方案中,所述成血管细胞由最初来自患者的细胞制备,例如来自骨髓。所述基因可通过任何基因转移操作插入成血管细胞,例如,裸DNA整合、DNA直接注射、受体介导DNA摄取、逆转录病毒介导转染、病毒介导转染、非病毒转染、脂质体介导的转染、电转移、电穿孔、磷酸钙介导转染、显微注射或脂蛋白体,上述这些都涉及使用基因治疗载体。除逆转录载体外还可以使用其它载体,包括源自DNA病毒和其它RNA病毒的载体。显而易见的,当使用RNA病毒时,所述病毒包括编码期望制剂的RNA,以便使被所述RNA病毒转染的成血管细胞能提供编码治疗性基因产物的DNA。将基因导入细胞的方法是本领域熟知的(参见例如Ausubel,id.)。
本发明的另一方面,提供容器中或商业包装的人成血管细胞的纯化制剂,其中所述细胞被修饰而携带治疗性基因,所述容器或商业包装还包括用于说明所述制剂在基因治疗中通过递送治疗性基因而预防和/或治疗疾病的说明书。相应的,本发明还提供商业包装(如试剂盒),其包含本发明的哺乳动物成血管细胞制剂,所述制剂被修饰以使所述制剂的细胞携带治疗性基因,也包含其治疗患适于基因治疗的疾病的患者的说明书。
其它商业应用和方法
本发明的某些方面涉及将人成血管细胞扩增至商业数量。在特定实施方案中,人成血管细胞被大规模生产,根据需要储存,并供给医院或临床医师或其它医疗机构。如果患者表现出下述适应症,例如,局部缺血或血管损伤,或需要造血重建,则可及时定购并提供人成血管细胞。相应的,本发明涉及产生和扩增人成血管细胞以使细胞达到商业规模的方法,包含用所述方法产生的人成血管细胞的细胞制剂,以及向医院和临床医师提供(如生产、任选贮存、销售)人成血管细胞的方法。而且,成血管细胞谱系细胞可在体外产生,可任选贮藏以及售往医院或临床医师。
本发明相应的某些方面涉及生产、贮存和分配通过本文公开的方法扩增的成血管细胞的方法。在体外产生和扩增人成血管细胞后,可收获人成血管细胞,纯化以及任选在治疗患者前贮存。另外,在需要成血管细胞谱系细胞的情况下,人成血管细胞在治疗患者前也可在体外进一步分化。因此在某些实施方案中,本发明提供向医院,医疗中心和临床医师供应成血管细胞的方法,其中用本文公开的方法产生的成血管细胞或成血管细胞谱系细胞被贮存并根据医院、医疗中心或临床医师根据需要定购,并施用于需要成血管细胞或成血管细胞谱系细胞治疗的患者。在替代性实施方案中,医院、医疗中心或临床医师根据患者的特定数据定购人成血管细胞,人成血管细胞根据患者的具体情况生产并随后提供给下定单的医院或临床医师。
本发明进一步的方面涉及成血管细胞和/或成血管细胞谱系细胞库,其能为可能的患病受者提供匹配的细胞。相应的,在一个实施方案中,本发明提供进行制药的方法,包括提供至少一种组织相容性抗原纯合的成血管细胞制剂的步骤,其中细胞选自包含由可通过本文公开的方法扩增的人成血管细胞组成的库,其中每种成血管细胞制剂对至少一个存在于人类种群的MHC等位基因是半合子的或纯合的,并且其中所述成血管细胞库包含每个都对相对于细胞库中其它成员不同的一组MHC等位基因是半合子的或纯合的细胞。如上所述,基因打靶或杂合子丢失可用于产生MHC等位基因半合子的或纯合的用于产生成血管细胞的干细胞。在一个实施方案中,在选择了适合患者的特定成血管细胞制剂后,其被扩增至适合于治疗患者的量。所述方法进一步包括使成血管细胞分化以在对受者施用细胞之前得到造血和/或内皮细胞。进行制药的方法也包括建立分配系统以分配待售制剂或包括建立销售药物制剂的销售团队。
本发明的其它方面涉及将本发明的人成血管细胞用作单位的研究工具,所述单位诸如医药、化学或生物公司,医院,学术机构或研究所。例如,人成血管细胞和成血管细胞衍生细胞(如内皮细胞)可用于筛选和评价血管原性的和抗血管原性的因子,或可用于组织工程。此外,由于通过本文公开的方法获得和扩增的成血管细胞具有分化成造血细胞和内皮细胞的双重潜能,其可用于造血作用和血管发生的细胞和分子生物学研究。并且,所述人成血管细胞可用于发现这些在造血作用和血管发生中发挥作用的细胞新靶标、基因、生长因子和分化因子,或用于寻药和发展对可能的毒性剂或保护剂进行筛选检测的技术。
在本发明的其它实施方案中,成血管细胞谱系细胞(如血细胞)也用于商业。造血细胞可用于产生血液制品,如可临床和研究应用的血红蛋白和生长因子,
本发明也包括从患者身上获得人ES细胞和随后产生和扩增来源于ES细胞人成血管细胞的方法。这些成血管细胞可以贮存。此外,这些成血管细胞可用于治疗所述ES细胞所来源的患者或所述患者的亲属。
由于上述方法和应用涉及成血管细胞的治疗、药物制剂和贮存,本发明也涉及适于这样应用的成血管细胞溶液。本发明相应的涉及适于注射给患者的成血管细胞溶液。所述溶液包含在生理可接受的溶液(如生理盐水、缓冲盐水或平衡盐溶液)中制成的细胞。溶液任选包含有助细胞体内分化的因子。依照骨髓移植运用的技术条件允许的方法,溶液可通过血管给药(如静脉输注)施用于患者。在一些实施方案中,将所述细胞溶液施用于外周静脉,表面外周静脉,或替代性地,通过中心静脉给药(如中心静脉导管)。溶液中细胞的数量是至少约102且少于约109。在其它实施方案中,溶液中细胞数量范围是大约101,102,5×102,103,5×103,104,105,106,107,108到大约5×102,103,5×103,104,105,106,107,108,或109,其中上限和下限独立选择,并且下限始终小于上限。此外,所述细胞可以用单独给药或多重给药的方式施用。
现参考以下的实施例对本发明做更加完整的描述,这些实施例只是说明性的,不被看作是对上述发明的限制。
实施例1:来源于人ES细胞的成血管细胞显示造血细胞和内皮细胞潜能
人胚胎干细胞系H1和H9培养于加入了鼠胚胎成纤维细胞(MEF)的ES细胞培养基中。培养的人ES细胞被分离,通过200g离心沉淀,并再悬浮于胚状体(EB)形成培养基中。EB形成培养基包含补充有BMP-4和VEGF的无血清Stemline培养基将细胞随后平板接种于超浅层附着培养皿中并在二氧化碳培养箱中培养。经过24-48小时,加入早期造血细胞因子(TPO,Flt-3配体,和SCF)并继续培养细胞24-48小时以形成EB。
将胚状体(EB)培养2-6天或任选2-5天并随后收集,用PBS洗涤并用胰蛋白酶/EDTA将其解聚成单细胞悬液。确定EB的数量并以大约5-10×106细胞/mL的量培养于无血清甲基纤维素培养基中,为成血管细胞的生长对所述培养基进行了优化,其包含BL-CFU培养基(Stem Cell TechnologyTM)并补充有细胞因子和PTD-HOXB4融合蛋白。将细胞随后平板接种于新的超浅层附着培养皿上以生长成血管细胞集落。
每日监控EB的成血管细胞集落形成情况。大约3天时,观察到成血管细胞集落形成。成血管细胞的特征是非常与众不同的葡萄状细胞形态。
一些细胞能再次形成EB(次级EB)。所述次级Eb不具有葡萄状形态,如图16b所示。成血管细胞也比次级EB小。
这些成血管细胞集落随后经筛选、挑选并重平板接种于甲基纤维素CFU-培养基以测试其进一步分化和形成造血细胞集落形成单位(CFU)的能力。类似的,这些成血管细胞集落经筛选,挑选和重平板接种于为向内皮细胞分化第一步进行了优化的包被有纤维连接蛋白的培养皿上。
为测试是否可由这些筛选出的成血管细胞集落产生造血祖细胞,在接下来的3-10天的培养中测量粒细胞、红细胞、巨噬细胞和巨核细胞的集落形成单位(CFU)的生长情况。
为检验由这些分离的成血管细胞集落产生内皮细胞的情况,检测了当把成血管细胞重平板接种于厚层基质胶时其形成分支管-索的能力。
分离的成血管细胞集落分化成内皮细胞的能力也可以使用其它内皮细胞特异性测定法加以确定,例如LDL吸收或内皮细胞表面标记物的存在与否。
实施例2:hESC衍生的BC细胞或成血管细胞的附加特征
人ES细胞培养。本研究使用的hES细胞系先前被描述为H1,H7和H9(NIH-注册为WA0l,WA07和WA09)细胞系和四个来自Advanced Cell Technology的细胞系(MA01,MA03,MA40和MA09)。未分化的人ES细胞培养于完全hES培养基的灭活(丝裂霉素C处理的)鼠胚胎成纤维细胞(MEF)上,并直至达到80%汇合。(Klimanskaya&McMahon,-Approaches of derivation and maintenance of human ES cells:*Detailed procedures and alternatives,in Handbook of Stem Cells.Volume 1:Embryonic Stem Cells,ed.Lanza,R.等.Elsevier/Academic Press,San Diego,2004)。然后用0.05%胰蛋白酶-0.53mM EDTA(InvitrogenTM)对未分化hES细胞解离2-5分钟,并通过1,000rpm离心5分钟收集细胞。
EB的形成。为诱导成血管细胞前体(中胚层)的形成,hES细胞(2-5×105细胞/ml)被平板接种于超浅层附着培养皿(CorningTM)中加入了BMP-4和VEGF165(50ng/ml,R&D SystemsTM)的无血清Stemline培养基中(如Stemline I或II,SigmaTM),并在5%CO2中培养。大约48h后,补充EB培养基并加入早期造血/内皮细胞生长因子。例如,48h后移去半数培养基并加入新鲜培养基并保持同样的BMP-4和VEGF以及SCF,TPO和FLT3配体(20ng/ml,R&D Systems)的终浓度。在48-72h间向培养基加入三重蛋白转导域(tPTD)-HoxB4融合蛋白(1.5μg/ml)以扩增成血管细胞及其前体。
成血管细胞或胚细胞扩增。经过3.5-5天,收集EB并用0.05%胰蛋白酶-0.53mM EDTA(InvitrogenTM)解离2-5分钟,过3-5次22G针并过一次40μM滤网从而制备单细胞悬液。1,000rpm离心5分钟收集细胞并计数。将细胞沉淀再悬浮于50-200μl无血清Stemline培养基中。为扩增成血管细胞,来自由2-5×105hES细胞分化而来的EB的单细胞悬液与2ml BL-CFC/成血管细胞扩增培养基(BGM)混合,所述培养基包括含1.0%甲基纤维素的Iscove's MDM,1-2%牛血清白蛋白,0.1mM 2-巯基乙醇并加入生长因子。例如,加入10μg/ml rh-胰岛素,200μg/ml饱和铁人转铁蛋白,20ng/ml rh-GM-CSF,20ng/ml rh-IL-3,20ng/ml rh-IL-6,20ng/ml rh-G-CSF,3-6单位/ml rh-EPO,50ng/ml rh-SCF,50ng/ml rh-FLt3配体,50ng/ml rh-VEGF和50ng/ml rh-BMP-4)(“rh”代表“重组的人的”)和1.5μg/ml的tPTD-HoxB4融合蛋白,加入或不加入50ng/ml的TPO和FL。细胞混合物被平板接种于超浅层附着培养皿(如6孔平板的每个孔中2-5×105细胞/2ml)上,并于37℃在5% CO2中培养4-7天。4-6天后,在显微镜下可见葡萄状成血管细胞胚细胞集落(称之为BL-CFC或BC),如图16a所示。
大约0.35+0.01%和0.52+0.06%来自WA01hES细胞和MA01hES细胞的个体细胞分别分化成葡萄状胚细胞集落(BC)。在最初3天,BC含<10个细胞,从4-6天开始迅速扩增到>100个细胞(图16a)。集落普遍不够紧密且与次级EB相比形态更均一(图16b)。hES源胚细胞集落的细胞离心涂片制备和Wright-Giemsa染色证实了未成熟胚细胞的形态特征(图16c)。为将这些结果扩展到其它hES细胞系(WA07[H7],WA09[H9],MA0l,MA03,MA09,和MA40),需要加入FL(50ng/ml)和Tpo(50ng/ml)以使BC集落的持续生长(不加入FL和Tpo,获得了小(10-20个细胞)hES-BC,其在4-8天后死亡)。在不同hESC细胞系中观察到的偏差可能是由于如先前Bowles等人观察到的这些细胞系内在性质的差别(2006Stem Cells 24:1359-1369)。Epo(3-6个单位/ml的人重组Epo)对于在所有测试的hES细胞系中BC的形成和生长是必需的。
检测了EB中人BL-CFC形成的时间过程(2-6天),并发现人ESC来源的EB产生最大数量的BL-CFC(或hES-BC)的时间很短。第2天,EB以低频产生hES-BC(57.3±7.4BC/1×105用于产生WA0l hES细胞的EB细胞,平均值±SE,n=3;395±10.4BC/l×105用于产生MA0l hES细胞的EB细胞,n=3),到第6天,只产生了造血(红细胞)祖细胞。但是,第3.5天,在所有被检测的hESC细胞系中,EB产生了大量成血管细胞或hES-BC(347.4±11.1BC/l×105用于产生WA0l hES细胞的EB细胞,n=3;523.3±60.1BC/l×105用于产生MA0l hES细胞的EB细胞,n=3),包括来自胚泡(WA0l和WA09)和单个卵裂球(MA0l和MA09)的hESC细胞系。虽然效率决定于hESC细胞系和生长条件(见表1),一个6-孔平板的WA01-GFP和MA01hES细胞(12-13×106个细胞)分别产生大约22.18±3.51×106(扩增6-8天,平均±SE,n=17)和49.73±7.23×106(扩增6-8天,n=9)和396.4±91.63×106(扩增10-13天,n=6)成血管细胞或hES-BC细胞。相应的,细胞可在上述清楚限定的可再现的条件下容易的扩增。
表1
来源于不同hES细胞系的hES-BC细胞的效力
*BGM培养基中培养6-8天后收集并纯化hES-BC细胞,随后用血细胞计数器统计细胞数量。根据标准6-孔平板中2×106细胞/孔的hES细胞计算效力。#将BC扩增10-13天
成血管细胞的冷藏
成血管细胞(或胚细胞或hES-BC细胞)可用无血清培养基冷藏。对于成血管细胞的冷藏,纯化的细胞被分成2个相同部分:其中一半直接平板接种而用于进行造血细胞CFU测定和内皮细胞发育,另一半再悬浮于含8%DMSO的Stemline培养基中并在液氮中保存。随后解冻细胞并检测其造血和内皮细胞发育潜能。解冻后,将所述成血管细胞如本文所述平板接种以产生造血和内皮细胞系并与新鲜的纯化细胞进行对比。对于内皮细胞谱系,经冷冻后恢复78±2%(平均值+SE,n=3)的细胞,而与新鲜hES-BC细胞相比,61+7%(n=3)的总造血细胞CFU和46±4%(n=3)的CFU-红细胞得到保持。当将hES-BC细胞从液氮保存中复苏后,没有观察到用于CFU-混合的更原始的多潜能祖细胞的损失。
成血管细胞的鉴定。为进行BL-CFC免疫细胞化学分析,纯化的BL-CFC在多聚赖氨酸处理过的载玻片上离心涂片,并用4%的多聚甲醛固定。为检测大部分基因的表达,于4℃温育第一抗体过夜,随后温育荧光染料标记的第二抗体,最后在荧光显微镜下镜检。用正常人BM细胞,K562细胞和HUVEC作为对照。
免疫细胞化学分析揭示了hES细胞来源的BL-CFC或BC表达几个成血管细胞相关蛋白但不表达CD31,CD34和KDR或其它粘附分子。hES-BC表达GATA-1(图16d和16e)和GATA-2蛋白。GATA-1是锌指转录因子,其对于原始(胚胎的)和成熟(成人的)的红细胞生成都是必需的,且其在鼠成血管细胞中表达(Ferreira等.2005MoI Cell Biol 25:1215-1227和Yokomizo等.2007EMBO J 26:184-196)。GATA-2是作用于成血管细胞发育和分化多个步骤的锌指转录因子(Lugus等.2007Development 134:393-405)。hES细胞衍生的BL-CFC或BC也表达LMO2(对成血管细胞发育至关重要的LIM结构域蛋白(Gering等.2003Development 130:6187-6199)(图16g和16h))和CXCR-4(Fig.16n和16o)。CXCR-4是趋化因子SDF-1的受体,其表达于衍生自hESC、造血干细胞和鼠成血管细胞的内皮细胞表面。CXCR-4在骨髓中造血祖细胞的迁移、保留和发育中都有重要作用。所述细胞还表达TPO和EPO受体(图16t和16u,和16q和16r,和表1),且易与CD71(转铁蛋白受体)的特异性抗体反应(图16j和16k)(见表2和图16d-v)。所述细胞表达很少或不表达CD31、CD34和KDR或其它粘附分子(表2)。CD34,CD31和KDR表达的缺失和CD133表达的缺失是表面标记物表达的独有特征。
对于基因表达谱分析,使用RNAeasy试剂盒(Qiagen)从纯化的BL-CFC/hES-BC细胞、3.5天的EB和未分化的ES细胞中分离总RNA。将片段化的反义cRNA用于与人U133.2阵列(Inc)在Massachusetts大学的Core Genomic Facility(Worcester,MA)中杂交。为进行β-簇珠蛋白基因的表达谱分析,挑选单个CFU集落,分离并扩增RNA,并如上所述(Lu等.2004Blood(103):4134-4141)分析β-,γ-和ε-珠蛋白基因的表达。
通过AffymetrixTM阵列进行的分子表达谱分析揭示了与早期EB相比,与成血管细胞和早期前成红细胞发育相关的基因有大量增加(表2)。SCL和LMO2,两个对成血管细胞发育的关键性基因(D'Souza等,2005Blood(105):
3862-3870;Park等.2004Development(131):2749-2762;Gering等.2003Development(130):6187-6199)以及FLT-1(VEGF受体)容易在BL-CFC/胚细胞集落中被检测到。BL-CFC/hES-BC中的胚胎珠蛋白(ε-珠蛋白,549倍)和胎珠蛋白(γ-珠蛋白,817倍)基因表达显著增加;NF-E2(12倍),GATA-1(6倍),EKLF(7倍),ICAM-4(4倍),血型糖蛋白(14倍)和Epo受体(4倍)的信使表达水平也有适当增加。
表2
利用Affymetrix阵列和免疫细胞化学方法鉴定BL-CFC(hES-BC)
免疫细胞化学:+,中到强着色;-,未着色;±,极弱着色。Affymetrix阵列:+,表达水平高于背景;-,表达水平低于背景;+↑,在BL-CFC中的表达水平高于在EB中的表达水平;+↓,在BL-CFC中的表达水平低于在EB中的表达水平。
成血管细胞的功能鉴定。解剖显微镜下人工挑选和分离葡萄状成血管细胞集落并再悬浮于无血清Stemline(Stemline I)培养基中。随后通过下述方法测试细胞的谱系分化潜能。
hES胚细胞集落形成能力。为确定hES胚细胞是否是克隆的并来自共同的双潜能祖细胞,根据已有的在小鼠研究中使用的方法进行细胞混合试验(Choi等.1998Development(125):725-732;Kennedy等.1997Nature(386):488-493)。混合来自WA0l-GFP和MA0l hES细胞的EB的细胞,并平板接种于BGM培养基上。4-6小时后用相差荧光显微镜检测hES胚细胞集落。在连续的3个试验中,100%(77/77)的胚细胞集落显示GFP阳性或GFP阴性(未观察到混合BC,图18a和18b)。
为排除GFP阴性集落包括带有失活GFP基因的细胞的可能性,检测GFP阳性和GFP阴性集落是否存在GFP序列。在相差荧光显微镜下人工挑选来自混合试验的12个单独的GFP阳性和12个单独的GFP阴性集落。通过MicroDNA试剂盒(QiagenTM)分离基因组DNA,并进行GFP特异性PCR反应。作为PCR反应的内部对照,所有PCR反应中均使用肌形成蛋白引物,产生245bp片段。用2%琼脂糖凝胶分离PCR产物并通过溴化乙锭染色观察。聚合酶链反应(PCR)证实了所有阴性集落中都不存在GFP基因序列(图18,PCR分析)。
稀释法研究进一步证实了初级和次级BC的集落生成(表3,图18c)。用来自分化的EB的不同数量的细胞(1.5×103到1.5×104)进行有限稀释研究。用150mlBGM稀释单EB-细胞悬液(100细胞/ml)后,将所述细胞平板接种于15个超浅层96孔平板,并于37℃进行BC发育培养。为证实胚细胞集落的克隆起源,平板接种后4小时在两个相关的掩蔽条件下检查平板接种物。含有2或3个细胞团块的孔不用于进一步研究。
Kennedy等人报道(1997.Nature 386:488-493),在小鼠ES细胞的研究中,人胚细胞集落(hES-BC或BC)发育也依赖于细胞密度,细胞数量少则发育较差。在15个96孔平板中发育出7个BC(图18c)。为确定BC是否包含具有次级BC产生潜能的细胞,进行了另外的有限稀释研究。
为使次级BC生长,人工挑选初级胚细胞集落并解离成单细胞。将所述单细胞随后与20mlBGM混合(分别200,300,和1000个细胞),以制成连续稀释液,并平板接种于6个超浅层96孔平板(0.1ml/孔)上。含有2或3个细胞团块的孔不用于本研究。由5个96孔板中共发育出29个与初级BC具有相同形态特征的次级BC。这些试验证实了初级和次级hES-BC的集落生成(表3)。
hES胚细胞集落的双潜能。两种策略可用于证明克隆来源的胚细胞的双潜能。第一种方法,对于单BC扩增,人工挑选单独的hES-BC集落,并转移到包被纤维连接蛋白的包含含有用于支持造血和内皮细胞系生长的生长因子的Stemline II的48孔板上。液体培养基中的生长因子包括重组人SCF(20ng/ml),Tpo(20ng/ml),FL(20ng/ml),IL-3(20ng/ml)VEGF(20ng/ml),G-CSF(20n ng/ml),BMP-4(15ng/ml),IL-6(10ng/ml),IGF-1(10ng/ml),内皮细胞生长添加剂(ECGS,100μg/ml)和Epo(3U/ml)。培养一周后,通过轻轻移液将非粘附的造血细胞移去并直接用于造血CFU分析。去除非粘附细胞后,于EGM-2内皮细胞培养基(CambrexTM)中培养粘附的群一周或更长,随后检测vWF的表达。
当单独BL-CFC被转入含支持造血和内皮细胞系生长的生长因子的液体培养基时,超过60%(15/24)的BL-CFC发育出了非粘附和粘附细胞(图18d和18e,表2);在重平板接种于加入一系列造血细胞因子的半固体培养基后,65%(16/24)的所述细胞形成造血细胞集落,包括红细胞(图18i),骨髓细胞(图18j和18k)和多谱系细胞(图18m)。超过95%(23of 24)的单独BC产生粘附的类间质细胞,其在基质胶上形成毛细血管结构(图18f),这种结构吸收Ac-LDL(图18g)并表达vWF(图18h)。
第二种方法中,挑选来自初级和次级胚细胞集落的单个BC并分为两组,一组检测造血CFU而另一组检测内皮祖细胞的形成。对于初级BC,90%以上(22/24)既产生造血细胞系又产生内皮细胞系;分别有100%和92%产生造血细胞和内皮细胞(表3)。类似的,也检测了来自有限稀释试验的7个单独BC的分化成造血细胞系和内皮细胞系的潜能。5个BC既产生造血细胞又产生内皮细胞后代(表3),显示了与来自常规实验的BC相比较低的效力(71% vs.92%),这可能是由于在非最佳条件下发育。对于29个次级BC,超过半数(15/29)既产生造血细胞系又产生内皮细胞系,而6个(21%)和3个(10%)分别只产生造血细胞或内皮细胞(表3)。虽然初级BC含有异源细胞群,包括造血细胞和内皮细胞前体,二次有限稀释实验清晰的证明了初级BC中的存在成血管细胞。
表3
来自克隆来源的胚细胞集落的造血和内皮细胞谱系发育
*单个BC被转移到包被有纤维连接蛋白的塑料孔上的含有造血和内皮细胞因子的液体培养基中。培养1周后,移去非附着和附着细胞并检测造血CFU和内皮细胞发育。
**单个BC被转移到EGM-2培养基中,将半数细胞培养于包被有纤维连接蛋白的孔中用来发育内皮细胞谱系,另一半直接平板接种用于造血CFU检测。
造血祖细胞分析。为进行造血祖细胞分析,将半数细胞与1ml添加了1.5μg/ml tPTD-HoxB4和0.5%EX-CYTE(Serologicals Proteins Inc.TM)的无血清造血细胞集落形成单位(CFU)培养基(H4436,Stem Cell TechnologiesTM)混合。细胞也可以与无血清造血集落形成细胞分析培养基混合,所述培养基含Iscove's MDM中的1.0%甲基纤维素,1-2%牛血清白蛋白,0.1mM 2-巯基乙醇,10μg/ml rh-胰岛素,200μg/ml饱和铁人转铁蛋白,20ng/ml rh-GM-CSF,20ng/ml rh-IL-3,20ng/ml rh-lL-6,20ng/ml rh-G-CSF,3个单位/ml rh-Epo,50ng/ml rh-SCF和1.5-5μg/ml PTD-HoxB4融合蛋白。将细胞混合物平板接种于未经处理的12孔细胞培养皿上,37℃培养10-14天。
开始平板接种后10-14天,显微镜下检查造血CFU。对于形态特征,挑选单个造血CFU并用PBS洗涤2次,离心涂布于载玻片上,用Wright-Giemsa染色,并在显微镜下检查细胞形态。
作为成血管细胞造血潜能的例证,从产生于Hl-GFP ES细胞的成血管细胞上观察到造血CFU,如图1所示。
图2-6中显示了观察到的其它造血CFU的形态学特征。根据图2显示的形态表征红细胞的CFU(CFU-E)。根据图3和4显示的形态表征多潜能CFU(CFU-GEMM/Mix)。根据图5显示的形态表征粒细胞的CFU(CFU-G)和巨噬细胞的CFU(CFU-M)。根据图6显示的形态表征粒细胞/巨噬细胞的CFU(CFU-GM)和巨核细胞巨噬细胞的CFU(CFU-Mk)。
作为成血管细胞造血潜能的又一例证,当将单细胞悬液平板接种于含有前述一系列细胞因子的无血清甲基纤维素培养基并培养10-14天后,也观察到了红细胞集落(图17a)、粒细胞集落(图17b),巨噬细胞集落(图17c)多谱系造血细胞集落(图17d)的形成。Wright-Giemsa染色(图17e-g),利用抗CD235a(红细胞),CD13(骨髓细胞)和CD45(白细胞)抗体的免疫染色(图17i-k)和FACS分析(图17v-y)证实了其造血谱系的同一性。大多数CFU(>50%)是具有红细胞为核心的多谱系的,并在平板接种后几天内形成。(如见图1)
红细胞集落类似于具有亮红色的原始红细胞,Wright-Giemsa染色显示所有红细胞都是有核的(图17e-g)。为进一步辨别红细胞的发育阶段,分析了CFU集落的β-簇珠蛋白基因的表达模式(Lu等.2004Blood(103):4134-4141)。所有红细胞和多谱系细胞集落主要表达胚胎ε-珠蛋白基因,未检测到β-珠蛋白基因信息(数据未显示),显示其处于原始的类卵黄囊的阶段。
为进行免疫鉴定,将离心涂布于载玻片上的CFU-E,CFU-G,和CFU-Mix细胞用抗人CD235a,CD13,和CD45抗体染色。为进行图17m-p所示FACS分析,将收集自1个孔的CFU细胞用小鼠IgG1同型对照,CD235a,CD13,和CD45进行染色并用库尔特流式细胞仪分析。Wright-Giemsa染色,免疫染色和FACS分析证实了其造血细胞谱系的同一性(图17e-p)。
为进行图17v-y中的FACS分析,利用标准程序在LSRII流式细胞仪(BD BiosciencesTM)上进行三色细胞计数分析。收集来自具有多种类型造血CFU的孔的细胞,并用通过5倍体积IMDM培养基稀释的甲基纤维素进行分离。等分单细胞悬液并用同型对照或抗原特异性抗体染色。使用的抗体制品是缀合于异硫氰酸荧光素(FITC)的CD235a,缀合于R-藻红蛋白(R-PE)的CD45和缀合于别藻蓝蛋白(APC)的CD13。等分的细胞也用缀合于FITC,PE,和APC的小鼠IgG进行染色作为同型对照(BD BioscienceTM)。样品在LSRII流式细胞仪上进行检测,并用FlowJoTM6.3.2版进行分析。
内皮祖细胞分析。为进行内皮祖细胞分析,将另一半细胞平板接种于包被有纤维连接蛋白的平板(BD BioscienceTM)上的EGM-2或EGM-2MV完全培养基(CambrexTM)中培养3-7天。利用基质胶上的管形成、LDL吸收和免疫细胞化学方法检测内皮细胞表面标记物的存在,也证实了分离的成血管细胞集落分化成内皮细胞的能力。
基质胶上的管形成。向4孔组织培养平板(0.2ml)或96孔板(0.05ml)的每个孔加入基质胶(BD BioscienceTM),并于37℃下凝固45-90分钟。凝胶化后,在含有0.5-1.5×105来源于上述培养物的细胞的EGM-2或EGM-2MV培养基中,取0.2-0.3ml(如,对于96孔板来说是0.1ml)细胞悬液平板接种于基质胶表面,并在37℃下5% CO2中培养。培养16-24hr后检测毛细管(管)样结构的形成。图7描述了来自H9(a)和ACT30(b)细胞的成血管细胞管-索形成的典型照片;在重平板接种于基于基质胶的培养基上后,所述成血管细胞产生形成毛细管-血管样结构的粘附细胞,并其也吸收Ac-LDL。图8(a)也描述了来自Hl-GFP细胞的具有内皮细胞潜能的成血管细胞管-索结构的典型照片。图17q也描述了重平板接种来自成血管细胞的粘附细胞后,在基质胶上形成的毛细管样结构。这样的细胞也能吸收AC-LDL(数据未显示)。
AC-LDL吸收。向在包被有纤维连接蛋白的孔上培养3-7天的成血管细胞中加入10μg/ml Alexa Fluor 647标记的AC-LDL(InvitrogenTM)并培养4-6hr。细胞随后用1×PBS洗涤3次并用4%多聚甲醛固定30分钟。荧光显微镜下可见AC-LDL吸收。例如,图8b展示了来自Hl-GFP细胞的成血管细胞的AC-LDL吸收。图17z和17aa也展示了与Alexa Fluor 594标记的AC-LDL一起培养显示了内皮细胞特有的加重染色方式。
免疫细胞化学。将在包被纤维连接蛋白的孔上培养3-7天的成血管细胞用1×PBS洗涤3次,并用4%多聚甲醛固定30分钟。为表达von Willebrand因子(vWF),PECAM-1(CD31),VE-钙粘蛋白,KDR和CD34,细胞经渗透处理并在4℃下分别与初级抗人vWF(DakoTM或ChemiconTM),PECAM-1和KDR(Cell Signaling TechnologiesTM),VE-钙粘蛋白(R&D SystemsTM),和CD34(Dako)抗体温育过夜,随后与相应的经若丹明或FITC(Jackson LaboratoryTM)标记的第二抗体温育30-60分钟。vWF蛋白的表达也通过与山羊抗小鼠IgG-Alexa Fluor 647第二抗体(Jackson LaboratoryTM)温育30-60分钟而检测。经过最后的洗涤,荧光显微镜下检测细胞。图9展示了来源于Hl-GFP ES细胞的成血管细胞的vWF表达。图17s也展示了成血管细胞来源的内皮细胞的vWF(箭标)表达。血管样结构中的粘附细胞是PECAM-1(CD31),KDR和VE-钙粘蛋白阳性的(图17t,17u,和17z-17cc)。
当粘附细胞或人工挑选的BL-CFC与基质胶混合并植入体内4-5周时,观察到新血管形成。基质胶填料的组织学检查证实了与人特异性细胞核和vWF抗体发生免疫反应的微血管的存在。见图10和11。
实施例3:产生和纯化代表性的HOXB4蛋白的方法
制备和纯化了代表性的HOXB4蛋白。其是TAT-HA-HOXB4融合蛋白。
通过克隆PCR片段(正义引物5'-TAC CTA CCC ATG GAC CAC TCG CCC-3'(SEQ ID NO:16)和反义引物5'-TCG TGG CTC CCG AAT TCG GGG GCA-3'(SEQ ID NO:17))产生pTAT-HA-HoxB4表达载体,所述片段将含有或不含有N末端32个氨基酸的HoxB4开放阅读框整合到pTAT-HA表达载体(获赠自Dr.SF.Dowdy,University of California San Diego,La Jolla,CA)的Ncol和EcoRl位点,所述载体含有一个N端TAT PTD。通过序列分析证实产生的pTAT-HA-HoxB4质粒并将其转化入BL21(DE3)pLysS细菌(InvitrogeneTM)。
用1mM IPTG在30℃下诱导对数生长期的细菌细胞4小时并离心收集。由于发现融合了6xHis的重组TAT-HoxB4蛋白被宿主细胞掩蔽进包含体,细胞在变性溶液(6M胍盐,20mM NaPO4,和0.5M NaCl,pH 7.8)中超声破碎,随后将融合了6xHis的TAT-HoxB4重组蛋白连接到镍树脂(ProBond resin,InvitrogenTM)上。
数次洗涤后,TAT-HoxB4融合蛋白被20mM NaPO4,pH 4.0,0.5M NaCl,8M尿素和10mM咪唑洗脱。随后在Sephadex G-25柱上用IMDM培养基对TAT-HoxB4融合蛋白进行脱盐,等分并立即在-80℃下保存。
通过SDS-PAGE凝胶电泳和考马斯蓝显色确定TAT-HoxB4融合蛋白的纯度和浓度。纯化的TAT-HA-HoxB4重组蛋白表现为≈37KD的蛋白。通过与BSA标准蛋白在同一凝胶中进行比较来估计纯化的TAT-HA-HoxB4蛋白的浓度。
基于计算机建模,Ho等人(2001Cancer Res 61:474-477)证明了修饰的PTD拥有与天然TAT PTD相比显著增强的蛋白转导能力,无论体内或体外。为产生修饰的PTD-HA-HoxB4融合蛋白,正义5'-CGA TGG GGA TCC GGC TAC GCA CGC GCA GCT GCG CGC CAG GCT CGC GCC GGT GGA TCC ACC ATG-3'(SEQ ID NO:18)和反义5'-CAT GGT GGA TCC ACC GGC GCG AGC CTG GCG CGC AGC TGC GCG TGC GTA GCC GGA TCC CCA TCG-3'(SEQ ID NO:19)寡聚核苷酸被BamHI消化并用试剂盒(QiagenTM)纯化。随后用修饰的PTD片段取代pTAT-HA-HoxB4质粒中的TAT片段,并根据限制性片段大小选择三次重复的PTD插入物并通过DNA序列分析加以确证。所述质粒被称为ptPTD-HA-HoxB4。pTAT-HA-HoxB4和ptPTD-HA-HoxB4质粒被转化入BL21(DE3)pLysS细菌(InvitrogenTM),通过在30℃加入1mM IPTG 4h诱导HoxB4融合蛋白表达。融合6xHis的重组TAT-HoxB4和tPTD-HoxB4蛋白被宿主细菌掩蔽入包含体,然后将细胞通过在变性溶液(6M胍盐,20mM NaPO4,和0.5M NaCl,pH 7.8)中超声破碎,并将融合6xHis的TAT-HoxB4和tPTD-HoxB4重组蛋白随后连接到镍树脂(ProBond resin,InvitrogenTM)上。数次洗涤之后,用20mM NaPO4,pH 4.0,0.5M NaCl,8M尿素和10mM咪唑洗提TAT-HoxB4和tPTD-HoxB4融合蛋白。随后在Sephadex G-25柱上用IMDM培养基对TAT-HoxB4和tPTD-HoxB4融合蛋白进行脱盐,等分并立即在-80℃下保存。通过SDS-PAGE凝胶电泳和考马斯蓝显色确定TAT-HoxB4和tPTD-HoxB4融合蛋白的纯度和浓度。纯化的TAT-HA-HoxB4和tPTD-HoxB4重组蛋白表现为≈38KD的蛋白。通过与BSA标准蛋白在同一凝胶中进行比较来估计纯化的TAT-HoxB4和tPTD-HoxB4蛋白的浓度。对于稳定性检测,TAT-HoxB4和tPTD-HoxB4蛋白加入超浅层24孔板中的含有5%FBS的IMDM培养基或含有活hESC的Stemline II培养基,并于37℃培养。不同时刻移去培养基等分并进行SDS-PAGE凝胶电泳,并通过考马斯蓝染色观察。
Beslu等人(2002Blood 100:22a)曾报道了HoxB4N端前31个氨基酸对于其功能不是必要的,移除N端33个氨基酸产生更稳定的蛋白。所述结果证实了全长TAT-HoxB4蛋白是不稳定的,几次解冻循环后形成≈36KD的蛋白,而除去N末端的TAT-HoxB4和tPTD-HoxB4蛋白在重复解冻和37℃培养过夜后仍保持完整性(图19C)。如图19A所示,在流经变性条件下的多重色谱柱和脱盐后,tPTD-HoxB4和TATHoxB4是相对纯的蛋白。通过与BSA蛋白标准进行对比而估计,纯化的tPTD-HoxB4蛋白在天然SDS-PAGE下表现为≈38KD的单一条带,在PBS或IMDM培养基中的最大溶解度为250-300μg/ml。TAT-HoxB4融合蛋白也可得到类似结果。
Krosl等人(2003Nat Medicine 9:1428-1432)曾观察到TAT-HoxB4蛋白在含有FBS的环境中非常不稳定,其需要每2小时再生一次以保持生物功能。本发明的结果证实了tPTD-HoxB4在含有5%FBS的培养基中是不稳定的,其半衰期不到1小时(Figure 19B);在70℃下用FBS预处理30分钟消除了大部分酶活性。为进一步检测其稳定性,将tPTD-HoxB4蛋白加入无血清Stemline培养基并在37℃与hESC一起培养。如图19C所示,可检测到绝大部分tPTD-HoxB4蛋白,甚至是在与hESC一起培养48h后。
实施例4:植入SCID小鼠的基质胶填料产生内皮细胞
成血管细胞衍生内皮细胞或来自Hl-GFP人ES细胞的纯成血管细胞(1×106cells)被纯化并再悬浮于700μl基质胶(BD BiosciencesTM)中。这些细胞被皮下注射到4周龄的SCID小鼠(Jackson LaboratoryTM)的背部。注射后5周,从动物身上移出基质胶填料并用所述填料制作冷冻切片。固定基质胶填料的横切片,并进行标准的苏木精和伊红(H&E)染色,并使用抗人特异性细胞核抗体(MAB1281,ChemiconTM)和人特异性抗vWF抗体,随后用荧光染料标记相应的第二抗体(山羊抗小鼠IgG-对MAB1281的得克萨斯红第二抗体)进行免疫细胞化学分析。图10显示了H&E染色的基质胶填料的横切片中的血管;图11显示了基质胶填料横切片上的血管来自人成血管细胞,其对人特异性核抗体呈阳性。
实施例5:眼局部缺血/再灌注的体内研究
两种方法,玻璃体内注射和过继性转移被用于直接检测hES来源的成血管细胞对体内修复过程的贡献。局部缺血/再灌注(I/R)损伤受眼内压升高诱导。所述I/R损伤模型导致视网膜内皮损伤,包括血管闭塞和无细胞毛细血管的形成。视网膜I/R损伤7天后,用收集自第6天hES-BC的经荧光标记的成血管细胞(亦称"hES-BC")通过眼球后窦进行全身性注射(n=13)或玻璃体内注射(n=4)小鼠。
注射后1日,无痛处死小鼠,移出视网膜并用缀合了若丹明的蓖麻子凝集素I进行标记。所述凝集素连接至内皮细胞特异性表达的糖蛋白,因此被用于荧光标记血管的外表面。
共聚焦显微镜能显示来源于成血管细胞(hES-BC)的内皮细胞的绿色荧光标记,所述细胞占有损伤眼部的视网膜血管系统的33.5±10%。在对照眼中未观察到绿色荧光(分别是图20a和20b),证明所述成血管细胞(hES-BC)被导归于无细胞区域,并在那里只被同化入受损区域,导致受损视网膜内非灌注的无细胞毛细血管的重新内皮化(图21a和21b)。在所有(n=l7)动物中都观察到所述修复过程以一致的方式进行。
第二组具有I/R损伤的动物(n=6)也按上述方法处理,随后在处死之前,用3-5ml缀合了TRITC的葡聚糖灌注固定以显现血管腔并最终证明被这些细胞修复的血管是开通的并且是有功能的。红染色显示开通的血管,绿染色证明成血管细胞(hES-BC)来源的内皮细胞,黄染色显示成血管细胞(hES-BC)产生开通的血管系统的位置。图21d显示了hES-BC细胞注射2天后具有黄(红和绿,表现为浅灰色)荧光的大血管,暗示着细胞已经整合到血管壁且血管被灌注。这些动物实验中尤其惊人的是观察到大量的微血管只是绿色,其代表新的旁系代偿新血管系统,其还不够成熟以致不能发育成开通的管腔,因此仍无TRITC-葡聚糖灌注。图20c显示了同一动物的未受损对照眼并清楚证明了BC细胞与血管系统未受损没有任何联系。在hES-BC细胞注射后7天处死的小鼠的视网膜平铺片中,绿色管(非腔化的,非灌注血管)的数量与2天处死小鼠相比较少。有较多黄色管(表现为浅灰色或白色),其表示来源于hES-BC细胞的血管(绿)灌注了TRITC-葡聚糖(红)。这些代表了全功能血管并证明了成血管细胞(hES-BC)已整合入受损眼部的血管并导致更多区域充满微血管(图20e)。
荧光免疫细胞化学方法使成血管细胞(hES-BC)来源的内皮细胞共定位于发生I/R损伤的小鼠眼横切片上已有的受损血管系统,并显示了来自受伤的眼的视网膜的神经节细胞层中血管的典型横切片(图20f)。血管中人细胞核抗原染色和抗CD31染色的共定位揭示了血管系统中的一些内皮细胞来源于成血管细胞(hES-BC)。图20f显示了临近内界膜的神经节细胞层中的血管腔高倍放大图。所述腔被内皮细胞所包围(图20f,箭头,CD31),也被来源于成血管细胞(hES-BC)的成熟内皮细胞所包围(图20f,箭标,人细胞核抗体)。
方法。为进行体内局部缺血/再灌注研究,在研究开始时让C57BL6/J小鼠(Jackson Laboratory)长到7-10周龄。局部缺血/再灌注损伤受眼内压(IOP)的升高诱导。在诱导局部缺血期间,小鼠被保持在吸入麻醉(异氟烷吸入剂)的状态下。用一个30-规格的针连接盐水输导线将导管插入眼前房,并使眼的前房经受2h流体静压(80-90mmHg,Tono Pen;Medtronic Solan,Jacksonville测量,FIa)。通过虹膜变白和红色灌注消失证明了其导致视网膜缺血。120分钟后,针被退出,使IOP恢复正常,产生再灌注损伤。将对侧的眼作为对照。
视网膜缺血再灌注损伤后7天,用收集自第6天hES-BC的经荧光标记的成血管细胞通过眼球后窦进行全身性注射(n=13)或玻璃体内注射(n=4)小鼠。成血管细胞的荧光关键标记通过使用染料PKH-67(Sigma-AldrichTM)根据制造商的指导进行。对于全身注射,每只小鼠接受4×105个经标记的成血管细胞(100μl),而对于玻璃体内注射,每只小鼠接受5×104个成血管细胞(2μl)。给玻璃体内注射组的对侧对照眼注射等体积的无菌等渗盐溶液。一天后小鼠被无痛处死,摘除眼并于4%多聚甲醛中固定1h。洗涤后,通过圆周切割的方式将眼切开,从而切除角膜和晶状体,随后切除玻璃体。随后将完整神经视网膜从下面的脉络膜上轻轻的切除。将完整视网膜置于渗透缓冲液中。将视网膜分离,在含有1:1000缀合了若丹明的蓖麻子凝集素I(Vector Laboratories),10mM HEPES,150mM NaCl和0.1%吐温20(pH 7.5)的溶液中4℃培养过夜。24h后,用10mM HEPES和150mM NaCl于4℃下洗涤视网膜24h,随后装于盖玻片上利用佛罗里达大学光学镜检实验室(Gainesville)的MRC-1024共聚焦显微镜(BioRad)成像。另外,也可用Zeiss激光扫描共焦显微镜对视网膜进行成像。
为利用Zeiss激光扫描显微镜进行镜检,视网膜被置于盖玻片上,并通过从睫状缘延伸到视神经盘内1mm处进行放射状切开4-5刀而使弯曲变平。随后通过使用10×或20×物镜的Zeiss激光扫描共焦显微镜制作所装的视网膜的同步红绿荧光数字图像。z-切面深度恒定保持2μm,扫描神经视网膜整个厚度(包括表面、中层和深层血管丛)的整个血管系统,结果为典型的每个荧光信道25-35z-切面图像。图像捕获在视网膜赤道部的随机位置进行,由于这个区域是在这些模型中观察到的大多数的发生血管损伤的典型位置。随后利用ImageJ软件(ImageJ 1.37c,Wayne Rasband,National Institutes of Health,USA,http://rsb.info.nih.gov/ij/index.html)将三维z-栈平面化,以使三个血管丛在一个的二维平面内可见。
同样患右眼I/R损伤的第二组小鼠(n=6)接受体积为100μl的含有大约2×105经PKH-67标记的hES-BC或成血管细胞,通过对眼球左后窦进行注射实现。小鼠在受伤后2天和7天(皆为n=3)被无痛处死并通过左脑室穿刺灌注3-5ml包含在4%缓冲多聚甲醛中的缀合了TRITC的葡聚糖(St.Louis,MO,5mg/ml)。随后眼被切除,分割,平铺视网膜以通过前述共聚焦显微镜进行数字成像。将对侧眼(未损伤的)作为对照。灌注固定法使开通的血管清楚呈现,由于只有有功能的血管才能被灌注。
实施例6:糖尿病模型中的体内修复
同样对患II型糖尿病超过3个月的自发性糖尿病肥胖BBZDR/Wor大鼠的体内修复进行了研究。这些小鼠呈现增殖前糖尿病性视网膜病的许多特征,包括无细胞血管和内皮细胞功能障碍,周皮细胞损失,和血管视网膜障碍破坏(Shi等.1998Blood(92):362-367;Asahara等.1997Science(275):964-967;Kalka等.2000 Circ.Res.(86):1198-1202;Murohara等.2000J.Clin.Invest.(105):1527-1536;Urbich 等.2004Trends Cardiovasc.Med.(14):318-322)。
患糖尿病至少3个月的雄性肥大性2型糖尿病BBZDR/Wor大鼠(Biomedical Research Models,Worcester,MA),与年龄和性别匹配的对照瘦大鼠一起,用于检测BC参与损伤毛细血管的重新内皮化的能力。在施用所述细胞前1天开始肌内注射环孢霉素A(2mg/Kg/天)并在本研究过程中持续注射,使大鼠免疫抑制。对hES-EBc进行离心沉淀,并将其再悬浮于3×104/μl的无菌盐水中,用5μl所述悬浮液注射6只糖尿病大鼠和对照大鼠的双眼。在施用hES-BC后2天(n=3糖尿病组,n=3对照组)和7天(n=3糖尿病组,n=3对照组)无痛处死小鼠。处理每个处理组6只眼中的4只,且将视网膜平铺物根据小鼠I/R实验中所描述的使用缀合了若丹明的蓖麻子凝集素使血管显影的方法制备。大鼠视网膜又与单克隆抗GFP(ChemiconTM,Temecula,CA;1:250于PBS中)反应,随后与缀合了FITC的山羊抗小鼠IgG(AbeamTM,Cambridge,MA;1:200于PBS中)反应,使表达GFP的BC显影。用在小鼠I/R实验中描述的共聚焦显微镜镜检法捕获数字图像。
固定每个处理组的剩余2只眼,在2.5M蔗糖中脱水,随后植入OCT培养基中以做冷冻切片。收集至少50个切片(10μm厚,每切割10片保存一片),与单克隆大鼠抗CD31(AbeamTM,1:100于PBS中)、兔抗人vWF(Sigma-AldrichTM,1:200于PBS中)和1:50生物素化的抗人核抗原反应,随后与缀合了FITC的抗兔IgG(1:320于PBS中)和缀合了AMCA的山羊抗兔IgG(Vector LaboratoriesTM,Burlingame,VT,1:75于PBS中)反应,并最后与缀合了德克萨斯红的抗生蛋白链菌素(Vector Laboratories,1:500于PBS中)反应。切片随后用Vectashield antifade培养基(Vector LaboratoriesTM)包埋,用配有spot CCD照相机的Zeiss Axioplan 2落射荧光显微镜进行数字成像。
像在I/R小鼠模型中一样,玻璃体内的给药的hES-BC细胞(成血管细胞)广泛掺入具有较大和较小(图21a和21b)血管系统的区域。图20b也显示了几乎完全绿色的很快变窄的大血管(图21b右上部的浅灰色血管)。这种紧缩式血管是增殖前糖尿病性视网膜病的典型特征,所述病微血栓导致血管退化以及下游缺血。紧缩的大血管继续延伸和分支形成的小血管显示了绿色BC细胞的高度掺入(图21中显示为浅灰色)。相反,未患糖尿病对照动物没有绿色hES-BC细胞共定位于眼内原有血管上。未患糖尿病对照动物的眼证实了玻璃体内施用hES-BC细胞后,BC细胞不掺入未受损伤的血管系统,而相反只留在视网膜表面层(图21c,浅灰色区域)。
免疫细胞化学分析显示了用CD31和人核抗原在衬于糖尿病大鼠视网膜的神经节细胞层的管腔内的细胞中共定位着色(图2le和21f),其在紧邻将神经视网膜与玻璃体分开的内部限制性膜的后面。所述解剖学位置是表面视网膜血管丛位点,并且是典型的糖尿病血管病理学位置。所述精确定位和牢固掺入清楚的证明了成血管细胞参与涉及糖尿病性视网膜病的血管修复。大多数切片显示了带有清晰可见管腔的血管,其外周衬有内皮细胞标记物(CD31)和人核抗原标记物着色的细胞(图21e和21f,箭标),而没有证据表明同样注射了BC细胞的未患糖尿病对照大鼠的眼中有成血管细胞(hES-BC)掺入(图21d,箭标)。
实施例7:鼠后肢缺血模型中的体内修复
也检测了鼠后肢缺血模型中BC细胞产生血管内皮细胞的能力。所述实验在8-12周龄(20-30g)的NOD-SCIDβ2小鼠(Jackson Laboratory)上进行。通过股动脉结扎手术诱导右后肢缺血,手术后立即将成血管细胞(hES-BC)(6×105hES-BC个细胞)或无细胞培养基注射入缺血肌肉周围区域。
为证明注射的成血管细胞(hES-BC)的生理功能,对右缺血后肢血流进行4周的监测并与正常左后肢的血流进行对比。用免疫荧光技术检测人特异性vWF(R and D SystemTM,MN),并鉴定来自植入的成血管细胞的(hES-BC)血管内皮细胞。使用了缀合了Alexa Fluor 594的第二抗体。为进行血流分析,用激光多普勒血流成像评价股动脉结扎前(第0天)后(第3-30天)小鼠的血流,血流速度根据缺血肢与不缺血肢血流的比率计算。
如图22f和22g所示,与培养基对照相比,成血管(hES-BC)细胞显著增强缺血肢的血流速度的恢复(p<0.0001)。改善持续了4周,直至血流速度接近正常。
将hES胚细胞集落细胞注射入缺血肌肉周围4周后,处死动物并进行人特异性vWF免疫染色。鉴定出肌内区域含有显示血管组织的人特异性vWF阳性着色的细胞(图22d-e)。来自注射了无细胞培养基的梗塞肌肉的对照组织未显示人vWF着色(图22c)。
实施例8:鼠心肌梗塞模型中的体内修复
在鼠心肌梗塞(MI)模型中的一系列实验中,通过前述左冠状动脉结扎(Yang等.2002J.Appl Physiol(93):1140-1151)来诱导8-12周龄(~20-30克)的NOD/SICDβ2小鼠(Jackson LaboratoryTM)的心肌梗塞。MI诱导后15分钟,将3×105个来源于Hl-GFP hES细胞的GFP-成血管(hES-BC)细胞或无细胞培养基植入缺血心肌或其周围。所述实验方案得到了纪念Sloan-Kettering肿瘤中心动物保护协会的批准。成血管细胞(hES-BC)注射后30天,71%(12/17)注射了成血管细胞(hES-BC)的动物存活,而相比之下42%(8/19)注射培养基对照的动物存活(图22h,P<0.002)。
将成血管细胞(hES-BC)注射入缺血心肌及其周围4周后处死动物,快速切除心脏并用PBS洗涤。心脏包埋于组织冷冻培养基(Fisher ScientificTM,NJ)。将冷冻组织切片并置于10-μm载玻片上。
梗塞组织的免疫染色恢复证明再生组织区域含有巨大数量的人vWF特异性着色的内皮细胞。共聚焦显微镜镜检证实了人特异性vWF阳性内皮细胞掺入了梗塞组织的微血管腔(图22i)。这些细胞紧密联系但并未形成高度组织化的血管组织(图22b)。在对照小鼠的梗塞心脏组织中未能监测到人vWF阳性细胞(Fig.22a)。
移植的成血管细胞也产生了心肌细胞。为鉴定由移植的成血管细胞再生的肌细胞,运用双免疫荧光染色技术检测只在由Hl-GFP hES产生的人细胞中表达的GFP(Santa Cruz Biotechnology Inc.TM,CA)和cTnl(心肌细胞标记物)(Santa Cruz Biotechnology Inc.TM,CA)。使用用于检测GFP的缀合了Alexa Fluor 488的第二抗体或用于检测Tnl的缀合了Alexa Fluor 594的第二抗体。荧光显微镜下拍照。N=3。图23显示了MI小鼠的GFP(最亮或最浅的染色区域)和cTnl(中灰色区域)的免疫染色;GFP和cTnl染色都为阳性的细胞是来源于注射的hES=BC细胞的心肌细胞(图23,200×放大率)。箭标所指为来源于注射的hES-BC细胞的双阳性染色细胞。
实施例7和8的结果证明了成血管细胞降低心肌梗塞后的死亡率并使缺血后肢的血流恢复到接近正常水平。
实施例9:成血管细胞或hES-BC细胞可在体外产生平滑肌细胞
本发明的成血管细胞或hES-BC细胞也可分化成平滑肌细胞,因此在特定实施例中,可以是多能的。
为检测成血管(hES-BC)细胞中的基因表达,第6天时在解剖显微镜下人工挑选细胞并分离总RNA。使用RNAeasy Micro试剂盒(QiagenTM),将RNA用于使用SMART II和CDS引物(ClontechTM)合成cDNA第一链,使用Superscript III逆转录酶,并使用SMART cDNA合成试剂盒(ClontechTM)构建cDNA库。使用对平滑肌钙调理蛋白(CNNl)、SM22、平滑肌肌动蛋白(α-SMA)和GAPDH(质量控制)特异的引物进行PCR分析平滑肌基因表达模式。将人主动脉平滑肌细胞(AoSM)的总RNA用作阳性对照,将小鼠成纤维细胞3T3总RNA用作阴性对照。在1%琼脂糖凝胶上分离PCR产物并用溴化乙锭荧光照射。
图24显示了成血管(hES-BC)细胞表达平滑肌特异性基因CNN1,α-SMA和SM22。
为从本发明的成血管细胞产生平滑肌细胞,将纯化的成血管(hES-BC)细胞平板接种于包被纤维连接蛋白的平滑肌培养基(LonzaTM)中的培养载玻片(BD BioscienceTM)上,诱导分化2-9天。随后用4%多聚甲醛固定细胞15分钟,用1×PBS洗涤,并用0.4%Triton×100渗透。为检测平滑肌蛋白的表达,将渗透细胞与抗钙调理蛋白(CNNl)和α-SMA(Dako)的第一抗体一起于4℃温育过夜,随后与经若丹明标记的第二抗体温育,并在荧光显微镜下检测。
图24展示的结果清楚证明了一些成血管(hES-BC)细胞在上述条件下体外分化后产生CNN1和α-SMA阳性平滑肌细胞。
实施例10:小鼠模型系统中移植受者免疫耐受的诱导
通过本发明的方法产生并扩增的人成血管细胞可用于诱导移植受者中的供者特异性耐受。当成血管细胞或衍生的造血干细胞数量较大时,其可植入非条件性的受者。成血管细胞植入和产生嵌合现象的能力可以在免疫妥协的NOD/SCID-Tg小鼠模型系统中检测,所述模型中小鼠利用人免疫细胞进行重建。可对免疫缺陷NOD/SCID-Tg小鼠进行全身照射,并在同一天注射人供者成血管细胞。将人胎胸腺和胎肝碎片植入小鼠肾囊下以实现淋巴细胞生成和人免疫系统重建。植入的人胸腺和肝碎片与人供者成血管细胞不匹配。随即可检测与第三方非匹配移植物相比,小鼠对与人成血管细胞匹配的移植物的耐受。
为优化移植,可通过施用胸腺照射诱导胸腺空间。在小鼠模型中,受者小鼠可接受抗T细胞mAbs,例如抗CD4和抗CD8mAbs,第0天接受7Gy胸腺照射,在第0-4天接受人成血管细胞。
为评价耐受,可进行混合淋巴细胞反应和细胞介导的淋巴细胞裂解试验
此外,可将人成血管细胞替换为前述方法中的人胎肝碎片以测试成血管细胞在hu-SCID小鼠或类似模型系统中诱导嵌合现象的能力。
实施例11:在移植受者中诱导免疫耐受
在人类中,可用通过本发明的方法产生和增值或扩增的大量人成血管细胞实现耐受。
可通过施用大量成血管细胞而不必使用全身照射产生外周嵌合现象。但是,为产生中枢缺失耐受,最好在胸腺建立空间以便产生高水平的胸腺嵌合现象。胸腺内的空间可通过特异性照射或使用多重给药抗T细胞抗体或使用耗尽胸腺的药物。
设计以下步骤用于延长植入器官、组织或细胞在患者(移植存活者)体内的存活时间并降低移植过程中需要的免疫抑制的水平。器官可以是任何器官,如肝、肾、胰腺或心脏。组织可是任何类型组织,如皮肤、骨骼、角膜、腱、韧带、心脏瓣膜等。细胞或细胞疗法包括但不限于,造血细胞(例如,用于治疗缺血的间充质干细胞或用于治疗血液学失调的其它细胞)、胰脏细胞诸如用于治疗糖尿病的胰岛素分泌型胰脏β细胞、用于治疗黄斑变性的视网膜色素上皮细胞、和用于治疗神经障碍的细胞疗法。
所述方法包括一个或多个下列步骤:受者T细胞的失活或共刺激阻滞;受者NK细胞的失活;移植耐受诱导细胞,例如人成血管细胞;任选植入供者间质组织或施用人细胞因子;及施用胸腺照射。足够大量的供者人成血管细胞的组合联合胸腺照射和/或T细胞共刺激阻滞显著降低或消除全身照射的必要。所述方法包括任何或全部这些步骤,并可按下列顺序执行。
首先,将马抗人胸腺细胞球蛋白(ATG)的制剂或其它具有耗尽作用的抗T细胞的耗尽剂静脉注射入受者。抗体制剂消除成熟T细胞。如果未被消除,成熟T细胞会促进人成血管细胞或来自其的造血干细胞的排斥反应,并且,在致敏作用后,可促进移植物自身的排斥反应。所述ATG制剂也消除自然杀伤(NK)细胞。NK细胞可能对移植器官没有影响,但可立即对新植入的人成血管细胞产生排斥。
当移植后受者T细胞再生时受者胸腺内供者抗原的存在对于耐受受者T细胞是至关重要的。如果供者人成血管细胞不能在受者胸腺内建立并在受者T细胞再生前诱导耐受,可能需要在非成骨髓细胞疗法的整个过程中施用重复剂量的抗受者T细胞抗体。可能需要连续几周耗尽受者T细胞。
非成骨髓细胞疗法第二步是提供特异性生长因子或细胞因子,以促进供者人成血管细胞或干细胞植入。
供者(或与供者相匹配)的人成血管细胞随后被注射入受者。供者细胞导归于受者的恰当位点,与其余受者细胞一起连续生长并增殖,形成嵌合淋巴造血细胞群。通过这一过程,新形成的B细胞(及其产生的抗体)暴露于供者抗原,以使移植物被识别为自体的。
在人成血管细胞或衍生的造血干细胞植入的受者内,在T细胞水平上同样观察到对供者的耐受。在诱导造血或骨髓嵌合现象后几个月,当将匹配器官移植物植入这样的受者中时,移植物将被体液免疫系统和细胞免疫系统所接受。所述方法的额外优点在于允许器官移植在供者人成血管细胞植入足够长时间后进行,以便受者患者的正常健康和免疫活性在器官移植时已经得到恢复。
许多建立造血空间的方法利用了全身照射来促进移植。施用大量供者成血管细胞可大幅度降低或消除对照射的需求。施用供者人成血管细胞可与治疗方法联用,例如诱导胸腺空间的胸腺照射,或T细胞共刺激阻滞。
最后,T细胞,尤其是胸腺或淋巴结T细胞,可通过向受者短期施用免疫抑制剂而得到进一步抑制,如环孢菌素或类似制剂。
为评价耐受,可对受者进行混合淋巴细胞反应和细胞介导的淋巴细胞裂解试验。
虽然任何这些操作步骤都有助于植入器官、组织或细胞的存活,但当一些或所有步骤联合使用时可达到最佳效果。
实施例12:人RBC输血
为证实依本发明的方法产生的红细胞(RBC)的生存能力和功能,将在NOD-scid小鼠中用人RBC进行输血。小鼠将于输血前1周在戊巴比妥麻醉下进行脾切除。在立即输血前将对受者放血以将血细胞比容降低到25%。放血后1小时内,通过i.v.注射向受者输注含有6×109个人RBVs的0.5mL PBS。用二醋酸羧基荧光素(CFSE)标记最初输血的细胞以进行荧光监测。第2天再次输血并在此后每4天重复输血。第1天输血后和此后长达4周内的每4天,通过用肝素化毛细管从尾部切口收集20μL血液监测受者小鼠。用显微镜镜检和流式细胞术用FITC抗Fy6抗体测定RBC和人RBC的百分比。计算植入细胞的半衰期。确定血红蛋白F的表达以证实RBC的载氧能力。期望的是RBC表达血红蛋白F并具有与正常来源的RBC相当的半衰期。因此也期望RBC是有功能的。
本发明公开的内容证明成血管细胞或人ES-BC细胞能在明确定义并可重现的条件下可靠地产生和扩增——代表了免疫力缺乏的患者取之不尽的细胞来源。这些细胞的浓度不受利用度的限制,而是根据个体的精确临床需求逐步增加剂量。如果医师认为必要,也可以对患者终生重复注入相同细胞群。进一步的,建立匹配的或复合性降低的HLA hES细胞系库的能力可潜在降低或消除使用免疫抑制药物和/或同时使用免疫调节方案的必要。
本发明公开的内容也第一次证明来自胚胎干细胞的成血管细胞可在4种不同动物模型中完成血管修复。新血管的形成迅速而强健,暗示着hES衍生成血管细胞具有强健的体内修复能力。所述结果也暗示了成血管细胞可用于恢复患有血管疾病的患者的血管化作用和血管功能。因此,诸如成血管细胞的内皮前体细胞的过继性转移对于恢复血流和增加毛细血管密度,减少肢损并促进心肌损伤的恢复都是有用的。
本发明公开的内容还提供了产生用于输血的分化细胞类型的方法。如,本文提供产生用于输血的红细胞的方法。在某些实施方案中,红细胞表达血红蛋白F。
所有试验都根据佛罗里达大学动物保护和利用委员会和动物眼科和视觉研究利用ARVO宣言的条款批准的方案进行。
1.体外产生和扩增人血管瘤集落形成细胞的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,在无血清培养基中培养包含所述胚胎衍生细胞的细胞培养物;和
(b)向所述含胚状体的培养物中加入至少一种生长因子,并继续在无血清培养基中培养所述培养物,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增,
其中在所述方法步骤(a)和(b)的整个过程中使所述胚胎衍生细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
⒉体外产生和扩增人血管瘤集落形成细胞的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,在无血清培养基中培养包含所述胚胎衍生细胞的细胞培养物;和
(b)向所述含胚状体的培养物中加入至少一种生长因子,并继续在无血清培养基中培养所述培养物,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增,
(c)将所述胚状体解聚为单细胞;
(d)向所述含所述单细胞的培养物中加入至少一种生长因子,并继续在无血清培养基中培养所述培养物,其中所述生长因子的量足够使人血管瘤集落形成细胞在含所述单细胞的培养物中扩增,
其中在所述方法步骤(a)-(d)的整个过程中使所述胚胎衍生细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
3.项目1或2的方法,其中所述胚胎衍生细胞是胚胎干细胞。
4.项目1或2的方法,其中所述生长因子是包括同源异型盒蛋白,或其功能变体,或活性变体的蛋白。
5.项目4的方法,其中所述同源异型盒蛋白包括HOXB4蛋白,或其功能变体,或活性变体。
6.项目1-5中任一项的方法,其中所述生长因子选自血管内皮生长因子(VEGF)、骨形态生成蛋白(BMP)、干细胞因子(SCF)、Flt-3L(FL)促血小板生成素(TPO)和促红细胞生成素(EPO)。
7.项目6的方法,其中在细胞培养的0-48小时内将所述血管内皮生长因子(VEGF)或骨形态生成蛋白(BMP),或两者加入到步骤(a)。
8.项目6的方法,其中从开始步骤(a)的48-72小时内将所述干细胞因子(SCF)、Flt-3L(FL)或促血小板生成素(TPO),或它们的任何组合加入到所述培养物中。
9.项目4-5中任一项的方法,其中从开始步骤(a)的48-72小时内将所述生长因子加入到步骤(b)。
10.项目5的方法,其中从开始步骤(a)的48-72小时内将所述生长因子加入到培养步骤(b)。
11.项目1的方法,还包括向步骤(b)加入促红细胞生成素(EPO)的步骤。
12.项目2的方法,还包括向步骤(b)和(d)加入促红细胞生成素(EPO)的步骤。
13.项目1-3中任一项的方法,还包括从所述培养物中纯化所述人血管瘤集落形成细胞的步骤。
14.项目13的方法,其中所述纯化所述血管瘤集落形成细胞的步骤包括使用带抗CD71抗体的免疫亲合柱层析的步骤。
15.项目1-3中任一项的方法,还包括从所述培养物中分离所述人血管瘤集落形成细胞的步骤。
16.项目15的方法,其中所述分离所述血管瘤集落形成细胞的步骤包括按细胞大小和/或形态分离所述血管瘤集落形成细胞的步骤。
17.项目4-5中任一项的方法,其中所述生长因子是包括HOXB4和蛋白转导域(PTD)的融合蛋白。
18.项目17的方法,其中通过接头连接所述PTD和所述HOXB4。
19.项目17的方法,其中所述蛋白转导域(PTD)是TAT蛋白,其功能变体或活性片段。
20.项目5的方法,其中所述HOXB4是哺乳动物HOXB4。
21.项目20的方法,其中所述哺乳动物HOXB4是小鼠或人HOXB4。
22.项目21的方法,其中所述哺乳动物HOXB4是人HOXB4。
23.项目5的方法,其中所述HOXB4包括全长蛋白。
24.项目22的方法,其中所述HOXB4包括SEQ ID NO:1或SEQ ID NO:3的氨基酸序列。
25.项目19的方法,其中所述TAT蛋白包括SEQ ID NO:14的氨基酸序列。
26.项目17的方法,其中所述PTD包括具有SEQ ID NO:14所示氨基酸序列的TAT多肽的一个或多个拷贝。
27.项目1-3中任一项的方法,其中所述包含人胚胎衍生细胞的细胞培养物来源于人胚胎干细胞库,其中所述人胚胎干细胞库包括干细胞,每个都是存在于人群中的至少一种MHC等位基因的半合子或纯合子,其中所述干细胞库的每个成员都是相对于所述库中其他成员有不同的一套MHC等位基因的半合子或纯合子;其中所述方法产生血管瘤集落形成细胞文库,每个都是存在于人群中的至少一种MHC等位基因的半合子或纯合子,其中所述干细胞库的每个成员都是相对于所述库中其他成员不同的一套MHC等位基因的半合子或纯合子。
28.项目27的方法,其中所述人胚胎干细胞文库包括干细胞,所述干细胞是人群中所有MHC等位基因的半合子或纯合子;其中所述方法产生包含血管瘤集落形成细胞的血管瘤集落形成细胞文库,所述血管瘤集落形成细胞是人群中所有MHC等位基因的半合子或纯合子。
29.项目1-3中任一项的方法,还包括在适合诱导所述人血管瘤集落形成细胞分化成人造血干细胞的条件下,培养所述人血管瘤集落形成细胞的步骤。
30.项目1-3中任一项的方法,还包括在适合诱导所述人血管瘤集落形成细胞分化成人内皮细胞的条件下,培养所述人血管瘤集落形成细胞的步骤。
31.项目30的方法,其中所述条件包括在包被有纤维连接蛋白的培养皿上培养所述人血管瘤集落形成细胞。
32.项目1-3中任一项的方法,其中所述培养物包括至少1×106个人血管瘤集落形成细胞。
33.项目32的方法,其中所述培养物包括至少2×106个人血管瘤集落形成细胞。
34.项目33的方法,其中所述培养物包括至少3×106个人血管瘤集落形成细胞。
35.项目34的方法,其中所述培养物包括至少4×106个人血管瘤集落形成细胞。
36.包括至少1×106个人血管瘤集落形成细胞的溶液。
37.项目36的溶液,其中可将所述溶液注射于受试者。
38.项目36的溶液,其中所述溶液适合于冷冻。
39.项目36的溶液,其中所述溶液包括至少2×106个人血管瘤集落形成细胞。
30.项目39的溶液,其中所述溶液包括至少3×106个人血管瘤集落形成细胞。
41.项目40的溶液,其中所述溶液包括至少4×106个人血管瘤集落形成细胞。
42.项目36的溶液,其中所述人血管瘤集落形成细胞至少能够分化成造血细胞或内皮细胞。
43.项目36-42中任一项的溶液在制备用于治疗可通过施用血管瘤集落形成细胞、造血细胞或内皮细胞来治疗的疾病的药物中的用途。
44.将人血管瘤集落形成细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供通过项目1-35中任一项的方法制得的人血管瘤集落形成细胞;
(c)将一些或所有所述人血管瘤集落形成细胞施用给所述患者。
45.将人血管瘤集落形成细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将一些或所有所述人血管瘤集落形成细胞施用给所述患者。
46.项目45的方法,其中所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
47.将人造血干细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供由项目1-35中任一项的方法制得的人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人造血干细胞;和
(d)将一些或所有所述人造血干细胞施用给所述患者。
48.将人造血干细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人造血干细胞;和
(d)将一些或所有所述人造血干细胞施用给所述患者。
49.项目48的方法,其中所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
50.将人内皮细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供由项目1-35中任一项的方法制得的人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞,和
(d)将一些或所有所述人内皮细胞施用给所述患者。
51.将人内皮细胞施用给有此需要的患者的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞;和
(d)将一些或所有所述人内皮细胞施用给所述患者。
52.项目51的方法,其中所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
53.治疗有此需要的患者的造血干细胞紊乱的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供由项目1-35中任一项的方法制得的人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人造血干细胞;和
(d)将一些或所有所述人造血干细胞施用给所述患者。
54.治疗有此需要的患者造血干细胞紊乱的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人造血干细胞;和
(d)将一些或所有所述人造血干细胞施用给所述患者。
55.项目54的方法,其中所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
56.治疗有此需要的患者内皮细胞紊乱的方法,包括步骤:
(a)选择有此需要的患者;
(b)提供由项目1-35中任一项的方法制得的人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞;和
(d)将一些或所有所述人内皮细胞施用给所述患者。
57.治疗有此需要的患者内皮细胞紊乱的方法,包括步骤:
(a)选择有此需要的患者;
(b)以至少10,000个细胞的数量提供人血管瘤集落形成细胞;
(c)将所述人血管瘤集落形成细胞分化成人内皮细胞;和
(d)将一些或所有所述人内皮细胞施用给所述患者。
58.项目57的方法,其中所述人血管瘤集落形成细胞的数量在10,000到4百万个细胞之间。
59.项目57-58中任一项的方法,其中所述内皮细胞紊乱选自心肌梗塞、中风、动脉粥样硬化和缺血。
60.项目59的方法,其中所述缺血发生在脑、四肢、心脏、肺、皮肤和眼。
61.体外产生人造血干细胞的方法,包括步骤:
(a)提供由项目1-34中任一项的方法制得的人血管瘤集落形成细胞;和
(b)使所述人血管瘤集落形成细胞在适于将所述人血管瘤集落形成细胞诱导分化成人造血干细胞的条件下生长。
62.体外产生人内皮细胞的方法,包括步骤:
(a)提供由项目1-35中任一项的方法制得的人血管瘤集落形成细胞;和
(b)使所述人血管瘤集落形成细胞在适于将所述人血管瘤集落形成细胞诱导分化成人内皮细胞的条件下生长。
63.项目27或项目28的方法制得的人血管瘤集落形成细胞文库。
64.治疗需治疗患者的方法,涉及将人造血干细胞或人内皮细胞施用给所述患者,包括步骤:
(a)选择所述患者;
(b)鉴定在所述患者细胞表面表达的MHC蛋白;
(c)提供项目63的人血管瘤集落形成细胞文库;
(d)筛选匹配所述患者细胞上的所述患者MHC蛋白的人血管瘤集落形成细胞;
(e)将步骤(d)中鉴定的所述人血管瘤集落形成细胞根据需要分化成人造血干细胞、内皮细胞或两者;
(f)将步骤(e)中得到的所述人造血干细胞、内皮细胞或两者中的一些或所有施用给所述患者。
65.项目64的方法,其中在区域中心实施所述方法。
66.项目65的方法,其中所述区域中心是医院。
67.扩增血管瘤集落形成细胞的方法,包括在存在足够支持所述血管瘤集落形成细胞增殖的量的包括同源异型盒蛋白或其功能等效物或其活性片段的蛋白的情况下,使哺乳动物血管瘤集落形成细胞在无血清培养基中生长。
68.项目67的方法,其中所述血管瘤集落形成细胞从脐带血、外周血或骨髓富集、纯化,或者分离。
69.项目67的方法,其中所述血管瘤集落形成细胞是人血管瘤集落形成细胞。
70.项目67的方法,其中使所述血管瘤集落形成细胞体外生长达至少1×106个血管瘤集落形成细胞。
71.项目67的方法,其中所述包括同源异型盒蛋白或其功能等效物或活性片段的蛋白质是包含HOXB4蛋白或其功能等效物或活性片段的蛋白质。
72.项目71的方法,其中所述蛋白质是包括HOXB4和蛋白转导域(PTD)的融合蛋白。
73.项目72的方法,其中所述蛋白转导域(PTD)是TAT蛋白,其功能变体或活性片段。
74.项目71的方法,其中所述HOXB4是哺乳动物HOXB4。
75.项目74的方法,其中所述哺乳动物HOXB4是小鼠或人HOXB4。
76.项目75的方法,其中所述哺乳动物HOXB4是人HOXB4。
77.项目71的方法,其中所述HOXB4包括全长蛋白。
78.项目71的方法,其中所述HOXB4包括SEQ ID NO:1或SEQ ID NO:3的氨基酸序列。
79.项目73的方法,其中所述TAT蛋白包括SEQ ID NO:14的氨基酸序列。
80.项目72的方法,其中所述PTD包括具有SEQ ID NO:14所示氨基酸序列的TAT多肽的一个或多个拷贝。
81.项目4或项目5的方法,其中在步骤(b)的整个过程中将所述生长因子多次加入到步骤(b)的所述培养物中。
82.项目4或项目5的方法,其中在步骤(b)和(d)的整个过程中将所述生长因子多次加入到步骤(b)和(d)的所述培养物中。
83.项目81或项目82的方法,其中每日加入一次所述蛋白。
84.项目81或项目82的方法,其中隔日加入一次所述蛋白。
85.根据项目1的方法制得的分离的血管瘤集落形成细胞。
86.根据项目2的方法制得的分离的血管瘤集落形成细胞。
87.诱导人受者对供者同种异体移植物的耐受性的方法,包括步骤:
(a)给受者施用抑制T细胞共刺激的制剂;
(b)将由项目1的方法产生的人血管瘤集落形成细胞导入所述受者,其中所述血管瘤集落形成细胞与相应供者匹配,和
(c)将所述同种异体移植物移植给受者,其中所述人血管瘤集落形成细胞诱导受者对同种异体移植物的耐受性。
88.项目87的方法,其中所述抑制T细胞共刺激的制剂是抑制CD40配体-CD40相互作用的制剂。
89.项目87的方法,其中所述方法还包括施用抑制CD28-B7相互作用的制剂。
90.项目87-89中任一项的方法,其中所述方法不包括胸腺照射,或T细胞耗尽或灭活的步骤。
91.项目87-89中任一项的方法,其中所述方法还包括对受者进行胸腺照射的步骤。
92.项目87-89中任一项的方法,其中所述方法还包括对受者进行T细胞耗尽或灭活处理的步骤。
93.项目87-89中任一项的方法,其中所述方法还包括对受者进行胸腺照射和T细胞耗尽或灭活处理的步骤。
94.诱导人受者对供者同种异体移植物的耐受性的方法,包括步骤:
(a)在受者中制造胸腺空间;
(b)耗尽或灭活受者中的供者反应性T细胞;
(c)将由项目1的方法产生的人血管瘤集落形成细胞导入所述受者,其中所述血管瘤集落形成细胞与相应供者匹配,和
(d)将所述同种异体移植物移植给受者,
其中所述人血管瘤集落形成细胞诱导受者对同种异体移植物的耐受性。
95.项目94的方法,其中通过给受者施用至少一种选自胸腺照射、类固醇、皮质激素、布喹那(brequinar)、或免疫抑制化学药品或药物来制造所述胸腺空间。
96.项目95的方法,其中通过给受者实施胸腺照射来制造所述胸腺空间。
97.项目95的方法,其中通过给受者施用免疫抑制化学药品或药物来制造所述胸腺空间。
98.项目95的方法,其中通过给受者施用环孢霉素来制造所述胸腺空间。
99.项目87或项目94的方法,其中给受者多次施用血管瘤集落形成细胞。
100.项目87或项目94的方法,其中在不存在通过全身照射制造的造血空间的情况下诱导所述耐受性。
101.项目87或项目94的方法,其中所述人血管瘤集落形成细胞和所述同种异体移植物获自同一供者。
102.项目87或项目94的方法,其中所述人血管瘤集落形成细胞和所述同种异体移植物获自不同供者。
103.人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞或内皮细胞类型,其中所述人血管瘤集落形成细胞与其他人血管瘤集落形成细胞松散粘连。
104.人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞与其他人血管瘤集落形成细胞松散粘连。
105.人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞与其他人血管瘤集落形成细胞松散粘连,且其中所述人血管瘤集落形成细胞不表达CD34蛋白。
106.人血管瘤集落形成细胞,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述人血管瘤集落形成细胞不表达下列任何一种蛋白:CD34、CD31、KDR和CD133。
107.包括人血管瘤集落形成细胞的细胞培养物,所述细胞至少能分化产生造血细胞或内皮细胞类型,其中所述人血管瘤集落形成细胞相互松散粘连。
108.包含基本纯化的人血管瘤集落形成细胞群的细胞培养物,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述血管瘤集落形成细胞相互松散粘连,并且其中所述血管瘤集落形成细胞不表达CD34蛋白。
109.包含分化自胚胎衍生细胞的人血管瘤集落形成细胞的细胞培养物,其中所述血管瘤集落形成细胞相互松散粘连。
110.包含人血管瘤集落形成细胞的细胞培养物,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述血管瘤集落形成细胞相互松散粘连。
111.包含人血管瘤集落形成细胞的药物制剂,所述细胞至少能分化产生造血细胞或内皮细胞类型,其中所述血管瘤集落形成细胞相互松散粘连。
112.包含人血管瘤集落形成细胞的药物制剂,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述血管瘤集落形成细胞相互松散粘连。
113.包含人血管瘤集落形成细胞的药物制剂,所述细胞至少能分化产生造血细胞和内皮细胞类型,其中所述血管瘤集落形成细胞不表达下列任何一种蛋白:CD34、CD31、KDR和CD133。
114.项目103-113中任一项的血管瘤集落形成细胞的冷藏制剂。
115.含至少1×106个人血管瘤集落形成细胞的冷藏制剂,其中所述血管瘤集落形成细胞不表达下列任何一种蛋白:CD34、CD31、KDR和CD133。
116.项目103的血管瘤集落形成细胞,其中所述细胞不表达一种或多种选自CD34、CD31、CD133和KDR的蛋白。
117.项目103的血管瘤集落形成细胞,其中所述细胞不表达CD34蛋白。
118.项目103的血管瘤集落形成细胞,其中所述细胞不表达CD34、CD31、CD133和KDR。
119.项目103的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
120.项目116的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
121.项目117的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
122.项目118的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
123.项目104的血管瘤集落形成细胞,其中所述细胞不表达一种或多种选自CD34、CD31、KDR和CD133的蛋白。
124.项目104的血管瘤集落形成细胞,其中所述细胞不表达CD34蛋白。
125.项目104的血管瘤集落形成细胞,其中所述细胞不表达CD34、CD31、KDR和CD133。
126.项目104的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
127.项目123的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
128.项目124的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
129.项目125的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
130.项目105的血管瘤集落形成细胞,其中所述细胞不表达一种或多种选自CD31、CD133或KDR的蛋白。
131.项目105的血管瘤集落形成细胞,其中所述细胞不表达CD31、CD133和KDR的蛋白。
132.项目105的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
133.项目130的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
134.项目131的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
135.项目106的血管瘤集落形成细胞,其中所述细胞表达LMO2和GATA2蛋白。
136.项目107的细胞培养物,其中所述培养物包含至少1×106个人血管瘤集落形成细胞。
137.项目136的细胞培养物,其中所述培养物包含至少5×106个人血管瘤集落形成细胞。
138.项目108的细胞培养物,其中所述培养物包含至少1×106个人血管瘤集落形成细胞。
139.项目138的细胞培养物,其中所述培养物包含至少5×106个人血管瘤集落形成细胞。
140.项目109的细胞培养物,其中所述胚胎衍生细胞是胚胎干细胞系。
141.项目109的细胞培养物,其中所述胚胎衍生细胞选自胚胎、卵裂球、胚泡或内细胞团。
142.项目110的细胞培养物,其中所述培养物包含至少1×106个人血管瘤集落形成细胞。
143.项目142的细胞培养物,其中所述培养物包含至少5×106个人血管瘤集落形成细胞。
144.项目107的细胞培养物,其中所述血管瘤集落形成细胞不表达一种或多种选自CD34、CD31、CD133或KDR的蛋白。
145.项目107的细胞培养物,其中所述血管瘤集落形成细胞不表达CD34蛋白。
146.项目107的细胞培养物,其中所述血管瘤集落形成细胞不表达CD34、CD31、CD133和KDR蛋白。
147.项目107的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
148.项目144的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
149.项目145的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
150.项目146的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
151.项目108的细胞培养物,其中所述血管瘤集落形成细胞不表达一种或多种选自CD31、CD133或KDR的蛋白。
152.项目108的细胞培养物,其中所述血管瘤集落形成细胞不表达CD31、CD133和KDR蛋白。
153.项目108的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
154.项目151的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
155.项目152的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
156.项目109的细胞培养物,其中所述血管瘤集落形成细胞不表达一种或多种选自CD34、CD31、CD133或KDR的蛋白。
157.项目109的细胞培养物,其中所述血管瘤集落形成细胞不表达CD34蛋白。
158.项目109的细胞培养物,其中所述血管瘤集落形成细胞不表达CD34、CD31、CD133和KDR蛋白。
159.项目109的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
160.项目156的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
161.项目157的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
162.项目158的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
163.项目110的细胞培养物,其中所述血管瘤集落形成细胞不表达一种或多种选自CD34、CD31、CD133或KDR的蛋白。
164.项目110的细胞培养物,其中所述血管瘤集落形成细胞不表达CD34蛋白。
165.项目110的细胞培养物,其中所述血管瘤集落形成细胞不表达CD34、CD31、CD133和KDR蛋白。
166.项目110的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
167.项目163的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
168.项目164的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
169.项目165的细胞培养物,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
170.项目111的药物制剂,其中所述制剂包含至少1×106个人血管瘤集落形成细胞。
171.项目170的药物制剂,其中所述制剂包含至少5×106个人血管瘤集落形成细胞。
172.项目112的药物制剂,其中所述制剂包含至少1×106个人血管瘤集落形成细胞。
173.项目172的药物制剂,其中所述制剂包含至少5×106个人血管瘤集落形成细胞。
174.项目113的药物制剂,其中所述制剂包含至少1×106个人血管瘤集落形成细胞。
175.项目174的药物制剂,其中所述制剂包含至少5×106个人血管瘤集落形成细胞。
176.项目115的冷藏制剂,其中所述制剂包含至少5×106个人血管瘤集落形成细胞。
177.项目115的冷藏制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
178.项目111-113中任一项的药物制剂,其中所述血管瘤集落形成细胞分化自胚胎衍生细胞。
179.项目178的药物制剂,其中所述胚胎衍生细胞是胚胎干细胞。
180.项目178的药物制剂,其中所述胚胎衍生细胞选自胚胎、卵裂球、胚泡或内细胞团。
181.项目111的药物制剂,其中所述血管瘤集落形成细胞不表达一种或多种选自CD34、CD31、CD133或KDR的蛋白。
182.项目111的药物制剂,其中所述血管瘤集落形成细胞不表达CD34蛋白。
183.项目111的药物制剂,其中所述血管瘤集落形成细胞不表达CD34、CD31、CD133和KDR蛋白。
184.项目111的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
185.项目181的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
186.项目182的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
187.项目183的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
188.项目112的药物制剂,其中所述血管瘤集落形成细胞不表达一种或多种选自CD34、CD31、CD133或KDR的蛋白。
189.项目112的药物制剂,其中所述血管瘤集落形成细胞不表达CD34蛋白。
190.项目112的药物制剂,其中所述血管瘤集落形成细胞不表达CD34、CD31、CD133和KDR蛋白。
191.项目112的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
192.项目188的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
193.项目189的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
194.项目190的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
195.项目113的药物制剂,其中所述血管瘤集落形成细胞表达LMO2和GATA2蛋白。
196.包含由项目103-115中任一项的血管瘤集落形成细胞分化得到的造血细胞的培养物。
197.包含由项目103-115中任一项的血管瘤集落形成细胞分化得到的内皮细胞的培养物。
198.包含由项目103-115中任一项的血管瘤集落形成细胞分化得到的平滑肌细胞的培养物。
199.包含由项目103-115中任一项的血管瘤集落形成细胞分化得到的心肌细胞的培养物。
200.项目103-106中任一项的人血管瘤集落形成细胞在制备用于治疗有此需要的患者病况的药物中的用途。
201.项目107-110中任一项的细胞培养物在制备用于治疗有此需要的患者病况的药物中的用途。
202.项目111-113中任一项的药物制剂在制备用于治疗有此需要的患者病况的药物中的用途。
203.由人血管瘤集落形成细胞体外分化产生分化的造血细胞的方法,所述方法包括步骤:
(a)提供人血管瘤集落形成细胞;和
(b)将所述血管瘤集落形成细胞分化成分化的造血细胞。
204.用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)提供人血管瘤集落形成细胞;
(b)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(c)用所述分化的造血细胞进行输血。
205.项目203或204中任一项的方法,其中所述血管瘤集落形成细胞恢复自冷冻培养物。
206.用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成血管瘤集落形成细胞的量的生长因子的情况下,培养包含所述胚胎衍生细胞的细胞培养物;
(b)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(c)用所述分化的造血细胞进行输血。
207.项目206的方法,其中在所述方法步骤(a)的整个过程中使所述胚胎衍生细胞和血管瘤集落形成细胞在无血清培养基中生长。
208.项目206的方法,其中所述胚胎衍生细胞是胚胎干细胞。
209.用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,培养包含所述胚胎衍生细胞的细胞培养物;
(b)向所述含胚状体的培养物中加入至少一种生长因子,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增;
(c)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(d)用所述分化的造血细胞进行输血。
210.项目209的方法,其中在所述方法步骤(a)和(b)的整个过程中使所述胚胎衍生细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
211.项目209的方法,其中所述生长因子是包括同源异型盒蛋白,或其功能变体,或其活性片段的蛋白质。
212.项目211的方法,其中所述同源异型盒蛋白包括HOXB4蛋白,或其功能变体,或其活性变体。
213.项目209的方法,其中所述胚胎衍生细胞是胚胎干细胞。
214.用体外分化自人血管瘤集落形成细胞的造血细胞进行输血的方法,所述方法包括步骤:
(a)在存在至少一种足够将人胚胎衍生细胞诱导分化成胚状体的量的生长因子的情况下,培养包含所述胚胎衍生细胞的细胞培养物;
(b)向所述含胚状体的培养物中加入至少一种生长因子,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述胚状体培养物中扩增;
(c)将所述胚状体解聚成单细胞;
(d)向所述含所述单细胞的培养物中加入至少一种生长因子,其中所述生长因子的量足够使人血管瘤集落形成细胞在所述含所述单细胞的细胞培养物中扩增;
(e)将所述血管瘤集落形成细胞分化成分化的造血细胞;和
(f)用所述分化的造血细胞进行输血。
215.项目214的方法,其中在所述方法步骤(a)-(d)的整个过程中使所述胚胎衍生细胞、胚状体和血管瘤集落形成细胞在无血清培养基中生长。
216.项目214的方法,其中所述生长因子是包括同源异型盒蛋白,或其功能变体,或其活性片段的蛋白。
217.项目216的方法,其中所述同源异型盒蛋白包括HOXB4蛋白,或其功能变体,或其活性变体。
218.项目214的方法,其中所述胚胎衍生细胞是胚胎干细胞。
219.项目203-218中任一项的方法,其中所述分化的造血细胞以单个细胞类型产生。
220.项目219的方法,其中所述单个细胞类型选自:红细胞、血小板或吞噬细胞。
221.项目220的方法,其中所述吞噬细胞选自:粒细胞:嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞;淋巴细胞或单核细胞。
222.项目220的方法,其中红细胞表达血红蛋白F。
223.项目219的方法,其中以约等于见于血液中的分化的细胞类型的比例混合所述单个细胞类型,其中所述见于血液中的分化的细胞类型的比例是96%的红细胞、1%的血小板和3%的吞噬细胞。
224.项目203-218中任一项的方法,其中在同一步骤中产生多种分化的造血细胞类型。
225.项目224的方法,其中所述多种分化的造血细胞类型选自:红细胞、血小板或吞噬细胞。
226.项目225的方法,其中所述吞噬细胞选自:粒细胞:嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞;淋巴细胞或单核细胞。
227.项目225的方法,其中所述红细胞表达血红蛋白F。
228.项目224的方法,其中以约等于见于血液中的分化的造血细胞类型的比例产生多种分化的造血细胞类型,其中所述见于血液中的分化的造血细胞类型的比例是96%的红造血细胞、1%的血小板和3%的吞噬细胞。
229.项目203-218中任一项的方法,其中在输血前向所述分化的造血细胞中加入血浆。
230.项目203-218中任一项的方法,其中所述血管瘤集落形成细胞与患者匹配,以保证能产生患者自身血型的分化的造血细胞。
231.项目203-218中任一项的方法,其中所述血管瘤集落形成细胞对抗原因子A、B、Rh或它们的任意组合呈阴性。
232.项目203-218中任一项的方法,其中所述分化的造血细胞是红细胞,并且其中分化所述红细胞的步骤包括促红细胞生成素(EPO)。
- 还没有人留言评论。精彩留言会获得点赞!