本发明涉及一类多功能影像探针,其制备方法以及所述探针作为肿瘤靶向光学及PET成像、术中影像导航和肿瘤边界精准定位的应用。
背景技术:
花菁染料IRDye800具有分子量小、毒性低、波长可调范围广、以及摩尔消光系数大等优点,使其广泛地用于荧光标记领域。目前,通过对IRDye800结构的修饰,使其连接上具有活性的反应基团,然后与特异性靶分子如抗体、蛋白质、短肽、小分子或者可激活的酶中的氨基或羧基发生反应形成稳定的共价键,形成具有靶向特异性的荧光分子探针进行荧光分子活体成像。Qi Shibo等人利用IRDye800CW标记表皮生长因子配体制备成可特异性与表皮生长因子受体结合的荧光分子探针,应用于高表达表皮生长因子受体的肿瘤成像中。KristineE.Day等人利用IRDye800与贝伐珠单抗(bevacizumab)、帕尼单抗(panitumumab)以及托珠单抗(tocilizumab)共价键偶联制备成荧光分子探针,用于皮肤鳞状细胞癌的诊断和治疗研究。C.Hope Heath等人将IRDye800与帕尼单抗(panitumumab)共价键结合使其可以靶向到表皮生长因子受体,并进行了头颈部鳞状细胞癌的微转移监测。ChenYing等人将IRDye800CW,IRDye800RS近红外荧光染料与前列腺特异膜抗原相偶联制备成特异性荧光分子探针,用于前列腺癌肿瘤特异性荧光成像。由于荧光穿透性深度限制,其在活体成像方面的应用十分有限。
正电子发射计算机断层技术(PET)利用探测正电子核素发射的信号可以获得化合物在体内的实时分布情况,且不受穿透深度限制。目前PET显像技术在临床上有广泛应用。但是PET显像必须使用放射性标记的药物,而临床上能够获得的放射性药物品种极少,严重限制了PET的推广和应用。临床上广泛使用的18F-FDG药物存在无法区分炎症和肿瘤、脑本底摄取高而不宜用于脑瘤以及葡糖转运蛋白低表达肿瘤的缺陷。特异性靶向肿瘤受体的探针可以克服18F-FDG的不足,比如将放射性核素与靶向多肽BBN(或RM26)相连接可以得到靶向肿瘤胃泌素释放肽受体(GRP-R)的放射性探针。68Ga、18F、64Cu属常用的正电子类放射性核素,比较易于获得,具有合适的半衰期并且适合商业化供应。
手术导航系统是基于光学分子成像技术对肿瘤及其他病灶组织进行实时动态成像,可完成结构和功能影像数据的多角度、高通量和动态连续获取;在实现多源数据补偿校正、快速分割、精确配准、实时可视化等关键技术的基础上,构建出光学分子影像肿瘤靶向手术导航系统设备信息融合与计算平台,完成多角度信息融合,实现定性、定位和定量分析功能。随着光学手术导航系统的发展,其对肿瘤边界精确定位和手术切除指导的重要意义越来越被认可。但是目前能够配合手术导航系统、具有肿瘤靶向且适用于人体的光学探针发展还不充分。
基于以上考虑,申请人提出了一类新型的多功能影像探针,其不仅具有肿瘤靶向性,而且还可以同时用于光学和PET成像。该技术方法具有实时性,高精确度,高特异性,高灵敏度以及高分辨率等优点,一方面可协助医生早期发现微小肿瘤病灶,提高肿瘤术前检出率,另一方面,利用分子影像手术导航设备可以在术中精确定位肿瘤边界,减少对病人创伤,降低术后复发的风险,这种成像方法为在脑肿瘤的术前检测、术中影像导航提供了一个可能广泛适用、快速、有效的手段。初步研究结果表明这类新型多功能探针具有优良的生物性能,有望在临床上得以推广应用。
技术实现要素:
本发明的首要目的在于提供一种具有优良显像性能的一类新的多功能影像探针;
本发明的另一目的在于提供一种新的多功能影像探针的制备方法;
本发明的再一目的是提供一种所述的探针在光学及PET成像、肿瘤边界的精准定位和术中影像导航中作为显像剂的应用。
为了实现上述首要目的,本发明首先提供一种具有肿瘤靶向荧光成像功能的多肽化合物,结构中含有用于靶向胃泌素释放肽受体的多肽和用于光学成像的红外荧光染料结构,其结构通式如下式(I)所示:
其中,X可以是NOTA基团或-CH2-;R可以是结构如式(II)所示的靶向多肽BBN,或结构如式(III)所示的靶向多肽RM26;
本发明所述的化合物结构中含有用于靶向胃泌素释放肽受体的多肽(BBN或RM26)和用于光学成像的红外荧光染料(IRDye 800)结构,因此具有良好的肿瘤靶向荧光成像功能,可以作为肿瘤靶向荧光成像探针。
本发明优选的具有肿瘤靶向荧光成像功能的多肽化合物,其结构如式(IV)所示:
其中,R是结构如式(II)所示的靶向多肽BBN,或结构如式(III)所示的靶向多肽RM26;
本发明还提供几种制备所述多肽化合物的方法,包括:
制备所述通式(I)中X为NOTA基团的多肽化合物的方法,包括以下步骤;
1)将保护的赖氨酸与靶向多肽以1-10:1-10的摩尔比混合,在N,N-二异丙基乙胺(DIPEA)和氯磷酸二乙酯(DECP)作用下,利用氨基缩合反应得到第一步产物;所述的靶向多肽选自BBN多肽或RM26多肽的任意一种;
2)步骤1)得到的第一步产物在哌啶条件下脱去保护基团Fmoc,得到第二步产物;
3)将步骤2)得到的第二步产物与NOTA-NHS在DIPEA条件下反应,得到第三步产物;
4)步骤3)得到的第三步产物在三氟乙酸(TFA)条件下脱去保护基团Boc,得到第四步产物;
5)将步骤4)得到的第四步产物和荧光染料活化酯(IR-800-NHS)在DIPEA条件下反应,得到本发明所述的一种肿瘤靶向荧光成像探针;
合成路线如下:
其中,R是结构如式(II)所示的靶向多肽BBN,或结构如式(III)所示的靶向多肽RM26;
以及,制备所述通式(I)中X为-CH2-的多肽化合物的方法,包括:
1)将保护的赖氨酸与靶向多肽以1-10:1-10的摩尔比混合,在DIPEA和DECP作用下,利用氨基缩合反应得到第一步产物;所述的靶向多肽选自BBN多肽或RM26多肽的任意一种;
2)第一步产物在哌啶条件下脱去保护基团Fmoc,得到第二步产物;
3)将第二步产物和荧光染料活化酯(IR-800-NHS)在DIPEA条件下反应,得到本发明所述的另一种肿瘤靶向荧光成像探针;
合成路线如下:
其中,R是结构如式(II)所示的靶向多肽BBN,或结构如式(III)所示的靶向多肽RM26;
在此基础上,本发明进一步提供一种多功能影像探针,它是放射性核素标记的多肽配合物,以结构如式(IV)所示的多肽化合物为配体。
所述的放射性核素可以选自18F、64Cu、68Ga、62Cu、67Cu、86Y或89Zr中的任意一种;优选18F、64Cu或68Ga中的任意一种。
所述的多功能影像探针可以通过含放射性核素的化合物与式(IV)所示多肽化合物按照现有的多种标记方法制备得到;本发明优选的标记方法为下述的湿法或冻干法:
湿法标记方案,包括:将适量式(IV)所示的多肽化合物溶于缓冲溶液或去离子水中;在所得溶液中加入放射性核素溶液,密闭反应5~40min,即生成放射性核素标记的多肽配合物;
或者,冻干法标记方案,包括:将适量式(IV)所示的多肽化合物溶于缓冲溶液或去离子水中;将所得步溶液经无菌过滤后,分装于容器中,经冷冻干燥后加塞密封,得到冻干药盒;向所述冻干药盒中加入适量乙酸溶液或缓冲液溶解,再加入相应的放射性核素溶液,密闭反应5~40min,即生成放射性核素标记的多肽配合物。其中,所述的分装用容器优选为冻存管或管制抗生素瓶。还可以根据药盒冻干粉成型情况可选择在药盒中增加赋形剂,比如甘露醇、抗坏血酸等,并通过调节所述多肽混合物化合物以及赋形剂的用量,使药盒成型达到最佳。
所述的湿法标记方案和冻干标记方案得到的产物均可经常规处理(如经色谱分离纯化、旋蒸除去溶剂、以PBS或水或生理盐水溶解剩余物、无菌过滤等)进一步制成注射液。
本发明一种优选的多功能影像探针制备方法,是68Ga的湿法标记法,包括:将式(IV)所示结构的化合物溶于缓冲溶液或去离子水中;在其中加入新鲜淋洗的68GaCl3盐酸溶液,密闭50~120℃反应5~40min,冷却;HPLC分离纯化,除去未反应的68Ga离子,旋蒸除去溶剂,再经生理盐水或PBS稀释后无菌过滤,即得结构如下式(V)所示的68Ga标记的多肽配合物的注射液。
其中,R是结构如式(II)所示的靶向多肽BBN,或结构如式(III)所示的靶向多肽RM26;
本发明优选的另一种多功能影像探针制备方法,是18F的冻干法标记法,包括:将式(IV)所示结构的化合物和氯化铝溶于缓冲溶液中,所得溶液经无菌过滤后分装于冻存管中,经冷冻干燥后密封得到冻干药盒;向冻干药盒中加入适量乙酸溶液或缓冲溶液溶解,再加入乙腈或乙醇和新鲜制得的18F离子水溶液,密闭70~120℃反应5~30min,冷却;加水稀释反应液后经Sep-Pak C18色谱柱分离纯化,以缓冲液或水冲洗色谱柱除去未反应的18F离子,以盐酸乙醇溶液或乙醇溶液淋洗,再经生理盐水稀释后无菌过滤即得结构如下式(VI)所示的18F标记的多肽配合物的注射液。
其中,R是结构如式(II)所示的靶向多肽BBN,或结构如式(III)所示的靶向多肽RM26;
上述方法中,所述的缓冲溶液为稳定反应液pH值的物质,可以为醋酸盐、乳酸盐、酒石酸盐、苹果酸盐、马来酸盐、琥珀酸盐、抗坏血酸盐、碳酸盐或磷酸盐中的任意一种或两种以上的混合物。
本发明还提供所述的多功能影像探针在制备用于人或动物的器官或组织显像剂中的应用。
本发明所述的具有肿瘤靶向荧光成像功能的多肽化合物,经过放射性标记后成为一种新的多功能影像探针,该探针应用于人或动物的器官或组织显像时具有优异的显像效果,生物试验结果表明其在GRP-R高表达的肿瘤中有很高的摄取和很好的滞留,具有较高的靶/非靶比值,适合用作荧光和PET双模显像的肿瘤像剂并用于肿瘤切除手术的术中影像导航,能够为术前和术中影像导航带来实时性、高精确度、高特异性、高灵敏度以及高分辨率等优点。本发明提供的放射性标记的多功能影像探针制法简单、成本低,特别是经药盒化后制备更加简便,更加有利于在临床上推广应用。
附图说明
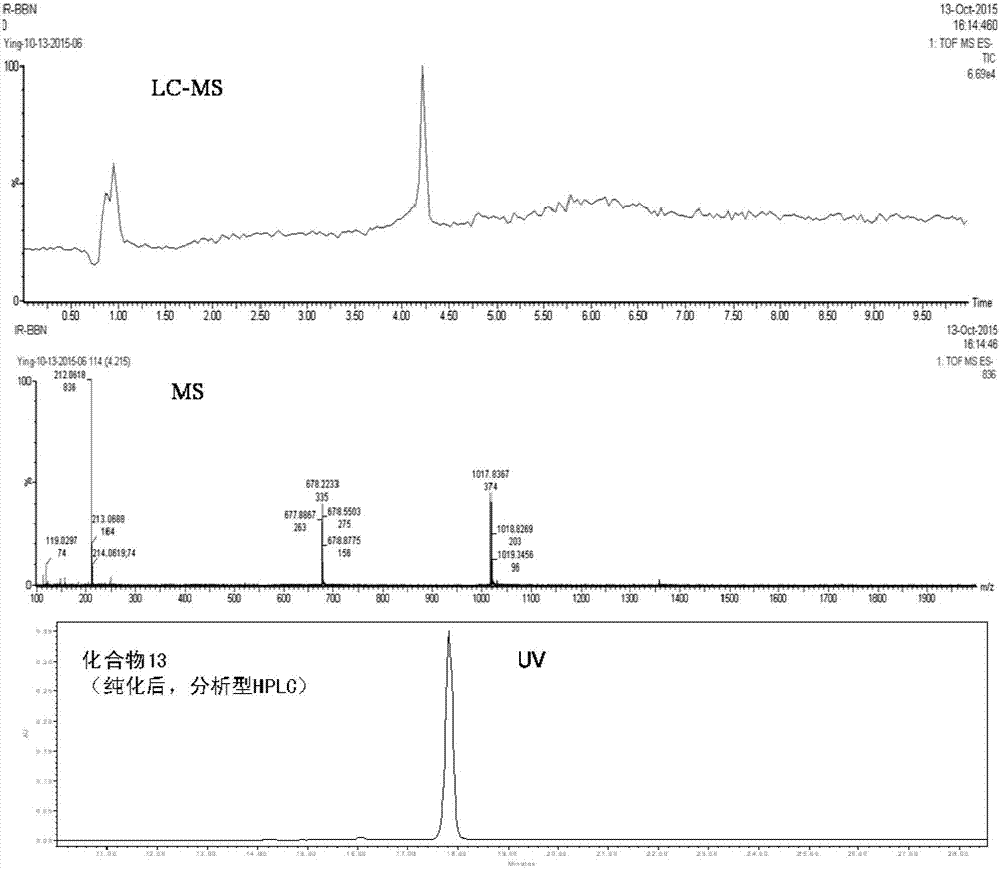
图1为实施例1制备的化合物13的LC-MS以及HPLC分析图。
图2为实施例2制备的化合物10标记反应混合物(放射性检测)的HPLC分析图。
图3为实施例1制备的化合物5(上,UV)和实施例2制备的化合物6纯化前(中,放射性检测)及纯化后(下,放射性检测)的HPLC分析图。
图4为实施例1制备的化合物5在荷瘤裸鼠内的光学成像图。
图5为实施例2制备的化合物6在荷PC3瘤裸鼠体内的PET显像图。
图6为实施例2制备的化合物10在荷PC3瘤裸鼠体内的PET显像图。
图7体现了实施例1制备的化合物13在脑胶质瘤边界定位和精准导航切除中的应用。
具体实施方式
以下通过具体的实施例和应用例来进一步说明本发明:其中合成步骤中所使用的化学物质均为现有物质或市售商品。
实施例1
制备一种具有肿瘤靶向光学成像功能的多肽化合物(化合物5),其合成路线如下:
具体制备过程包括以下步骤:
1)化合物2的合成:
将9.5mg Fmoc-Lys(Boc)-OH(Fmoc和Boc保护的赖氨酸)、25μL二异丙基乙胺(DIPEA)和5μL氯化二乙基磷酸(DECP)混合液加入到含有27.5mg BBN(市售肿瘤靶向多肽,溶于2.6mL二甲基甲酰胺(DMF))的20mL玻璃瓶中。混合溶解后在室温下搅拌2h,然后进行液相色谱和质谱联用(LC-MS)分析,结果显示有目标化合物1生成。紧接着加入0.6mL哌啶在化合物1溶液中并继续在室温下搅拌1h,脱去Fmoc保护基团,得到目标产物(化合物2)。以HPLC分离纯化并经冷冻干燥后得到纯化合物2约18.5mg,产率71%。经LC-MS鉴定中间产物:[MH]+=1279.5933,计算值(m/z)为1280.7063(C60H96N16O13S)。
2)化合物4的合成:
将溶于2mL二甲亚砜(DMSO)的18.5mg上步产物化合物2和20μLDIPEA以及24.0mgNOTA-NHS(1,4,7-三氮杂环壬烷-N,N',N″-三乙酸活化酯,2倍当量)混合溶解。混合物在室温下搅拌20min并以HPLC监测反应进程。待化合物2消耗完后以LC-MS检测目标化合物(化合物3)的生成。然后再加入0.1mL三氟乙酸(TFA)以脱去保护基团Boc得到化合物4。冻干除去溶剂DMSO后的混合物以HPLC分离纯化得到化合物4,经冷冻干燥后得到目标产物(化合物4)约6.5mg,产率30.6%。经LC-MS鉴定产物:[MH]+=1464.6552,计算值(m/z)为1465.7864(C67H107N19O16S)。
3)化合物5的合成:
在含有6.5mg化合物4(溶于1mLDMSO)的20mL玻璃反应瓶中,加入6.0mgIR-800-NHS(800CW荧光染料活化酯,市售)和10μLDIPEA混合溶解。混合物在室温下搅拌1h并以HPLC纯化,经冷冻干燥后得到目标产物(化合物5)约2mg,产率18.5%,纯度大于97%。经LC-MS鉴定产物:[(MHH)/2]++=1224.9103,计算值(m/z)为2450.0165(C113H159N21O30S5)。
在上述制备过程中,以RM26多肽(市售)替代步骤1)中使用的BBN多肽,即得到本发明另一种具有肿瘤靶向光学成像功能的多肽化合物(化合物9),得到的化合物9结构如下式(VII)所示,精确质量为2623.16(C125H174N22O32S4)。
2.制备一种具有肿瘤靶向光学成像功能的多肽化合物(化合物13),其合成路线如下:
具体制备过程包括以下步骤:
1)将5.5mg Fmoc-Lys(Boc)-OH(Fmoc和Boc保护的赖氨酸)、15μL二异丙基乙胺(DIPEA)和8μL氯化二乙基磷酸(DECP)混合液加入到含有38mg BBN(市售肿瘤靶向多肽,溶于6mL二甲基甲酰胺(DMF))的玻璃瓶中。混合溶解后在室温下搅拌1h,然后进行液相色谱和质谱联用(LC-MS)分析,结果显示有第一步目标产物生成。紧接着在第一步目标产物溶液中加入1mL哌啶并继续在室温下搅拌0.5h,脱去Fmoc保护基团,得到第二步目标产物。
2)将10.5mg第二步目标产物和8.0mg IR-800-NHS(800CW荧光染料活化酯,市售)溶于4mL DMF,并加入50μL DIPEA混合。混合物在室温下搅拌2h并以HPLC监测反应进程,当IR-800-NHS全部消耗完毕后,混合物以4mL水稀释并制备型HPLC(配C18柱)分两次进样并按以下梯度在12mL/min流速下纯化。线性梯度:0-5min:6%有机相(含0.1%TFA的乙腈)和94%水相(含0.1%TFA的水),5-35min:有机相比例增加到65%(水相35%)。收集目标化合物组份,经冷冻干燥后得到目标产物(化合物13)约11.4mg,产率81.4%,经分析型HPLC分析其纯度大于97%(线性梯度:0-5min:5%有机相(含0.1%TFA的乙腈)和95%水相(含0.1%TFA的水),5-35min:有机相比例增加到65%(水相35%);流速1mL/min;HPLC分析图参见图1)。经LC-MS鉴定产物:[(MHH)/2]++=1017.8367,计算值(m/z)为2036.7891(C95H128N16O24S5)。
在上述制备过程中,以RM26多肽(市售)替代步骤1)中使用的BBN多肽,即得到本发明另一种具有肿瘤靶向光学成像功能的多肽化合物(化合物14),得到的化合物14结构如下式(VIII)所示,精确质量为2209.93(C107H143N17O26S4)。
实施例2
1.放射性64Cu和68Ga标记用冻干药盒的制备(以制备100支为例)
称取4mg实施例1制备的化合物5(或9)溶于10mL 0.5mol/L的醋酸-醋酸钠缓冲溶液(pH 4)中,经无菌过滤后分装于100支冻存管中,然后置于冷冻干燥机中冷冻干燥24小时,加塞密封,得到冻干药盒I。根据药盒冻干粉针成型情况可在药盒中增加赋形剂,比如甘露醇、抗坏血酸等,可调节化合物5(或9)以及赋形剂的用量,使药盒成型达到最佳。
2.放射性18F标记用冻干药盒的制备(以制备100支为例)
称取4mg实施例1制备的化合物5(或9)溶于10mL 0.5mol/L的酒石酸-酒石酸钾钠缓冲溶液(pH 4)中,再将0.04mg氯化铝(AlCl3)溶于10mL 0.5mol/L的酒石酸-酒石酸钾钠缓冲溶液(pH 4)中,将二者均匀混合。经无菌过滤后分装于100支冻存管中,然后置于冷冻干燥机中冷冻干燥24小时,加塞密封,得到冻干药盒II。根据药盒产量以及对每支药盒中组分含量要求的不同,可调节化合物5(或9)以及氯化铝的用量,使它们的重量比落在(20~100):1范围内。
3.一种68Ga标记的多功能影像探针(化合物6)的制备:
1)湿法:将约18.5~1850兆贝可(MBq)68GaCl3盐酸溶液(淋洗自镓发生器)加入到含0.5mL实施例1制备的化合物5的醋酸-醋酸盐溶液(4.0g/L)的离心管中,置于室温下反应20min,即得到目标化合物6。经HPLC分离纯化,旋蒸除去溶剂,以磷酸盐缓冲液(PBS)溶解剩余物,经无菌过滤即得化合物6注射液。
2)冻干法:将约18.5~1850MBq68GaCl3盐酸溶液(淋洗自镓发生器)加入到含有化合物5的冻干药盒I内,混匀后室温下反应20min,即得到目标化合物6。经HPLC分离纯化,旋蒸除去溶剂,以PBS溶解剩余物,经无菌过滤即得化合物6注射液。
4.一种18F标记的多功能影像探针(化合物7)的制备:
1)湿法:在1mL离心管中,加入3μL 2mM的AlCl3醋酸-醋酸盐缓冲溶液(0.5mol/L,pH=4)和6μL 3mM实施例1制备的化合物5的醋酸-醋酸盐缓冲溶液(0.5mol/L,pH=4),然后加入0.13mL的乙腈和0.05mL约370MBq的18F-水溶液,充分混合后置于沸水浴中反应10min,即得到目标化合物7配合物。反应液冷却后加水稀释至10mL体积,经C18色谱柱分离纯化,以10mL水冲洗色谱柱除去未反应的18F离子,以0.3mL80%乙醇水溶液(含1mM HCl)淋洗出化合物7,在氩气保护下旋干乙醇,最终产品溶于PBS(0.5mol/L,pH=7.4)并经无菌过滤,所得化合物7注射液,经分析型HPLC鉴定。
2)冻干法:将含有化合物5的冻干药盒II中加入0.5mL 0.5mol/L的醋酸-醋酸盐缓冲液(pH=4),全部溶解后加入约37~3700MBq18F-乙腈淋洗液(从阴离子捕获柱QMA获得),密闭120℃反应5min,冷却;加水稀释反应液后经C18色谱柱分离纯化,以0.5mol/L磷酸盐缓冲液(pH 7.4)冲洗色谱柱除去未反应的18F离子,以盐酸乙醇溶液淋洗得到化合物7,经生理盐水稀释后无菌过滤即得化合物7注射液。
5.一种64Cu标记的探针多功能影像探针(化合物8)的制备:
1)湿法:将约18.5~1850MBq64CuCl2醋酸钠溶液加入到含0.5mL实施例1制备的化合物5的醋酸-醋酸盐溶液(4.0g/L)的管制抗生素瓶中,置于60℃水浴中反应20min,即得到目标化合物8。经HPLC分离纯化,旋蒸除去溶剂,以水溶解剩余物,经无菌过滤即得化合物8注射液。
2)冻干法:将约18.5~1850MBq64CuCl2醋酸钠溶液加入到含有化合物5的冻干药盒I内,混匀后60℃水浴加热20min,即得到目标化合物8。经HPLC分离纯化,旋蒸除去溶剂,以PBS溶解剩余物,经无菌过滤即得化合物8注射液。
6.另一种68Ga标记的探针多功能影像探针(化合物10)的制备:
1)湿法:将约18.5~1850兆贝可(MBq)68GaCl3盐酸溶液(淋洗自镓发生器)加入到含0.5mL实施例1制备的化合物9的醋酸-醋酸盐溶液(4.0g/L)的离心管中,置于室温下反应20min,即得到目标化合物10。经HPLC分离纯化,旋蒸除去溶剂,以磷酸盐缓冲液(PBS)溶解剩余物,经无菌过滤即得化合物10注射液。
2)冻干法:将约18.5~1850MBq68GaCl3盐酸溶液(淋洗自镓发生器)加入到含有化合物9的冻干药盒I内,混匀后室温下反应20min,即得到目标化合物10。经HPLC分离纯化,旋蒸除去溶剂,以PBS溶解剩余物,经无菌过滤即得化合物10注射液。HPLC分析结果参见图2(保留时间约17min,放射化学纯度大于99%)。
分析及应用效果
以下以实施例2制备的放射性68Ga标记探针(化合物6)为例,其性能测定描述如下:
1.HPLC分析鉴定
HPLC体系如下:Waters 600型(Waters 996PDA检测器);C18色谱柱(PROTO 300C185μm,250x 20mm,Higgins Analytical,Inc.)用于多肽分析纯化。化合物5保留时间约为17.5min并以此计算化学纯度大于97%。HPLC结果见图3的上图。
Perkin-Elmer Series 200LC配备Waters 2784双吸收波长紫外检测器和Bioscan放射性检测器,Waters Symmetry分析柱(5μm,150x 3.9mm)。流速1mL/min,化合物6保留时间约为17.5min并以此计算化学纯度大于98%。HPLC结果见图3的中、下图。
淋洗梯度:0~5分钟:5%乙腈(0.1%TFA)和95%水(0.1%TFA)保持不变;5~35分钟:增加到65%乙腈(0.1%TFA)和35%水(0.1%TFA)。
2.化合物5在肿瘤模型鼠体内的荧光成像效果试验
按实施例1制备好化合物5并配制成生理盐水溶液,取0.1mL(约3nmol)注射于荷PC3瘤裸鼠(体重约20克)尾静脉,并于给药后30min、60min和120min进行光学信号采集。观察探针在小鼠体内的分布以及在肿瘤区域的富集。显像结果图如图4所示,化合物5在肿瘤中有明显摄取,而在其它背景器官的摄取清除较快。
3.化合物6在肿瘤模型鼠MicroPET显像效果试验
按实施例2制备好放射化学纯度大于95%的化合物6溶液,取0.1mL(约3.7MBq)注射于荷PC3瘤裸鼠(体重约20克)尾静脉,并于给药后30min、60min和120min进行PET图像采集。对MicroPET扫描所得全身衰变校正冠状图像勾画感兴趣区(ROI)。从多个ROI平均像素值中获得肿瘤、肌肉、肝、肾和尿等器官中的放射性活度并转化为MBq/mL,所得值除以注射剂量得到%ID/g(假定组织密度为1g/mL)。显像结果图如图5所示,化合物6在肿瘤中有明显摄取,在给药后30min达到最大值,其后逐步清除。而肾中摄取逐步增加,可能因为该化合物为肾代谢所致。
4.化合物10在荷PC3瘤裸鼠体内的MicroPET显像效果试验
按实施例2冻干法制备得到化合物10,采取同上述化合物6在荷PC3瘤裸鼠体内的MicroPET显像效果试验的方法,进行PET显像。结果如图6所示,化合物10可作为显像剂,给药后30min肿瘤摄取明显,而且滞留较好,而其他组织或器官摄取已经基本清除。
5.化合物13在脑胶质瘤边界定位和精准导航切除中的应用
(1)术前1周内注射任意一种68Ga标记的探针,为脑胶质瘤患者行全脑PET/CT显像,有条件者可直接行全脑PET/MRI显像。
(2)术前1周患者静脉注射二亚乙基三胺五乙酸钆(Gd-DTPA)后行全脑核磁共振(MRI)检查。
(3)在仅能行PET/CT,无PET/MRI一体化成像的条件下,在医用大型PET设备平台上或者目前市面销售的神经导航仪上,将PET/CT和MRI的标准Dicom-3数据格式的影像资料实现图像融合,以实现MRI及PET基于脑胶质瘤血脑屏障破坏增强剂渗漏及肿瘤受体表达活性区域不同肿瘤边界的三维比对,既应用MRI对软组织的高灵敏度特点,又应用PET基于肿瘤特异受体识别的高灵敏性,改进目前在神经肿瘤学界广受质疑的MRI T1增强显示肿瘤边界仅仅基于血脑屏障破坏、并非肿瘤真实的生物学边界。
(4)术前制定计划,可应用神经导航设计脑胶质瘤的皮瓣设计、骨瓣开窗,不仅实现三维立体定位达到精准,也能更接近于肿瘤的生物学边界,避免术中被动。
(5)麻醉诱导前给予静脉注射实施例1制备的化合物13后,观察患者反应,若无反应则进行全身麻醉,进行手术准备。
(6)在打开骨窗后,以上述步骤(3)得到的PET/MRI导航系统的导航探针,在硬膜上勾划肿瘤的真实边界,再次确定硬膜剪开的实际范围和大小;打开硬膜后,再次在脑皮层上勾划肿瘤整体轮廓及边界,若肿瘤位于表浅灰质皮层,则直接确定切除范围,若肿瘤位于深层白质或传导束,则确定皮层造瘘的方向及大小。
(7)打开近红外光激发及接收仪,在关闭手术无影灯及光学显微镜照明灯的情况下,将近红外光激发及接收探头置于肿瘤术野上方10-15cm,以视频实时录入及展示荧光范围。比较基于68Ga标记探针显像的PET/MRI导航探针标注的肿瘤范围边界与化合物13靶向荧光成像的肿瘤范围边界。
(8)肿瘤沿边界切除后,由于脑脊液释放、脑移位等引起导航偏变,原基于68Ga标记探针显像的导航系统将失灵。这时切除残腔边缘的残余肿瘤呈灶性分布,且光学显微镜下难以区分,随时以化合物13荧光成像显示残腔的肿瘤残留情况,并定点精准切除。
以上脑胶质瘤边界定位和精准导航切除相关过程及结果见图7,其中,A)图为术前PET图像(左:横断面图;右:侧位投影图);B)图为术前增强MRI图像;C)图为术前PET与增强MRI的融合图像;D)图为术中打开硬脑膜后,近红外光激发及接收仪下,显示肿瘤全貌;E)图为肿瘤残腔内以近红外显像提示肿瘤残留灶,指导继续定点精准全切除。
上述应用过程,一方面可以利用放射性射线穿透性强进行活体无创肿瘤显像,协助医生早期发现微小肿瘤病灶,提高肿瘤术前检出率;另一方面,利用分子影像手术导航设备可以在术中精确定位肿瘤边界,减少对病人创伤,降低术后复发的风险,这种成像方法为在脑肿瘤的术前检测、术中影像导航提供了一个可能广泛适用、快速、有效的手段。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:陈小元;郎立新;张静静;朱朝晖;张现忠;李方;
- 技术所有人:陈小元;朱朝晖;
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!