从南极磷虾油中分离具有抗肿瘤活性的全反式脂肪酸的方法与流程
本发明涉及一种从南极磷虾油中分离具有抗肿瘤活性的天然E型脂肪酸的方法,经鉴定的全反式EPA和DHA对人乳腺癌、肝细胞癌、早幼粒白血病、慢性粒细胞白血病、组织细胞性淋巴瘤等具有显著的抗肿瘤细胞生长的效果。
背景技术:
在过去的几十年内,肿瘤的发病率呈逐年上升趋势,即使有医疗技术的不断进步,肿瘤仍然是和平时期人类死亡的一大病因。研究人员从不同方向研究肿瘤的发生及发展,并研发出以放射线疗法(放疗)、化学疗法(化疗)及外科手术疗法(手术)为主的三大疗法,但三大疗法均存在不同程度的弊端。放疗存在显著的副作用,如食欲不振、脱发、嗜睡、白细胞减少,部分患者还伴有出血等情况;手术疗法对肿瘤发生的前期或前中期效果较好,但肿瘤发生扩散后,手术疗法的效果便变差,并且手术疗法对患者的心理及生理负担皆较大,有些患者会因手术而引起后遗症或并发症,而且手术疗法只能针对实体瘤,对非实体瘤如血癌等无能为力。化疗的药物比较多,逐渐形成合成药、中药或天然产物、生物药物等系列产品,但许多抗肿瘤药物存在特异性差等弊端,有些药物进入患者体内后,杀伤肿瘤细胞的同时也大量杀死患者体内的正常细胞,导致一系列副作用,如脱发、呕吐、恶心及食欲不振等,因此开发一类安全性高、副作用小、抗肿瘤效果好的药物是人们的迫切需要,其中多不饱和脂肪酸的研发曾受到人们的广泛关注。
脂肪酸是脂肪、磷脂和糖脂的主要成分,是生命的物质基础。根据其碳链上是否含有不饱和键或双键而分为饱和脂肪酸和不饱和脂肪酸,含有两个以上不饱和键的脂肪酸被称为多不饱和脂肪酸,如二十碳五烯酸(EPA)及二十二碳六烯酸(DHA)分别含有五个和六个双键。依据其构型脂肪酸又有顺式(Z型)和反式(E型)之别,常见的深海鱼油中的EPA和DHA是Z型的,被认为是极具营养价值和生理活性的ω-3族脂肪酸。已有研究表明,Z-EPA及Z-DHA具有增强人体免疫、抗过敏及促进细胞内脂肪酸代谢等重要作用,而且DHA对婴幼儿神经系统发育也发挥重大作用。自二十世纪七十年代以来,研究人员发现 Z-EPA及Z-DHA具有抑制多种肿瘤细胞生长的能力,如对人早幼粒急性白血病细胞系HL60的半数致死浓度(IC50)分别为85μM和70μM,对人乳腺癌细胞系MCF-7的IC50分别为85±5μM和65±5μM;它们的主要作用机理为诱导肿瘤细胞凋亡或造成肿瘤细胞生长周期阻滞。现阶段由于Z-EPA及Z-DHA必须在高浓度下才可以对多种肿瘤细胞产生杀伤作用,导致其应用受到很大限制。
反式(E型)脂肪酸有天然存在和人工制造两种类型,如牛羊奶等乳类制品中含4-9%的E型脂肪酸或酯,而氢化油则是对植物油进行氢化改性产生的一种不饱和脂肪酸,含有14.2-34.3%的E型脂肪酸;共轭亚油酸(CLA)存在一个E型碳碳双键也被归类为E型脂肪酸。这类脂肪酸的生物学功能存在较大争议,尤其在致癌和治癌两个看似对立的方面。有研究表明CLA可以辅助治疗乳腺癌,也有研究认为它可加速乳腺癌的恶性进程,另有研究认为两者之间无相关性,迄今未能形成定论。对E型脂肪酸的研究主要以E-油酸为主,研究认为E-油酸的高摄入量会增加心血管疾病的风险,尤其是冠心病,但对早期生长发育、Ⅱ型糖尿病、高血压、癌症等疾病与反式脂肪的相关性,目前没有明确证据能够证实。E型EPA及DHA作为Z型EPA及DHA的异构体,至今尚未有报道。
南极磷虾油脂富含多不饱和脂肪,尤其是ω-3不饱和脂肪酸,其中EPA和DHA含量高达20%以上。通常人们认为南极磷虾中的EPA及DHA都是Z型,具有抗氧化、抗衰老、抗肿瘤等作用,但实际上多为类推,缺乏实验依据。本发明采用溶剂萃取、硅胶层析、制备高效液相色谱等方法对南极磷虾油脂进行了分离纯化,通过高分辨电喷雾电离质谱(HRESIMS)、核磁共振、拉曼光谱等技术鉴定两个单一成分为E型EPA和DHA,其抗肿瘤活性优于Z型为主的市售鱼油EPA和DHA,为新型抗肿瘤药物的开发提供了新的线索。
技术实现要素:
本发明的目的在于提供一类具有良好抗肿瘤作用,且安全性高、副作用小的抗肿瘤剂—全反式多不饱和脂肪酸,E型EPA和DHA。用混合溶剂萃取、硅胶层析、制备液相色谱法分离纯化南极磷虾油脂中具有抗肿瘤活性的有效组分,通过气相色谱-质谱联用、液相色谱-质谱联用、高分辨电喷雾电离质谱、核磁共振、拉曼光谱等仪器分析有效成分的结构,并考察它们对多种肿瘤细胞生长的影响,并与市售鱼油EPA和DHA以及鲟鱼肝EPA和DHA进行比较。
本发明提供一种具有抗肿瘤活性的全反式EPA或全反式DHA,其从南极磷虾油中分离得到。常见的深海鱼油中的EPA和DHA是Z型的,E型EPA及DHA作为Z型EPA及DHA的异构体,至今尚未有抗肿瘤活性报道。
本发明还提供从南极磷虾油中分离具有抗肿瘤活性的天然全反式EPA或全反式DHA的方法,其包括如下步骤:
(1)将南极磷虾油加入至硅胶柱中进行柱层析分离,收集洗脱液,去除溶剂,得到馏分Ⅰ和馏分Ⅱ,馏分Ⅰ为黄色油状物,馏分Ⅱ为鲜红色油状物;
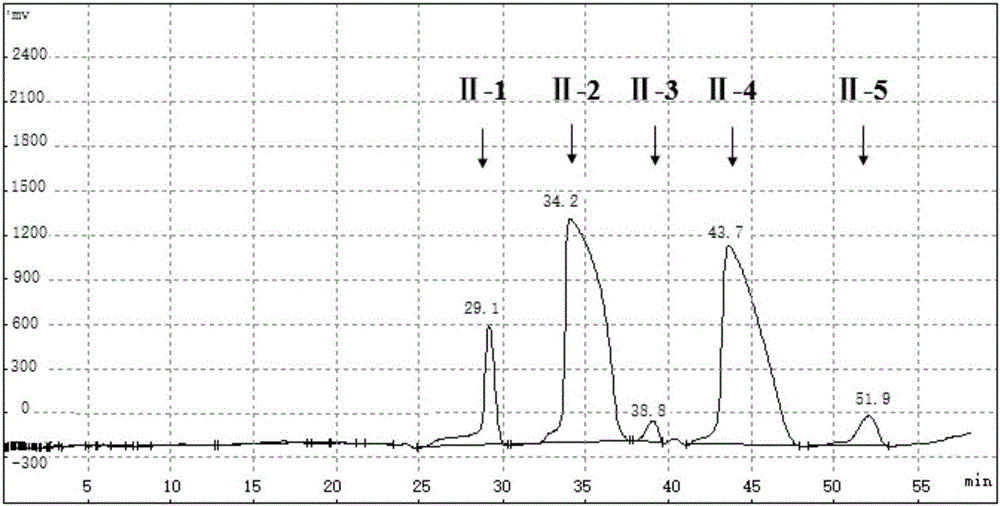
(2)馏分Ⅱ用乙腈稀释,用高效制备液相色谱法进行分离,以乙腈和水的混合溶剂系统为流动相进行洗脱,收集洗脱所得不同组分,去除溶剂,依次得到组分Ⅱ-1至Ⅱ-5,均为无色或略带黄色的油状物质,其中组分Ⅱ-2为全反式EPA,组分Ⅱ-4为全反式DHA。
进一步地,在步骤(1)所述的柱层析分离中,所述的洗脱液是体积比为7:3-9:1的正己烷和乙醚混合液,混合液中添加体积百分比为1-5%的乙酸。
进一步地,步骤(1)中所述的硅胶的粒径为300~400目,硅胶与南极磷虾油的质量比为30~100:1,优选为50~80:1,更优选为60~70:1,层析柱高径比为10~16:1。
进一步地,步骤(2)中所述的色谱柱填料为反相C18,粒径10μm,流动相的洗脱程序依次如下:洗脱0-10min之间,用62-68%乙腈洗脱;洗脱10-20min之间,用67-73%乙腈洗脱;洗脱20-60min之间,用72-78%乙腈洗脱,更优选的流动相的洗脱程序依次如下:洗脱0-10min之间,用65%乙腈洗脱;洗脱10-20min之间,用70%乙腈洗脱;洗脱20-60min之间,用75%乙腈洗脱。
在上述分离方法中,南极磷虾油上样至硅胶柱,并使用洗脱液进行洗脱,收集洗脱液,每馏分的体积为层析柱保留体积的1/20~1/40,优选为1/30,同时用薄层层析方法检测所得洗脱液中所含的不同极性的物质,合并经检测具有相同极性馏分的洗脱液,在温度20-40℃,压力为-0.08~-0.1Mpa的条件下旋转蒸发去除溶剂,分别得到馏分Ⅰ和馏分Ⅱ,馏分Ⅰ为黄色油状物,馏分Ⅱ为鲜红色油状物。抗肿瘤活性检测结果显示馏分Ⅱ具有较强的抗肿瘤活性,采用制备高效液相色谱柱进一步分离馏分Ⅱ。
在上述分离方法中,硅胶柱层析分离得到的馏分Ⅱ进一步用反向C18高效制备液相色谱法进行分离,用乙腈和水的混合溶剂为流动相,流动相的流速不进 行特别限定,本领域技术人员可以根据本领域常规技术,选择适当的流动相流速,可以优选10~20mL/min,更优选15mL/min。在紫外检测210nm处的吸光值,根据出峰时间进行分段收集,在温度20-40℃,压力为-0.08~-0.1Mpa的条件下旋转增发回收溶剂,依次得到组分Ⅱ-1至组分Ⅱ-5。抗肿瘤活性检测结果显示组分Ⅱ-2与Ⅱ-4具有较强的抗肿瘤活性。对组分Ⅱ-2与组分Ⅱ-4采用HRESIMS、 1H-NMR、13C-NMR、激光拉曼散射光谱等进行结构鉴定,确定组分Ⅱ-2为全反式EPA,组分Ⅱ-4为全反式DHA。
本发明中,所述的南极磷虾油按如下方法制备得到:南极磷虾冻虾或南极磷虾粉为原料,用混合溶剂(正己烷:乙醇=10:1,v/v)在室温下搅拌2h,将有机溶剂相经旋转蒸发浓缩后即可得到南极磷虾虾油。为了获得更多的游离EPA及DHA,可使用酶解法水解南极磷虾油脂,具体酶解条件为:1.0g南极磷虾油、1.0g去离子水与20mg固定化脂肪酶(Novozym 435)置于15mL离心管中,然后在30℃摇床中于避光条件下反应24小时,反应结束后使用氯仿抽提酶解液,再进行分离纯化。南极磷虾油也可以采用市售的产品。
本发明还提供上述所述的全反式EPA或全反式DHA在制备抗肿瘤药物中的应用。优选地,所述的肿瘤为人乳腺癌、肝细胞癌、早幼粒白血病、慢性粒细胞白血病、组织细胞性淋巴瘤或前列腺癌。
本发明还提供包括上述全反式EPA和药学上可接受的辅料,或包括上述全反式DHA和药学上可接受的辅料的药物组合物。优选地,所述药物组合物为颗粒剂、片剂或胶囊。
本发明具有以下有益效果:
本发明采用硅胶层析偶联制备液相色谱的方法从南极磷虾油中分离得到具有抗肿瘤活性的全反式EPA(E-EPA)或全反式DHA(E-DHA)。常见的深海鱼油中的EPA和DHA是Z型的,E型EPA及DHA作为Z型EPA及DHA的异构体,至今尚未有报道。南极磷虾的E-EPA和E-DHA对多种肿瘤细胞具有优异的杀伤能力,其作用均强于市售鱼油及鲟鱼肝油来源的EPA与DHA,而且对正常肝细胞HL7702无明显生长抑制,具有开发新型抗肿瘤药物的潜力。
附图说明
图1是表示不同极性馏分的薄层层析图;
图2是表示硅胶层析馏分Ⅱ的制备高效液相色谱图;
图3是表示制备组分Ⅱ-2对MCF-7的生长抑制曲线;
图4是表示制备组分Ⅱ-4对MCF-7的生长抑制曲线;
图5是表示组分Ⅱ-2(EPA)的质谱图;
图6是表示组分Ⅱ-4(DHA)的质谱图;
图7是表示组分Ⅱ-2(EPA)的1H-NMR图;
图8是表示组分Ⅱ-4(DHA)的1H-NMR图;
图9是表示组分Ⅱ-2(EPA)的13C-NMR图;
图10是表示组分Ⅱ-4(DHA)的13C-NMR图;
图11是表示南极磷虾与市售鱼油EPA的激光拉曼散射光谱图;
图12是表示南极磷虾与市售鱼油DHA的激光拉曼散射光谱图。
具体实施方式
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学公司购买。
本发明的具体实施方式中涉及如下实验技术与分析方法:
1.细胞培养
人乳腺癌细胞系MCF-7及MDA-MB-231、人肝癌细胞系SMMC-7721、人早幼粒急性白血病细胞系HL60、人慢性粒细胞白血病细胞系K562、人组织细胞性淋巴瘤细胞系U937、人前列腺癌细胞系PC-3及人正常肝组织细胞HL7702均购自中国科学院细胞库,其中MCF-7及MDA-MB-231所使用培养基为DMEM高糖培养基(Hyclone),其余细胞所使用培养基为RPMI-1640培养基(Hyclone),培养过程中均添加10%FBS(Hyclone)及1%青霉素-链霉素混合液(Hyclone)。所有细胞均在25cm2培养瓶中培养。上述细胞于培养瓶中培养两天后,贴壁细胞与悬浮细胞分别进行相应处理:贴壁细胞经PBS缓冲液清洗后加入一定量胰蛋白酶溶液,然后加入相应培养基反复轻轻吹打至细胞分散,使用细胞计数板计算细胞数;悬浮细胞经800r/min离心沉淀后去掉上清,使用PBS缓冲液洗涤两次再用相应培养基重悬,然后使用细胞计数板计数。将上述细胞加入96孔板,控制每个孔的细胞数为3000,每个孔的培养基体积为200μL,将96孔板放入细 胞培养箱孵育24小时。
2.抗肿瘤活性检测
用MTT法或CCK-8试剂盒检测分离纯化的物质对不同肿瘤细胞生长的影响,以确定其抗肿瘤活性。贴壁细胞的检测使用MTT法,悬浮细胞使用CCK-8试剂盒。将待测物质先溶解于DMSO后再进行检测,以含0.5%DMSO的培养基作为对照。先将按照适当的浓度加入待测物质或对照液的96孔板置于细胞培养箱孵育16-18小时,向各孔添加20μL MTT或CCK-8(凯基)试剂,再孵育4小时后于570nm(MTT)/450nm(CCK-8)及630nm下分别检测吸光值。细胞存活率按以下公式计算:
细胞存活率(MTT法,%)=[实验组吸光值(A570-A630)平均值/对照组吸光值(A570-A630)平均值]*100
细胞存活率(CCK-8法,%)=[实验组吸光值(A450-A630)平均值/对照组吸光值(A450-A630)平均值]*100
半数致死浓度IC50的计算采用改良寇氏法公式:
lg(IC50)=Xm-I*(P-(3-Pm-Pn)/4)
其中Xm为lg(最大药物浓度),I为lg(最大药物浓度/次高药物浓度),P为实验组细胞存活率之和,Pm为最大细胞存活率,Pn为最小细胞存活率。
3.南极磷虾油的提取:
首先以南极磷虾冻虾或南极磷虾粉为原料,用混合溶剂(正己烷:乙醇=10:1,v/v)在室温下搅拌2h,提取原料中虾油,将有机溶剂相经旋转蒸发浓缩后即可得到南极磷虾虾油。类似地,用混合溶剂从鲟鱼鱼肝中提取油脂。
实施例1南极磷虾油中各种组分的分离
(1)硅胶柱的准备:将300g活化后的300-400目硅胶湿法装入内径为3.0cm,长为35.0cm的玻璃分离柱中,用正己烷平衡。
(2)取南极磷虾虾油5g,加入至准备好的硅胶柱中进行柱层析分离,依次用洗脱液A(正己烷:乙醚:乙酸=80:20:1.5,v/v/v)与洗脱液B(氯仿:甲醇:水=60:30:5,v/v/v)进行洗脱,每馏分为10mL,经薄层层析检测洗脱液中所含物质的不同极性,如图1所示,图中以南极磷虾油作为对照,且数字i、ii及iii分别对应甘油三酯或极性接近于甘油三酯的物质,油酸或极性接近于油酸的物 质,磷脂类物质。按照薄层层析结果合并具有相同极性的馏分,最后共得到4组馏分,其中馏分Ⅰ与馏分Ⅱ是经洗脱液A洗脱得到的,馏分Ⅲ与馏分Ⅳ是经过洗脱液B洗脱得到的,收集四种馏分的总体积分别为510、420、285及225mL,将各馏分经旋转蒸发浓缩备用,经减压旋蒸浓缩后得到四种馏分的质量分别为2.78、1.12、0.59及0.17g。其中,馏分Ⅰ为黄色油状物质,馏分Ⅱ为鲜红色油状物质,馏分Ⅲ与馏分Ⅳ均为暗红色油状物质。图1的薄层层析条件为:采用硅胶薄层层析板,在距层析板底部1cm处用铅笔轻划一条点样线,将所收集各接收管洗脱液等距点样于点样线上并置于含展开剂的层析缸中进行层析,展开剂为洗脱液A或洗脱液B,图1(a)、1(b)及1(c)所使用展开剂为洗脱液A,1(d)所使用展开剂为洗脱液B,在上述条件下可以达到较优的检测效果。经对肿瘤细胞的抗肿瘤活性检测,馏分Ⅱ对人早幼粒急性白血病细胞系HL60、人组织细胞性淋巴瘤细胞系U937具有生长抑制作用,且对人正常肝细胞HL7702无生长抑制作用,其它三种馏分均对上述细胞无明显作用。
(3)馏分Ⅱ的纯化
将步骤(2)中得到的馏分Ⅱ按体积比1:3用乙腈稀释、混匀,再上样于制备高效液相色谱柱中,其中色谱柱为YMC制备柱(YMC-Pack ODS-A,20×250mm,粒径10μm),每次进样0.6mL,以乙腈-水系统为洗脱液,以15mL/min的速度恒流洗脱,洗脱程序为:0-10分钟,用65%乙腈水溶液洗脱;10-20分钟,用70%乙腈水溶液洗脱;20-60分钟,用75%乙腈洗脱。紫外检测210nm处的吸光值,其谱图如图2所示。根据出峰时间进行分段收集,共得到5种物质,依出峰时间先后标号为Ⅱ-1至Ⅱ-5,用旋转蒸发仪去除溶剂备用。用DMSO稀释至合适浓度后使用MTT法检测各种物质对MCF-7的生长抑制作用,检测结果表明Ⅱ-2与Ⅱ-4对MCF-7存在不同程度的生长抑制作用(如图3、4所示),而Ⅱ-1、Ⅱ-3及Ⅱ-5对MCF-7无生长抑制作用。图3结果显示,组分Ⅱ-2对MCF-7的生长抑制作用随着浓度的增加而提高,在浓度12.5μg/mL时抑制率达到59%。图4结果显示组分Ⅱ-4对MCF-7的生长抑制作用随着浓度的增加而提高,在浓度12.5μg/mL时抑制率达到71%。
(4)组分Ⅱ-2与Ⅱ-4的结构鉴定
将步骤(3)中得到的组分Ⅱ-2与Ⅱ-4经HRESIMS、1H-NMR及13C-NMR进行检测,结果如图5-10。图5-6说明这两种物质的质谱碎片相对分子质量分别 为320.2570及346.2707,推测可能为加NH4+峰,经计算这两种物质实际相对分子质量为302.2246及328.2402,分别与EPA及DHA的相对分子质量数据吻合;两种物质的1H-NMR谱图(图7-8)与文献中EPA及DHA的1H-NMR谱图较吻合,具体结果见表1;两种物质的13C-NMR谱图(图9-10)也与文献中报道数据一致,因此可确定组分Ⅱ-2与Ⅱ-4分别是ω-3多不饱和脂肪酸中的EPA与DHA。
表1.两种有效组分Ⅱ-2和Ⅱ-4的1H-NMR谱图的测定结果
南极磷虾油及市售鱼油中EPA与DHA的激光拉曼散射光谱(图11、12)显示,两种不同来源的EPA和DHA的拉曼光谱在位移1658cm-1、1671cm-1、1265cm-1和1303cm-1四处存在明显差异,前两处位移分别代表Z型碳碳不饱和双键和E型不饱和双键,而后两处位移的比值[ν(1303cm-1)/ν(1265cm-1)]越大,表示样品中Z型碳碳双键数目越多。在南极磷虾油中提取的EPA及DHA的拉曼散射光谱中看不到有明显的E型不饱和双键,因此南极磷虾油中EPA及DHA的Z型不饱和碳碳双键数目是低于拉曼散射光谱检出限,因此可认为该EPA及DHA为全反式EPA及DHA,而市售鱼油EPA和DHA中则同时存在E与Z两种不饱和碳碳双键,Z型要远多于E型。
实施例2南极磷虾油EPA与DHA的抗肿瘤活性检测
南极磷虾油中分离得到的E型EPA与DHA对多种肿瘤细胞的生长都有抑制作用,其IC50值见表2,这些数值均低于对照组标准品EPA及DHA、鲟鱼肝和市售鱼油来源的EPA及DHA的对应IC50值,而且与现在市售的许多抗肿瘤药物相比,南极磷虾EPA与DHA对人正常肝细胞HL7702无明显毒性,因此在 应用上其具有较大的优势,也具有较广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!