一种高效稳定表达抗体的杀伤性细胞及其用途的制作方法
本发明属于细胞生物学和肿瘤学领域,具体涉及一种高效稳定表达抗体的杀伤性细胞及其用途。
背景技术:
癌症现在已成为人类健康的头号杀手,快速的生活节奏、巨大的工作压力、不健康的饮食习惯、糟糕的环境都是癌症发生的帮凶,使得癌症的高发率和年轻化趋势也越来越明显。目前传统治疗手段疗效已到瓶颈,亟需探索一个更加有效的治疗方法,来提高癌症患者的生存率和生存质量。针对恶性肿瘤的免疫治疗近年来发展迅速,取得令人瞩目的临床疗效。2011年,nature及临床肿瘤最顶级杂志jco分别发表相同题目“肿瘤免疫治疗的时代已经来临”的评论文章(nature.2011;480(7378):480;jclinoncol.2011;29(36):4828),肿瘤免疫细胞治疗迎来新一轮的研究高潮,未来有可能在肿瘤治疗中占据相当重要的地位。
“免疫作用”可分为细胞免疫及体液免疫,两者具有截然不同杀灭肿瘤或病毒的方式。细胞免疫是以细胞直接发挥效应来清除异物,它是机体免疫应答的参与者,也是免疫功能的执行者。目前用于临床治疗的效应免疫细胞,即杀伤性免疫细胞,主要包括自然杀伤细胞(naturekiller,nk)、淋巴因子激活的杀伤细胞(lymphokineactivatedkillercell,lak)、细胞因子诱导的杀伤细胞(cytokineactivatedkillercells,cik)、树突状细胞刺激的细胞因子诱导的杀伤细胞(dc-cik)、细胞毒性t淋巴细胞(ctl)、γδt细胞、肿瘤浸润淋巴细胞(tumorinfiltratinglymphocyte,til)、cd3ak细胞(抗cd3单抗的杀伤细胞)等,这些细胞都不表达抗体,它们直接杀灭或通过抗体依赖的细胞介导的细胞毒性细胞效应(antibodydependentcell-mediatedcytotoxicity,adcc)起作用。
体液免疫是由抗体所介导产生作用,人体内的抗体是由b淋巴细胞产生。1997年,第一个用于临床癌症治疗的单抗——抗人cd20(rituximab)获得fda批准。随着抗体技术的发展,至今全球已报道的抗体有10多万种,其中基因工程抗体有1000多种,人源化抗体200多种。截止2016年3月,fda至今已批准50个抗体上市,其中26个用于肿瘤治疗,这些抗体既有作用于肿瘤细胞本身直接发挥作用,也有作用于免疫细胞间接发挥作用。
然而,效应免疫细胞虽然具有一定的抗肿瘤作用,但其临床治疗效果有限;而大分子抗体对实体瘤的穿透力不足,且全身用药有可能引起系统性不良反应。例如,her2单抗具有心脏毒性,而pd1抗体打破机体免疫平衡,可引起自身免疫疾病。而且,由于抗体药物涉及复杂的体外生产与制备工艺,纯度要求高且用量大,导致用药费用高昂。因而,如果在细胞免疫效应细胞保持细胞杀伤毒性的前提下,能由其高效表达具有抗肿瘤活性的抗体,将同时克服细胞免疫治疗作用不足与大分子抗体难以进入实体瘤内部的困难,同时可以降低治疗成本。这些既具有细胞杀伤毒性、又能高水平表达抗体的细胞,在趋化因子作用下,经过细胞变形主动进入肿瘤组织内部,从而在肿瘤组织局部高水平表达抗体,可以避免全身性用药带来的副作用。同时,作用于免疫细胞自身的抗体(如her2抗体herceptin),由于抗体与细胞杀伤毒性免疫细胞双重存在,可产生强烈的adcc效应及cdc效应,高效杀灭肿瘤细胞;而作用于t细胞自身的抗体(如pd1抗体keytruda),可以避免肿瘤微环境对回输的效应性t细胞的抑制作用,使其持续发挥治疗作用。
尽管已经有将外源基因转导入例如nk细胞或t细胞的报导,但目前常用基因转染载体系统对具有细胞杀伤毒性的效应免疫细胞转染率低,或者难以使外源基因在其细胞内高水平地表达。利用腺病毒载体(非整合型)可以介导外源基因在nk细胞或t细胞内较高效的短时表达,但活化的nk细胞或t细胞增殖速度非常快,携带的外源基因表达框在细胞传代中将快速丢失,表达难以持久;利用逆转录病毒或慢病毒可以介导外源基因在nk细胞或t细胞基因组中的整合,理论上可实现稳定表达,但抗体包含轻链与重链,编码序列长、分子量大,导致携带全长抗体表达框的逆转录病毒或慢病毒的包装与制备存在较大困难、难以高效表达抗体,只能用于表达结构简单的单链抗体(缺乏fc段片段,功能不全且半衰期短)。因而在此之前,尚无具有细胞杀伤毒性并且能稳定、高水平地表达含有人fc段的抗体的转基因细胞的报道。
技术实现要素:
本发明第一方面提供一种转基因杀伤性细胞,所述杀伤性细胞的基因组中稳定整合了包含人fc段的抗体的编码序列,或包含嵌合抗原受体及感兴趣单链抗体的编码序列的表达框,且表达框的两端包含转座子的反向末端重复序列。
在一个或多个实施方案中,每百万所述杀伤性细胞48小时内表达的抗体量高于2μg。
在一个或多个实施方案中,所述转座子选自:piggybac、sleepingbeauty、frogprince、tn5和ty;优选地,所述转座子为piggybac。
在一个或多个实施方案中,所述杀伤性细胞选自:细胞因子诱导的杀伤细胞、树突状细胞刺激的细胞因子诱导的杀伤细胞、细胞毒性t淋巴细胞、γδt细胞、自然杀伤细胞、nkt细胞、肿瘤浸润淋巴细胞、淋巴因子激活杀伤细胞、抗cd3单抗的杀伤细胞和基因修饰car-t/car-nk/tcr-t细胞;优选地,所述杀伤性细胞为t细胞、nk细胞或car-t细胞。
在一个或多个实施方案中,所述杀伤性细胞还包含刹车分子。
在一个或多个实施方案中,所述刹车分子为可被已上市抗体药物识别的膜抗原。
在一个或多个实施方案中,所述膜抗原选自cd11a、cd15、cd19、cd20、cd25、cd44、cd47、cd52、egfr、erbb2、erbb3、erbb4、vegfr1、vegfr2、epcam、msln、gpiib/iiia、α4整合素和α4β7整合素;优选地,所述膜抗原为cd20。
在一个或多个实施方案中,所述抗体为抗肿瘤或抗病毒的抗体。
在一个或多个实施方案中,所述抗体选自:免疫检查点抗体、t细胞共刺激信号抗体、抗新生血管生成的抗体、抗肿瘤细胞生长因子受体的抗体、抗肿瘤细胞膜抗原的抗体和抗病毒抗体。
在一个或多个实施方案中,所述抗体针对如下抗原中的一种或多种:pd-1、ctla4、pdl1、pdl2、pdl3、tim3、lag3、cd28、cd137、cd40、cd40l、cd47、cd19、cd20、cea、gd2(又称b4galnt1,β1,4-乙酰基-氨基半乳糖基转移酶1)、fr(flavin还原酶)、psma(前列腺特异性膜抗原)、gp100(pmel前黑素小体蛋白)、ca9(碳酸酐酶ix)、cd171/l1-cam、il-13rα2、mart-1(又称melan-a)、erbb2、ny-eso-1(又称ctag1b,癌/睾丸抗原1b)、mage(黑素瘤相关抗原e1)家族蛋白、bage(b黑素瘤抗原家族)家族蛋白、gage(生长激素释放因子)家族蛋白、afp(α-胎蛋白)、muc1(mucin1,细胞表面相关)、cd22、cd23、cd30、cd33、cd44v7/8、cd70、vegfr1、vegfr2、il-11rα、egp-2、egp-40、fbp、gd3(又称st8sia1,st8α-n-乙酰基-神经酰胺α-2,8-唾液酸转换酶1)、psca(前列腺干细胞抗原)、fsa(又称kiaa1109)、psa(又称klk3,激肽释放酶相关的肽酶3)、hmga2、胎儿型乙酰胆碱受体、ley(又称fut3)、epcam、msln(间皮素)、igfr1、egfr、egfrviii、erbb3、erbb4、ca125(又称muc16,mucin16,细胞表面相关)、ca15-3、ca19-9、ca72-4、ca242、ca50、cyfra21-1、scc(又称serpinb3)、afu(又称fuca1)、ebv-vca、poa(又称vdr,维生素d(1,25-二氢维生素d3)受体)、β2-mg(β-2-微球蛋白)和progrp(grp胃泌素释放肽)、乙肝病毒、艾滋病毒。
在一个或多个实施方案中,所述抗体为pd-1抗体或her2抗体。
在一个或多个实施方案中,所述转基因杀伤性细胞转入了以下核酸构建物a和b,或核酸构建物c:
核酸构建物a:含有转座子5’反向末端重复序列(5’itr)、包含人fc段的抗体的编码序列及控制该核酸序列表达的启动子、polya加尾信号序列和转座子3’反向末端重复序列(3’itr);
核酸构建物b:含有转座子5’反向末端重复序列(5’itr)、编码刹车分子的核酸序列及控制该核酸序列表达的启动子、polya加尾信号序列、转座子3’反向末端重复序列(3’itr)、转座酶编码序列和任选的控制转座酶编码序列表达的启动子;
核酸构建物c:含有转座子5’反向末端重复序列(5’itr),编码任选的刹车分子、嵌合抗原受体(car)和感兴趣单链抗体的抗原结合片段的核酸序列及控制该核酸序列表达的启动子,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子。
在一个或多个实施方案中,采用病毒转导、显微注射、粒子轰击、基因枪转化和电转中的一种或多种方法将所述核酸构建物转入所述细胞中,优选地采用电转。
本发明第二方面提供一种药物组合物,所述药物组合物含有本文所述的转基因杀伤性细胞和药学上可接受的辅料。
本发明第三方面提供本文所述的转基因杀伤性细胞或药物组合物的用途,所述用途选自:
制备用于抑制肿瘤细胞生长的药物、制备用于抑制病毒生长的药物、制备用于治疗肿瘤的药物、制备用于治疗病毒感染性疾病的药物、制备用于治疗细菌感染性疾病的药物和制备用于治疗自身免疫疾病的药物;
其中,所述肿瘤选自:肝癌、肺癌、结肠癌、胰腺癌、胃癌、乳腺癌、鼻咽癌、淋巴瘤、卵巢癌、膀胱癌、前列腺癌和头颈部肿瘤。
附图说明
图1:pd-1抗体的表达框模式图。itr为转座子末端重复序列,hypb是piggybac转座酶。
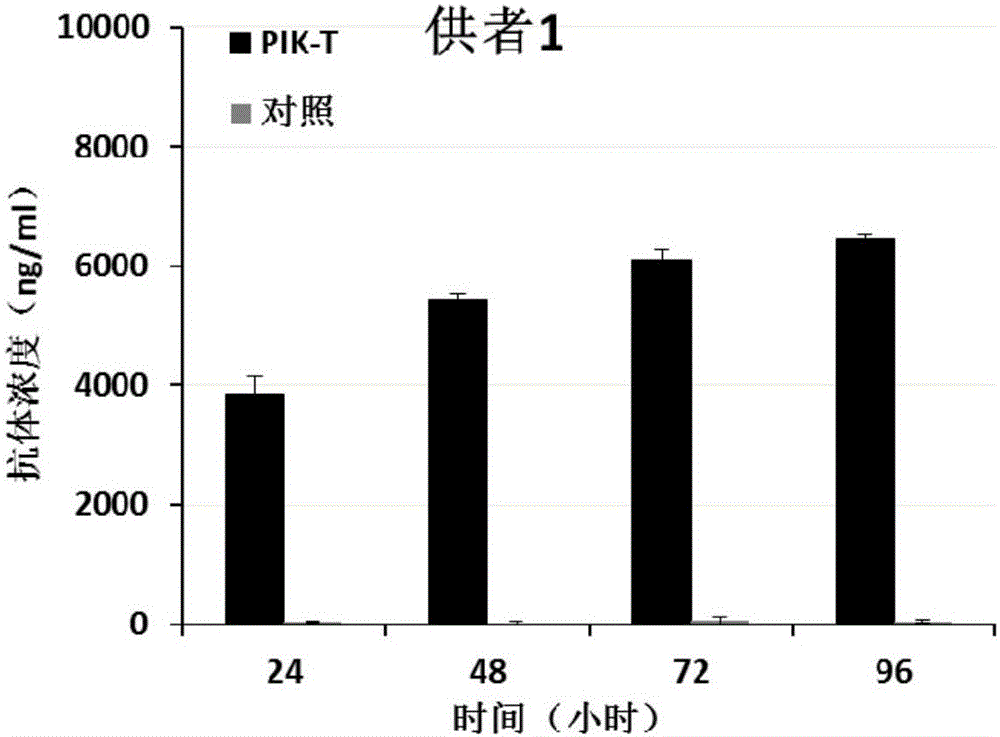
图2a、2b和2c:不同供体来源的pik-t细胞表达pd1抗体水平的elisa检测图。对照为非转基因的同一来源t细胞。
图3:不同供体来源的pik-t细胞表达pd1抗体的蛋白质印迹检测图。
图4:pd1抗体表达框在pik-t细胞基因组中的检测。
图5:pik-t细胞表面pd1分子的流式检测。
图6:pik-t细胞的增殖检测。
图7:pik-t细胞分泌il-2,il-4,il-6,il-10,tnfα和ifn-γ细胞因子的检测。
图8:pik-t细胞在体外对肿瘤细胞的杀伤活性检测。
图9:pik-t细胞对移植瘤的体内抑制作用检测。
图10:pik-t细胞分子刹车系统的功能检测。
图11:her2抗体的表达框模式图。itr为转座子末端重复序列,hypb是piggybac转座酶。
图12a和12b:不同供体来源的pik-nk细胞表达her2抗体水平的elisa检测图。对照为非转基因的同一来源nk细胞。
图13:pik-nk细胞表达her2抗体的蛋白质印迹检测图。
图14:her2抗体表达框在pik-nk细胞基因组中的检测。
图15:pik-nk细胞表面表达抗体分子的流式检测。
图16a、16b、16c和16d:pik-nk细胞在体外对不同肿瘤细胞的杀伤活性检测。
图17:pik-nk细胞对移植瘤的体内抑制作用检测。
图18:pik-nk细胞分子刹车系统的功能检测。
图19:herincar-pd1的表达框模式图。itr为转座子末端重复序列,hypb是piggybac转座酶。hinge为抗体铰链。
图20:herincar-pd1细胞表达pd1抗体水平的elisa检测。对照为herincar细胞。
图21:herincar-pd1细胞表达pd1抗体的蛋白质印迹检测。
图22:herincar-pd1细胞增殖检测。
图23a、23b和23c:herincar-pd1细胞对肿瘤细胞的体外杀伤活性检测。e:t,效靶比。
图24:herincar-pd1细胞的对移植瘤的体内抑制作用检测。control,pbs治疗组;mock-t,未转基因的t细胞。
图25:herincar-pd1细胞在移植瘤内的增殖检测。mock-t为未转基因的t细胞。
图26:herincar-pd1细胞分子刹车系统的功能检测。
图27:herincar-cd28的表达框模式图。itr为转座子末端重复序列,hypb是piggybac转座酶。
图28:herincar-cd28细胞表面表达cd28抗体分子的流式检测。对照为herincar细胞。
图29:herincar-cd28细胞表面cd28分子的流式检测。
图30:herincar-cd28细胞增殖检测。
图31:herincar-cd28细胞对肿瘤细胞的体外杀伤活性检测。e:t,效靶比。
图32:herincar-cd28细胞的对移植瘤的体内抑制作用检测。
图33:herincar-pd1细胞在移植瘤内的增殖检测。
具体实施方式
下面对本发明涉及的部分术语进行解释。
在本发明中,术语“表达框”是指表达一个基因所需的完整元件,包括启动子、基因编码序列和polya加尾信号序列。
术语“编码序列”在文中定义为核酸序列中直接确定其蛋白产物的氨基酸序列的部分。编码序列的边界通常是由紧邻mrna5’端开放读码框上游的核糖体结合位点(对于原核细胞)和紧邻mrna3’端开放读码框下游的转录终止序列确定。编码序列可以包括,但不限于dna、cdna和重组核酸序列。
术语“激活型抗体”指存在时可激活某一特定的免疫反应的抗体。术语“抑制性抗体”指存在时可抑制某一特定免疫反应的抗体。所述激活型抗体或抑制性抗体可以是抗体的全长序列或其功能性片段。在一个或多个实施方案中,所述激活型抗体或抑制性抗体可选自:fab、fab’、f(ab’)2、fv、scfv和scfv-fc。
术语“抗原结合片段”(antigen-bindingfragment,fab)是指位于抗体分子"y"结构两臂末端,由高变区氨基酸序列组成,决定抗体结合抗原的特异性的肽段。
术语“fc”即抗体的可结晶段(fragmentcrystallizable,fc),是指位于抗体分子"y"结构的柄部末端,包含抗体重链恒定区ch2和ch3结构域的肽段,是抗体与效应分子或者细胞相互作用的部位。
术语“抗原表位”,又称抗原决定簇(antigenicdeterminant,ad),指抗原分子中决定抗原特异性的特殊化学基团。一般情况下,一个多肽表位含5~6个氨基酸残基抗原表位,可被特定的抗体所识别。抗原表位的性质、数目和空间构型决定抗原的特异性。而根据抗原表位的氨基酸连续性的不同,可以分为线性表位与空间表位,线性表位是一段序列相邻的氨基酸组成的表位,而空间表位是数个不相邻,但在空间结构上相邻的氨基酸组成的表位。
术语“共刺激分子”是指存在于抗原提呈细胞表面,能与th细胞上的共刺激分子受体结合,产生协同刺激信号的分子。淋巴细胞的增殖不仅需要抗原的结合,还需要接受共刺激分子的信号。共刺激信号传递给t细胞主要是通过表达在抗原呈递细胞表面的共刺激分子cd80,cd86与t细胞表面的cd28分子结合。b细胞接受共刺激信号可以通过一般的病原体成分例如lps,或者通过补体成分,或者通过激活了的抗原特异性的th细胞表面的cd40l。
术语“接头”或铰链是连接不同蛋白或多肽之间的多肽片段,其目的是使所连接的蛋白或多肽保持各自的空间构象,以维持蛋白或多肽的功能或活性。
术语“特异性结合”是指抗体或者抗原结合片段与其所针对的抗原之间的反应。在某些实施方式中,特异性结合某抗原的抗体(或对某抗原具有特异性的抗体)是指,抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的亲和力(kd)结合该抗原。“特异性识别”具有类似的含义。
术语“药学上可接受的辅料”是指在药理学和/或生理学上与受试者和活性成分相容的载体和/或赋形剂,其是本领域公知的(参见例如remington'spharmaceuticalsciences,gennaroar编,第19版,pennsylvania:mackpublishingcompany,1995),并且包括但不限于:ph调节剂,表面活性剂,佐剂,离子强度增强剂。例如,ph调节剂包括但不限于磷酸盐缓冲液;表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80;离子强度增强剂包括但不限于氯化钠。
术语“有效量”是指可在受试者中实现治疗、预防、减轻和/或缓解本发明所述疾病或病症的剂量。
术语“疾病和/或病症”是指所述受试者的一种身体状态,该身体状态与本发明所述疾病和/或病症有关。
术语“受试者”可以指患者或者其它接受本发明药物组合物以治疗、预防、减轻和/或缓解本发明所述疾病或病症的动物,特别是哺乳动物,例如人、狗、猴、牛、马等。
本文提供一类核酸构建物(本文也称为“核酸构建物a”),该类核酸构建物含有转座子5’反向末端重复序列(5’itr)、感兴趣的核酸序列及任选的控制该感兴趣的核酸序列表达的启动子、polya加尾信号序列和转座子3’反向末端重复序列(3’itr)。
本文还提供另一类核酸构建物(本文也称为“核酸构建物b”),该类核酸构建物含有转座子5’反向末端重复序列(5’itr)、任选的编码刹车分子的核酸序列及任选的控制该核酸序列表达的启动子、polya加尾信号序列、转座子3’反向末端重复序列(3’itr)、转座酶编码序列和任选的控制转座酶编码序列表达的启动子。
本文还提供另外一类核酸构建物(本文也称为“核酸构建物c”),该类核酸构建物含有转座子5’反向末端重复序列(5’itr),编码任选的刹车分子、嵌合抗原受体(car)和抑制性抗体或激活型抗体(如感兴趣单链抗体)的核酸序列及控制该核酸序列表达的启动子,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子。
本文中,“感兴趣的核酸序列”可以是编码本领域周知的各种功能蛋白的核酸序列。这类功能蛋白包括各类抗体,尤其是抗体的恒定区段和/或可变区,包括但不限于重链恒定区段、轻链恒定区段、重链可变区和轻链可变区。在某些实施方案中,所述感兴趣的核酸序列编码抗体的fc段的全长序列或其功能性片段。在某些实施方案中,所述感兴趣的核酸序列编码抗体的重链恒定区段(如fc)和轻链。在某些实施方案中,所述感兴趣的核酸序列编码抗体的重链全长序列和轻链全长序列。在某些实施方案中,编码重链区段和轻链区段的核酸序列可通过本领域常用的接头序列(如furin2a的编码序列)连接。“区段”在本文中指抗体的基础结构单元,例如抗体的ch1、ch2、ch3、cl、vl、vh等部分。
感兴趣的抗体可以是人抗体,包括人鼠嵌合抗体和人源化抗体。感兴趣的抗体可选自:免疫检查点抗体、t细胞共刺激信号抗体、抗新生血管生成的抗体、抗肿瘤细胞生长因子受体的抗体以及抗肿瘤细胞膜抗原的抗体。在某些实施方案中,感兴趣的抗体可以是针对如下抗原中的一种或多种的抗体:pd-1、ctla4、pdl1、pdl2、pdl3、tim3、lag3、cd28、cd137、cd40、cd40l、cd47、cd19、cd20、cea、gd2(又称b4galnt1,β1,4-乙酰基-氨基半乳糖基转移酶1)、fr(flavin还原酶)、psma(前列腺特异性膜抗原)、gp100(pmel前黑素小体蛋白)、ca9(碳酸酐酶ix)、cd171/l1-cam、il-13rα2、mart-1(又称melan-a)、erbb2、ny-eso-1(又称ctag1b,癌/睾丸抗原1b)、mage(黑素瘤相关抗原e1)家族蛋白、bage(b黑素瘤抗原家族)家族蛋白、gage(生长激素释放因子)家族蛋白、afp(α-胎蛋白)、muc1(mucin1,细胞表面相关)、cd22、cd23、cd30、cd33、cd44v7/8、cd70、vegfr1、vegfr2、il-11rα、egp-2、egp-40、fbp、gd3(又称st8sia1,st8α-n-乙酰基-神经酰胺α-2,8-唾液酸转换酶1)、psca(前列腺干细胞抗原)、fsa(又称kiaa1109)、psa(又称klk3,激肽释放酶相关的肽酶3)、hmga2、胎儿型乙酰胆碱受体、ley(又称fut3)、epcam、msln(间皮素)、igfr1、egfr、egfrviii、erbb3、erbb4、ca125(又称muc16,mucin16,细胞表面相关)、ca15-3、ca19-9、ca72-4、ca242、ca50、cyfra21-1、scc(又称serpinb3)、afu(又称fuca1)、ebv-vca、poa(又称vdr,维生素d(1,25-二氢维生素d3)受体)、β2-mg(β-2-微球蛋白)和progrp(grp胃泌素释放肽)、乙肝病毒、艾滋病毒。在某些实施方案中,抗体为作用于t细胞自身的抗体,使得t细胞表达该抗体后,能保护t细胞自身免受肿瘤微环境的抑制,在肿瘤局部表达抗体,减低毒副作用。在其它实施方案中,抗体为作用于肿瘤细胞的抗体,在杀伤性细胞如nk细胞中表达后,通过该抗体的引导作用,使该杀伤性细胞协同发挥adcc效应。在某些实施方案中,抗体为分泌型抗体。在其它实施方案中,抗体为膜锚定型抗体。在一个或多个实施方案中,所述抗体为pd-1抗体或her2抗体。
术语“单链抗体”(scfv)是指由抗体轻链可变区(vl区)氨基酸序列和重链可变区(vh区)氨基酸序列经铰链连接而成,具有结合抗原能力的抗体片段。在某些实施方案中,感兴趣单链抗体(scfv)来自上述感兴趣的抗体,含有各感兴趣抗体各自的重链可变区和轻链可变区,或由重链可变区和轻链可变区以及任选的接头组成。重链可变区和轻链可变区之间可通过熟知的接头连接,例如含g和s的接头。接头长度通常为15~20个氨基酸。在某些实施方案中,接头为(gggs)n,n为1-5的整数。应理解的是,本文的核酸构建物可编码两种单链抗体,一种单链抗体存在于所示的car之中,另一种单链抗体为与car相连的单链抗体。这两种单链抗体可相同,也可不同,优选的是,两种单链抗体执行不同的抗体功能。
在某些实施方案中,本发明核酸构建物c中,编码抑制性抗体(如感兴趣单链抗体)的核酸序列之后还可包括来自免疫球蛋白的铰链区和fc区的编码序列。可使用本领域周知的各种类型的免疫球蛋白,但在某些优选实施方案中,该免疫球蛋白是人igg4。
在某些实施方案中,本发明核酸构建物c中,编码激活型抗体(如感兴趣单链抗体)的核酸序列之后可包括来自该抗体所针对的抗原的胞外铰链区和跨膜区序列。例如,当使用抗cd28抗体时,可使用衍生自该抗体的scfv,并在该scfv之后连接上cd28胞外铰链区和跨膜区序列。
在某些实施方案中,所述抑制性抗体为免疫检查点抑制抗体。在某些实施方案中,所述抑制性抗体针对如下抗原中的一种或多种:pd-1、ctla4、pdl1、pdl2、pdl3、tim3、lag3、cd47、btla、tigit、cd160、lair1、b7-h1、b7-1、vsir和cd244;优选地,所述抑制性抗体为抗pd-1抗体(如scfv-fc)。在某些实施方案中,所述抑制性抗体为scfv-fc抗体。
在某些实施方案中,所述激活型抗体是针对免疫共刺激分子及其受体的激活型抗体。在某些实施方案中,所述激活型抗体针对如下抗原中的一种或多种:cd28、cd137、cd134、cd40、cd40l、icos、hvem、cd2、cd27、cd30、gitr、light、dr3、slam、cd226。优选地,所述激活型抗体为抗cd28抗体(如scfv)。在某些实施方案中,所述抑制性抗体为单链抗体。
本文中,“pd1”是指程序性死亡受体1,它在ncbigenebank的官方名称为pdcd1,id号为5133,其cdna序列/蛋白序列为nm_005018.2/np_005009.2。
“erbb2”是指细胞生长因子受体2,又称her2,它在ncbigenebank的官方名称为erbb2,id号为2064,它有5个异构体,cdna序列/蛋白序列为nm_004448.3/np_004439.2,nm_001005862.2/np_001005862.1,nm_001289936.1/np_001276865.1,nm_001289937.1/np_001276866.1,nm_001289938.1/np_001276867.1。
“cd20”是指人白细胞分化抗原20,它在ncbigenebank的官方名称为ms4a1,id号为931,有2个异构体(cdna序列/蛋白序列),分别为nm_021950.3/np_068769.2,nm_152866.2/np_690605.1。当提及cd20的氨基酸序列时,其包括,cd20蛋白的全长或者具有cd20功能的cd20的片段;还包括所述全长或片段的融合蛋白。并且,本领域技术人员理解,在cd20的氨基酸序列中,可天然产生或人工引入突变或变异(包括但不限于置换,缺失和/或添加),而不影响其生物学功能。并且,当描述cd20的蛋白序列片段时,还包括其天然或人工变体中的相应序列片段。
“cd28”是指人白细胞分化抗原28,它在ncbigenebank的官方名称为cd28,id号为940,有3个异构体(cdna序列/蛋白序列),分别为nm_006139.3/np_006130.1,nm_001243077.1/np_001230006.1,nm_001243078.1/np_001230007.1。
“嵌合抗原受体”(car)是人工改造受体,能够将识别肿瘤细胞表面抗原的特异性分子(如抗体)锚定在免疫细胞(如t细胞)上,使免疫细胞识别肿瘤抗原或病毒抗原和杀死肿瘤细胞或病毒感染的细胞。适用于本文的嵌合抗原受体可以是本领域周知的各种car。在某些实施方案中,所述嵌合抗原受体针对如下抗原中的一种或多种:cd19、cd20、cea、gd2(又称b4galnt1,β1,4-乙酰基-氨基半乳糖基转移酶1)、fr(flavin还原酶)、psma(前列腺特异性膜抗原)、pmel前黑素小体蛋白)、ca9(碳酸酐酶ix)、cd171/l1-cam、il-13rα2、mart-1(又称粘蛋白-a)、erbb2、ny-eso-1(又称ctag1b,癌/睾丸抗原1b)、mage(黑素瘤相关抗原e1)家族蛋白、bage(b黑素瘤抗原家族)家族蛋白、gage(生长激素释放因子)家族蛋白、afp(α-胎蛋白)、muc1(mucin1,细胞表面相关)、cd22、cd23、cd30、cd33、cd44v7/8、cd70、vegfr1、vegfr2、il-11rα、egp-2、egp-40、fbp、gd3(又称st8sia1,st8α-n-乙酰基-神经酰胺α-2,8-唾液酸转换酶1)、psca(前列腺干细胞抗原)、fsa(又称kiaa1109)、psa(又称klk3,激肽释放酶相关的肽酶3)、hmga2、胎儿型乙酰胆碱受体、ley(又称fut3)、epcam、msln(间皮素)、igfr1、egfr、egfrviii、erbb3、erbb4、ca125(又称muc16,mucin16,细胞表面相关)、ca15-3、ca19-9、ca72-4、ca242、ca50、cyfra21-1、scc(又称serpinb3)、afu(又称fuca1)、ebv-vca、poa(又称vdr,维生素d(1,25-二氢维生素d3)受体)、β2-mg(β-2-微球蛋白)和progrp(grp胃泌素释放肽)。优选地,所述car为针对egfr家族的嵌合抗原受体。
在某些实施方案中,本文使用来自cn201510812654.9的herincar(本文将该申请的全部内容以引用的方式纳入本文)。
在某些实施方案中,所述结合肿瘤细胞膜抗原的多肽为天然多肽,是人类her2基因第8个内含子herin编码的氨基酸序列herin;优选地,其氨基酸序列如cn201510812654.9的seqidno:5所示。
在某些实施方案中,本发明car信号肽的氨基酸序列如cn201510812654.9的seqidno:3所示。
在某些实施方案中,本发明car的铰链区选自cd8的胞外铰链区、cd28的胞外铰链区和cd4的胞外铰链区的任意一种或多种;优选地为cd8的胞外铰链区。在某些实施方案中,所述cd8的胞外铰链区如cn201510812654.9的seqidno:7所示。
在某些实施方案中,本发明car的跨膜区选自cd8的跨膜区、cd28的跨膜区和cd4的跨膜区的任意一种或多种;优选地,为cd8跨膜区;优选地,所述cd8跨膜区的氨基酸序列如cn201510812654.9的seqidno:8所示。
在某些实施方案中,本发明car的胞内信号区可选自cd28、cd134/ox40、cd137/4-1bb、lck、icos、dap10、cd3ζ和fcεriγ中的任意一种或多种的胞内信号区,优选为4-1bb胞内信号区和cd3ζ胞内信号区,或者cd28胞内信号区和cd3ζ胞内信号区;优选地,所述4-1bb胞内信号区和cd3ζ胞内信号区的氨基酸序列分别如cn201510812654.9的seqidno:9和seqidno:10所示;优选地,所述cd28胞内信号区和cd3ζ胞内信号区的氨基酸序列分别如cn201510812654.9的seqidno:11和seqidno:10所示。
在某些实施方案中,所述抗原表位与结合肿瘤细胞膜抗原的多肽直接相连或者通过蛋白接头相连。通常,所述接头为至少2个甘氨酸,例如2、3、4、5、6、7、8、9或10个甘氨酸。
在某些实施方案中,本发明的嵌合抗原受体由信号肽、cd20抗原表位、人类her2基因第8个内含子herin编码的氨基酸序列herin、cd20抗原表位、cd8铰链区、cd8跨膜区、4-1bb共刺激肽段依次构成。优选地,其氨基酸序列如cn201510812654.9的seqidno:1所示。
可根据所选的感兴趣核酸序列选择相应的启动子序列。这类启动子的例子包括但不限于ef1α启动子。如cn201510021408.1所述(本文将其全部内容以引用的方式纳入本文),启动子上游还可包括增强子,如mcmv增强子、hcmv增强子和cd3e增强子中的一个、任意两个或全部三个。
因此,在某些实施方案中,本文使用cn201510021408.1所公布的各种启动子序列,包括但不限于该申请seqidno:1所示的含mcmv增强子、hcmv增强子和ef1α启动子的ccef启动子;seqidno:2所示的含cd3e增强子和ef1α启动子的tef启动子;seqidno:3所示的含cd3e增强子、mcmv增强子、hcmv增强子和ef1α启动子的tcef启动子;seqidno:4所示的含mcmv增强子、hcmv增强子和含内含子的ef1α启动子的ccefi启动子;seqidno:5所示的含cd3e增强子和含内含子的ef1α启动子的tefi启动子;以及seqidno:5所示的含cd3e增强子、mcmv增强子、hcmv增强子和含内含子的ef1α启动子的tcefi启动子。
本文中,转座酶可以是来自piggybac、sleepingbeauty、frogprince、tn5或ty转座系统的转座酶。当使用来自不同转座系统的转座酶时,本发明核酸构建物中的5’itr和3’itr的序列也相应改变为与该转座系统适配的序列,这可由本领域技术人员容易地确定。
在某些实施方案中,转座酶是来自piggybac转座系统的转座酶。因此,在这些实施方案中,转座子5’反向末端重复序列和3’反向末端重复序列分别为piggybac的转座子5’反向末端重复序列和3’反向末端重复序列。在某些实施方案中,转座子5’反向末端重复序列如cn201510638974.7(本文将其内容以引用的方式纳入本文)seqidno:1所示。在某些实施方案中,转座子3’反向末端重复序列如cn201510638974.7seqidno:4所示。在某些实施方案中,piggybac转座酶为含c-myc核定位信号编码序列的转座酶。在某些实施方案中,piggybac转座酶的编码序列如cn201510638974.7seqidno:5所示。
转座酶编码序列的启动子可以是本领域已知的用于控制转座酶编码序列表达的各种启动子。在某些实施方案中,使用cmv启动子控制转座酶编码序列的表达。cmv启动子的序列可如cn201510638974.7seqidno:6所示。
可使用本领域周知的polya加尾信号序列。在某些实施方案中,所述polya来自sv40。在某些实施方式中,可使用cn201510638974.7seqidno:3所示的序列。
本文所用“刹车分子”指可被已上市抗体药物识别的膜抗原。通过加入识别该“刹车分子”的抗体药物,携带该“刹车分子”的细胞能被快速清除,从而提高治疗安全性。合适的刹车分子(膜抗原)可选自:cd11a、cd15、cd19、cd20、cd25、cd44、cd47、cd52、egfr、erbb2、erbb3、erbb4、vegfr1、vegfr2、epcam、msln(间皮素)、gpiib/iiia、α4整合素和α4β7整合素。在某些实施方案中,膜抗原为cd20。在某些实施方案中,可使用所述膜抗原的线性表位或空间表位。
可针对所选膜抗原选择合适的启动子,用以控制膜抗原的表达。在某些实施方案中,启动子是ef1α启动子。在某些实施方案中,ef1α启动子的序列如cn201510638974.7seqidno:8所示。
在某些实施方案中,本文的核酸构建物a含有依次连接的转座子5’反向末端重复序列(5’itr)、控制感兴趣的核酸序列表达的启动子、感兴趣的核酸序列、polya加尾信号序列和转座子3’反向末端重复序列(3’itr)。
在某些实施方案中,本文的核酸构建物b含有依次连接的转座子5’反向末端重复序列(5’itr)、控制编码刹车分子的核酸序列表达的启动子、编码刹车分子的核酸序列、polya加尾信号序列、转座子3’反向末端重复序列(3’itr)、转座酶编码序列以及控制该转座酶编码序列表达的启动子。
在某些实施方案中,本文的“核酸构建物c”含有依次连接的转座子5’反向末端重复序列(5’itr),控制编码刹车分子、嵌合抗原受体(car)和抑制性抗体或激活型抗体(如感兴趣单链抗体)的核酸序列表达的启动子,编码刹车分子、嵌合抗原受体(car)和抑制性抗体或激活型抗体(如感兴趣单链抗体)的核酸序列,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子。
在某些实施方案中,本文的核酸构建物c含有依次连接的转座子5’反向末端重复序列(5’itr),ef1α启动子,刹车分子(cd20)的编码序列,car的编码序列,抗pd1单链抗体的编码序列,免疫球蛋白铰链区和fc的编码序列,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子(cmv)。
在某些实施方案中,本文的核酸构建物c含有依次连接的转座子5’反向末端重复序列(5’itr),ef1α启动子,刹车分子(cd20)的编码序列,car的编码序列,抗pd1单链抗体的编码序列,igg4铰链区的编码序列,igg4fc的编码序列,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子(cmv)。
在某些实施方案中,本文的核酸构建物c含有依次连接的转座子5’反向末端重复序列(5’itr),控制编码刹车分子、嵌合抗原受体(car)、感兴趣单链抗体、抗体的铰链区和跨膜区的核酸序列表达的启动子,编码刹车分子、嵌合抗原受体(car)、激活型单链抗体(如感兴趣单链抗体)、该激活型抗体所针对的抗原的铰链区和跨膜区的核酸序列,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子。
在某些实施方案中,本文的核酸构建物c含有依次连接的转座子5’反向末端重复序列(5’itr),ef1α启动子,刹车分子(cd20),car,抗cd28单链抗体,cd28的铰链区和跨膜区,polya加尾信号序列,转座子3’反向末端重复序列(3’itr),转座酶编码序列和控制转座酶编码序列表达的启动子(cmv)。
在某些实施方案中,所述核酸构建物a含有seqidno:3或7所示的核酸序列。在某些实施方案中,所述核酸构建物b含有seqidno:4所示的核酸序列。在某些实施方案中,所述核酸构建物c含有seqidno:11或14所示的核酸序列。
本文的核酸构建物a、b和c各自可以是种重组表达载体(重组表达载体a、b和c),用于表达感兴趣的核酸序列和所述任选的编码刹车分子的核酸序列。优选的是,表达载体是转座子载体。在某些实施方案中,载体为选自如下转座子载体中的一种或多种:piggybac、sleepingbeauty、frogprince、tn5和ty。除核酸构建物a、b和c所含的核酸序列外,表达载体中通常还含有载体通常所含的其它元件,例如多克隆位点、抗性基因、复制起始位点等。应理解,通常,本发明的核酸构建物a/重组表达载体a不含有转座酶的编码序列。
在某些实施方案中,所述重组表达载体采用puc18、puc19、pmd18-t、pmd19-t、pgm-t载体、puc57、pmax或pdc315系列载体作为骨架。在其它实施方案中,所述重组表达载体采用pcdna3系列载体、pcdna4系列载体、pcdna5系列载体、pcdna6系列载体、prl系列载体、puc57载体、pmax载体或pdc315系列载体作为骨架。在某些实施方案中,本发明使用cn201510638974.7构建的psn载体,其载体结构如该申请图1所示。
可将本发明的核酸构建物a/重组表达载体a和核酸构建物b/重组表达载体b转入感兴趣的细胞中,或者将核酸构建物c/重组表达载体c。转入的方法为本领域常规的方法,包括但不限于:病毒转导、显微注射、粒子轰击、基因枪转化和电转等。在某些实施方案中,采用电转将所述核酸构建物或重组表达载体。
感兴趣的细胞可以是本领域周知的各种功能细胞,例如各种杀伤性细胞,包括但不限于细胞因子诱导的杀伤细胞(cik)、树突状细胞刺激的细胞因子诱导的杀伤细胞(dc-cik)、细胞毒性t淋巴细胞(ctl)、γδt细胞、自然杀伤细胞(nk)、肿瘤浸润淋巴细胞(til)、淋巴因子激活杀伤细胞(lak)、cd3ak细胞(抗cd3单抗的杀伤细胞)和car-t/tcr-t细胞。在某些实施方案中,所述杀伤性细胞为t细胞或nk细胞。
示例性的nk细胞包括但不限于原代nk细胞、nk细胞株(如nk92)和nkt细胞。在某些实施方案中,所述nk细胞为原代nk细胞。示例性的t细胞包括但不限于外周血t淋巴细胞、细胞毒杀伤t细胞(ctl)、辅助t细胞、抑制/调节性t细胞、γδt细胞以及细胞因子诱导的杀伤细胞(cik)、肿瘤浸润淋巴细胞(til)等混合细胞群体的t细胞。在某些实施方案中,所述t细胞为外周血t淋巴细胞与源自til的t细胞。
由于核酸构建物a/重组表达载体a含有转座所需的itr元件但不含有转座酶,而核酸构建物b/重组表达载体b含有外源基因整合所需的转座酶,因此,只有同时转染了核酸构建物a/重组表达载体a和核酸构建物b/重组表达载体b的细胞中才能实现含感兴趣核酸序列的表达框整合。更进一步地,核酸构建物a或重组表达载体a中转座子5’反向末端重复序列和转座子3’反向末端重复序列之间的核酸序列,包括5’和3’反向末端重复序列本身,都整合到细胞的基因组中。当核酸构建物b/重组表达载体b含有编码刹车分子的核酸序列时,细胞将进一步表达刹车分子。同样地,核酸构建物b或重组表达载体b中转座子5’反向末端重复序列和转座子3’反向末端重复序列之间的核酸序列,包括5’和3’反向末端重复序列本身,也都整合到细胞的基因组中。
另一方面,当将核酸构建物c/重组表达载体c转染感兴趣的杀伤性细胞时,由于其含有转座所需的itr元件和转座酶,因此该核酸构建物或重组表达载体所含的转座子5’反向末端重复序列和转座子3’反向末端重复序列之间的核酸序列(包括5’和3’反向末端重复序列本身)被整合到感兴趣细胞的基因组中。当核酸构建物c/重组表达载体c含有编码刹车分子的核酸序列时,细胞将进一步表达刹车分子。
因此,本文还提供一类杀伤性细胞,所述杀伤性细胞的基因组中稳定整合了包含所述感兴趣的核酸序列的表达框。更进一步地,所述杀伤性细胞的基因组中稳定整合了依次连接的转座子5’反向末端重复序列(5’itr)、控制感兴趣的核酸序列表达的启动子、感兴趣的核酸序列、polya加尾信号序列和转座子3’反向末端重复序列(3’itr)。在优选的实施方案中,所述杀伤性细胞的基因组中还进一步整合有依次连接的转座子5’反向末端重复序列(5’itr)、控制编码刹车分子的核酸序列表达的启动子、编码刹车分子的核酸序列、polya加尾信号序列、以及转座子3’反向末端重复序列(3’itr)。
在其它实施方案中,所述杀伤性细胞的基因组中稳定整合了包含编码car及抑制性抗体或激活型抗体(如感兴趣单链抗体)的核酸序列的表达框。更进一步地,所述杀伤性细胞的基因组中稳定整合了依次连接的转座子5’反向末端重复序列(5’itr),控制编码刹车分子、嵌合抗原受体(car)和抑制性抗体或激活型抗体(如感兴趣单链抗体)的核酸序列表达的启动子,编码刹车分子、嵌合抗原受体(car)和抑制性抗体或激活型抗体(如感兴趣单链抗体)的核酸序列,polya加尾信号序列,以及转座子3’反向末端重复序列(3’itr)。
在某些实施方案中,本文提供一类转基因nk细胞,所述转基因nk细胞的基因组中稳定整合了包含所述感兴趣的核酸序列的表达框。更进一步地,所述nk细胞的基因组中稳定整合了依次连接的转座子5’反向末端重复序列(5’itr)、控制感兴趣的核酸序列表达的启动子、感兴趣的核酸序列、polya加尾信号序列和转座子3’反向末端重复序列(3’itr)。在优选的实施方案中,所述转基因nk细胞的基因组中还进一步整合有依次连接的转座子5’反向末端重复序列(5’itr)、控制编码刹车分子的核酸序列表达的启动子、编码刹车分子的核酸序列、polya加尾信号序列、以及转座子3’反向末端重复序列(3’itr)。
在某些实施方案中,本文的转基因nk细胞稳定表达抗体fc段的全长序列或其功能性片段。在某些实施方案中,本文的转基因nk细胞稳定表达抗体的重链恒定区段(如fc)和轻链。在某些实施方案中,本文的转基因nk细胞稳定表达抗体的重链和轻链。在某些实施方案中,本文的转基因nk细胞转入了本文所述的核酸构建物a/重组表达载体a和核酸构建物b/重组表达载体b。在其它实施方案中,本文的每百万细胞转基因nk细胞48小时内表达的抗体量高于2μg。
在某些实施方案中,本文提供一类转基因t细胞,所述转基因t细胞的基因组中稳定整合了包含所述感兴趣的核酸序列的表达框。更进一步地,所述t细胞的基因组中稳定整合了依次连接的转座子5’反向末端重复序列(5’itr)、控制感兴趣的核酸序列表达的启动子、感兴趣的核酸序列、polya加尾信号序列和转座子3’反向末端重复序列(3’itr)。在优选的实施方案中,所述转基因t细胞的基因组中还进一步整合有依次连接的转座子5’反向末端重复序列(5’itr)、控制编码刹车分子的核酸序列表达的启动子、编码刹车分子的核酸序列、polya加尾信号序列、以及转座子3’反向末端重复序列(3’itr)。
在某些实施方案中,本文的转基因t细胞稳定表达抗体fc段的全长序列或其功能性片段。在某些实施方案中,本文的转基因t细胞稳定表达抗体的重链恒定区段(如fc)和轻链。在某些实施方案中,本文的转基因t细胞稳定表达抗体的重链和轻链。在某些实施方案中,本文的转基因t细胞转入了本文所述的核酸构建物a/重组表达载体a和核酸构建物b/重组表达载体b。在其它实施方案中,每百万本文的转基因t细胞48小时内表达的抗体量高于2μg。
在某些实施方案中,本文所述的杀伤性细胞为car-t细胞,其表达抑制性抗体。所述抗体可以为分泌型抗体或膜锚定型,优选为分泌型抗体。该抗体可以是作用于t细胞自身的免疫检查点抑制抗体。该抗体在car-t细胞中表达后,保护该细胞自身不受肿瘤微环境的抑制,且能激活残留的肿瘤特异性t细胞。
在其它实施方案中,所述car-t细胞表达激活型抗体。所述抗体可以为分泌型抗体或膜锚定型,优选为膜锚定型。该抗体可以是作用于t细胞自身的免疫共刺激分子激活型抗体。在car-t细胞表达该抗体后,可增强集群效应。
在某些实施方案中,本文的杀伤性细胞稳定表达抗体fc段的全长序列或其功能性片段,或稳定表达抗体的重链恒定区段(如fc)或全长序列和轻链全长序列,或稳定表达感兴趣的car及感兴趣的scfv。在某些实施方案中,本文的杀伤性细胞转入了本文所述的核酸构建物a/重组表达载体a和核酸构建物b/重组表达载体b,或核酸构建物c/重组表达载体c。在其它实施方案中,每百万本文的杀伤性细胞48小时内表达的抗体量高于2μg。
本文的杀伤性细胞具有细胞免疫与体液免疫双重功能。本文将其命名为多能杀伤细胞(pluripotentimmunekillercell,简称为pik),如多能杀伤t细胞(pluripotentimmunekillertcell,简称为pik-t),多能杀伤nk细胞(pluripotentnaturekillercell,简称为pik-nk)。这类细胞一方面能发挥抗肿瘤细胞免疫(主要由杀伤性细胞介导),另一方面则发挥体液免疫(主要由抗体介导),能够有效地抑制肿瘤、病毒和细菌的增殖。同时,当存在刹车分子时,本文的杀伤性细胞又能快速的被上市的识别该刹车分子的抗体药物清除,提高了治疗的安全性。
根据所表达的抗体的生物学功能,本文的杀伤性细胞可具有不同的生物学活性,包括但不限于抑制肿瘤、抑制病毒、抑制细菌等。因此,本文的杀伤性细胞可用于抑制肿瘤细胞的生长、抑制病毒的生长、治疗肿瘤、治疗病毒感染性疾病、治疗细菌感染性疾病、以及治疗自身免疫疾病。肿瘤包括但不限于肝癌、肺癌、结肠癌、胰腺癌、胃癌、乳腺癌、鼻咽癌、淋巴瘤、卵巢癌、膀胱癌、前列腺癌、头颈部肿瘤。
因此,本文也提供一种药物组合物,该药物组合物含有本文杀伤性细胞和药学上可接受的载体或赋形剂。本文还提供本文所述的杀伤性细胞在制备用于抑制肿瘤细胞生长的药物、制备用于抑制病毒生长的药物、制备用于治疗肿瘤的药物、制备用于治疗病毒感染性疾病的药物、制备用于治疗细菌感染性疾病的药物、或制备用于治疗自身免疫疾病的药物中的用途。
本发明还提供一种转染杀伤性细胞(尤其是t细胞和nk细胞)的方法,所述方法包括使用两种重组表达载体共转染所述杀伤性细胞;其中,一种重组表达载体含有感兴趣核酸序列的表达框,在该表达框的两端包含转座子的反向末端重复序列,且该重组表达载体不含有转座酶的编码序列;另一种重组表达载体含有任选的刹车分子的表达框,在在该表达框的两端包含转座子的反向末端重复序列,且该重组表达载体含有转座酶的编码序列。在一个或多个实施方案中,所述两种重组表达载体分别为本文所述的重组表达载体a和b。转染的方法为本文周知的方法,包括但不限于病毒转导、显微注射、粒子轰击、基因枪转化和电转中的一种或多种。转染时,两种重组表达载体的用量可根据实际情况调整,通常不含转座酶编码序列的重组表达载体与含转座酶编码序列的表达载体的用量配比可在1~5:1的范围之内。
因此,本发明还提供了一种试剂盒,所述试剂盒含有两种重组表达载体:一种重组表达载体含有感兴趣核酸序列的表达框,在该表达框的两端包含转座子的反向末端重复序列,且该重组表达载体不含有转座酶的编码序列;另一种重组表达载体含有任选的刹车分子的表达框,在在该表达框的两端包含转座子的反向末端重复序列,且该重组表达载体含有转座酶的编码序列。在一个或多个实施方案中,所述两种重组表达载体分别为本文所述的重组表达载体a和b。试剂盒还可含有适用于将所述重组表达载体转染入细胞中的各种试剂,以及任选的指导本领域技术人员将所述重组表达载体转染入细胞的说明书。试剂盒中,两种重组表达载体可独立包装,也可以混合物的形式包装在同一容器中。
因此,在某些实施方案中,本发明也涉及一种重组表达载体的组合物,该组合物至少含有两种重组表达载体:一种重组表达载体含有感兴趣核酸序列的表达框,在该表达框的两端包含转座子的反向末端重复序列,且该重组表达载体不含有转座酶的编码序列;另一种重组表达载体含有任选的刹车分子的表达框,在在该表达框的两端包含转座子的反向末端重复序列,且该重组表达载体含有转座酶的编码序列。在一个或多个实施方案中,所述两种重组表达载体分别为本文所述的重组表达载体a和b。组合物中还可含有相应的溶剂或载体。
本发明克服了目前常用基因转染载体系统对杀伤性细胞转染率低、介导抗体表达水平低的缺陷,使免疫杀伤细胞高水平稳定地表达包含人fc段全长的抗体,克服了细胞免疫治疗作用不足与大分子抗体难以进入实体瘤内部的困难。此外,本发明的杀伤性细胞在保持细胞杀伤毒性作用的同时又能够高水平、稳定表达包含人fc段的抗体,或稳定表达car和感兴趣抗体的抗原结合片段。此外,为了防止稳定表达抗体的免疫细胞在体内不断增殖,导致抗体过量表达,进而造成系统性毒性和自身免疫病,我们引入分子刹车系统(如cd20-美罗华分子刹车系统,cd20br)。应用上市单抗药物(如美罗华),可通过其介导的adcc效应与cdc效应,快速清除整合有抗体表达框的杀伤性细胞,有效提高了其治疗的安全性。
下面将结合实施案例对本发明所涉及的实施方案进行详细描述。本领域技术人员将会理解,下面的实施案例仅用于说明本发明,而不应视为限定本发明的范围。实施案例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件(例如参考j.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版社)或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:重组质粒ps838-antipd1与pnb328-cd20br的构建
委托上海杰瑞生物公司合成两段dna序列,序列如下:
seq1:cgataggacgctgatcttaat(seqidno:1)
seq2:tacctgcgactagaat(seqidno:2)
98℃变性5分钟,随后自然降温,形成上下游分别具有clai与paci粘性末端的双链dna接头。
pnb载体经cali与paci双酶切(构建过程参考cn201510638974.7),装入上述双链dna,获得ps载体。
按cn201510021408.1所公布的ccef启动子序列,委托上海杰瑞生物公司合成,并在上下游分别引入xbai与ecori酶切位点,装入经xbai与ecori双酶切的ps载体,获得ps838载体。
按seqidno:3所示pd1抗体编码序列,委托上海杰瑞生物公司合成,并在其上下游分别引入ecori与sali酶切位点,装入ps838载体,命名为ps838-antipd1。
antipd1编码序列:
按seqidno:4所示cd20br的编码序列,委托上海杰瑞生物公司合成,并在其上下游分别引入ecori与sali酶切位点,装入pnb328载体(构建过程参考cn201510638974.7),命名为pnb328-cd20br。
cd20br编码序列:
pnb328-cd20br与ps838-antipd1载体模式图见图1。
实施例2:外周血t淋巴细胞的遗传修饰
准备1×107新鲜分离获得的外周血单个核细胞(peripheralbloodmononuclearcell,pbmc),通过lonza2b-nucleofector仪器,按1:2的比例将pnb328-cd20br与ps838-antipd1共转染到细胞核中,置37℃、5%co2孵箱培养;6小时后转移到含30ng/ml抗cd3抗体、3000iu/mlil-2(购自novoprotein公司)的6孔板中,置37℃、5%co2孵箱培养。待细胞健康生长后,即获得表达pd1抗体的多能t细胞,简称pik-t。未转染的pbmc通过铺在含30ng/ml抗cd3抗体、3000iu/mlil-2(购自novoprotein公司)培养板,置37℃、5%co2孵箱培养,作为对照。由于只有pnb328载体中含有外源基因整合所需的转座酶,ps838载体中只含转座所需的itr元件,只有同时转染了pnb328-cd20br与ps838-antipd1载体的细胞中才能实现pd1抗体表达框的整合,保证了pik-t细胞中均包含cd20分子刹车。
实施例3:pik-t细胞中pd1抗体表达量的定量检测
将实施例2制备得到的pik-t和对照t细胞按1:3的稀释比例传代培养,两周后,按1.0×106细胞/孔铺在加有4mlaim-v培液(购自gibco公司)的6孔板中,置于37℃,5%co2培养箱培养,并于培养24小时、48小时、72小时、96小时后收集800μl细胞上清,-20℃保存备用。应用人源的pd1重组蛋白包被酶标板(购自sinobiological公司),带hrp标记的鼠抗人iggmab(购自abcam公司)检测,以商品化的抗pd1抗体(购自merck公司)作为标准品,用双夹心elisa方法检测pd1抗体的表达量。
结果发现,3个不同供体来源的pik-t细胞均能够高水平稳定的表达pd1抗体,具体如图2a、2b和2c所示。
实施例4:pik-t细胞中pd1抗体表达量的定性检测
将实施例2制备得到的pik-t按1.0×106细胞/孔铺在加有4mlaim-v培液的6孔板中,置于37℃,5%co2培养箱培养,并于培养48h、72h、96h后收集细胞上清,每个时间点各取120ul的细胞上清,加入30ul的5xsds-pageloading缓冲液100℃煮沸10min,将样品-20℃保存备用。蛋白质印迹(使用羊抗人igg(h+l)作为一抗,hrp-兔抗羊为二抗,一抗和二抗都购买于jacksonimmunoresearch公司)实验检测抗pd1抗体的表达。结果发现,pik细胞表达的抗pd1抗体包含正确的重链(50kd)和轻链(25kd),具体如图3所示。
实施例5:pik-t细胞基因组中pd1抗体表达框的检测。
提取实施例2制备得到的pik-t细胞和对照t细胞的基因组dna,实验步骤参照试剂盒内附带的说明书,测定pik-t细胞和对照t细胞dna的浓度,采用荧光实时定量pcr检测抗pd1抗体基因组的表达水平,反应程序为:95℃,15s→95℃,5s→60℃,15s,40个循环。结果发现,pd1抗体表达框被整合到t细胞基因组中,具体如图4所示。
引物序列:
f:atctccaaagccaaagggca(seqidno:5);
r:cgatgtcgctggggtagaag(seqidno:6)。
实施例6:pik-t细胞表面pd1分子的流式检测
收集悬浮的pik-t细胞(实施例2制备得到)和对照t细胞,计数后以1×106个细胞/管分别加入2个1.5ml的ep管中,pbs清洗两遍,1200rpm离心5min,弃上清;分别加入2μl的同型对照抗体igg1-pe,anti-cd279-pe抗体(均购自bd公司),轻弹沉淀使其混合均匀,室温避光孵育30min,pbs清洗一遍,1200rpm离心5min,弃上清加入400μl的生理盐水将细胞转移至流式管中,上机检测。实验结果发现,相对于对照细胞pik-t细胞pd1分子显著降低,表明pik-t细胞通过自分泌或旁分泌pd1抗体,可有效封闭细胞表面pd1分子,具体如图5所示。
实施例7:pik-t细胞的增殖检测
将实施例2制备得到的pik-t细胞和对照t细胞按4×104/孔铺在96孔板中,每种细胞铺3个复孔,总体积为200μl,置于37℃,5%co2培养箱培养,分别在培养24h,48h,72h,96h后加入20μl的cck8试剂,37℃避光孵育6h,酶标仪上450nm测od值,根据标准曲线计算细胞数量。结果发现,pik-t细胞的增殖速度明显高于对照t细胞,说明pik-t细胞分泌的抗体能够促进t细胞的增殖,具体如图6所示。
实施例8:pik-t细胞的细胞因子分泌检测。
用5μg/ml的cd3抗体(购自novoprotein公司)包被24孔板,4℃包被过夜,pbs清洗3遍,加入3×105的实施例2制备得到的pik-t细胞和对照t细胞,培养24h后收集细胞上清。用bdtmcbahumanth1/th2cytokinekitii(购自bd公司)检测pik-t细胞和对照t细胞受cd3抗体刺激后细胞因子的分泌情况。结果发现,pik-t细胞分泌的il-4,il-6,tnfα和ifn-γ相对于对照t细胞显著增强,而il-2,il-10两种细胞因子的分泌量无明显差异,具体如图7所示。
实施例9:til来源的pik-t细胞在体外对肿瘤细胞的杀伤实验
收集新切除的肺癌标本,立即在无菌条件下进行处理。具体方法如下:去除肺癌标本周围的正常组织和坏死区域,从标本的不同区域取下大小为1-2mm3的小组织块,24孔板的每一孔放置一块。每孔加2ml完全培养基(含10%fbs的gt-t551培养基)和3000iu/ml的il-2。将24孔板置于37℃,5%co2培养箱中培养。培养起始后的第5-6天为所有孔进行半量换液。之后,根据肿瘤浸润淋巴细胞(tumorinfiltratinglymphocyte,til)生长情况,每隔1-2天进行一次半量换液。一旦孔内til长满,且所有贴壁细胞已除去,就将各个长满孔内的til收集起来。随后,1×106til重悬于含150ml完全培养基、30ng/ml抗cd3抗体、不少于200倍于til的照射过的饲养细胞(来自3个不同健康人的pbmc)和6000iu/mlil-2的t175培养瓶中,将培养瓶竖直培养。培养至第5天,瓶内65%液体换为新的完全培养基和il-2。培养至第7天,2个t175培养瓶内的细胞悬液转移至细胞培养袋内,加入300ml完全培养基和il-2。从第6天开始,每隔1天进行一次台盼蓝染色计数,通过加入新的完全培养基和il-2控制细胞密度至0.5-2×106/ml。随后,按实施实例2的方法,转染pnb328-cd20br与ps838-antipd1质粒,获得til来源的pik-t细胞。
选取mhcclassi分型匹配的肺癌细胞株nci-h460(购自美国典型物保藏中心,atcc),在rtca细胞增殖板(购自美国aceabiosciences公司)上按10000个/孔的比例铺孔,随后按照操作说明书,应用实时无标记细胞功能分析仪(rtca)检测细胞的体外杀伤活性,效靶比分别设置为8:1、4:1、2:1,以未转染质粒的til细胞作为对照(效靶比8:1),观察细胞增殖曲线。结果发现,pik-t细胞相对于对照细胞,能更高效的杀伤h446肿瘤细胞。具体如图8所示。
实施例10:til来源的pik-t细胞用于治疗移植瘤的体内实验。
在nod-scid小鼠(购自上海斯莱克实验动物有限公司)中皮下注射5×106的h446恶性肺癌细胞,10天后经尾静脉分别注射til来源的pik-t细胞(实施例9制备)、对照til细胞(注射剂量2×105)或pbs缓冲液,测定移植瘤的生长状况。结果表明,相对于对照组,pik-t细胞对肺癌的抑制作用具有显著差异(图9)。
实施例11:pik-t细胞的体内清除试验(分子刹车功能的验证)
在babl/c裸鼠(购自上海斯莱克实验动物有限公司)尾静脉注射实施例2制备的pik-t细胞(注射剂量5×106),3天后静脉注射100μg的美罗华抗体或人igg对照抗体。12个小时后,采集血液及骨髓样品,用流式细胞仪检测pik-t细胞的比例(cd20与cd3双阳性细胞)。
结果表明,相对于注射人igg抗体的对照组,在注射美罗华抗体后,输注的pik-t细胞在血液与骨髓中的比例显著降低(图10)。可见,cd20分子刹车在体内能有效发挥作用,可以通过adcc及cdc效应将含有cd20表位的pik-t细胞清除。
实施例12:重组质粒ps838-antiher2的构建
采用与实施例1类似的方法构建ps838-antiher2重组质粒。
具体而言,按seqidno:7所示her2抗体编码序列,委托上海杰瑞生物公司合成,并在其上下游分别引入ecori与sali酶切位点,装入ps838载体,命名为ps838-antiher2。
antiher2编码序列:
pnb328-cd20br(如实施例1所述构建)与ps838-antiher2载体模式图见图11。
实施例13:外周血来源nk细胞的遗传修饰
新鲜分离获得外周血单个核细胞(pbmc),置于含30ng/ml抗cd16抗体,500iu/mlil-21(购自novoprotein公司),3mlnk培养基的培养板中(购自stemcelltechnologies公司),37℃、5%co2孵箱培养。收集5×106nk细胞,通过lonza2b-nucleofector仪器,按1:2的比例将pnb328-cd20br与ps838-antiher2共转染到细胞核中。待细胞健康生长后,即获得表达her2抗体的多能nk细胞,简称pik-nk。由于只有pnb328载体中含有外源基因整合所需的转座酶,ps838载体中只含转座所需的itr元件,只有同时转染了pnb328-cd20br与ps838-antiher2载体的细胞中才能实现her2抗体表达框的整合,保证了pik-nk细胞中均包含cd20分子刹车。
实施例14:pik-nk细胞中her2抗体表达量的定量检测
将实施例13制备得到的pik-nk和对照nk细胞按1:3的稀释比例传代培养,按1.0×106细胞/孔铺在加有nk培液(购自stemcelltechnologies公司)的6孔板中,置于37℃,5%co2培养箱培养,并于培养24小时、48小时、72小时、96小时后收集800μl细胞上清,-20℃保存备用。应用人源的her2重组蛋白包被酶标板(购自sinobiological公司),带hrp标记的鼠抗人iggmab(购自abcam公司)检测,以商品化的her2抗体(herceptin,购自roche公司)作为标准品,用双夹心elisa方法检测her2抗体的表达量。
结果发现,2个不同供体来源的pik-nk细胞均能够高水平稳定的表达her2抗体,具体如图12a和12b所示。
实施例15:pik-nk细胞中her2抗体表达量的定性检测
将实施例13制备得到的pik-nk按1.0×106细胞/孔铺在加有4mlnk培液(购自stemcelltechnologies公司)的6孔板中,置于37℃,5%co2培养箱培养,并于培养48h后收集细胞上清,取120μl的细胞上清,加入30μl的5xsds-pageloading缓冲液100℃煮沸10min,将样品-20℃保存备用。蛋白质印迹(使用羊抗人igg(h+l)作为一抗,hrp-兔抗羊为二抗,一抗和二抗都购买于jacksonimmunoresearch公司)实验检测抗her2抗体的表达。结果发现,pik-nk细胞表达的抗her2抗体包含正确的重链(50kd)和轻链(25kd),具体如图13所示。
实施例16:pik-nk细胞基因组中her2抗体表达框的检测
提取实施例13制备得到的pik-nk细胞和对照nk细胞的基因组dna,实验步骤参照试剂盒内附带的说明书,测定pik-nk细胞和对照t细胞dna的浓度,采用荧光实时定量pcr检测抗pd1抗体基因组的表达水平(引物如seqidno:8与seqidno:9所示),反应程序为:95℃,15s→95℃,5s→60℃,15s,40个循环。结果发现,her2抗体表达框被整合到nk细胞基因组中,具体如图14所示。
f:ggctgtcctacagtcctcag(seqidno:8)
r:ttgtccaccttggtgttgct(seqidno:9)
实施例17:pik-nk细胞表面抗体分子的流式检测
收集悬浮的pik-nk细胞(实施例13制备得到)和对照nk细胞,计数后以1×106个细胞/管分别加入2个1.5ml的ep管中,pbs清洗两遍,1200rpm离心5min,弃上清;分别加入2μl抗人iggfab2’抗体(购自jacksonimmunoresearch公司),轻弹沉淀使其混合均匀,室温避光孵育30min,pbs清洗一遍,1200rpm离心5min,弃上清加入400μl的生理盐水将细胞转移至流式管中,上机检测。实验结果发现,相对于对照细胞,pik-nk细胞表面具有her2抗体分子,具体如图15所示。
实施例18:pik-nk细胞在体外对肿瘤细胞的杀伤实验
选取her2阳性的肿瘤细胞株sk-ov3、bgc27、mcf7以及her2阴性的肿瘤细胞株a549(均购自美国典型物保藏中心,atcc),应用ldh乳酸脱氢酶-细胞毒性检测分析试剂盒(ldh-cytotoxicityassaykit,biovision)检测不转基因前后的nk细胞对不同类型肿瘤细胞的体外杀伤能力。效靶比分别设置为8:1、4:1、2:1,以未转染质粒的nk细胞作为对照(效靶比8:1),观察细胞增殖曲线。结果发现,相对于对照细胞,表达her2抗体的pik-nk细胞(实施例13制备得到)对her2阳性的肿瘤细胞杀伤作用显著增强,而对her2阴性的肿瘤细胞的杀伤作用无明显差异。具体如图16a-16d所示。
实施例19:pik-nk细胞用于治疗移植瘤的体内实验。
在nod-scid小鼠(购自上海斯莱克实验动物有限公司)中皮下注射5×106的sk-ov3恶性卵巢癌细胞,10天后经尾静脉分别注射pik-nk来细胞(实施例13制备)、对照nk细胞(注射剂量1×107)或pbs缓冲液,测定移植瘤的生长状况。结果表明,相对于对照组,pik-nk细胞对肺癌的抑制作用具有显著差异(图17)。
实施例20:pik-nk细胞的体外清除试验(分子刹车功能的验证)
将实施例13制备得到的pik-nk及nk细胞按1.0×105细胞/孔铺在加有4mlnk培液(购自stemcelltechnologies公司)的12孔板中,分别加入50μg/ml的美罗华抗体或人igg抗体,应用ldh乳酸脱氢酶-细胞毒性检测分析试剂盒(ldh-cytotoxicityassaykit,biovision)检测加入抗体后,pik-nk细胞的裂解率。结果发现,相对于对照人igg抗体,加入美罗华抗体后,pik-nk细胞能被快速裂解;而nk细胞对美罗华抗体与对照人igg抗体均无明显反应。结果表明,因nk细胞能高效介导adcc效应,加入美罗华抗体后,能结合到pik-nk细胞表面的cd20表位上,启动细胞间的相互杀伤,导致pik-nk细胞被清除,说明cd20-美罗华分子刹车系统能有效清除pik-nk细胞,具有良好的安全性。具体如图18所示。
实施例21:重组质粒pnb328-herincar-pd1的构建
按seqidno:10所示含cd20-美罗华分子刹车的herincar编码序列(靶向egfr家族的car,可参见cn201510812654.9)与seqidno:11所示herincar-pd1编码序列(靶向egfr家族且包含cd20-美罗华分子刹车的car与pd1单链-fc抗体,中间用2a相连),委托上海杰瑞生物公司合成,并在其上下游分别引入ecori与sali酶切位点,装入pnb328载体,分别命名为pnb328-herincar、pnb328-herincar-pd1。
含cd20-美罗华分子刹车的herincar编码序列:
herincar-pd1编码序列:
pnb328-herincar-pd1载体的模式图见图19。
实施例22:herincar-pd1细胞的构建
准备1×107新鲜分离获得的外周血单个核细胞(pbmc),通过lonza2b-nucleofector仪器,将6μg的pnb328-herincar-pd1,质粒转染到细胞核中,置37℃、5%co2孵箱培养;6小时后转移到含30ng/ml抗cd3抗体、3000iu/mlil-2(购自novoprotein公司)的6孔板中,置37℃、5%co2孵箱培养。待细胞长满后,按1:5的比例传代培养。即得同时表达靶向egfr家族的且含cd20-美罗华分子刹车car、pd1单链-fc抗体的基因修饰t细胞,简称herincar-pd1细胞。同时,相同来源pbmc转染pnb328-herincar质粒,获得herincar-t细胞。
实施例23:herincar-pd1细胞中pd1抗体表达量的定量检测
将实施例22构建的和herincar细胞按1:3的稀释比例传代培养,两周后,按1.0×106细胞/孔铺在加有4mlaim-v培液(购自gibco公司)的6孔板中,置于37℃,5%co2培养箱培养,并于培养24小时、48小时、72小时、96小时后收集800μl细胞上清,-20℃保存备用。应用人源的pd1重组蛋白包被酶标板(购自sinobiological公司),带hrp标记的鼠抗人iggmab(购自abcam公司)检测,以商品化的抗pd1抗体(购自merck公司)作为标准品,用双夹心elisa方法检测pd1抗体的表达量。
结果发现,herincar-pd1细胞均能够高水平稳定的表达pd1抗体,具体如图20所示。
实施例24:herincar-pd1细胞中pd1抗体表达量的定性检测
将实施例22构建的herincar-pd1按1.0×106细胞/孔铺在加有4mlaim-v培液的6孔板中,置于37℃,5%co2培养箱培养,并于培养48h后收集细胞上清,取120ul的细胞上清,加入30ul的5xsds-pageloading缓冲液100℃煮沸10min,将样品-20℃保存备用。蛋白质印迹(使用羊抗人igg(h+l)作为一抗,hrp-兔抗羊为二抗,一抗和二抗都购买于jacksonimmunoresearch公司)实验检测抗pd1抗体的表达。结果发现,herincar-pd1细胞表达的抗pd1抗体包含正确的scfv-fc抗体(52kd),具体如图21所示。
实施例25:herincar-pd1细胞的增殖检测
将实施例22构建的herincar-pd1细胞和herincar细胞按4×104/孔铺在96孔板中,每种细胞铺3个复孔,总体积为200μl,置于37℃,5%co2培养箱培养,分别在培养24h,48h,72h,96h后加入20μl的cck8试剂,37℃避光孵育6h,酶标仪上450nm测od值。结果发现,herincar-pd1细胞的增殖速度明显高于对照herincar细胞,说明herincar-pd1细胞分泌的抗体能够促进t细胞的增殖,具体如图22所示。
实施例26:herincar-pd1细胞的体外杀伤活性检测
在rtca细胞增殖板(购自美国aceabiosciences公司)上按10000个/孔的比例铺肺癌细胞株nci-h23、h446、h460、h1299(购自美国标准生物品收藏中心,atcc),置于xcelligencertcadp多功能实时无标记细胞分析仪上,实时记录细胞的生长情况(以测得的细胞指数来反映,数值越高表明细胞状态越佳)。24小时后,分别按4:1、2:1效靶比(e:t),分别加入实施例22构建的herincar细胞与herincar-pd1细胞,重新置于xcelligencertcadp多功能实时无标记细胞分析仪上进行细胞生长情况检测。结果显示,相对于不表达pd1抗体的herincar-t细胞,表达pd1抗体的herincar-t细胞,即herincar-pd1细胞对肺癌细胞的杀伤活性显著提高(图23a-c)。以上结果表明,共表达pd1抗体后,能增强car-t细胞对肺癌细胞的杀伤活性。
实施例27:herincar-pd1细胞的体内杀伤活性鉴定
在nod-scid小鼠(购自上海斯莱克实验动物有限公司)中皮下注射5×106的huh7恶性肝癌细胞,10天后经尾静脉分别注射实施例22构建的herincar细胞、herincar-pd1细胞、未转基因的同一供体来源t细胞(注射剂量2×105)或pbs缓冲液,测定移植瘤的生长状况。结果表明,相对于对照组,herincar-pd1细胞对肝癌的抑制作用具有显著差异(图24)。共表达pd1抗体的herincar-t细胞在体内具有良好的抗肿瘤作用。
实施例28:herincar-pd1细胞在移植瘤内的增殖检测
在实施例27的治疗后第35天,处死荷瘤小鼠,取移植瘤组织,提取基因组dna(按sigma-aldrich公司的组织dna抽提试剂盒进行操作)。利用rt-pcr检测herincar基因在移植瘤组织中的相对拷贝数(引物如seqidno:12与seqidno:13所示,反应体系与程序按天根生物的realmastermix(sybrgreen)检测试剂盒操作)。结果表明,相对于herincar-t细胞,herincar-pd1细胞在移植瘤内的拷贝数显著提高,表明表达pd1抗体可增强car-t细胞在移植瘤内的存活时间(图25)。
f:cagtgagattgggatgaaagg(seqidno:12);
r:gaagggcgtcgtaggtgtc(seqidno:13)。
实施例29:herincar-pd1细胞的体内清除试验(分子刹车功能的验证)
在babl/c裸鼠(购自上海斯莱克实验动物有限公司)尾静脉注射实施例22构建的herincar-pd1细胞(注射剂量5×106),3天后静脉注射100μg的美罗华抗体或人igg对照抗体。12个小时后,采集血液及骨髓样品,用流式细胞仪检测car-t细胞的比例。
结果表明,相对于注射人igg抗体的对照组,在注射美罗华抗体后,输注的herincar-pd1细胞在血液与骨髓中的比例显著降低(图26)。可见,cd20分子刹车在体内能有效发挥作用,可以通过adcc及cdc效应将含有cd20表位的pik-t细胞清除。
实施例30:重组质粒pnb328-herincar-cd28的构建
按seqidno:14所示herincar-cd28编码序列(靶向egfr家族且包含cd20-美罗华分子刹车的car与cd28单链-膜结合型抗体,中间用2a相连),委托上海杰瑞生物公司合成,并在其上下游分别引入ecori与sali酶切位点,装入pnb328载体,分别命名为pnb328-herincar、pnb328-herincar-cd28。
herincar-cd28编码序列:
pnb328-herincar-cd28载体的模式图见图27。
实施例31:herincar-cd28细胞的构建
准备1×107新鲜分离获得的外周血单个核细胞(pbmc),通过lonza2b-nucleofector仪器,将6μg的pnb328-herincar-cd28质粒转染到细胞核中,置37℃、5%co2孵箱培养;6小时后转移到含30ng/ml抗cd3抗体、3000iu/mlil-2(购自novoprotein公司)的6孔板中,置37℃、5%co2孵箱培养。待细胞长满后,按1:5的比例传代培养。即得同时表达靶向egfr家族的且含cd20-美罗华分子刹车car、cd28单链抗体的基因修饰t细胞,简称herincar-cd28细胞。同时,相同来源pbmc转染pnb328-herincar质粒,获得herincar-t细胞。
实施例32:herincar-cd28细胞表面cd28抗体分子的检测
收集悬浮的实施例31构建的herincar-cd28细胞和对照herincar-t细胞,计数后以1×106个细胞/管分别加入2个1.5ml的ep管中,pbs清洗两遍,1200rpm离心5min,弃上清;分别加入2μl抗人iggfab2’抗体(购自jacksonimmunoresearch公司),轻弹沉淀使其混合均匀,室温避光孵育30min,pbs清洗一遍,1200rpm离心5min,弃上清加入400μl的生理盐水将细胞转移至流式管中,上机检测。实验结果发现,相对于对照细胞,herincar-cd28细胞表面具有cd28抗体分子,具体如图28所示。
实施例33:herincar-cd28细胞表面cd28分子的检测
收集悬浮的实施例31构建的herincar-cd28细胞和对照herincar-t细胞,计数后以1×106个细胞/管分别加入2个1.5ml的ep管中,pbs清洗两遍,1200rpm离心5min,弃上清;分别加入2μl的同型对照抗体igg1-pe,anti-cd28-pe抗体(均购自bd公司),轻弹沉淀使其混合均匀,室温避光孵育30min,pbs清洗一遍,1200rpm离心5min,弃上清加入400μl的生理盐水将细胞转移至流式管中,上机检测。实验结果发现,相对于herincar对照细胞,herincar-cd28细胞cd28的阳性率显著提高,表明herincar-cd28细胞通过其膜表面cd28抗体,可有效激活邻近t细胞的cd28信号,具体如图29所示。
实施例34:herincar-cd28细胞的增殖检测
将实施例31构建的herincar-cd28细胞和herincar细胞按4×104/孔铺在96孔板中,每种细胞铺3个复孔,总体积为200μl,置于37℃,5%co2培养箱培养,分别在培养24h,48h,72h,96h后加入20μl的cck8试剂,37℃避光孵育6h,酶标仪上450nm测od值。结果发现,herincar-cd28细胞的增殖速度明显高于对照herincar细胞,说明herincar-cd28细胞膜表面的cd28抗体能够促进t细胞的增殖,具体如图30所示。
实施例35:herincar-cd28细胞的体外杀伤活性检测
在rtca细胞增殖板(购自美国aceabiosciences公司)上按10000个/孔的比例铺胃癌细胞株bgc-27、卵巢癌细胞株sk-ov3(购自美国标准生物品收藏中心,atcc),置于xcelligencertcadp多功能实时无标记细胞分析仪上,实时记录细胞的生长情况(以测得的细胞指数来反映,数值越高表明细胞状态越佳)。24小时后,分别按8:1、4:1、2:1、0:1效靶比(e:t),分别加入实施例31构建的herincar细胞与herincar-cd28细胞,重新置于xcelligencertcadp多功能实时无标记细胞分析仪上进行细胞生长情况检测,48个小时后,根据测得的各效靶比条件下细胞指数与0:1效靶比条件下(不加效应细胞)相应细胞指数的比值,确定肿瘤细胞裂解率。结果显示,相对于不表达cd28抗体的herincar-t细胞,表达cd28抗体的herincar-t细胞,即herincar-cd28细胞对bgc-27与sk-ov3细胞的杀伤活性显著提高(图31)。以上结果表明,共表达cd28抗体后,能增强car-t细胞对肿瘤细胞的杀伤活性。
实施例36:herincar-cd28细胞的体内杀伤活性鉴定
在nod-scid小鼠(购自上海斯莱克实验动物有限公司)中皮下注射5×106的bgc-27恶性胃癌细胞,10天后经尾静脉分别注射实施例31构建的herincar细胞、herincar-cd28细胞(注射剂量2×105)或pbs缓冲液,测定移植瘤的生长状况。结果表明,相对于对照组,herincar-cd28细胞对肝癌的抑制作用具有显著差异(图32)。表明共表达cd28抗体的herincar-t细胞在体内具有良好的抗肿瘤作用。
实施例37:herincar-cd28细胞在移植瘤内的增殖检
实施例36的治疗后第35天,处死荷瘤小鼠,取移植瘤组织,提取基因组dna(按sigma-aldrich公司的组织dna抽提试剂盒进行操作)。利用rt-pcr检测herincar基因在移植瘤组织中的相对拷贝数(引物如seqidno:12与seqidno:13所示,反应体系与程序按天根生物的realmastermix(sybrgreen)检测试剂盒操作)。结果表明,相对于herincar-t细胞,herincar-cd28细胞在移植瘤内的拷贝数显著提高(图33),表明表达cd28抗体可增强car-t细胞在移植瘤内的存活时间。
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!