结直肠癌的外遗传标记以及使用它们的诊断方法与流程
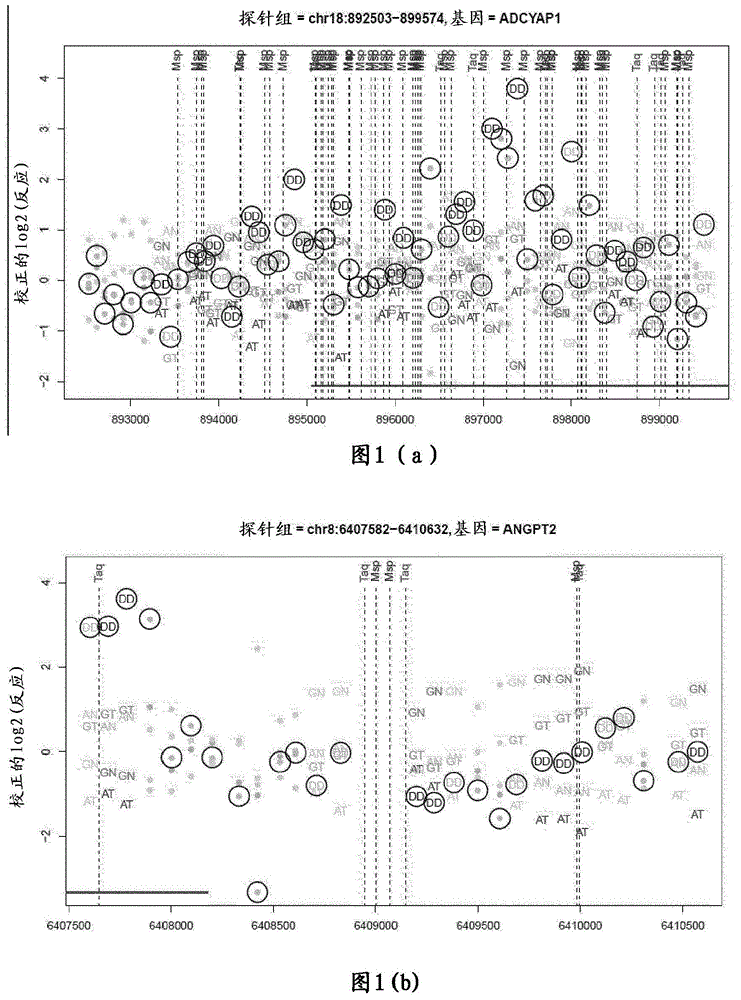
发明领域本发明一般地涉及核酸分子,就所述的核酸分子而言,针对DNA甲基化水平的变化表示肿瘤开始或肿瘤开始倾向。更具体地,本发明涉及核酸分子,就所述的核酸分子而言,针对DNA甲基化水平的变化表示大肠瘤(如腺瘤或腺癌)开始和/或进展。本发明的DNA甲基化状态用于一系列应用中,所述应用包括但不限于涉及诊断和/或监测结直肠肿瘤(如结直肠腺癌)的那些应用。因此,在一个相关方面,本发明涉及一种通过筛查一种或多种核酸分子的DNA甲基化方面的调节作用,筛查肿瘤开始、开始倾向和/或进展的方法。
背景技术:
:结直肠癌包括在结肠、直肠和盲肠中的癌性生长。随着世界范围每年655,000例死亡,它是美国的第四最常见的癌症形式并且是西方世界中癌症死亡的第三主导原因。结直肠癌源自结肠中的腺瘤息肉。这些蕈形生长物通常是良性的,但是一些生长物随时间推移形成癌症。通常借助结肠镜检查诊断局限化结肠癌。限于结肠壁内部的侵袭性癌(TNM第I和第II期)是用手术可治愈的。如果不治疗,它们扩散至区域性淋巴结(第III期),其中至多到73%是通过手术和化疗可治愈。转移至远处部位的癌(第IV期)通常不是可治愈的,虽然化疗可以延长存活,并且在罕见病例中,手术和化疗一起见证患者直至治愈(Markowitz和Bertagnolli,2009,N.Engl.J.Med.361(25):2449-60)。将辐射用于直肠癌。结直肠癌的前奏是腺瘤。腺瘤是上皮源良性肿瘤或肿瘤,其源自腺组织或显示清晰界定的腺结构。一些腺瘤显示可识别的组织成分,如纤维组织(纤维腺瘤)和上皮结构,而其他腺瘤,如支气管腺瘤,产生可能引起临床综合征的活性化合物。腺瘤可以进展以变成侵袭性肿瘤并随后称作腺癌。因此,腺癌定义为源自腺结构的恶性上皮肿瘤,所述腺结构是身体许多器官的组成部分。术语“腺癌”也适用于显示腺状生长样式的肿瘤。这些肿瘤可以根据它们产生的物质细分,例如分泌黏液腺癌和浆液性腺癌,或根据其细胞微观排列成的样式细分,例如乳头状和滤泡性腺癌。这些癌瘤可以是固体的或囊性的(囊腺癌)。每种器官可以产生显示多种组织学类型的肿瘤,例如卵巢可以产生粘液腺癌和囊腺癌。不同器官中的腺瘤行为不同。通常,癌瘤在腺瘤内部存在(即癌灶已经在良性病灶内部形成)的总几率是大约5%。然而,这与腺瘤的大小相关。例如,在大肠(特别是结肠和直肠)中,在小于1厘米的腺瘤中,癌几乎不出现在腺瘤内部。这种形成在大于4厘米的腺瘤中估计占40至50%并且显示某些组织病理学变化如绒毛变化或高等级异型增生(异型增生)。异型增生程度更高的腺瘤具有更高癌瘤发生率。在任何给定的结直肠腺瘤中,癌症在器官中现在或将来出现的预测物包括从管状至绒毛形态的尺寸(尤其大于9mm)变化程度、存在高等级异型增生和称作“锯齿状腺瘤”的形态学变化。在任何给定的个体中,额外特征:年龄渐增、家族性发生结直肠腺瘤或癌、男性性别或多次腺瘤预测了器官中未来增加的癌风险-所谓癌风险因素。除了存在腺瘤及其尺寸之外,这些中没有一个经客观地定义并且就所讨论特征的精确定义而言,除数目和尺寸之外的全部那些特征均受观察者误差和混淆影响。因为这类素可能难以评估和限定,所以它们的值作为当前或未来癌症风险的预测物是不精确的。一旦零星腺瘤已经形成,则新腺瘤出现的几率在26个月内是大约30%。结直肠癌的症状取决于肿瘤在肠中位置和是否已经转移。不过地,许多症状可能在其他疾病中也出现,因此,症状可能并不令人信服地诊断结直肠癌。如果肿瘤位于更靠近肛门,则局部症状更有可能出现。可能存在排便习惯变化(在另一种病因不存在的情况下新发作的便秘或腹泻)、排便未尽感和粪便直径缩减。里急后重和粪便形状的变化均是直肠癌的特征。下胃肠道出血,包括粪便中排出鲜红色血液,可以指示结直肠癌,黏液存在增加也可以指示结直肠癌。沥青样大便(具有柏油外观的黑色粪便)正常情况下在上胃肠道出血时出现(如来自十二指溃疡),但是有时当病患位于大肠起始端,在结直肠癌中遇到它。大到足以充满整个肠腔的肿瘤可以导致肠道阻塞。这种情况以便秘、腹痛、腹胀和呕吐为特征。这偶尔导致阻塞性和胀气性肠穿孔并引起腹膜炎。当结直肠癌变为更晚期时,这种疾病的某些局部影响出现。当抚触腹部时,更可能注意到巨大的肿瘤,并且可能在体格检查由医生注意到。这种疾病可以侵入其他器官,并且可以在尿道或阴道分泌物造成出血或空气。如果肿瘤已经造成慢性潜隐性出血,则缺铁性贫血可能发生这可以体验为乏力、心悸并因脸色苍白而引人注目。结直肠癌也可以导致体重减轻,通常归因于减退的食欲。更不寻常的构造性症状是无法解释的发热和几种副肿瘤综合征之一。最常见副肿瘤综合征是血栓形成,通常是深静脉血栓形成。结直肠癌最常见地扩展至肝脏。这可以察觉不到,但是肝脏中的巨大沉积物可以造成黄疸和腹痛(归因于胆囊拉伸)。如果肿瘤沉积物阻塞胆管,则黄疸可以伴发胆道阻塞的其他特征,如灰白粪便。结直肠癌可以经过许多年形成,结直肠癌的早期检测大大改善倾向。甚至执行结直肠癌筛查方法的适中努力也可以导致癌症死亡的降低。尽管如此,结直肠癌筛查率仍低。目前存在可用于这个目的的几种不同检验:·数字式直肠检查:医生将润滑的戴手套的手指插入直肠中以触摸异常区域。这种方法仅检测到直肠远端部分大到足以摸到的肿瘤,但是作为初筛检查有用。·粪便潜血试验:一项用于粪便中血液的试验。两种类型的检验法可以用于检测粪便中的潜血,即基于愈创木脂的试验(化学试验)和免疫化学试验。免疫化学检验的灵敏度优于化学检验的的灵敏度,而特异性并未不可接受地降低(WeitzelJN(1999年12月),"Geneticcancerriskassessment.Puttingitalltogether".Cancer86(11Suppl):2483-92)。·内窥镜:o乙状结肠镜检查:将照明探头(乙状结肠镜)插入直肠和下结肠以检查息肉和其他畸形。o结肠镜检查:将称作结肠镜的插入直肠和下结肠以寻找可以由癌症引起的息肉和其他畸形。结肠镜检查具有以下优点:如果在这个过程期间找到息肉,可以立即去除它们。也可以取得组织用于活组织检查。·钡灌肠双重造影(DCBE):首先,取得过夜制备物以清洁结肠。施用含有硫酸钡的灌肠剂,随后将空气喷注入结肠,使其鼓胀。结果是在结肠内衬上X射线胶片上可见到的钡薄层。以这种方式可以检测到癌症或前癌息肉。这项技术可能错过(较不常见)扁平息肉。·虚拟结肠镜检查用专用计算机断层成像扫描替代钡灌肠双重造影(上文)中的X射线胶片并且需要专用工作站软件,以便放射科医师解读。在对息肉的灵敏度方面,这项技术接近于结肠镜检查。然而,仍必须通过标准结肠镜检查除去任何息肉。·标准计算机轴向断层成像是一种X射线方法,它可以用来确定癌症扩展度,但灵敏度不足以用于筛查。在出于其他原因进行的CAT扫描中找到一些癌症。·血液检验:针对升高的某些蛋白质水平测量患者的血液可以指示肿瘤负荷。具体而言,血液中高水平的癌胚抗原(CEA)可以指示腺癌转移。尽管这些检验经常是假阳性或假阴性的,并且不推荐用于筛查,它们可以用于评估疾病复发。CA19-9和CA242生物标记可以指示e-选择素相关的转移风险,帮助跟踪治疗进展并评估疾病复发。最近,一种用于检测血浆中Septin9基因的甲基化序列测定法也已经可用于辅助诊断结直肠癌。·正电子发射断层摄影术(PET)是一种立体扫描技术,其中将放射性糖注射至患者中,糖积存在具有高代谢活动的组织中,并且通过测量来自糖的辐射发射形成图像。因为癌细胞经常具有极高的代谢速率,所以这项技术可以用来区分良性肿瘤和恶性肿瘤。PET不用于筛查并且(仍)不用结直肠癌病例的例行病情检查。·粪便DNA检验是一项筛查结直肠癌的新出现技术。恶变前腺瘤和癌从它们的细胞中散播DNA标记,所述DNA标记在消化过程期间不降解并且在粪便中保持稳定。按照PCR的捕获将DNA扩增至分析可检测的水平。·高C-反应蛋白水平作为风险标记尽管存在这些试验,诊断仍有问题。大部分更敏感的试验具有相当的侵入性并且昂贵,因此患者吞咽意愿低。因此持续需要开发简单和更富有信息的诊断操作方案或辅助措施以针对更可能已经形成腺瘤或癌瘤的人指导结肠镜检查。简单和精确的筛查试验将使得建立广泛得多的适用筛查系统成为可能。在引向本发明的工作中,已经确定某些基因的甲基化的变化指示大肠瘤(如腺瘤和腺瘤)的形成。此外,鉴定变得过度甲基化的特定基因组DNA胞嘧啶核苷酸已经使得开发例行用于诊断环境下的非常简单和特异性扩增反应成为可能。可以因此基于筛查一组这些差异性甲基化的基因中一者或多者作出诊断。因而,发明人已经鉴定一组基因,所述基因促进腺瘤和腺瘤形成的诊断和/或监测以形成这些类型肿瘤为特征的病状。发明概述遍及整个说明书和后续权利要求书,除非上下文另外要求,否则词汇“包含”及其变化形式如“包括”及“包含有”应理解为表示包括所陈述的整数或步骤或者所陈述的整数或步骤组,但不排除任何其它整数或步骤或任何其它整数或步骤组。如本文所用,术语“源自”应当理解为表示,特定的整体或整体群组已经起源于指定的物种,但是不必然已经从指定的来源直接获得。除非上下文另外清楚地说明,否则单数形式“一个(a)”、“一种(an)”和“该(the)”包括复数指称。除非另外限定,否则本文中所用的全部技术与科学术语具有如本发明所属领域的普通技术人员通常理解的相同含义。主题说明书含有核苷酸序列信息,所述核苷酸序列信使用在参考书目后提供的程序PatentIn3.4准备。每个核苷酸序列在序列表中由数字指示符<210>后接序列标识符(例如<210>1、<210>2等)来确定。序列的长度、类型(DNA等)和每个序列的来源生物由分别以数字指示符域<211>、<212>和<213>提供的信息指示。本说明书中提到的核苷酸序列由指示符SEQIDNO:后接序列标识符确定(例如SEQIDNO:1、SEQIDNO:2等)。本说明书中提到的序列标识符与序列表中以数字指示符域<400>提供的信息相关,所述数字指示符域跟随序列标识(例如<400>1、<400>2等)。即,如本说明书中详述的SEQIDNO:1与序列表中显示为<400>1的序列相关。本发明的一个方面涉及一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估DNA区域的甲基化状态,所述DNA区域选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:其中相对于对照水平而言,组(i)和/或(ii)的DNA区域的较高甲基化水平指示有大肠瘤或大肠瘤形成状态开始的倾向。在另一个方面,提供了一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估DNA区域的甲基化状态,所述DNA区域选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:其中相对于对照水平而言,组(i)和/或(ii)的DNA区域的较高甲基化水平指示有大肠瘤或大肠瘤形成状态开始的倾向。将已经确定显示特殊用途的亚区域参考其中存在这些亚区域的基因和染色体区域在下文列出:(1)Chr12:52400748-52409671(GRASP)亚区域Chr12:52399672-52399922(SEQIDNO:15)、Chr12:52400821-52401119(SEQIDNO:16)和Chr12:52401407-52401664(SEQIDNO:17)。(2)Chr8:97505882-97624037(SDC2)亚区域Chr8:97506813-97507045(SEQIDNO:18)和Chr8:97507037-97507257(SEQIDNO:19)。(3)Chr13:110959094-110959330(SEQIDNO:20)(COL4A1)。(4)Chr5:3596168-3601517(IRX1)亚区域Chr5:3597227-3597480(SEQIDNO:21)、Chr5:3599990-3600175(SEQIDNO:22)、Chr5:3600160-3600352(SEQIDNO:23)和Chr5:3594657-3594847(SEQIDNO:24)。(5)Chr13:95361879-95364389(SOX21)亚区域Chr13:95364013-95364178(SEQIDNO:25)和Chr13:95364515-95364784(SEQIDNO:26)。(6)Chr4:81187742-81212171(FGF5)亚区域Chr4:81186918-81187228(SEQIDNO:27)、Chr4:81187326-81187578(SEQIDNO:28)和Chr4:81187571-81187792(SEQIDNO:29)。(7)Chr19:57019212-57040269(ZNF471)亚区域Chr19:57018955-57019135(SEQIDNO:30)和Chr19:57019294-57019573(SEQIDNO:31)。(8)Chr3:33191537-33260707(SUSD5)亚区域Chr3:33260566-33260818(SEQIDNO:32)。(9)Chr2:56093097-56151298(EFEMP1)亚区域Chr2:56150356-56150606(SEQIDNO:33)。(10)Chr6:134210259-134216675(TCF21)亚区域Chr6:134210545-134210749(SEQIDNO:34)、Chr6:134210712-134210951(SEQIDNO:35)和Chr6:134210994-134211274(SEQIDNO:36)。(11)Chr7:94023873-94060544(COL1A2)亚区域Chr7:94023751-94023975(SEQIDNO:37)和Chr7:94024141-94024345(SEQIDNO:38)。(12)Chr15:60296421-60298142(FOXB1)亚区域Chr15:60296522-60296719(SEQIDNO:39)和Chr15:60297024-60297305(SEQIDNO:40)。(13)Chr16:86544133-86548070(FOXF1)亚区域Chr16:86544560-86544770(SEQIDNO:41)、Chr16:86544265-86544584(SEQIDNO:42)和Chr16:86544795-86545110(SEQIDNO:43)。(14)Chr13:28494168-28500451(PDX1)亚区域Chr13:28502100-28502311(SEQIDNO:44)、Chr13:28502417-28502603(SEQIDNO:45)和Chr13:28503006-28503210(SEQIDNO:46)。(15)Chr7:96649702-96654143(DLX5)亚区域Chr7:96650026-96650127(SEQIDNO:47)、Chr7:96651454-96651618(SEQIDNO:48)和Chr7:96653553-96653732(SEQIDNO:49)。(16)Chr21:28208606-28217728(ADAMTS1)亚区域Chr21:28217946-28218109(SEQIDNO:50)、Chr21:28218494-28218777(SEQIDNO:51)和Chr21:28218859-28219017(SEQIDNO:52)。(17)Chr13:110959631-111165373(COL4A2)亚区域Chr13:110960787-110961141(SEQIDNO:53);Chr13:110961331-110961659(SEQIDNO:54)和Chr13:110959932-110960181(SEQIDNO:82);(18)Chr5:83238126-83680611(EDIL3)亚区域Chr5:83679544-83679807(SEQIDNO:55)、Chr5:83679784-83679988(SEQIDNO:56)、Chr5:83679960-83680263(SEQIDNO:57)、Chr5:83680075-83680383(SEQIDNO:58)和Chr5:83680356-83680630(SEQIDNO:59)。(19)Chr15:48700503-48937985(FBN1)亚区域Chr15:48938136-48938384(SEQIDNO:60)。(20)Chr1:47901689-47906363(FOXD2)亚区域Chr1:47899091-47899337(SEQIDNO:61)和Chr1:47909944-47910172(SEQIDNO:62)。(21)Chr2:66662532-66799891(MEIS1)亚区域Chr2:66662009-66662219(SEQIDNO:63)和Chr2:66662177-66662430(SEQIDNO:64)。(22)Chr16:55513081-55540586(MMP2)亚区域Chr16:55512662-55512856(SEQIDNO:65)和Chr16:55513916-55514215(SEQIDNO:66)。(23)Chr7:24323807-24331484(NPY)亚区域Chr7:24323765-24323936(SEQIDNO:67)、Chr7:24324150-24324342(SEQIDNO:68)和Chr7:24324513-24324717(SEQIDNO:69)。(24)Chr19:38741877-38747172(PPP1R14A)亚区域Chr19:38747251-38747424(SEQIDNO:70)和Chr19:38746653-38746912(SEQIDNO:71)。在又一个实施方案中,提供了一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括评估一个或多个胞嘧啶残基的甲基化状态,所述DNA区域选自:Chr12:52400748-52409671(GRASP)Chr8:97505882-97624037(SDC2)Chr8:97506843Chr8:97506845Chr8:97506861Chr8:97506876Chr8:97506902Chr8:97506909Chr8:97506911Chr8:97506913Chr8:97506924Chr8:97506932Chr8:97506934Chr8:97506940Chr8:97506977Chr8:97506993Chr8:97507005Chr8:97507008Chr8:97507014Chr8:97507038Chr8:97507061Chr8:97507064Chr8:97507078Chr8:97507082Chr8:97507084Chr8:97507089Chr8:97507119Chr8:97507128Chr8:97507136Chr8:97507144Chr8:97507153Chr8:97507162Chr8:97507214Chr8:97507216Chr13:110959094-110959330(COL4A1).Chr5:3596168-3601517(IRX1)Chr13:95361879-95364389(SOX21)Chr4:81187742-81212171(FGF5)Chr4:81186919Chr4:81186947Chr4:81186964Chr4:81186968Chr4:81186973Chr4:81186975Chr4:81186983Chr4:81187001Chr4:81187011Chr4:81187041Chr4:81187056Chr4:81187062Chr4:81187093Chr4:81187116Chr4:81187125Chr4:81187161Chr4:81187191Chr4:81187196Chr4:81187198Chr4:81187367Chr4:81187389Chr4:81187458Chr4:81187467Chr4:81187495Chr4:81187498Chr4:81187504Chr4:81187512Chr4:81187514Chr4:81187530Chr4:81187539Chr4:81187547Chr4:81187549Chr4:81187551Chr4:81187554Chr4:81187556Chr4:81187575Chr4:81187575Chr4:81187592Chr4:81187601Chr4:81187605Chr4:81187610Chr4:81187648Chr4:81187652Chr4:81187679Chr4:81187685Chr4:81187691Chr4:81187693Chr4:81187707Chr4:81187712Chr4:81187733Chr4:81187735Chr4:81187752Chr4:81187758Chr4:81187764Chr4:81187784Chr19:57019212-57040269(ZNF471)Chr19:57019505Chr3:33191537-33260707(SUSD5)Chr3:33260601Chr3:33260621Chr3:33260631Chr3:33260640Chr3:33260651Chr3:33260665Chr3:33260676Chr3:33260694Chr3:33260698Chr3:33260711Chr3:33260715Chr3:33260732Chr3:33260742Chr3:33260748Chr3:33260755Chr3:33260760Chr3:33260769Chr3:33260776Chr3:33260778Chr3:33260780Chr3:33260788Chr3:33260806Chr2:56093097-56151298(EFEMP1)Chr2:56150376Chr2:56150389Chr2:56150394Chr2:56150415Chr2:56150419Chr2:56150423Chr2:56150433Chr2:56150473Chr2:56150475Chr2:56150478Chr2:56150499Chr2:56150537Chr2:56150549Chr2:56150580Chr2:56150601Chr6:134210259-134216675(TCF21)Chr7:94023873-94060544(COL1A2)Chr7:94024172Chr7:94024191Chr7:94024214Chr7:94024230Chr7:94024254Chr7:94024266Chr7:94024268Chr7:94024272Chr7:94024288Chr7:94024291Chr7:94024310Chr15:60296421-60298142(FOXB1)Chr16:86544133-86548070(FOXF1)Chr13:28494168-28500451(PDX1)Chr7:96649702-96654143(DLX5)Chr7:96650062Chr7:96650072Chr7:96650078Chr7:96650096Chr7:96650099Chr7:96650102Chr7:96651485Chr7:96651488Chr7:96651518Chr7:96651523Chr7:96651532Chr7:96651535Chr7:96651537Chr7:96651542Chr7:96651550Chr7:96651586Chr7:96653596Chr7:96653605Chr7:96653607Chr7:96653617Chr7:96653620Chr7:96653623Chr7:96653644Chr7:96653656Chr7:96653683Chr7:96653686Chr7:96653692Chr7:96653698Chr7:96653701Chr21:28208606-28217728(ADAMTS1)Chr13:110959631-111165373(COL4A2)Chr5:83238126-83680611(EDIL3)Chr5:83679825Chr5:83679827Chr5:83679836Chr5:83679843Chr5:83679846Chr5:83679860Chr5:83679864Chr5:83679883Chr5:83679894Chr5:83679900Chr5:83679906Chr5:83679910Chr5:83679937Chr5:83679953Chr5:83679957Chr5:83679961Chr5:83679976Chr5:83679982Chr5:83679987Chr5:83680003Chr5:83680007Chr5:83680011Chr5:83680026Chr5:83680032Chr5:83680086Chr5:83680090Chr5:83680103Chr5:83680106Chr5:83680122Chr5:83680126Chr5:83679546Chr5:83679568Chr5:83679571Chr5:83679585Chr5:83679602Chr5:83679617Chr5:83679630Chr5:83679640Chr5:83679667Chr5:83679675Chr5:83679689Chr5:83679693Chr5:83679699Chr5:83679701Chr5:83679733Chr5:83679973Chr5:83679989Chr5:83679992Chr5:83680001Chr5:83680003Chr5:83680006Chr5:83680012Chr5:83680015Chr5:83680019Chr5:83680033Chr5:83680036Chr5:83680045Chr5:83680051Chr5:83680061Chr5:83680063Chr5:83680066Chr5:83680108Chr5:83680115Chr5:83680118Chr5:83680132Chr5:83680147Chr5:83680159Chr5:83680174Chr5:83680181Chr5:83680185Chr5:83680198Chr5:83680205Chr5:83680209Chr5:83680217Chr5:83680232Chr5:83680235Chr5:83680237Chr5:83680253Chr5:83680108Chr5:83680115Chr5:83680118Chr5:83680132Chr5:83680147Chr5:83680159Chr5:83680174Chr5:83680181Chr5:83680185Chr5:83680198Chr5:83680205Chr5:83680209Chr5:83680217Chr5:83680232Chr5:83680235Chr5:83680237Chr5:83680253Chr5:83680264Chr5:83680284Chr5:83680310Chr5:83680326Chr5:83680355Chr5:83680401Chr5:83680406Chr5:83680409Chr5:83680411Chr5:83680413Chr5:83680430Chr5:83680438Chr5:83680441Chr5:83680444Chr5:83680458Chr5:83680463Chr5:83680474Chr5:83680483Chr5:83680485Chr5:83680488Chr5:83680492Chr5:83680497Chr5:83680499Chr5:83680507Chr5:83680509Chr5:83680513Chr5:83680518Chr5:83680529Chr5:83680531Chr5:83680548Chr5:83680559Chr5:83680564Chr5:83680568Chr5:83680572Chr5:83680579Chr5:83680589Chr5:83680591Chr5:83680593Chr5:83680596Chr5:83680602Chr15:48700503-48937985(FBN1)Chr1:47901689-47906363(FOXD2)Chr1:47899102Chr1:47899126Chr1:47899129Chr1:47899143Chr1:47899152Chr1:47899168Chr1:47899184Chr1:47899205Chr1:47899212Chr1:47899230Chr1:47899232Chr1:47899253Chr1:47899286Chr1:47899327Chr1:47909988Chr1:47909995Chr1:47910005Chr1:47910036Chr1:47910051Chr1:47910056Chr1:47910062Chr1:47910074Chr1:47910103Chr1:47910122Chr1:47910137Chr1:47910142Chr1:47910144Chr1:47910146Chr2:66662532-66799891(MEIS1)Chr2:66662043Chr2:66662047Chr2:66662049Chr2:66662063Chr2:66662073Chr2:66662107Chr2:66662111Chr2:66662124Chr2:66662145Chr2:66662156Chr2:66662161Chr2:66662163Chr2:66662178Chr2:66662218Chr2:66662178Chr2:66662218Chr2:66662220Chr2:66662246Chr2:66662265Chr2:66662280Chr2:66662306Chr2:66662310Chr2:66662323Chr2:66662333Chr2:66662337Chr16:55513081-55540586(MMP2)Chr7:24323807-24331484(NPY)Chr7:24323767Chr7:24323792Chr7:24323794Chr7:24323799Chr7:24323817Chr7:24323834Chr7:24323840Chr7:24323844Chr7:24323848Chr7:24323866Chr7:24323876Chr7:24323880Chr7:24323882Chr7:24323884Chr7:24323894Chr7:24323905Chr7:24323910Chr7:24323930Chr7:24323934Chr7:24324180Chr7:24324186Chr7:24324206Chr7:24324217Chr7:24324222Chr7:24324225Chr7:24324244Chr7:24324249Chr7:24324251Chr7:24324268Chr7:24324274Chr7:24324280Chr7:24324311Chr7:24324313Chr7:24324549Chr7:24324570Chr7:24324592Chr7:24324595Chr7:24324597Chr7:24324599Chr7:24324621Chr7:24324625Chr7:24324633Chr7:24324635Chr7:24324668Chr7:24324672Chr7:24324676Chr7:24324679Chr7:24324683Chr7:24324690Chr19:38741877-38747172(PPP1R14A)或对侧DNA链上位置n+1处的相应胞嘧啶,在来自所述个体的生物学样品中,其中相对于对照样品中相应残基的甲基化水平而言,一个或多个所述残基的较高甲基化水平指示有大肠瘤或瘤形成状态开始的倾向。在又一个方面,本发明涉及一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括评估DNA区域的表达水平,所述DNA区域选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:在来自所述个体的生物学样品中,其中相对于对照水平而言,组(i)和/或(ii)的DNA区域的较低表达水平指示有大肠瘤或瘤形成状态开始的倾向。本发明的一个相关方面提供分子阵列,所述阵列包含多个:(i)核酸分子或所述核酸分子的功能衍生物、片段、变体或同源物,所述核酸分子包含与下文描述的任何一个或多个肿瘤标记DNA相对应的核苷酸序列或与其显示至少80%同一性的序列;或(ii)核酸分子或所述核酸分子的功能衍生物、片段、变体或同源物,所述核酸分子包含能够在中等严格性条件下与(i)的任何一个或多个序列杂交的核苷酸序列;或(iii)核酸探针或寡核苷酸或所述核酸分子的功能衍生物、片段、变体或同源物,所述核酸探针或寡核苷酸包含能够在中等严格性条件下与(i)的任何一个或多个序列杂交的核苷酸序列;或(iv)能够与(i)的核酸分子编码的任何一种或多种蛋白质结合的探针或其衍生物、片段或同源物。其中所述(i)的标记基因或(iv)的蛋白质的表达水平指示源自大肠的细胞或细胞亚群的瘤形成状态。附图简述图1和图2分别描述表3和表4中显示的基因的差异性甲基化图。叠覆区域的染色体坐标在X-轴上显示。TaqI和MspI限制性位点的位置由垂直短划线指示。在Y-轴上显示(log2尺度)杂交强度。在每个探针位置上的栏中代表正常DNA和癌DNA的甲基化部分(分别是GN和GT)和它们的非甲基化部分(分别是AN和在AT)的信号。对于具有最高17%质量评分的探针,代表癌症和正常之间差异性甲基化的“双重-差异”(GT-GN)-(AT-AN)显示为黑色DD,对于具有顶级43%质量评分的那些探针,显示为灰色DD,并且对于具有较低质量评分或距离TaqI或MspI限制性位点超过300bp的那些探针,显示为灰点。为清晰起见,将全部DD探针点圈定。图3-26显示从来自24个基因的一个或多个扩增子的亚硫酸氢盐序列分析获得的DNA甲基化图。在每幅图中,上方框显示基因(Hg19序列)和各个扩增子的染色体坐标。DNA甲基化图显示如通过序列分析所确定的在每个CpG位点处甲基化胞嘧啶(Y-轴)的分数。在扩增子内部每个CpG位点的位置在X-轴上显示。各个灰色点代表10种癌DNA在每个CpG位点处的甲基化部分;这10份样品的平均甲基化由连续灰线显示并且四分位数范围由阴影区域显示。类似地,正常DNA样品的甲基化部分由黑色点显示,平均甲基化和四分位数分别由黑线和黑色阴影区域显示。血液DNA中的甲基化部分由浅灰色短划线显示(这经常因正常组织DNA的甲基化数据而模糊)。这些图也包括在亚硫酸氢盐修饰之前每个PCR扩增子的序列区域。在一些情况下,已经相对于转录基因的方向设计成底部链并且将这些标记为BS。在这些图底部的图标显示基因的染色体位置和地图,所述地图显示基因转录物的位置和外显子结构、AffymetrixU133Plus探针的位置和CpG岛位置以及不同扩增区域的位置。本发明的具体实施方案本发明部分地基于阐明表征大肠瘤的DNA甲基化状态。这项研究结果现在已经促进基于相对于对照水平而言某些基因增加的甲基化,开发筛查大肠瘤开始或开始的倾向或监测大肠瘤的例行手段。根据本发明,已经确定某些基因就它们的甲基化平的差异性变化而言受到调节,这取决于所讨论细胞是否为肿瘤性或不是肿瘤性的。应当理解所讨论的基因在本文中通过提到它们的名称和它们的染色体坐标来描述。Nimblegen启动子叠覆阵列的叠覆性区域的染色体坐标与人类基因组数据库Hg18版(在本文中称作“Hg18坐标”并且在表3和表4中详述)一致。与基因名称相对应的染色体坐标如此程度地列出,这些染色体坐标与2009年2月发布的人类基因组数据库Hg19版(本文中称作“Hg19坐标”)一致。因此,本发明的一个方面涉及一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估DNA区域的甲基化状态,所述DNA区域选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:其中相对于对照水平而言,组(i)和/或(ii)的DNA区域的较高甲基化水平指示有大肠瘤或大肠瘤形成状态开始的倾向。对“大肠”的指称应当理解为指称源自大肠的8个解剖区域之一的细胞,所述区域始于回肠的终端区域,这些区域是:(i)盲肠;(ii)升结肠;(iii)横结肠;(iv)降结肠;(v)乙状结肠;(vi)直肠;(vii)脾曲;和(viii)肝曲。对“肿瘤”的指称应当理解为指称包含肿瘤细胞的病灶、肿瘤或其他包囊化或未包囊化的块体或其他形式的生长物。“肿瘤细胞”应当理解指显示异常生长的细胞。术语“生长”应当以最广泛的意义理解并且包括增殖。在这方面,异常细胞生长的实例是细胞的失控增殖。另一个实例是细胞中凋亡失败,因此延长其寻常寿命。肿瘤细胞可以是良性细胞或恶性细胞。在一个优选实施方案中,主题肿瘤是腺瘤或腺癌。不使本发明限于任一理论或作用模式,腺瘤通常是上皮源良性肿瘤,其源自上皮组织或显示清晰界定的上皮结构。这些结构物可以采取腺状外观。它可能在腺瘤内部包含恶性细胞群体,如随良性腺瘤或良性肿瘤病灶进展成恶性腺癌而发生。优选地,所述肿瘤细胞是腺瘤或腺癌并且甚至更优选地是结直肠腺瘤或腺癌。对“DNA区域”的指称应当理解为指称基因组DNA的特定区段。这些DNA区域通过提到基因名称或一组染色体坐标来规定。这些基因名称和染色体坐标将均是本领域技术人员熟知和理解的。如本文中详述,针对Nimblegen启动子叠覆阵列上所分析的区域的染色体坐标对应于基因组的Hg18版,而描述相关基因符号的那些对应于基因组的Hg19版。通常,一个基因可以常规地通过参考其名称确定,其中可以借助所述名称常规地获得其序列和染色体位置,或常规地通过参考其染色体坐标确定,其中也可以借助所述染色体坐标常规地获得基因名称及其序列。对以上详述的每个基因区域的指称应当理解为指称这些分子的全部形式及其片段或变体。如本领域技术人员将领会,一些基因已知显示个体间等位变异或单核苷酸多态性。SNP包括不定尺寸的插入和缺失和简单序列重复序列,如二核苷酸和三核苷酸重复序列。变体包括来自相同区域的核酸序列,所述的相同区域相对于本文所述的DNA区域共有至少90%、95%、98%、99%序列同一性即具有一个或多个缺失、添加、置换、倒转序列等。因而,本发明应当理解为延伸至这类变体,其中就现有诊断应用而言,尽管如下事实:实际核酸序列之间的少量遗传性变异可能在个体之间存在,但是所述变体实现相同的结果。本发明因此应当理解为延伸至全部形式的DNA,它们源自任何其他的突变、多态性变异或等位变异。应当理解,作为测试主体的“个体”可以是任何的人类或非人类哺乳动物。非人类哺乳动物的实例包括灵长类、家畜动物(例如马、牛、羊、猪、驴)、实验室试验动物(例如小鼠、大鼠、兔、豚鼠)、伴侣动物(例如犬、猫)和圈养野生动物(例如鹿、狐)。优选地,哺乳动物是人。已经鉴定的基因群在大肠瘤细胞中相对于相应的非肿瘤细胞显示增加的甲基化。在一些情况下,这种增加的甲基化定位至DNA区域内部的少数特定CpG位点,而在其他情况下,观察到它横贯类型广泛的CpG位点。然而,虽然来自全部基因的特定区域显示增加的甲基化并且因此是有用的诊断标记,但是这些基因的几种提供特别好的灵敏度和特异性,原因为以下二者之一或二者:在更高比例的肿瘤中观察到升高的甲基化或在肿瘤组织和正常结肠组织或外周血白细胞之间它们的DNA甲基化水平的差异更大。根据这个实施方案,提供了一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估DNA区域的甲基化状态,所述DNA区域选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:其中相对于对照水平而言,组(i)和/或(ii)的DNA区域的较高甲基化水平指示有大肠瘤或大肠瘤形成状态开始的倾向。根据这些方面,在又一个实施方案中,所述对照水平是非肿瘤水平。根据这些本发明的多个方面,所述大肠组织优选地是结直肠组织。在又一个实施方案中,肿瘤是恶性的,如癌瘤。在又一个实施方案中,肿瘤是非恶性的,如腺瘤。不使本发明限于任一理论或作用模式,虽然在这些DNA区域范围内测量甲基化水平可诊断大肠瘤病症,但是已经确定独立的亚区域在这方面是特别有用,因为这些亚区域含有高密度的CpG二核苷酸,所述的CpG二核苷酸经常在大肠瘤形成(如结直肠癌)中过度甲基化。为此目的,也已经确定,在先前已知就大肠瘤背景下它们的表达水平而言下调的其他15个DNA区域的情况下,实际上存在独立的亚区域,所述亚区域显示特别高的过度甲基化CpG二核苷酸的密度。这项研究结果使这些亚区域成为特别有用的分析靶,因为它简化筛查过程,原因在于需要分析更短的更清晰限定的DNA区域并且进一步在于以下事实:与如果横跨整体的DNA区域进行这项分析将获得的结果相比,来自这些区域的结果将关于存在或不存在过度甲基化而提供明显更确定的结果。这项研究结果因此既简化筛查方法又增加大肠瘤形成诊断的灵敏度和特异性。将已经确定显示特殊用途的亚区域参考其中存在这些亚区域的基因和染色体区域在下文列出:(1)Chr12:52400748-52409671(GRASP)亚区域Chr12:52399672-52399922(SEQIDNO:15)、Chr12:52400821-52401119(SEQIDNO:16)和Chr12:52401407-52401664(SEQIDNO:17)。(2)Chr8:97505882-97624037(SDC2)亚区域Chr8:97506813-97507045(SEQIDNO:18)和Chr8:97507037-97507257(SEQIDNO:19)。(3)Chr13:110959094-110959330(SEQIDNO:20)(COL4A1)。(4)Chr5:3596168-3601517(IRX1)亚区域Chr5:3597227-3597480(SEQIDNO:21)、Chr5:3599990-3600175(SEQIDNO:22)、Chr5:3600160-3600352(SEQIDNO:23)和Chr5:3594657-3594847(SEQIDNO:24)。(5)Chr13:95361879-95364389(SOX21)亚区域Chr13:95364013-95364178(SEQIDNO:25)和Chr13:95364515-95364784(SEQIDNO:26)。(6)Chr4:81187742-81212171(FGF5)亚区域Chr4:81186918-81187228(SEQIDNO:27)、Chr4:81187326-81187578(SEQIDNO:28)和Chr4:81187571-81187792(SEQIDNO:29)。(7)Chr19:57019212-57040269(ZNF471)亚区域Chr19:57018955-57019135(SEQIDNO:30)和Chr19:57019294-57019573(SEQIDNO:31)。(8)Chr3:33191537-33260707(SUSD5)亚区域Chr3:33260566-33260818(SEQIDNO:32)。(9)Chr2:56093097-56151298(EFEMP1)亚区域Chr2:56150356-56150606(SEQIDNO:33)。(10)Chr6:134210259-134216675(TCF21)亚区域Chr6:134210545-134210749(SEQIDNO:34)、Chr6:134210712-134210951(SEQIDNO:35)和Chr6:134210994-134211274(SEQIDNO:36)。(11)Chr7:94023873-94060544(COL1A2)亚区域Chr7:94023751-94023975(SEQIDNO:37)和Chr7:94024141-94024345(SEQIDNO:38)。(12)Chr15:60296421-60298142(FOXB1)亚区域Chr15:60296522-60296719(SEQIDNO:39)和Chr15:60297024-60297305(SEQIDNO:40)。(13)Chr16:86544133-86548070(FOXF1)亚区域Chr16:86544560-86544770(SEQIDNO:41)、Chr16:86544265-86544584(SEQIDNO:42)和Chr16:86544795-86545110(SEQIDNO:43)。(14)Chr13:28494168-28500451(PDX1)亚区域Chr13:28502100-28502311(SEQIDNO:44)、Chr13:28502417-28502603(SEQIDNO:45)和Chr13:28503006-28503210(SEQIDNO:46)。(15)Chr7:96649702-96654143(DLX5)亚区域Chr7:96650026-96650127(SEQIDNO:47)、Chr7:96651454-96651618(SEQIDNO:48)和Chr7:96653553-96653732(SEQIDNO:49)。(16)Chr21:28208606-28217728(ADAMTS1)亚区域Chr21:28217946-28218109(SEQIDNO:50)、Chr21:28218494-28218777(SEQIDNO:51)和Chr21:28218859-28219017(SEQIDNO:52)。(17)Chr13:110959631-111165373(COL4A2)亚区域Chr13:110960787-110961141(SEQIDNO:53);Chr13:110961331-110961659(SEQIDNO:54)和Chr13:110959932-110960181(SEQIDNO:82);(18)Chr5:83238126-83680611(EDIL3)亚区域Chr5:83679544-83679807(SEQIDNO:55)、Chr5:83679784-83679988(SEQIDNO:56)、Chr5:83679960-83680263(SEQIDNO:57)、Chr5:83680075-83680383(SEQIDNO:58)和Chr5:83680356-83680630(SEQIDNO:59)。(19)Chr15:48700503-48937985(FBN1)亚区域Chr15:48938136-48938384(SEQIDNO:60)。(20)Chr1:47901689-47906363(FOXD2)亚区域Chr1:47899091-47899337(SEQIDNO:61)和Chr1:47909944-47910172(SEQIDNO:62)。(21)Chr2:66662532-66799891(MEIS1)亚区域Chr2:66662009-66662219(SEQIDNO:63)和Chr2:66662177-66662430(SEQIDNO:64)。(22)Chr16:55513081-55540586(MMP2)亚区域Chr16:55512662-55512856(SEQIDNO:65)和Chr16:55513916-55514215(SEQIDNO:66)。(23)Chr7:24323807-24331484(NPY)亚区域Chr7:24323765-24323936(SEQIDNO:67)、Chr7:24324150-24324342(SEQIDNO:68)和Chr7:24324513-24324717(SEQIDNO:69)。(24)Chr19:38741877-38747172(PPP1R14A)亚区域Chr19:38747251-38747424(SEQIDNO:70)和Chr19:38746653-38746912(SEQIDNO:71)。根据这个实施方案,因此提供了一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估一个或多个DNA区域的甲基化状态,所述DNA区域选自由Hg19坐标限定的区域:此时,相对于对照水平而言所述DNA区域的较高甲基化水平指示有大肠瘤形成或大肠瘤形成状态开始的倾向。在另一个实施方案中,所述肿瘤细胞是腺瘤或腺癌并且甚至更优选地是结直肠腺瘤或腺癌。在一个具体的实施方案中,因此提供了一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估一个或多个DNA区域的甲基化状态,所述DNA区域选自由Hg19坐标限定的区域:此时,相对于对照水平而言所述DNA区域的较高甲基化水平指示有大肠瘤形成或大肠瘤形成状态开始的倾向。在又一个实施方案中,所述DNA区域选自由Hg19坐标限定的区域:在另一个实施方案中,所述肿瘤细胞是腺瘤或腺癌并且甚至更优选地是结直肠腺瘤或腺癌。不使本发明限于任一理论或作用模式,DNA甲基化是在细菌、植物和动物中普遍的。DNA甲基化是一种类型的DNA化学修饰,所述化学修饰经过多轮细胞分裂是稳定的但是不涉及生物的基础性DNA序列的变化。染色质修饰和DNA修饰是表观遗传学的两个重要特征并且在细胞分化过程中发挥作用,允许细胞即便含有相同的基因组物质但仍稳定维持不同的特征。在真核生物中,DNA甲基化仅在胞嘧啶的嘧啶环的编号5碳处发生。在哺乳动物中,DNA甲基化大多在CpG二核苷酸的编号5碳处发生。CpG二核苷酸占据大约1%人类基因组。70-80%的全部CpG是甲基化的。CpG可以成簇地群集,称作“CpG岛”,其存在于许多基因的5'调节区中并且经常是非甲基化的。在许多疾病过程如癌症中,基因启动子和/或CpG岛获得异常的过度甲基化,这与可遗传的转录性沉默相关。DNA甲基化可以按两种方式影响基因的转录。首先,DNA的甲基化本身可以物理阻碍转录蛋白与基因结合,因此阻断转录。其次,甲基化DNA可以由称作甲基-CpG-结合结构域蛋白(MBD)的蛋白质结合。MBD蛋白随后召集额外的蛋白质至基因座,如组蛋白脱乙酰酶和可以修饰组蛋白从而形成紧凑无活性的染色质(称作沉默染色质)的他染色质重塑蛋白。DNA甲基化和染色质结构之间的这种联系是非常重要的。具体而言,甲基-CpG-结合蛋白2(MeCP2)的丢失已经在Rett综合征中显示意义并且甲基-CpG结合结构域蛋白2(MBD2)介导癌症中过度甲基化基因的转录性沉默。在人类中,DNA甲基化的过程由3种酶DNA甲基转移酶1、3a和3b(DNMT1、DNMT3a、DNMT3b)实施。认为DNMT3a和DNMT3b是在发育中早期建立DNA甲基化样式的从头甲基转移酶。DNMT1是提出的维护甲基转移酶,其负责在DNA复制期间将DNA甲基化样式拷贝至子代链。DNMT3L是与其他DNMT3同源但是没有催化活性的蛋白质。相反,DNMT3L通过以下方式辅助从头甲基转移酶:增加它们与DNA结合的能力并刺激它们的活性。最后,已经将DNMT2鉴定“神秘”DNA甲基转移酶同源物,其含有全部DNA甲基转移酶共同的全部10个序列基序;然而,DNMT2不可以使DNA甲基化,而相反已经显示使小RNA甲基化。“甲基化状态”应当因此理解为指甲基化在在DNA区域内部的一个特定核苷酸或多个核苷酸处的存在、不存在和/或其量。特定DNA序列(例如,如本文所述的DNA区域)的甲基化状态可以表示这个序列中每个碱基的甲基化状态,或可以表示这个序列中碱基对亚集的甲基化状态(例如,胞嘧啶的或一种或多种特异性限制性酶识别序列的甲基化状态),或可以表示这个序列内部关于区域甲基化密度的信息,而不提供该序列中哪里发生甲基化的精确信息。甲基化状态可以任选地由“甲基化值”代表或指示。可以例如通过对采用甲基化依赖性限制性酶进行限制酶切消化后存在的完整DNA的量定量,产生甲基化值。在这个实例中,如果DNA中的特定序列使用定量PCR定量,则与模拟处理的对照大致相等的模板DNA的量表示该序列未经高度甲基化,而比模拟处理的样品中出现的模板量明显更少的模板量表示甲基化的DNA在这个序列存在。因此,例如来自上述实例的值(即,甲基化值)代表甲基化状态并且因此可以用作甲基化状态的定量性指示物。当需要将样品中序列的甲基化状态与阈值比较是,这是特别有用的。本发明的方法基于生物学样品的特定DNA区域的甲基化水平与这些DNA区域的对照甲基化水平比较。“对照水平”是“正常水平”,所述正常水平是无肿瘤性的相应大肠细胞或细胞群体的DNA区域的或在可以从中分离DNA用于分析的另一个生物学样品中的甲基化水平。可以使用源自作为测试主体的相同个体的非肿瘤性组织确定正常(或“非肿瘤性”)甲基化水平。然而,将理解,这可能对于涉及的个体是相当有侵入性的,因此可能更便利的是相对于标准结果而分析检验结果,其中所述标准结果反映了从除所讨论的患者之外的个体所获得的单个或综合结果。后一种形式的分析实际上是优选的分析方法,因为它使设计试剂盒成为可能,其中所述试剂盒需要采集和分析作为目的测试样品的单一生物学样品。提供正常甲基化水平的标准结果可以通过本领域技术人员将熟知的任何适合手段计算。例如,可以就本发明的基因的甲基化水平评估一群正常组织,从而提供全部未来测试品针对其进行分析的标准值或值范围。也应当理解,正常水平可以从来自特定队列的受试者确定并相对于源自这个队列的测试样品使用。因此,可以存在确定的众多标准值或范围,它们对应于在多个特征如年龄、性别、种族性或健康状态方面不同的队列。所述“正常水平”可以是独立的水平或水平范围。相对于正常水平,主题基因的甲基化水平增加表示组织具有肿瘤性。术语“甲基化”应当理解为意指在核酸(例如基因组DNA)的区域内存在通过DNA甲基转移酶的作用向一个胞嘧啶碱基或多个碱基添加的甲基。如本文所述,存在本领域技术人员已知的用于确定核酸的甲基化水平或程度的几种方法。“更高水平”意指对照样品相比,在诊断的受试者中存在更高数目的甲基化CpG二核苷酸,即,在特定CpG位点处甲基化的DNA分子的比例更高或在受试者中存在更高数目的独立的甲基化CpG位点。应当理解术语“增强”和“增加”与术语“更高”互换使用。本发明不受被视为诊断出受试者中瘤形成的甲基化残基的精确数目限制,因为一些变异将在患者样品之间出现。本发明是也不受甲基化残基的位置限制。然而,也已经鉴定在这些亚区域内部经历过度甲基化的众多特定胞嘧啶残基。因此,在另一个实施方案中,可以使用一种筛查方法,所述筛查方法尤其涉及评估这些残基或在对侧DNA链上位置n+1内的相应胞嘧啶中一者或多者的甲基化状态。为此目的,下文列出已经在这方面鉴定到的胞嘧啶残基。本领域技术人员应当理解通过,这些独立残基通过参考Hg19进行编号,其中所述Hg19也对应于本文中列出的特定亚区域的编号并且当给每个亚区域编号的坐标应用于序列表中提供的相应亚区域序列时可以进一步被确定。应当理解已经在亚区域DNA的背景下鉴定这些残基。然而,在这些亚区域自身之外但在衍生这些亚区域的较大DNA区域范围内部存在过度甲基化的其他残基。因此,这些指定的残基代表一个特别有用的独立胞嘧啶残基亚集,其中所述胞嘧啶残基在本文公开的DNA区域和亚区域的背景范围内经历过度甲基化。这些独立残基根据它们在其中出现的DNA区域如下分组。这些DNA区域通过参考Hg19染色体坐标和基因区域名称确定。根据这个实施方案,因此提供了一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估一个或多个胞嘧啶残基的甲基化状态,所述DNA区域选自:Chr12:52400748-52409671(GRASP)Chr8:97505882-97624037(SDC2)Chr8:97506843Chr8:97506845Chr8:97506861Chr8:97506876Chr8:97506902Chr8:97506909Chr8:97506911Chr8:97506913Chr8:97506924Chr8:97506932Chr8:97506934Chr8:97506940Chr8:97506977Chr8:97506993Chr8:97507005Chr8:97507008Chr8:97507014Chr8:97507038Chr8:97507061Chr8:97507064Chr8:97507078Chr8:97507082Chr8:97507084Chr8:97507089Chr8:97507119Chr8:97507128Chr8:97507136Chr8:97507144Chr8:97507153Chr8:97507162Chr8:97507214Chr8:97507216Chr13:110959094-110959330(COL4A1).Chr5:3596168-3601517(IRX1)Chr13:95361879-95364389(SOX21)Chr4:81187742-81212171(FGF5)Chr4:81186919Chr4:81186947Chr4:81186964Chr4:81186968Chr4:81186973Chr4:81186975Chr4:81186983Chr4:81187001Chr4:81187011Chr4:81187041Chr4:81187056Chr4:81187062Chr4:81187093Chr4:81187116Chr4:81187125Chr4:81187161Chr4:81187191Chr4:81187196Chr4:81187198Chr4:81187367Chr4:81187389Chr4:81187458Chr4:81187467Chr4:81187495Chr4:81187498Chr4:81187504Chr4:81187512Chr4:81187514Chr4:81187530Chr4:81187539Chr4:81187547Chr4:81187549Chr4:81187551Chr4:81187554Chr4:81187556Chr4:81187575Chr4:81187575Chr4:81187592Chr4:81187601Chr4:81187605Chr4:81187610Chr4:81187648Chr4:81187652Chr4:81187679Chr4:81187685Chr4:81187691Chr4:81187693Chr4:81187707Chr4:81187712Chr4:81187733Chr4:81187735Chr4:81187752Chr4:81187758Chr4:81187764Chr4:81187784Chr19:57019212-57040269(ZNF471)Chr3:33191537-33260707(SUSD5)Chr3:33260601Chr3:33260621Chr3:33260631Chr3:33260640Chr3:33260651Chr3:33260665Chr3:33260676Chr3:33260694Chr3:33260698Chr3:33260711Chr3:33260715Chr3:33260732Chr3:33260742Chr3:33260748Chr3:33260755Chr3:33260760Chr3:33260769Chr3:33260776Chr3:33260778Chr3:33260780Chr3:33260788Chr3:33260806Chr2:56093097-56151298(EFEMP1)Chr2:56150376Chr2:56150389Chr2:56150394Chr2:56150415Chr2:56150419Chr2:56150423Chr2:56150433Chr2:56150473Chr2:56150475Chr2:56150478Chr2:56150499Chr2:56150537Chr2:56150549Chr2:56150580Chr2:56150601Chr6:134210259-134216675(TCF21)Chr7:94023873-94060544(COL1A2)Chr7:94024172Chr7:94024191Chr7:94024214Chr7:94024230Chr7:94024254Chr7:94024266Chr7:94024268Chr7:94024272Chr7:94024288Chr7:94024291Chr7:94024310Chr15:60296421-60298142(FOXB1)Chr16:86544133-86548070(FOXF1)Chr13:28494168-28500451(PDX1)Chr7:96649702-96654143(DLX5)Chr7:96650062Chr7:96650072Chr7:96650078Chr7:96650096Chr7:96650099Chr7:96650102Chr7:96651485Chr7:96651488Chr7:96651518Chr7:96651523Chr7:96651532Chr7:96651535Chr7:96651537Chr7:96651542Chr7:96651550Chr7:96651586Chr7:96653596Chr7:96653605Chr7:96653607Chr7:96653617Chr7:96653620Chr7:96653623Chr7:96653644Chr7:96653656Chr7:96653683Chr7:96653686Chr7:96653692Chr7:96653698Chr7:96653701Chr21:28208606-28217728(ADAMTS1)Chr13:110959631-111165373(COL4A2)Chr5:83238126-83680611(EDIL3)Chr5:83679825Chr5:83679827Chr5:83679836Chr5:83679843Chr5:83679846Chr5:83679860Chr5:83679864Chr5:83679883Chr5:83679894Chr5:83679900Chr5:83679906Chr5:83679910Chr5:83679937Chr5:83679953Chr5:83679957Chr5:83679961Chr5:83679976Chr5:83679982Chr5:83679987Chr5:83680003Chr5:83680007Chr5:83680011Chr5:83680026Chr5:83680032Chr5:83680086Chr5:83680090Chr5:83680103Chr5:83680106Chr5:83680122Chr5:83680126Chr5:83679546Chr5:83679568Chr5:83679571Chr5:83679585Chr5:83679602Chr5:83679617Chr5:83679630Chr5:83679640Chr5:83679667Chr5:83679675Chr5:83679689Chr5:83679693Chr5:83679699Chr5:83679701Chr5:83679733Chr5:83679973Chr5:83679989Chr5:83679992Chr5:83680001Chr5:83680003Chr5:83680006Chr5:83680012Chr5:83680015Chr5:83680019Chr5:83680033Chr5:83680036Chr5:83680045Chr5:83680051Chr5:83680061Chr5:83680063Chr5:83680066Chr5:83680108Chr5:83680115Chr5:83680118Chr5:83680132Chr5:83680147Chr5:83680159Chr5:83680174Chr5:83680181Chr5:83680185Chr5:83680198Chr5:83680205Chr5:83680209Chr5:83680217Chr5:83680232Chr5:83680235Chr5:83680237Chr5:83680253Chr5:83680108Chr5:83680115Chr5:83680118Chr5:83680132Chr5:83680147Chr5:83680159Chr5:83680174Chr5:83680181Chr5:83680185Chr5:83680198Chr5:83680205Chr5:83680209Chr5:83680217Chr5:83680232Chr5:83680235Chr5:83680237Chr5:83680253Chr5:83680264Chr5:83680284Chr5:83680310Chr5:83680326Chr5:83680355Chr5:83680401Chr5:83680406Chr5:83680409Chr5:83680411Chr5:83680413Chr5:83680430Chr5:83680438Chr5:83680441Chr5:83680444Chr5:83680458Chr5:83680463Chr5:83680474Chr5:83680483Chr5:83680485Chr5:83680488Chr5:83680492Chr5:83680497Chr5:83680499Chr5:83680507Chr5:83680509Chr5:83680513Chr5:83680518Chr5:83680529Chr5:83680531Chr5:83680548Chr5:83680559Chr5:83680564Chr5:83680568Chr5:83680572Chr5:83680579Chr5:83680589Chr5:83680591Chr5:83680593Chr5:83680596Chr5:83680602Chr15:48700503-48937985(FBN1)Chr1:47901689-47906363(FOXD2)Chr1:47899102Chr1:47899126Chr1:47899129Chr1:47899143Chr1:47899152Chr1:47899168Chr1:47899184Chr1:47899205Chr1:47899212Chr1:47899230Chr1:47899232Chr1:47899253Chr1:47899286Chr1:47899327Chr1:47909988Chr1:47909995Chr1:47910005Chr1:47910036Chr1:47910051Chr1:47910056Chr1:47910062Chr1:47910074Chr1:47910103Chr1:47910122Chr1:47910137Chr1:47910142Chr1:47910144Chr1:47910146Chr2:66662532-66799891(MEIS1)Chr2:66662043Chr2:66662047Chr2:66662049Chr2:66662063Chr2:66662073Chr2:66662107Chr2:66662111Chr2:66662124Chr2:66662145Chr2:66662156Chr2:66662161Chr2:66662163Chr2:66662178Chr2:66662218Chr2:66662178Chr2:66662218Chr2:66662220Chr2:66662246Chr2:66662265Chr2:66662280Chr2:66662306Chr2:66662310Chr2:66662323Chr2:66662333Chr2:66662337Chr16:55513081-55540586(MMP2)Chr16:55512695Chr16:55512711Chr16:55512732Chr16:55512750Chr16:55512753Chr16:55512793Chr7:24323807-24331484(NPY)Chr7:24323767Chr7:24323792Chr7:24323794Chr7:24323799Chr7:24323817Chr7:24323834Chr7:24323840Chr7:24323844Chr7:24323848Chr7:24323866Chr7:24323876Chr7:24323880Chr7:24323882Chr7:24323884Chr7:24323894Chr7:24323905Chr7:24323910Chr7:24323930Chr7:24323934Chr7:24324180Chr7:24324186Chr7:24324206Chr7:24324217Chr7:24324222Chr7:24324225Chr7:24324244Chr7:24324249Chr7:24324251Chr7:24324268Chr7:24324274Chr7:24324280Chr7:24324311Chr7:24324313Chr7:24324549Chr7:24324570Chr7:24324592Chr7:24324595Chr7:24324597Chr7:24324599Chr7:24324621Chr7:24324625Chr7:24324633Chr7:24324635Chr7:24324668Chr7:24324672Chr7:24324676Chr7:24324679Chr7:24324683Chr7:24324690Chr19:38741877-38747172(PPP1R14A)或对侧DNA链上位置n+1处的相应胞嘧啶,其中相对于对照样品中相应残基的甲基化水平而言,一个或多个所述残基的较高甲基化水平指示有大肠瘤或瘤形成状态开始的倾向。在另一个实施方案中,所述一个或多个胞嘧啶残基选自GRASP、SDC2、COL4A1、IRX1、SOX21、FGF5、ZNF471、SUSD5、EFEMP1、TCF21、COL1A2、FOXB1、FOXF1、PDX1和DLX5。在一个具体实施方案中,所述一个或多个胞嘧啶残基选自:Chr12:52400748-52409671(GRASP)Chr8:97505882-97624037(SDC2)Chr8:97506843Chr8:97506845Chr8:97506861Chr8:97506876Chr8:97506902Chr8:97506909Chr8:97506911Chr8:97506913Chr8:97506924Chr8:97506932Chr8:97506934Chr8:97506940Chr8:97506977Chr8:97506993Chr8:97507005Chr8:97507008Chr8:97507014Chr8:97507038Chr8:97507061Chr8:97507064Chr8:97507078Chr8:97507082Chr8:97507084Chr8:97507089Chr8:97507119Chr8:97507128Chr8:97507136Chr8:97507144Chr8:97507153Chr8:97507162Chr8:97507214Chr8:97507216Chr13:110959094-110959330(COL4A1).Chr13:95361879-95364389(SOX21)Chr4:81187742-81212171(FGF5)Chr4:81186919Chr4:81186947Chr4:81186964Chr4:81186968Chr4:81186973Chr4:81186975Chr4:81186983Chr4:81187001Chr4:81187011Chr4:81187041Chr4:81187056Chr4:81187062Chr4:81187093Chr4:81187116Chr4:81187125Chr4:81187161Chr4:81187191Chr4:81187196Chr4:81187198Chr19:57019212-57040269(ZNF471)Chr3:33191537-33260707(SUSD5)Chr3:33260601Chr3:33260621Chr3:33260631Chr3:33260640Chr3:33260651Chr3:33260665Chr3:33260676Chr3:33260694Chr3:33260698Chr3:33260711Chr3:33260715Chr3:33260732Chr3:33260742Chr3:33260748Chr3:33260755Chr3:33260760Chr3:33260769Chr3:33260776Chr3:33260778Chr3:33260780Chr3:33260788Chr3:33260806Chr2:56093097-56151298(EFEMP1)Chr2:56150376Chr2:56150389Chr2:56150394Chr2:56150415Chr2:56150419Chr2:56150423Chr2:56150433Chr2:56150473Chr2:56150475Chr2:56150478Chr2:56150499Chr2:56150537Chr2:56150549Chr2:56150580Chr2:56150601Chr6:134210259-134216675(TCF21)Chr7:94023873-94060544(COL1A2)Chr7:94024172Chr7:94024191Chr7:94024214Chr7:94024230Chr7:94024254Chr7:94024266Chr7:94024268Chr7:94024272Chr7:94024288Chr7:94024291Chr7:94024310Chr15:60296421-60298142(FOXB1)Chr16:86544133-86548070(FOXF1)Chr13:28494168-28500451(PDX1)Chr7:96649702-96654143(DLX5)Chr7:96653596Chr7:96653605Chr7:96653607Chr7:96653617Chr7:96653620Chr7:96653623Chr7:96653644Chr7:96653656Chr7:96653683Chr7:96653686Chr7:96653692Chr7:96653698Chr7:96653701本发明的检测方法可以对任何适合的生物学样品进行。为此目的,对“生物学样品”的指称应当理解为指称生物材料的任何样品,其源自动物,如但不限于细胞材料、生物流体(例如血液)、粪便、组织活组织检查标本、手术标本或已经导入动物身体中并且随后取出的流体(如,例如,从灌肠洗涤中抽回的溶液)。根据本发明方法检验的生物学样品可以直接进行检验或可能在检验之前需要某种形式的处理。例如,活组织检查或手术样品可能在检验之前需要匀浆或它可以需要切片用于原位检验各个基因的定性表达水平。可选地,细胞样品可能在检验之前需要透化。另外,就生物学样品不处于液体形式而言,(如果要求这类形式用于检验),可能需要添加试剂,如缓冲液,以便动员样品。就目的DNA区域在生物学样品中存在而言,可以直接检验生物学样品或可以在检验之前分离生物学样品中存在的其他全部或一些核酸。在又一个实例中,可以在分析之前部分纯化或否则富集样品。例如,就生物学样品包含非常多样的细胞群体而言,可能需要富集特定目的亚群。在检验之前处理靶细胞群体或源自其中的分子(例如,病毒失活)处于本发明的范围内。也应当理解,生物学样品可以新鲜收获或它可以在检验之前已经贮存(例如通过冷冻)或否则在检验之前处理(如通过进行培养)。哪种类型样品最合适根据本文中公开的方法检验的选择将取决于情况的性质。优选地,所述样品是粪便(粪便)样品、灌肠洗涤、手术切除、组织活组织检查样品或血液样品(例如全血、血清或血浆)。更优选地,所述生物学样品是血液样品、活组织检查样品或粪便样品。如本文中之前详述,将本发明设计成筛查位于大肠中的肿瘤细胞或细胞群体。因此,对“细胞或细胞群体”的指称应当理解为指称个体细胞或细胞群组。所述细胞群组可以是弥散细胞群组、细胞悬液、包囊化细胞群组或采取组织形式的细胞群组。对肿瘤(如腺瘤或腺癌)“开始”的指称应当理解为指称显示异型增生的的个体的一个或多个细胞。在这方面,腺瘤或腺癌可以充分发挥,以至已经形成一团发育不良性细胞。可选地,腺瘤或腺癌可以处在极早期,在于仅相对少的异常细胞分裂已经在诊断时发生。本发明也延伸至评估个体形成肿瘤(如腺瘤或腺癌)的倾向。不以任何方式限制本发明,改变的甲基化水平可以表示个体发生瘤形成(如未来形成一种腺瘤或腺癌或另一种腺瘤或腺癌)的倾向预测。虽然优选的方法是出于诊断瘤形成发展或其倾向的目的评估甲基化水平,但是可以在某些情况下需要检测所述甲基化水平的相反变化,例如,以监测涉及调节肿瘤性病状,如腺瘤或腺癌发展的治疗性或预防性疗法的有效性。例如,其中升高的的甲基化水平表示个体已经形成以腺瘤或腺癌发展为特征的病状,而筛查到开始一种治疗性治疗方案后甲基化水平下降可以用来指示成功清除肿瘤细胞。在另一个实例中,可以使用这种方法检验肿瘤切除边缘处的组织,以便确定测定是否已经去除全部肿瘤边缘。本发明方法因此可以用于疾病风险的诊断、倾向、分类、预测、检测疾病复发,选择众多类型瘤形成的疗法和监测瘤形成。可以检测处于任何进展阶段的癌症,如原发性、转移性和复发性癌症。本发明提供用于以下目的的方法:确定哺乳动物(例如,人)是否具有大肠的瘤形成、取自哺乳动物的生物学样品是否含有肿瘤细胞或源自肿瘤细胞的DNA、评估哺乳动物形成肿瘤的风险或可能性、监测抗癌疗法的功效或在患有癌症的哺乳动物中选择适宜的抗癌疗法。这类方法基于确定肿瘤细胞在本文所述的DNA区域中具有与正常细胞不同的甲基化状态。因此,通过确定细胞在如本文所述的DNA区域中是否含有差异性甲基化的序列,可以测定细胞是肿瘤性的。本发明的方法可以用来评价已知或疑似具有瘤形成的个体或作为常规临床试验,即,在并不必然疑似具有瘤形成的个体中进行评价。可以进行其他诊断测定法以证实个体中瘤形成的状态。另外,本发明的方法可以用来评估治疗过程的功效。例如,可以在患有癌症的哺乳动物中随时间推移通过监测本文所述的序列的DNA甲基化,评估抗癌疗法的功效。例如,与从治疗之前或治疗早期的哺乳动物取得的样品中的水平相比,在从治疗后的哺乳动物取得的生物学样品中本发明的任何诊断性序列的甲基化减少或不存在表示有效治疗。本发明方法因此用作一次性试验或用作据认为存在瘤形成发展风险的那些个体的持续监测或用作涉及抑制或减慢瘤形成发展的治疗性或预防性治疗方案的有效性的监测。在这些情况下,确定任何一种或多种类型的生物学样品中甲基化水平的调节是个体状态或当前使用的治疗性或预防性方案的有效性的有价值指示物。因而,本发明的方法应当理解为延伸至监测个体中甲基化水平相对于其正常水平(如本文中限定)或相对于从所述个体的生物学样品所确定的一个或多个早期甲基化水平的增加或下降。用于检测瘤形成的方法可以包含检测癌相关的一个或多个其他多核苷酸或多肽序列。因此,通过本发明方法检测甲基化可以单独或与用于诊断或预测瘤形成的其他筛查方法组合使用。可以在本发明方法中使用用于检测DNA甲基化的任何方法。众多方法可用于原代组织样品中或患者样品如血液、尿粪便或唾液中检测在特定基因座处差异性甲基化的DNA(综述见Kristensen和HansenClinChem.55:1471-83,2009;Ammerpohl等人,BiochimBiophysActa.1790:847-62,2009;Shames等人,CancerLett.251:187-98,2007;Clark等人,NatProtoc.1:2353-64,2006)。为了分析靶基因中DNA甲基化的比例或程度,DNA正常情况下用亚硫酸氢钠处理,使用与甲基化状态无关地扩增DNA的引物和PCR条件扩增目的区域。随后可以通过测序(包括焦磷酸测序法)、限制性酶消化(COBRA)或通过解链曲线分析法评估整体扩增子或各个CpG位点的甲基化。可选地,可以使用基于连接的用于分析特定CpG位点处甲基化的方法。正在开发异常甲基化DNA的检测作为癌症诊断的手段,其中所述异常甲基化DNA从肿瘤中释放并进入体液。这里,在过度甲基化的序列情况下,需要使用允许从未甲基化的正常细胞DNA的背景中选择性扩增甲基化DNA序列的敏感方法。这类方法基于亚硫酸氢盐处理的DNA,例如;包括甲基化选择性PCR(MSP)、重度甲基(Heavymethyl)PCR、HeadloopPCR和辅助物依赖性链反应(Helper-dependentchainreaction)(PCT/AU2008/001475)。简而言之,在一些实施方案中,用于检测甲基化的方法包括随机剪切或随机片段化基因组DNA、用甲基化依赖性或甲基化敏感性限制性酶切割DNA并且随后选择性鉴定和/或分析切割或未切割的DNA。选择性鉴定例如可以包括分离切割或未切割的DNA(例如,按大小)并且定量经切割或可选地未经切割目的序列。见,例如,美国专利号7,186,512。可选地,该方法可以包括在限制性酶消化后扩增完整DNA,从而仅扩增在所扩增的区域内未遭限制性酶切割的DNA。见,例如,美国专利申请系列号10/971,986;11/071,013;和10/971,339。在一些实施方案中,可以使用具有基因特异性的引物进行扩增。可选地,可以将衔接子添加至随机片段化的DNA的末端,这种DNA可以用甲基化依赖性或甲基化敏感性限制性酶消化,可以使用与衔接子序列杂交的引物扩增完整的DNA。在这种情况下,可以进行第二步骤以确定特定基因在中扩增的DNA汇集物中的存在、不存在或其量。在一些实施方案中,使用实时定量PCR扩增DNA。在一些实施方案中,这些方法包括对基因组DNA群体内部的靶序列中的平均甲基化密度定量。在一些实施方式中,所述方法包括:使基因组DNA与甲基化限制性酶或甲基化敏感性限制性酶在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下接触;对基因座的完整拷贝定量;并且将扩增产物的量与代表对照DNA的甲基化的量的对照值比较,从而与对照DNA的甲基化密度相比,对基因座中的平均甲基化密度定量。可以通过以下方式确定DNA的基因座的甲基化的量:提供包含这个基因座的基因组DNA的样品,用甲基化敏感或甲基化依赖的限制性酶切割DNA,并且随后对完整DNA的量定量或对目的DNA基因座处切割的DNA的量定量。完整或切割的DNA的量将取决于含有这个基因座的基因组DNA的初始量、该基因座中甲基化的量和该基因座中在基因组DNA中甲基化的核苷酸的数目(即,份数)。可以通过将完整DNA或切割的DNA的量与对照值比较,确定DNA基因座中甲基化的量,其中所述对照值代表完整DNA或切割的DNA在类似处理的DNA样品中的量。对照值可以代表已知或预测的甲基化核苷酸数目。可选地,对照值可以代表来自另一个(例如,正常、不患病的)细胞中的相同基因座或第二基因座的完整或切割的DNA的量。通过使用在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下至少一种甲基化敏感性或甲基化限制性酶并且随后对剩余完整拷贝定量并且将这个量与对照比较,可以确定基因座的平均甲基化密度。甲基化敏感酶是如果DNA的识别序列未甲基化则切割这种DNA的一种酶,而如果DNA的识别序列甲基化,则甲基化依赖酶切割这种DNA。如果使甲基化敏感性限制性酶与DNA基因座的拷贝在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下接触,则剩余的完整DNA将完全与甲基化密度成正比,并且因此可以与对照比较以便确定样品中基因座的相对甲基化密度。类似地,如果使甲基化依赖性限制性酶与DNA基因座的拷贝在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下接触,则剩余的完整DNA将与甲基化密度成反比,并且因此可以与对照比较以便确定样品中基因座的相对甲基化密度。此类测定法在例如美国专利申请系列号10/971,986中公开。用于以上方法的试剂盒可以例如包含甲基化依赖性限制性酶、甲基化敏感性限制性酶、扩增(例如,PCR)试剂、探针和/或引物中的一种或多种。定量性扩增方法(例如,定量PCR或定量性线性扩增)可以用来在限制酶切消化后对侧翼分布有扩增引物的基因座内部的完整DNA的量定量。定量性扩增方法在例如美国专利号6,180,349;6,033,854;和5,972,602中以及在例如,Gibson等人,GenomeResearch6:995-1001(1996);DeGraves等人,Biotechniques34(1):106-10,112-5(2003);DeimanB等人,Mol.Biotechnol.20(2):163-79(2002)中公开。可以“实时”监测扩增。用于检测DNA甲基化的额外方法可以涉及对亚硫酸氢盐处理DNA之前和之后的基因组测序。见,例如,Frommer等人,Proc.Natl.Acad.Sci.USA89:1827-1831(1992)。当亚硫酸氢钠与DNA接触时,非甲基化胞嘧啶转化成尿嘧啶,而甲基化的胞嘧啶不受修饰。在一些实施方案中,从亚硫酸氢盐转化的DNA中扩增的PCR产物的限制性酶消化法用来检测DNA甲基化。见,例如,Sadri和Hornsby,Nucl.AcidsRes.24:5058-5059(1996);Xiong和Laird,NucleicAcidsRes.25:2532-2534(1997)。在一些实施方案中,将甲基化特异性PCR(“MSP”)反应单独或与检测DNA甲基化的其他方法组合使用。MSP测定法通过亚硫酸氢钠引起DNA的初始修饰,所述亚硫酸氢钠将全部未甲基化胞嘧啶而不将非甲基化胞嘧啶转化成尿嘧啶,并且随后用相对于非甲基化DNA对甲基化DNA特异的引物用扩增。见,Herman等人,Proc.Natl.Acad.Sci.USA93:9821-9826(1996),(1996);美国专利号5,786,146。在一些实施方案中,将MethyLight测定法单独或与检测DNA甲基化的其他方法组合使用。(见,Eads等人,CancerRes.59:2302-2306(1999))。简而言之,在MethyLight方法中,将基因组DNA在亚硫酸氢钠反应中转化(亚硫酸氢盐过程使非甲基化胞嘧啶残基转化成尿嘧啶)。随后使用与CpG二核苷酸杂交的PCR引物进行目的DNA序列的扩增。通过使用仅与因亚硫酸氢盐转化甲基化DNA所产生的序列(或可选地与未甲基化序列)序列杂交的引物,扩增可以表示与引物杂交的序列的甲基化状态。另外,可以用与序列特异性结合的探针检测扩增产物,所述序列因亚硫酸氢盐处理非甲基化DNA产生。如果需要,引物和探针均可以用来检测甲基化状态。因此,与MethyLight一起使用的试剂盒可以包括亚硫酸氢钠以及区分已经用亚硫酸氢盐处理的甲基化和非甲基化DNA的引物或以可检测方式标记的探针(包括但不限于Taqman或分子信标探针)。其他试剂盒组分例如可以包括扩增DNA所必需的试剂,包括但不限于PCR缓冲液、脱氧核苷酸;和热稳定性聚合酶。在一些实施方案中,将Ms-SNuPE(甲基化敏感性单核苷酸引物延伸)反应单独或与检测DNA甲基化的其他方法组合使用(见,Gonzalgo和Jones,NucleicAcidsRes.25:2529-2531(1997))。Ms-SNuPE技术是一种基于亚硫酸氢盐处理DNA、随后单核苷酸引物延伸而评估特定CpG位点处甲基化差异的定量方法(Gonzalgo和Jones,上文)。简而言之,基因组DNA与亚硫酸氢钠反应以使未甲基化的胞嘧啶转化成尿嘧啶而留下5-甲基胞嘧啶不变。随后使用对亚硫酸氢盐转化的DNA特异的PCR引物进行所需靶序列的扩增,并且分离所得到的产物并且用作目的CpG位点处分析甲基化的模板。用于Ms-SNuPE分析的常见试剂(例如,如可能在基于Ms-SNuPE的常见试剂盒中找到)可以包括但不限于:特定基因(或甲基化改变的DNA序列或CpG岛)的PCR引物;优化的PCR缓冲液和脱氧核苷酸;凝胶提取试剂盒;阳性对照引物;用于特定基因的Ms-SNuPE引物;反应缓冲液(用于Ms-SNuPE反应);和以可检测方式标记的核苷酸。额外地,亚硫酸氢盐转化试剂可以包括:DNA变性缓冲液;磺化缓冲液;DNA回收试剂或试剂盒(例如,沉淀、超滤、亲和柱);脱磺酸基缓冲液;和DNA回收组分。额外的甲基化检测方法包括但不限于甲基化CpG岛扩增法(见,Toyota等人,CancerRes.59:2307-12(1999))和在例如美国专利公开2005/0069879;Rein等人,NucleicAcidsRes.26(10):2255-64(1998);Olek等人,Nat.Genet.17(3):275-6(1997);和PCT公开号WO00/70090中描述的那些。下文提供与一般描述的这些方法中几种方法相关的更详细信息:(a)探针或引物设计和/或产生本文所述的用于诊断瘤形成的几种方法使用一种或多种探针和/或引物。用于设计例如在PCR或杂交中使用的探针和/或引物的方法是本领域已知的并且在例如Dieffenbach和Dveksler(编著)(引自:PCRPrimer:ALaboratoryManual,ColdSpringHarborLaboratories,NY,1995)中描述。另外,为多种测定法设计最佳探针和/或引物的的几种软件包是公众可获得的,例如从美国马萨诸塞州Cambridge的基因组研究中心(CenterforGenomeResearch,Cambridge,Mass.,USA)可获得的Primer3。显然,应当在其设计期间考虑探针或引物的可能用途。例如,如果产生探针或引物用于甲基化特异性PCR或连接酶链反应(LCR)测定法,则在3'末端的核苷酸(或在LCR情况下5'末端)应当优选地对应于核酸中的甲基化核苷酸。评估用于检测与瘤形成相关的序列的探针和/或引物,例如,以便确定不形成发夹、不自我引发或不形成引物二聚体(例如不与检测测定法中所用的另一个探针或引物形成引物二聚体)的那些。另外,经常评估探针或引物(或其序列)以确定它从靶核酸变性的温度(即探针或引物的解链温度或Tm)。用于估计Tm的方法是本领域已知的并且例如在SantaLucia,Proc.Natl.Acad.Sci.USA,95:1460-1465,1995或Bresslauer等人,Proc.Natl.Acad.Sci.USA,83:3746-3750,1986中描述。用于产生/合成本发明探针或引物的方法是本领域已知的。例如,寡核苷酸合成在Gait(编著)(引自:OligonucleotideSynthesis:APracticalApproach,IRLPress,Oxford,1984)中描述。例如,探针或引物可以通过生物学合成法(例如通过用限制性核酸内切酶消化核酸)或通过化学合成法获得。对于短序列(至多到约100个核苷酸),化学合成法是优选的。对于较长序列,分子生物学中使用的标准复制方法是有用的,例如,对于单链DNA,使用M13,如Messing,MethodsEnzymol,101,20-78,1983所述。用于寡核苷酸合成的其他方法例如包括磷酸三酯方法和磷酸二酯方法(Narang等人,Meth.Enzymol68:90,1979)和支持物上合成法(Beaucage等人,TetrahedronLetters22:1859-1862,1981)以及磷酰胺酯技术,Caruthers,M.H.等人,MethodsinEnzymology,第154卷,第287-314页(1988)和在"SynthesisandApplicationsofDNAandRNA,"S.A.Narang,editor,AcademicPress,NewYork,1987及其中引用的参考文献中描述的其他方法。例如,包含锁定核酸(LNA)的探针如Nielsen等人,Chem.Soc.PerkinTrans.,1:3423,1997;Singh和Wengel,Chem.Commun.1247,1998中所述那样合成。同时,包含肽-核酸(PNA)的探针如Egholm等人,Am.Chem.Soc.,114:1895,1992;Egholm等人,Nature,365:566,1993;和Orum等人,Nucl.AcidsRes.,21:5332,1993中所述那样合成。(b)DNA的甲基化敏感性核酸内切酶消化在一个实例中,使用下述方法确定样品中增加的甲基化,所述方法包括用一定量的甲基化敏感性限制性核酸内切酶在足以消化核酸的条件下处理核酸并且随后检测产生的片段。示例性甲基化敏感性核酸内切酶例如包括HhaI或HpaII。优选地,测定法包括内对照用与所用甲基化敏感酶具有相同特异性的甲基化不敏感性酶消化。例如,甲基化酶不敏感性MspI是甲基化敏感酶HpaII的同裂酶。杂交分析模式在一个实例中,通过探针或引物与未消化的核酸的选择性杂交检测核酸的消化可选地,探针选择性地与消化的和未消化的核酸杂交,但是例如通过电泳促进这两种形式之间的区分。实现与杂交探针的选择性杂交的合适检测方法例如包括DNA印迹法或其他核酸杂交法(Kawai等人,Mol.Cell.Biol.14:7421-7427,1994;Gonzalgo等人,CancerRes.57:594-599,1997)。基于包含探针的核酸双链体的解链温度(Tm)确定合适的杂交条件。技术人员将明白,虽然某些一般性可能适用,但是应当经验地针对每种探针确定最佳杂交反应条件。优选地,使用短寡核苷酸探针的杂交在低至中等严格性进行。在GC丰富的探针或引物或较长探针或引物情况下,优选高严格性杂交和/或洗涤。高严格性在本文中定义为在约0.1xSSC缓冲液和/或约0.1%(w/v)SDS中或更低盐的浓度和/或在至少65℃的温度或等同条件实施的杂交和/或洗涤。本文中对特定严格性水平的指称包括本领域技术人员已知的使用除SSC之外的洗涤/杂交溶液的等同条件。根据本发明实施例,针对测试样品和阴性对照样品所产生的片段的差异指示受试者具有瘤形成。类似地,在其中对照样品包含来自肿瘤、癌组织或癌细胞或前癌细胞的数据情况下,测试样品和对照样品之间的相似性,尽管不必然地是绝对同一,表示阳性诊断(即癌症)。扩增分析模式在可选的实例中,使用一种扩增系统,例如聚合酶链反应(PCR)、滚环扩增(RCA),逆聚合酶链反应(iPCR),原位PCR(Singer-Sam等人,Nucl.AcidsRes.18:687,1990)、链置换扩增(SDA)或循环探针技术检测由限制性酶产生的片段。PCR方法是本领域已知并且例如由byMcPherson等人,PCR:APCR:APracticalApproach.(系列丛书(编者),D.Rickwood和B.D.Hames),IRLPressLimited,Oxford.第1-253页,1991和Dieffenbach(编著)和Dveksler(编著)(引自:PCRPrimer:ALaboratoryManual,ColdSpringHarbourLaboratories,NY,1995))描述,所述文献各自通过引用的方式完整并入。总体上,对于PCR,包含至少约18个核苷酸长度和更优选地至少20-30个核苷酸长度的两个非互补性核酸引物分子与核酸模板分子的不同链在它们的相应复性位点处杂交,并且酶促地扩增间插于各复性位点之间的模板的特异性核酸分子拷贝。扩增产物可以例如使用电泳和用结合核酸的可检测标记物检测进行检测。可选地,一个或多个寡核苷酸用可检测标记物(例如荧光团)标记并且例如使用lightcycler(PerkinElmer,Wellesley,Mass.,USA,RocheAppliedScience,Indianapolis,IN,USA)检测扩增产物。链置换扩增(SDA)利用寡核苷酸引物、DNA聚合酶和限制性核酸内切酶来扩增靶序列。寡核苷酸与靶核酸杂交并且聚合酶用来产生间插于引物复性位点之间的区域的拷贝。拷贝的核酸和靶核酸的双链体随后用特异性识别拷贝核酸的始端处序列的核酸内切酶形成切刻。DNA聚合酶识别切刻的DNA并且产生靶区域的另一个拷贝,与此同时置换先前产生的核酸。SDA的优点是它以等温形式发生,从而促进高通量自动化分析。循环探针技术使用合成的嵌合引物,所述嵌合引物包含能够与靶序列杂交的DNA-RNA-DNA。一旦与靶序列杂,形成的RNA-DNA双链体成为RNA酶的靶,从而切割引物。随后检测切割的引物,例如,使用质谱法或电泳检测。对于在甲基化敏感性核酸内切酶识别位点侧翼分布或与之毗邻的引物,优选仅在瘤形成时过度甲基化的那些位点侧翼分布的这类引物以确保产生诊断性扩增产物。在这方面,扩增产物仅在限制性位点未受切割,即,它发生甲基化时才产生。因此,检测到扩增产物表示目的CpG二核苷酸是甲基化的。如技术人员将已知,扩增产物的精确长度将根据引物之间的距离变动。显然,这种形式的分析可以用来确定多个CpG二核苷酸的甲基化状态,前提是每种二核苷酸处于甲基化敏感性限制性核酸内切酶位点范围内。在这些方法中,一条或多条引物可以用促进快速检测扩增的核酸的可检测标记物标记,例如,荧光标记物(例如Cy5或Cy3)或放射性同位素(例如32P)。通常使用例如,非变性琼脂糖凝胶电泳,非变性聚丙烯酰胺凝胶电泳、质谱法、液相色谱(例如HPLC或dHPLC)或毛细管电泳法(例如MALDI-TOF)分析扩增的核酸。高通量检测方法,如,例如基质辅助激光解吸附/电离飞行时间法(MALDI-TOF)、电喷雾电离(ESI)、质谱法(包括串联质谱法,例如LCMS/MS)、生物传感器技术、倏逝光纤技术或DNA芯片技术(例如,WO98/49557;WO96/17958;Fodor等人,Science767-773,1991;美国专利号5,143,854;和美国专利号5,837,832,所述文献的内容均全部通过引用方式并入本文)特别优选用于本文所述的全部分析模式。可选地,可以使用如本文中和/或例如美国专利号6,174,670中所述的解链曲线分析方法连续监测核酸的扩增,其中所述文献通过引用方式并入本文。(c)其他分析模式在一个替代性实例中,通过实施下述方法确定样品中增加的甲基化,所述方法包括用一定量的DNA酶I在足以消化核酸的条件下处理含有核酸的染色质并且随后检测产生的片段。这种分析模式基于以下理解,含有甲基化DNA(例如,过度甲基化的DNA)的染色质比非过度甲基化的DNA具有更紧密的构象,并且因此更不易感于借助DNA酶I的核酸内切酶消化。根据这种方法,与非甲基化DNA相比,通过DNA酶I消化甲基化DNA产生了不同长度的DNA片段。检测这类不同的DNA片段,例如,使用较早描述的测定法。可选地,基本上如Gregory和FeilNucleicAcidsRes.,27,e32i-e32iv,1999中描述那样使用PCR-SSCP检测这些DNA片段。在使PCR-SSCP适应于本发明时,使用在核酸中旁侧分布于或包含一个或多个CpG二核苷酸的扩增引物来扩增DNA酶I产生的片段,其中所述在瘤形成样品抵抗DNA酶I消化但在健康/正常对照或健康/正常测试样品中不抵抗DNA酶I消化。在这种情况下,使用DNA酶I时特定核酸片段的产生诊断出瘤形成,因为这种DNA未高效地降解。相反,来自健康/正常受试者样品的模板DNA被DNA酶I的作用降解,和因此,扩增没有产生独立的扩增产物。PCR-SSCP的替代性方法例如PCR-dHPLC也是本领域已知并且由本发明构思。(d)非甲基化DNA的选择性诱变在一个替代性方法中,使用下述方法确定样品中增加的甲基化,所述方法包括用一定量的选择性突变CpG二核苷酸内部非甲基化胞嘧啶残基的化合物在足以诱导诱变的条件下处理核酸。优选的化合物使胞嘧啶突变成尿嘧啶或胸苷,例如,亚硫酸氢盐,例如,亚硫酸氢钠或亚硫酸氢钾(Frommer等人,Proc.Natl.Acad.Sci.USA89,1827-1831,1992)。已知通过突变不受甲基化保护的胞嘧啶残基,DNA的亚硫酸氢盐处理区分甲基化胞嘧啶残基与非甲基化胞嘧啶残基,包括不处于CpG二核苷酸内部或位于不经历甲基化的CpG二核苷酸内部的胞嘧啶残基。基于序列的检测在一个实例中,通过对突变的DNA测序确定存在一个或多个突变的核苷酸或突变序列的数目。一种形式的分析包括使用本文所述的扩增反应(例如,PCR)扩增突变的核酸。随后将扩增产物直接测序或克隆并且将克隆的产物测序。用于DNA测序的方法是本领域已知并且例如包括双脱氧链终止法或Maxam-Gilbert法(见Sambrook等人,MolecularCloning,ALaboratoryManual(第2版),CSHP,NewYork1989)或Zyskind等人,RecombinantDNALaboratoryManual(Acad.Press,1988))。由于用化合物(例如,亚硫酸氢盐)处理核酸导致非甲基化胞嘧啶突变成尿嘧啶(并且因此在扩增过程后突变成胸苷),所以序列的分析确定甲基化核苷酸的存在或不存在。例如,通过将使用对照样品或未用亚硫酸氢盐处理过的样品所获得的序列或目的区域的已知核苷酸序列与处理的样品比较,促进检测核苷酸序列中的差异。与对照或未处理的样品相比,在处理的样品中的胞嘧啶位点处检测到的任何胸腺嘧啶残基可以视为由作为亚硫酸氢盐处理的结果的突变引起。利用对亚硫酸氢盐处理的核酸的测序检测甲基化的合适方法例如在Frommer等人Proc.Natl.Acad.Sci.USA89:1827-1831,1992或Clark等人,Nucl.AcidsRes.22:2990-2997,1994中描述。在另一种方法中,使用焦磷酸测序法,例如,如Uhlmann等人,Electrophoresis,23:4072-4079,2002中所述那样检测突变或非突变的核苷酸在亚硫酸氢盐处理的样品中的存在。实质上,这种方法是一种形式的使用以下引物的实时测序,其中所述引物杂交于甲基化的胞嘧啶位点相邻或接近的位点。在引物和模板在DNA聚合酶存在的情况下杂交后,根据预定的分配次序独立地添加4种修饰的脱氧核苷酸三磷酸的每一个。仅掺入所添加的与亚硫酸氢盐处理的样品互补的核苷酸并且释放无机焦磷酸盐(PPi)。PPi随后驱动导致可检测水平的光产生的反应。这种方法允许确定与引物的杂交位点毗邻的特定核苷酸的身份。固相焦磷酸测序方法是本领域已知并且例如在Landegren等人,GenomeRes.,8(8):769-776,1998中综述。这类方法使得高通量检测众多CpG二核苷酸的甲基化成为可能。一种用于测定亚硫酸氢盐处理的核苷酸的序列的相关方法是甲基化敏感性单核苷酸引物延伸法(Me-SnuPE)或SNaPmeth。合适的方法例如在Gonzalgo和Jones,Nucl.AcidsRes.,25:2529-2531或Uhlmann等人,Electrophoresis,23:4072-4079,2002中描述。使用一种寡核苷酸,其杂交至与甲基化的胞嘧啶的位点毗邻的核酸区域。这种寡核苷酸随后用于采用聚合酶和游离核苷酸二磷酸或双脱氧核苷酸三磷酸的引物延伸操作方案中,其中所述的游离核苷酸二磷酸或双脱氧核苷酸三磷酸对应于亚硫酸氢盐处理后在这个位点处出现的可能碱基二者之一或任一种(即,胸腺嘧啶或胞嘧啶)。优选地,核苷酸用可检测标记物(例如荧光团)标记。在引物延伸后,将未结合的标记的核苷酸二磷酸除去(例如使用大小排阻层析或电泳)或水解(例如使用碱性磷酸酶),并且检测到标记的核苷酸掺入至这种寡核苷酸,从而显示在该位点存在的碱基。显然,其他高通量测序方法由本发明包括。这类方法例如包括固相微量测序法(例如,如Southern等人,Genomics,13:1008-1017,1992中描述)或采用FRET的微量测序法(例如,如Chen和Kwok,NucleicAcidsRes.25:347-353,1997中描述)。基于限制性核酸内切酶的分析模式在一种方法中,基本上如Xiong和Laird,Nucl.AcidsRes.,25:2532-2534,2001中所述,使用联合亚硫酸氢盐限制性分析(COBRA),检测非突变序列的存在。这种方法利用化合物(例如,亚硫酸氢盐)处理后甲基化核酸和未甲基化核酸之间限制性酶识别位点的差异,所述化合物选择性突变非甲基化胞嘧啶残基。在亚硫酸氢盐处理后,使用本文所述的扩增反应(例如,PCR)扩增目的区域,所述目的区域包含经甲基化并包含于限制性核酸内切酶识别序列内的一个或多个CpG二核苷酸。扩增产物随后与限制性酶接触,所述限制性酶按足以使切割发生的时间并在这样的条件下在CpG二核苷酸的位点处切割。可以选择限制性位点以指示甲基化的存在或不存在。例如,限制性核酸内切酶TaqI切割序列TCGA,在亚硫酸氢盐处理非甲基化核酸后,序列将是TTGA并且作为结果,将不受切割。随后使用本领域已知的检测手段(例如,电泳和/或质谱法)检测消化和/或未消化的核酸。核酸的切割或未切割显示受试者中的癌症。显然,这种方法可以用于诊断癌症的阳性读出或阴性读出系统中。阳性读出分析模式在一个实施方案中,本发明的分析模式包括阳性读出系统,其中将源自已经例如用亚硫酸氢盐处理的样品的DNA检测为阳性信号。优选地,未检测到或仅微弱检测到来自健康或正常对照受试者的未过度甲基化的DNA。在一个优选实施方案中,使用以下方法确定受试者样品中增加的甲基化,所述方法包括:(i)用一定量的选择性突变非甲基化胞嘧啶残基的化合物在足够诱导诱变的条件下处理核酸,从而产生突变的核酸;(ii)使核酸与包含核苷酸序列的探针或引物在如此条件下杂交,从而出现与非突变核酸的选择性杂交,其中所述核苷酸序列与包含甲基化胞嘧啶残基的序列互补;和(iii)检测选择性杂交。在这种情境下,术语“选择性杂交”意指探针或引物与非突变核酸的杂交以较高的频率或速率发生或具有比相同探针或引物与相应的突变序列的杂交更高的最大反应速度。优选地,探针或引物在所用的反应条件下不与携带突变的非甲基化序列杂交。基于杂交的分析模式在一个实施方案中,使用DNA印迹、点印迹、狭缝印迹或其他核酸杂交手段检测杂交(Kawai等人,Mol.Cell.Biol.14:7421-7427,1994;Gonzalgo等人,CancerRes.57:594-599,1997)。在选择适宜探针的条件下,此类分析模式总体上在本文中如上描述并且已作必要的修正情况下适用于目前描述的选择性诱变方案。优选地,使用连接酶链反应模式来区分突变的和非突变的核酸。连接酶链反应(在EP320,308和美国专利号4,883,750中描述)使用至少两种寡核苷酸探针,所述寡核苷酸探针以如此方式与靶核酸复性从而它们在靶核酸上靠近。在连接酶链反应测定法中,靶核酸与互补于靶序列的诊断部分(例如,包含一个或多个甲基化CpG二核苷酸的核酸)的第一探针(诊断探针)并且与互补于与诊断部分毗连的核苷酸序列的第二探针(毗连探针)在其中诊断探针保持基本上仅与靶核酸结合的条件下杂交。诊断探针和毗连探针可以具有不同的长度和/或具有不同的解链温度,从而可以调节杂交的严格性以允许它们与靶选择性杂交,其中具有较高解链温度的探针以较高的严格性杂交,并且在洗涤以除去未结合和/或未选择性结合的探针后,具有较低解链温度的其他探针以较低的严格性杂交。随后使诊断探针和毗连探针共价地连接,例如,使用T4DNA连接酶,从而以产生与靶序列互补的较大靶探针,并且通过调整杂交严格性,移除未连接的探针。在这个方面,未曾连接的探针将在比已经连接的探针更低的严格性杂交条件下选择性地杂交。因而,可以增加杂交严格性至这样的严格性,它至少与用来杂交并且优选地以更高的严格性杂交较长探针的严格性同样高,这归因于增加的连接后由较短探针贡献的长度。在另一个实例中,将探针之一或二者均标记,从而可以通过使靶-探针双链体解链、洗脱解离的探针和检验标记物检验靶序列的存在或不存在。在两种探针均标记的情况下,使用不同的配体以允许区分连接和未连接的探针,在这种情况下,相同洗脱物级分中存在两种标记物证实了连接事件。如果靶核酸与固体基质结合例如,在DNA印迹杂交、狭缝印迹、点印迹或微芯片分析模式中,则可以直接确定诊断探针和毗连探针二者的存在。甲基化特异性微阵列(MSO)也用于区分突变和非突变的序列。合适的方法例如在Adorjan等人,Nucl.AcidsRes.,30:e21,2002中描述。MSO使用已经用选择性突变非甲基化胞嘧啶残基的化合物(例如,亚硫酸氢盐)处理的核酸作为扩增突变核酸和非突变核酸的扩增反应的模板。这种扩增用包含可检测标记物(例如,荧光团(例如,Cy3或Cy5))的至少一种引物进行。为了产生用于检测突变核酸的微阵列,将寡核苷酸点到例如,玻璃载片上,优选地以一定冗余度进行(例如,如Golub等人,Science,286:531-537,1999中所述)。优选地,对于分析的每个CpG二核苷酸,使用两种不同的寡核苷酸。每种寡核苷酸包含了反映CpG二核苷酸的甲基化或非甲基化状态的序列N2-16CGN2-1或N2-16TGN2-16(其中N是与目的CpG二核苷酸相邻或靠近的核苷酸的数目)。标记的扩增产物随后与微阵列上的寡核苷酸在能够检测单核苷酸差异的条件下杂交。在洗涤以除去未结合的扩增产物后,使用例如微阵列扫描仪检测杂交。这种方法不仅允许确定大量CpG二核苷酸的甲基化状态,它也是半定量的,从而使得确定所分析的每个CpG二核苷酸处的甲基化程度成为可能。由于在单一样品中可能存在某种程度的甲基化异质性,这种定量可以辅助诊断癌症。基于扩增的分析模式在替代性实例中,使用扩增系统检测杂交。在甲基化特异性PCR模式中(MSP;Herman等人,Proc.Natl.Acad.Sci.USA93:9821-9826,1992),使用包括扩增亚硫酸氢盐处理的DNA的方法检测杂交。因此,通过使用在中等和/或高严格性条件下与未突变的序列特异性复性的一个或多个探针或引物,使用包含甲基化核苷酸的样品,仅产生扩增产物。提供从亚硫酸氢盐处理的DNA的混合物中选择性扩增甲基化或非甲基化组分的另一种测定法由Cottrell等人,Nucl.AcidsRes.32:e10,2003(HeavyMethylPCR)、Rand等人,Nucl.AcidsRes.33:e127,2005(HeadloopPCR)、Rand等人,pigenetics1:94-100,2006(亚硫酸氢盐差异性变性PCR)和PCT/AU07/000389(末端特异性PCR)提供。可以使用本文所述的任何扩增分析模式,例如聚合酶链反应(PCR)、滚环扩增(RCA),逆聚合酶链反应(iPCR),原位PCR(Singer-Sam等人,Nucl.AcidsRes.18,687,1990)、链置换扩增(SDA)或循环探针技术。已经开发了用于检测基因突变(Kuppuswamy等人,Proc.Natl.Acad.Sci.USA88:1143-1147,1991)和定量等位特异性表达的PCR技术(Szabo和Mann,GenesDev.9:3097-3108,1995;和Singer-Sam等人,PCRMethodsAppl.1:160-163,1992)。这类技术使用与PCR产生的模板复性并且正好止于待测定的单核苷酸的5'的内引物。此类模式轻易地与如本文以上所述的连接酶链反应组合。实时定量性分析模式的用途也是有用的。在选择适宜引物的条件下,此类分析模式总体上在本文中如上描述并且已作必要的修正情况下适用于目前描述的选择性诱变方案。甲基化特异性解链曲线分析(基本上如Worm等人,Clin.Chem.,47:1183-1189,2001中所述)也由本发明构思。这种方法利用扩增产物中解链温度的差异,其中使用亚硫酸氢盐处理的甲基化或非甲基化核酸产生所述扩增产物。基本上,在与双链DNA特异性结合的荧光染料(例如,SYBRGreenI)存在的情况下进行亚硫酸氢盐处理的样品的非差别性扩增。通过增加扩增产物的温度同时监测荧光,确定解链特性并且因此测定扩增产物的序列。荧光下降反映扩增产物中的至少一个区域解链。荧光下降的温度指示所扩增核酸的核苷酸序列,从而允许在一个或多个CpG二核苷酸的位点处确定核苷酸。作为使用本发明扩增的核酸的序列本发明也包括使用实时定量性形式的PCR,例如,TaqMan(Holland等人,Proc.Natl.Acad.Sci.USA,88:7276-7280,1991;Lee等人,NucleicAcidRes.21:3761-3766,1993)来执行这个实施方案。例如,Eads等人,Nucl.AcidsRes.28:E32,2000的MethylLight方法使用改良Taqman测定法来检测CpG二核苷酸的甲基化。基本上,这种方法包括用亚硫酸氢盐处理核酸样品并且使用扩增反应(例如,PCR)扩增包含在肿瘤细胞中甲基化并且在对照样品中不甲基化的一个或多个CpG二核苷酸的核酸。扩增反应在3种寡核苷酸、在目的区域旁侧分布的正向引物和反向引物和在这两个引物之间与一个或多个甲基化CpG二核苷酸的位点杂交的探针存在的情况下进行。探针用5'荧光报道分子和3'猝灭剂双重标记(或反之亦然)。当探针是完整时,猝灭剂染料吸收报道分子的荧光,原因在于它们彼此靠近。与PCR产物复性后,探针由例如TaqDNA聚合酶的5'至3'核酸外切酶活性切割。这种切割从猝灭剂中释放报道分子,从而导致可以用来估计初始模板甲基化水平的增加的荧光信号。通过使用与未突变的核酸(即甲基化核酸)选择性杂交的探针或引物,例如,使用标准曲线,确定甲基化水平。可选地,不使用需要切割的标记探针,使用例如分子信标探针(见例如,Mhlanga和Malmberg,Methods25:463-471,2001)。分子信标是具有茎-环结构的单链核酸分子。这种环结构与包围一个或多个CpG二核苷酸的区域互补,其中所述CpG二核苷酸在肿瘤中甲基化并且在对照样品中不甲基化。茎结构通过使彼此互补的位于探针任一侧(环)的两条“臂”复性而形成。荧光部分与一条臂结合,并且当分子信标不与靶序列结合时,抑制任何可检测荧光的猝灭部分与另一条臂结合。一旦环区域与其靶核酸结合,则这些臂分开并且荧光是可检测的。然而,即便一个单碱基错配也显著改变样品中检测到的荧光水平。因而,通过检测到的荧光水平确定特定碱基的存在或不存在。这种测定法促进检测核酸中一个或多个未突变的位点(即甲基化核苷酸)。将荧光标记的锁定核酸(LNA)分子或荧光标记的蛋白质-核酸(PNA)分子用于核苷酸差异的检测(例如,如Simeonov和Nikiforov,NucleicAcidsResearch,30(17):1-5,2002中所述)。LNA和PNA分子以高亲和力结合于核酸,特别是DNA。与LNA或PNA探针缀合的荧光团(尤其,罗丹明或六氯荧光素)在探针与靶核酸杂交时以明显更高的水平发荧光。然而,荧光增加的水平不增强至即便单核苷酸错配出现时的相同水平。因而,样品中检测到的荧光度表示在LNA或PNA探针和靶核酸之间存在错配,如在甲基化的CpG二核苷酸中的突变胞嘧啶情况下。优选地,将荧光标记的LNA或PNA技术用来检测在已经例如使用本领域已知和/或本文所述的扩增方法事先扩增的核酸中的至少单碱基变化。如技术人员将显而易见,LNA或PNA检测技术使得通过固定LNA或PNA探针至固相支持物而高通量检测一种或多种标记可行,如Orum等人,Clin.Chem.45:1898-1905,1999中所述。可选地,将实时测定法(例如,所谓HeavyMethyl测定法)(Cottrell等人,Nucl.AcidsRes.32:e10,2003)用来确定测试样品中核酸的存在或甲基化水平。基本上,这种方法使用以甲基化特异性方式与亚硫酸氢盐处理的核酸结合(即,封闭物在中等至高严格性条件下与未突变的DNA特异性结合)的一个或多个不可延伸性核酸(例如,寡核苷酸)封闭物。使用可以任选地具有甲基化特异性但是在一个或多个封闭物旁侧分布的一条或多条引物,进行扩增反应。在非甲基化核酸(即,非突变的DNA)存在的情况下,封闭物结合并且无PCR产物产生。使用基本上如上文描述的Taqman测定法,确定样品中核酸的甲基化水平。在用选择性突变非甲基化胞嘧啶残基的化合物处理后检测甲基化核酸的基于扩增的其他方法例如包括甲基化单链构象分析法(MS-SSCA)(Bianco等人,Hum.Mutat.,14:289-293,1999)、甲基化特异性变性梯度凝胶电泳(MS-DGGE)(Abrams和Stanton,MethodsEnzymol.,212:71-74,1992)和甲基化特异性变性高效液相色谱(MS-DHPLC)(Deng等人,Chin.J.CancerRes.,12:171-191,2000)。这些方法的每一种使用不同技术以便基于核苷酸序列和/或二级结构的差异检测扩增产物中的核酸差异。这类方法显然由本发明构思。与其他扩增分析模式一样,使用一系列方法(包括凝胶电泳、凝胶过滤、质谱法)和在标记引物的情况下通过鉴定扩增产物中的标记物分析扩增产物。在一个备选实施方案中,基本上如Sadri和Hornsby,Nucl.AcidsRes.24:5058-5059,1996;以及Xiong和Laird,Nucl.AcidsRes.25:2532-2534,1997)所述那样,进行从亚硫酸氢盐转化的DNA中扩增的PCR产物的限制性酶消化以分析形成的产物。也可以使用高通量检测方法,如,例如基质辅助激光解吸附/电离飞行时间法(MALDI-TOF)、电喷雾电离(ESI)、质谱法(包括串联质谱法,例如LCMS/MS)、生物传感器技术、倏逝光纤技术或DNA芯片技术。与本文所述的利用杂交和/或扩增检测系统的其他分析模式一样,如本文以上所述的这类方法的组合特别由本发明的基于选择性诱变的分析模式构思。在一个实例中,通过实施以下方法检测增加的甲基化,所述方法包括:(i)用一定量的选择性突变CpG二核苷酸内部非甲基化胞嘧啶残基的化合物在足够诱导诱变的条件下处理核酸,从而产生突变的核酸;(ii)使核酸与两个非重叠和非互补引物在如此条件下杂交,从而出现与非突变核酸的杂交,其中所述引物的每一个包含与DNA中包含甲基化胞嘧啶残基的序列互补的核苷酸序列;(iii)扩增间插于杂交的引物之间的核酸,从而产生由包含引物序列的序列组成的DNA片段;(iv)使扩增的DNA片段与包含核苷酸序列的探针在如此条件下杂交,从而出现与非突变核酸的杂交,其中所述核苷酸序列与包含甲基化胞嘧啶残基的序列对应或互补;并且检测这种杂交。阴性读出测定法在另一个实例中,分析模式包括一种阴性读出系统,其中将源自健康/正常对照样品的减少的DNA甲基化检测为阳性信号,并且优选地未检测到或仅微弱检测到来自肿瘤样品的甲基化DNA。在一个优选实施方案中,使用以下方法确定减少的甲基化,所述方法包括:(i)用一定量的选择性突变CpG岛内部非甲基化胞嘧啶残基的化合物在足够诱导诱变的条件下处理核酸,从而产生突变的核酸;(ii)使核酸与包含核苷酸序列的探针或引物在如此条件下杂交,从而出现与突变核酸的选择性杂交,其中所述核苷酸序列与包含突变的胞嘧啶残基的序列互补;和(iii)检测选择性杂交。在这种情境下,术语“选择性杂交”意指探针或引物与突变核酸的杂交以较高的频率或速率发生或具有比相同探针或引物与相应的非突变序列的杂交更高的最大反应速度。优选地,探针或引物在所用的反应条件下不与甲基化序列(或非突变的序列)杂交。基于杂交的分析模式在一个实施方案中,使用DNA印迹、点印迹、狭缝印迹或其他核酸杂交手段检测杂交(Kawai等人,Mol.Cell.Biol.14:7421-7427,1994;Gonzalgo等人,CancerRes.57:594-599,1997)。在选择适宜探针的条件下,此类分析模式总体上在本文中如上描述并且已作必要的修正情况下适用于目前描述的选择性诱变方案。优选地,使用连接酶链反应模式来区分非突变的和突变的核酸。在这个方面,测定法要求和条件是如本文以上对阳性读出测定法所述那样并且已作必要的修正情况下适用于本发明的模式。然而,探针的选择将不同。对于阴性读出测定法,选择与突变序列而不是与非突变序列选择性杂交的一个或多个探针。优选地,连接酶链反应探针具有包含CpG二核苷酸的3'末端序列和/或5'末端序列,其中所述CpG二核苷酸在健康对照样品中未甲基化,但是在癌症中过度甲基化,从而诊断探针和毗连探针仅在CpG二核苷酸的胞嘧啶突变成胸苷时(例如,在非甲基化胞嘧啶残基的情况下)才能够连接。如技术人员将显而易见,上文描述的MSO方法可用于任一种或两种阳性和/或阴性读出测定法。这是因为所描述的测定法检测突变的和非突变的序列,从而促进确定甲基化水平。然而,仅检测甲基化序列或非甲基化序列的测定法由本发明构思。基于扩增的分析模式在替代性实例中,使用扩增系统检测杂交,所述扩增系统使用如本文以上对阳性读出测定法所述的任何扩增分析模式,即便使用与突变核酸选择性杂交的引物(和探针,在适用的情况下)。在使上文描述的HeavyMethyl测定法适应于阴性读出形式时,以甲基化特异性方式与亚硫酸氢盐处理的核酸结合的封闭物在中等至高严格性条件下与突变的DNA特异性结合。使用可以任选地具有甲基化特异性(即仅与突变的核酸结合)但是在一个或多个封闭物旁侧分布的一条或多条引物,进行扩增反应。在甲基化核酸(即,突变的DNA)存在的情况下,封闭物结合并且无PCR产物产生。在一个实例中,通过实施以下方法检测正常/健康对照受试者中减少的甲基化,所述方法包括:(i)用一定量的选择性突变非甲基化胞嘧啶残基的化合物在足够诱导诱变的条件下处理核酸,从而产生突变的核酸;(ii)使核酸与两个非重叠和非互补引物在如此条件下杂交,从而出现与突变核酸的杂交,其中所述引物的每一个包含与DNA中包含突变的胞嘧啶残基的序列互补的核苷酸序列;(iii)扩增间插于杂交的引物之间的核酸,从而产生由包含引物序列的序列组成的DNA片段。(iv)使扩增的DNA片段与包含核苷酸序列的探针在如此条件下杂交,从而出现与突变核酸的杂交,其中所述核苷酸序列与包含突变的胞嘧啶残基的序列对应或互补;并且(v)检测这种杂交。如技术人员将显而易见,阴性读出测定法优选地包括合适的对照样品以确保阴性结果由甲基化的核酸而不是反应失败引起。本发明也提供了使用本文所述的方法检测和/或定量本发明诊断性序列或其表达或甲基化的试剂盒。对于检测甲基化的试剂盒,本发明的试剂盒可以包含与本发明诊断性序列的至少一种杂交的至少一种多核苷酸和用于检测基因甲基化的至少一种试剂。用于检测甲基化的试剂例如包括亚硫酸氢钠、设计成与序列杂交的多核苷酸和/或甲基化敏感性或甲基化依赖性限制性酶,其中如果本发明的生物标记序列未甲基化,则所述序列是该生物标记序列的产物(例如,含有至少一个C→U转化)。这种试剂盒也可以包含天然或合成性对照DNA序列,其代表序列的甲基化或非甲基化形式。试剂盒可以提供适应于在测定法中使用的分析设备形式的固相支持物。试剂盒还可以在试剂盒中包含可检测标记物,其任选地与多核苷酸(例如,探针)连接。也可以在试剂盒中包括在实施测定法时有用的其他材料,包括试管、移液管等。试剂盒也可以包括这些试剂中一种或多种在本文所述的任何测定法中使用的书面指导。如本文中之前详述,过度甲基化与转录性沉默相关。因此,除这些基因增加的甲基化水平提供筛查大肠瘤倾向或大肠瘤开始的基础之外,这些基因的表达水平下调也是有诊断价值的。根据本发明的这个方面,对基因“表达产物”或“基因表达”的指称是对转录产物(如初级RNA或mRNA)或翻译产物如蛋白质的指称。在这方面,可以通过以下方式评估基因表达水平的变化:筛查所产生的表达产物(即RNA或蛋白质)的水平变化、与基因相关联的染色质蛋白的变化(例如在氨基酸位置编号9或27处的赖氨酸上甲基化(阻遏性修饰)的组蛋白H3存在)或起到下调表达作用的DNA本身变化(如DNA甲基化的变化)。这些基因和它们的基因表达产物(无论它们是否为RNA转录物)、起下调表达作用的DNA的变化或编码的蛋白质统称为“肿瘤性标记”。因此,本发明的另一个方面涉及一种在个体中筛查大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估DNA区域的表达水平,所述DNA区域选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:其中相对于对照水平而言,组(i)和/或(ii)的DNA区域的较低表达水平指示有大肠瘤或瘤形成状态开始的倾向。本发明的这个方面的方法基于生物学样品的肿瘤性标记的甲基化水平与这些标记的对照水平比较。“对照水平”可以是“正常水平”,所述正常水平是由非肿瘤性的相应大肠细胞或细胞群体所表达的标记的水平。如前文中详述,可以使用源自作为测试主体的相同个体的组织确定正常(或“非肿瘤性”)水平。然而,将理解,这可能对于涉及的个体是相当有侵入性的,因此可能更便利的是相对于标准结果而分析检验结果,其中所述标准结果反映了从除所讨论的患者之外的个体所获得的单个或综合结果。因此更具体地提供一种在个体中筛选大肠瘤开始或开始的倾向或监测大肠瘤的方法,所述方法包括在来自所述个体的生物学样品中评估一种或多种基因或转录物的表达水平,所述种基因或转录物选自:(i)由Hg19坐标的任何一个或多个和转录起始位点上游2kb限定的区域:(ii)以下任何一个或多个的基因区域,包括上游2kb:其中相对于对照水平而言,组(i)和/或组(ii)的基因或转录物的较低表达水平指示有肿瘤性大肠瘤或瘤形成状态开始的倾向。优选地,所述对照水平是非肿瘤水平。如本文中之前详述,将本发明设计成筛查位于大肠中的肿瘤细胞或细胞群体。因此,对“细胞或细胞群体”的指称应当理解为指称个体细胞或细胞群组。所述细胞群组可以是弥散细胞群组、细胞悬液、包囊化细胞群组或采取组织形式的细胞群组。对“表达”的指称应当理解为指核酸分子的转录和/或翻译。对“RNA”的指称应当理解为包括对任何形式的RNA,如初级RNA或mRNA或不翻译的RNA(例如miRNA等)的指称。不以任何方式限制本发明,导致增加或减少的RNA合成的基因转录调节作用也可以与翻译这些RNA转录物中一些(如mRNA)以产生蛋白质产物相关。因而,本发明也延伸至检测方法学,所述检测方法学涉及筛查肿瘤性标记蛋白产物的受调节的水平或模式作为细胞或细胞群体的肿瘤状态的指示物。虽然一种方法将时筛查mRNA转录物和/或相应的蛋白质产物,但是应当理解,本发明在此方面不受限制并且延伸至筛查任何其他形式的肿瘤性标记表达产物,例如,初级RNA转录物。就筛查标记表达的下调而言,本领域技术人员也将熟知,在DNA水平可检测的变化表示基因表达活性的变化并且因此表示表达产物水平的变化。这类变化包括但不限于DNA甲基化的变化。因此,本文中对“筛查表达水平”和比较这些“表达水平”与对照“表达水平”应当理解为指称评估与转录相关的DNA因素,如基因/DNA甲基化样式。这些已经部分地在本文中详述。本领域技术人员也将已知,染色质结构的变化显示基因表达的变化。基因表达的沉默经常与染色质蛋白的修饰相关,在组蛋白H3的位置9和27的任一个或这两个位置处的赖氨酸甲基化是充分研究的实例,同时活性染色质以组蛋白H3的赖氨酸9的乙酰化特征。因此,基因序列与携带阻遏性或活性修饰的染色质的关联可以用来评估基因的表达水平。对“核酸分子”的指称应当理解为指脱氧核糖核酸分子和核糖核酸分子及其片段。本发明因此延伸至直接筛查生物学样品中的mRNA水平或筛查已经从目的mRNA群体逆转录出来的互补性cDNA。设计涉及筛查DNA或RNA的方法学完全在本领域技术人员的能力范围内。如上文详述,本发明的方法也延伸筛查从主题mRNA或基因组DNA本身翻译的蛋白质产物。在一个优选的实施方案中,通过参考编码蛋白质产物的基因测量基因表达水平,并且更具体地,在蛋白质水平测量所述表达水平。在另一个特别优选的实施方案中,通过DNA与携带阻遏性修饰(例如,组蛋白H3的赖氨酸9或27的甲基化)的染色质蛋白的关联评估所述基因表达。本发明应当理解成包括基于鉴定一种或多种生物学样品中蛋白质和/或核酸分子的检测方法。就一些目的肿瘤性标记可能对应于不编码蛋白质产物的基因或基因片段而言,这可以是特别有意义的。因此,就这种情况出现而言,将不可能检验蛋白质并且将不得不基于转录表达谱或基因组DNA的改变评估主题标记。术语“蛋白质”应当理解成包括肽、多肽和蛋白质(包括蛋白质片段)。蛋白质可以是糖基化或非糖基化的,和/或可以含有与该蛋白质融合、连接、结合或要么连接的一系列其他分子,如氨基酸、脂类、糖或其他的肽、多肽或蛋白质。本文中对“蛋白质”的指称包括包含氨基酸序列的蛋白质,以及与其他分子如氨基酸、脂类、糖或其他肽、多肽或蛋白质结合的蛋白质。由本发明肿瘤性标记编码的蛋白质可以处于多聚体形式,意指两个或更多个分子缔合在一起。在相同的蛋白质分子缔合在一起的情况下,复合物是同型多聚体。同型多聚体的实例是同型二聚体。在至少一种标记蛋白与至少一种非标记蛋白缔合的情况下,则复合物是异多聚体如异二聚体。对“片段”的指称应当理解为指主题核酸分子或蛋白质的一部分。对于筛查粪便样品中调节的RNA水平而言,这是特别有意义的,因为主题RNA可能已经因肠道环境而降解或片段化。可以因此实际地检测主题RNA分子的片段,其中通过使用适当特异性的探针鉴定所述片段。虽然优选的方法是出于诊断瘤形成发展或其倾向的目的检测肿瘤性标记的表达产物或DNA变化,但是可以在某些情况下需要检测所述标记水平的相反变化,例如,以监测涉及调节肿瘤性病状,如腺瘤或腺癌发展的治疗性或预防性疗法的有效性。例如,其中减少的主题标记表达表示个体已经形成以腺瘤或腺癌发展为特征的病状,例如,筛查到开始一种治疗性治疗方案后这些标记水平的增加可以用来指示主题个体病状的逆转或此病状的其他形式的改善。本发明方法因此用作一次性试验(oneofftest)或用作据认为存在瘤形成发展风险的那些个体的持续监测或用作涉及抑制或减慢瘤形成发展的治疗性或预防性治疗方案的有效性的监测。可以通过本领域技术人员将熟知的任何适合方法实现评估生物学样品中表达的主题肿瘤标记的手段。为此目的,将理解,就正在检查同质细胞群体(如肿瘤活组织检查样品或已经从异源起始群体富集的细胞群体)或组织切片而言,可以利用类型广泛的技术如原位杂交、用微阵列评估表达谱、免疫测定法等(下文更详细地描述)来检测一个或多个目的标记的不存在或其表达水平下调。然而,就正在筛查异质性细胞群体或其中存在异质性细胞群组的体液(如血液样品)而言,特定标记的不存在或其表达水平减少可能因标记由样品中存在的非肿瘤细胞固有表达而是不可检测的。即,某个亚组细胞的表达水平的减少可能不是可检测的。在这种情况下,检测肿瘤亚群中本发明的一种或多种标记的表达水平减少的更适宜机制是借助间接手段,如检测表观遗传变化。检测基因表达水平变化的方法(除本文中详述的甲基化分析法之外),尤其在主题生物学样品未遭大数目非肿瘤细胞污染情况下,包括但不限于:(i)体内检测可以在施用能够揭示肠组织中改变的标记表达的成像探针或试剂后使用分子成像法。分子成像法(Moore等人,BBA,1402:239-249,1988;Weissleder等人,NatureMedicine6:351-355,2000)是分子表达的体内成像,所述分子表达与使用“经典”诊断成像技术如X射线、计算机断层成像(CT)、MRI、正电子发射断层摄影术(PET)或内窥镜目前可视化的宏观特征相关。(ii)通过荧光原位杂交(FISH),检测细胞中或通过多项技术如定量性逆转录酶聚合酶链反应(QRTPCR)或竞争性RT-PCR产物的流式细胞术定量,检测来自细胞的提取物中RNA表达的下调(Wedemeyer等人,ClinicalChemistry48:91398-1405,2002)。(iii)例如通过阵列技术(Alon等人,Proc.Natl.Acad.Sci.USA:96:6745-6750,1999年6月)评估RNA表达谱。“微阵列”是一种优选地具有独立区域的线性或多维阵列,每个区域具有在固相支持物表面上形成的限定面积。微阵列上独立区域的密度由单一固相支持物的表面上待检测的靶多核苷酸的总数决定。如本文所用,DNA微阵列是置于芯片或其他表面上的用来扩增或克隆靶多核苷酸的寡核苷酸探针的阵列。由于阵列中每个特定探针组位置是已知,所以靶多核苷酸的身份可以基于它们与微阵列中特定位置结合来确定。DNA微阵列技术使得对单一固相支持物上的多个靶核酸分的大规模测定成为可能。美国专利号5,837,832(Chee等人)和相关专利申请描述了固定寡核苷酸探针阵列以便杂交并检测样品中的特定核酸序列。从目的组织分离的靶目的多核苷酸与DNA芯片杂交,并且基于靶多核苷酸在独立探针位置处杂交的优选性和程度检测特定序列。阵列的一项重要用途是分析差异性基因表达,其中比较基因在不同细胞或组织(经常是目的组织和对照组织)中的表达谱并且鉴定相应组织之间基因表达的任何差异。这种信息用于鉴定特定组织类型中表达的基因的类型和基于表达谱诊断病症。(iv)例如通过免疫测定测量细胞提取物中改变的肿瘤性标记蛋白水平。可以通过本领域技术人员熟知的众多合适方法的任一种,检验生物学样品中蛋白质性质的肿瘤性标记表达产物。合适方法的实例包括但不限于抗体筛查组织切片、活组织检查标本或体液样品。就使用基于抗体的诊断方法而言,可以按众多方式如通过蛋白质印迹、ELISA或流式细胞术确定标记蛋白的存在。当然,这些方法包括非竞争性类型以及在传统竞争性结合分析中的单位点和双位点或“夹心”测定法。这些测定法也包括标记抗体与靶的直接结合。(v)例如通过免疫组织化学确定细胞表面上蛋白质性质的肿瘤性标记的改变表达。(vi)除上文(iv)和(v)点中详述的那些之外,基于适合的任何功能试验、酶促试验或免疫试验,确定改变的蛋白质表达。作为常规方法,本领域技术人员可以确定给定方法对特定类型生物学样品的适合程度。本发明的一个相关方面提供分子阵列,所述阵列包含多个:(i)核酸分子或所述核酸分子的功能衍生物、片段、变体或同源物,所述核酸分子包含与下文描述的任何一个或多个肿瘤标记DNA相对应的核苷酸序列或与其显示至少80%同一性的序列;或(ii)核酸分子或所述核酸分子的功能衍生物、片段、变体或同源物,所述核酸分子包含能够在中等严格性条件下与(i)的任何一个或多个序列杂交;或(iii)核酸分子探针或寡核苷酸或所述核酸分子的功能衍生物、片段、变体或同源物,所述核酸分子探针或寡核苷酸包含能够在中等严格性条件下与(i)的任何一个或多个序列杂交;或(iv)能够与(i)的核酸分子编码的任何一种或多种蛋白质结合的探针或其衍生物、片段或同源物,其中所述(i)的标记基因或(iv)的蛋白质的表达水平指示源自大肠的细胞或细胞亚群的瘤形成状态。优选地,所述同一性百分比是至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。“杂交”指一条核酸链通过碱基配对与互补链结合的过程。杂交反应可能是敏感和有选择性的,从而可以在特定目的序列以低浓度存在的样品中鉴定该序列。严格条件可以由例如预杂交溶液和杂交溶液中盐或甲酰胺的浓度或由杂交温度限定并且是本领域熟知的。例如,可以通过降低盐浓度、增加甲酰胺浓度或升高杂交温度、改变杂交时间增加严格性,如下文详细描述。在替代性方面中,本发明的核酸由它们在多种严格性条件(例如,高、中等和低)下杂交的能力限定,如本文中所述。本文中对低严格性的指称包括并涵盖至少约0%到至少约15%v/v甲酰胺和至少约1M到至少约2M盐用于杂交条件,和至少约1M到至少约2M盐用于洗涤条件。总体上,低严格性是在约25-30℃至约42℃。所述温度可以是用来替代甲酰胺和/或产生替代严格性条件的改变的和更高的温度。在需要的情况下,替代严格性条件可以适用于如中等严格性,其包括并涵盖至少约16%v/v到至少约30%v/v甲酰胺和至少约0.5M到至少约0.9M盐用于杂交条件,和至少约0.5M到至少约0.9M盐用于洗涤条件,或高严格性,其包括并涵盖至少约31%v/v到至少约50%v/v甲酰胺和至少约0.01M到至少约0.15M盐用于杂交条件,和至少约0.01M到至少约0.15M盐用于洗涤条件。通常,洗涤在Tm=69.3+0.41(G+C)%实施(Marmur和Doty,J.Mol.Biol.5:109,1962)。然而,双链体DNA的Tm随错配碱基对数目每增加1%而减少1℃(Bonner和Laskey,Eur.J.Biochem.46:83,1974)。甲酰胺是在这些杂交条件中任选的。因此,特别优选的严格性水平定义如下:低严格性是6xSSC缓冲液,0.1%w/vSDS,在25-42℃;中等严格性是2xSSC缓冲液,0.1%w/vSDS,在范围20℃至65℃的温度;高严格性是0.1xSSC缓冲液,0.1%w/vSDS,在至少65℃温度。在本发明的核酸由它们在高严格性下杂交的能力限定情况下,这些条件包括约50%甲酰胺,在约37℃至42℃。在一个方面,本发明的核酸由它们在降低的严格性下杂交的能力限定,所述降低的严格性包括在约35%至25%甲酰胺中在约30℃至35℃的条件。可选地,本发明的核酸由它们在高严格性下杂交的能力限定,所述高严格性包括以下条件:在42℃在50%甲酰胺、5XSSPE、0.3%SDS和封闭重复序列的核酸,如cot-1或鲑精DNA(例如,200n/ml剪切和变性的鲑精DNA)中。在一个方面,本发明的核酸由它们在降低的严格性条件下杂交的能力限定,所述降低的严格性条件包括35%甲酰胺在降低的温度35℃。优选地,将主题探针设计成与这些探针所针对的核酸或蛋白质以使得非特异性反应发生率最小的特异性水平结合。然而,将理解不可能消除全部潜在交叉反应性或非特异性反应性,这是任何基于探针的系统的内在局限性。就用来检测主题蛋白质的探针而言,它们可以采取任何适合的形式,包括抗体和适配体。核酸探针或蛋白质探针的文库或阵列提供丰富和高度有价值的信息。另外,这类序列的两种或更多种阵列或概况(使用阵列所获得的信息)是用于比较试验结果集合与参比物(如另一份样品或贮存的校准物)的有用工具。在使用阵列时,各个探针一般地固定在独立的位置处并且允许发生结合反应。与装配的标记集合结合的引物用于制备序列文库或直接检测来自其他生物学样品的标记。基因标记的文库(或当指与文库中至少一些序列相对应的物理分离的核酸时,阵列)显示出高度合乎需要的特性。这些特性与特定病状相关,并且可以表征为调节概况。如本文中所称,概况指一组成员(member),其提供最初衍生所述标记的组织的诊断信息。在许多情况下,概况包含阵列上一系列由沉积的序列制成的点。总体上通过使用阵列制备特征性患者概况。阵列概况可以与一个或多个其他阵列概况或其他参考概况比较。对比结果可以提供涉及疾病状态、发展状态、疗法接受性的丰富信息和关于患者的其他信息。本发明的另一个方面提供用于分析生物学样品的诊断试剂盒,所述诊断试剂盒包含用于检测一个或多个肿瘤性标记的一种或多种物质和用于促进借助所述物质进行检测的试剂。也可以包括其他工具,例如,以便接受生物学样品。这种物质可以是任何适合的检测分子。本发明进一步通过参考以下非限制性实施例来描述。实施例1采用亚硫酸氢盐标签技术以产生如下文描述的甲基化和未甲基化基因组部分。简而言之,将DNA用甲基化不敏感性酶MspI和TaqI消化并且在非变性条件下用亚硫酸氢钠处理,从而如果它未甲基化,则由每种限制性酶留下的5'-CG单链突出端中的胞嘧啶将转化成尿嘧啶,但是如果是甲基化的,则将保持不转化。将具有5'-CG或5'-CA突出端的独立接头连接以分别提供连接的甲基化和非甲基化部分。通过随机引发拷贝反向链掺入第二引物后,将这种共同引物与适宜的正向引物组合使用以扩增甲基化和非甲基化部分。详细地,将源自8位患者的肿瘤样品和匹配的正常DNA样品如下文所述那样加工和分析。1.使用BioruptorUCD-200超声破碎器(Diagenode,比利时),在300μL10mMTris,0.1mMEDTA,pH7.5中以设定“高”的功率,在冰上通过超声波处理将源自癌组织和正常组织的DNA(1至2ug)剪切60分钟,伴以30秒“开”或“关”交替循环。随后将每份样品的一小部分施加至2%琼脂糖凝胶,以证实已经实现200至300bp的平均尺寸范围。使DNA沉淀并重悬于水中。2.在热敏磷酸酶(AntarcticPhosphatase)反应缓冲液(NewEnglandBiolabs)中调节体积至20μL并且在37℃使用5单位热敏磷酸酶使DNA去磷酸化60分钟。随后通过加热至65℃持续10分钟使酶失活。3.后续的限制性酶消化:添加3μL的10XNewEnglandBiolabs缓冲液4和2μL的20单位MspI酶并且在37℃继续孵育2小时。添加20单位2μL的TaqI和BSA至100μg/ml以产生28μL体积,并且在65℃继续孵育另外2小时。通过添加2μL500mMEDTA终止孵育。4.使用来自HumanGeneticSignatures(NorthRyde,澳大利亚)的MethylEasy试剂盒,但是省略任何事先加热或碱变性步骤,使切割的DNA(1μg)与亚硫酸氢钠反应。简而言之:(a)将25-30uL限制性消化的DNA在2mL管中与250μl亚硫酸氢钠合并,随后在37℃孵育4小时,同时省略矿物油。(b)添加20μg蓝色染料标记的糖原并且用750μLMethylEasy溶液4和1ml异丙醇沉淀DNA。在离心和用70%乙醇洗涤沉淀物后,DNA溶解于12μLMethylEasy溶液3中。可选地,使用小硅胶柱移除过多的亚硫酸氢盐,并且从该柱中洗脱样品入16μLMethylEasy溶液3中。(c)通过在MethylEasy溶液3中于72℃加热60分钟,同时离心数次以减少蒸发,实现脱磺酸作用(desulphonation)。5.CG接头和CA接头的连接。用如下文描述的P1-CG或P1-CA接头(表1)建立单独的连接。通过掺入生物素在上链的3'末端修饰P1-CG和P1-CA接头(表1)以允许后续捕获。表1.促进检测和竞争者接头的序列P1-CG接头-上5'-pCGCGTATCACCGACTGCCCTT-生物素-3'SEQIDNO:1P1-CG接头-下5'-GGGCAGTCGGTGATACG-3'SEQIDNO:2P1-CA接头-上5'-pCAGCAATCACCGACTGCCCTT-生物素-3'SEQIDNO:3P1-CA接头-下5'-GGGCAGTCGGTGATTGC-3'SEQIDNO:4CG-竞争者-上5'-ACAGAGTCGTA-3'SEQIDNO:5CG-竞争者-下5'-CGTACGACTCTG-3'SEQIDNO:6CA-竞争者-上5'-AGTGATCAGCA-3'SEQIDNO:7CA-竞争者-下5'-pCATGCTGATCAC-3'SEQIDNO:8P2-N6引物5'-CTGCCCCGGGTTCCTCATTCTCTNNNNNN-3'SEQIDNO:9P2-长引物5'-CTGCCCCGGGTTCCTCATTCT-3'SEQIDNO:10合并接头和竞争者的混合物如下表2中那样制备。这些量和比率是针对平均长度200bp的1000ngDNA。表2连接接头(20bp)竞争者(10bp)CG200ng(2:1)200ng(4:1)CA1000ng(10:1)100ng(2:1)在具有0.6μL(12单位)T4DNA连接酶的50μL中建立具有1μg亚硫酸氢盐处理的DNA的连接反应并且将它在室温孵育5小时。在连接后,DNA借助PromegaWizard柱纯化并用2x50μL10mMTris.HCl,0.1mMEDTA,pH8洗脱。这个步骤除去未连接的接头。6.珠捕获和单链的释放:25μLDynalM280链霉亲和素珠首先用500μl2X盐洗涤缓冲液(2MNaCl,10mMTrispH7.5,1mMEDTA,0.2%Tween20)洗涤两次并且重悬于100μl2x洗涤缓冲液中。添加100μL洗脱的DNA并且在摇床上在室温与这些珠以500转/分钟混合15分钟。以磁性方式捕获珠子1分钟并且除去上清液。接着在65℃在500μL的1X洗涤缓冲液中洗涤两次,在500μL的1xSSC中洗涤一次并且随后用500μL的0.5xSSC洗涤一次持续3分钟,伴以振摇。7.珠子随后重悬于50μL10mMTris.HCl,0.1mMEDTA,pH8中并且转移至新管。在98℃孵育5分钟并在冰上冷却1分钟后,将珠在冰上以磁性方式捕获1分钟,并且将上清液(50μL)转移至新管。在干燥后,使DNA重悬于10μL水中。8.随机引发。使用P2-N6引物(表1)通过随机引发掺入P2引物序列。将10μL洗脱的单链DNA与500ng(5μL)P2-N6引物混合,在98℃加热2分钟并且在冰上冷却。向这种混合物添加2.5ul10xNewEnglandBiolabs缓冲液2,0.625ul10mMdNTP,0.625ulDNA聚合酶Klenow片段(5000u/ul),并且将体积调节至25μL。在冰上孵育10分钟后,随后在室温孵育60分钟,通过在75℃加热20分钟终止反应。9.扩增。在使用1μL随机引发的DNA试验反应以大体估计扩增循环后,如下建立分别用于甲基化部分和非甲基化部分的300μL扩增反应:10μL随机引发的DNA样品150μLPromegaGoTaq2x热启动主混合物18μLP1-CA或P1-CG引物(表1,5uM母液)18μLP2-长引物(表1,5uM母液)7.5μLSybrGreen(10000x浓度的1:3000稀释度)96.5μL水样品在RocheLightCycler480上按SYBR绿程序运行:95℃2分钟x1个循环和95℃15秒,60℃1分钟x40个循环。监测荧光并在指数期顶部停止反应。将DNA使用PromegaWizard柱纯化,洗脱于30μL水中并且通过分光光度法定量。10.标记和杂交。使用Nimblegen双色DNA标记试剂盒,将每个级分的20μg样品进行荧光标记,但是用Cy3和Cy5随机六聚物替代Cy3和Cy5随机九聚物(Geneworks,Adelaide,澳大利亚)。甲基化DNA级分用Cy3标记,而非甲基化DNA级分用Cy5染料标记。按照Nimblegen操作方案,使癌DNA和正常DNA的甲基化级分与720K启动子叠覆阵列共杂交,并且根据制造商的操作方案,使非甲基化级分与独立的阵列共杂交。在Axon扫描仪上扫描阵列。除各个样品之外,制备4份DNA汇集物用于荧光标记(以及4份额外汇集物,其中Cy3标记物用于癌DNA并且Cy5用于正常DNA)汇集物1合并来自癌组织:cy5标记物的甲基化DNA级分汇集物2合并来自匹配正常组织:cy3标记物的甲基化DNA级分汇集物3合并来自癌组织:cy5标记物的非甲基化DNA级分汇集物汇集物4合并来自匹配正常组织:cy3标记物的非甲基化DNA级分鉴定差异性甲基化的基因如下文描述合并来自微阵列的针对8例单独癌症和正常配对的数据以及汇集的DNA和与汇集DNA的染料交换杂交的分析结果,以便鉴定最差异性甲基化的基因。借助差异-差异评分DD评估差异性甲基化。对于每个探针,这定义为DD=(Y.甲基化肿瘤-Y.非甲基化肿瘤)-(Y.甲基化正常-Y.非甲基化正常)其中每个Y值是探针原始反应值的log2,所述探针原始反应值是针对甲基化状态(甲基化/非甲基化)和疾病状态(肿瘤/正常)的给定组合。较大DD值意指相对于正常样品,肿瘤样品中的甲基化增加。对于每个叠覆区域,将探针以最高DD的顺组排序为DD1、DD2、DD3等。产生两个基因列表,一个列表基于叠覆区域(DD2)中差异最大的两个探针的差异性甲基化,并且一个列表基于前4个差异性探针(DD4)。对于DD2列表,弃去其中探针质量由评定为超过阈值1.5的数据。这个阈值接受约17%的全部探针并且当仅考虑两个探针时,使“噪声”的可能性最小化。对于每个叠覆区域,借助中位数合并8份独立样品的DD2值。随后,从以下3个值的平均数获得覆盖全部样品的总DD2值:该中位数和正向和染料交换的两个汇集样品值。随后通过这项评分对全部叠覆区域排序,并且返回前30个叠覆区域。对于其中考虑每个叠覆区域更多数目探针的DD4列表,使用质量评分阈值4(接受约40%的探针)。如对DD2那样,确定每个叠覆区域的总DD4值,例外是在每种情况下使用独立的DD4值。表3显示44个基因的列表,其中基于以DD2或DD4分析为基础的差异性信号水平,显示所述基因在癌DNA和正常DNA之间差异性甲基化。通过基于4种探针并且随后基于2种探针的差异,将这个名单排序。排在前4位的探针(和全部探针中前9位)出现在通过两种方法推导的前30个基因列表中。在第一列中给出Nimblegen阵列上的叠覆区域的hg18坐标,其显示差异性甲基化。在右侧两列中显示可用于与叠覆区域联系的相应基因名称和基因坐标(hg19)。图1中显示横穿每个基因的叠覆区域的DD曲线。表3图1中显示这些差异性甲基化的基因的双重差异曲线。在这些曲线中,在探针距限制性位点>300bp存在(因为均具有位于限制性位点处的一个末端的片段的剪切长度)或其中限制性位点位于探针内部,从而缩短杂交区域尺寸的情况下,预期了低信号。在一些基因(例如PDX1和TRAPP9C)的叠覆区域范围内见到广泛的差异性甲基化,而在一些情况下,增加的甲基化限于叠覆区域的部分,例如ZNF471的右半部分。实施例2使用下文描述的生物素捕获方法,制备甲基化DNA部分,所述甲基化DNA部分来自结直肠癌细胞系HCT116、HT29和SW480的亚硫酸氢盐处理的DNA并且来自从全血分离的DNA,并且使用AppliedBiosystemsSOliD测序系统,对甲基化DNA的文库测序。简而言之,将DNA剪切,并且将改良的SOLiDP2接头与剪切的DNA连接。DNA随后用Csp61(切割位点G'TAC)切割并与改良的SOLiDP1接头连接。随后将DNA变性并且用亚硫酸氢钠处理,以使全部未甲基化的胞嘧啶转化成尿嘧啶。使用改良的P2引物拷贝亚硫酸氢盐处理的DNA,并且除去原始的含有尿嘧啶的亚硫酸氢盐处理的DNA链。P1正向引物随后用来在生物素-dCTP存在下引发正向链合成。因此在原始DNA中含有甲基化胞嘧啶并且因而未转化成尿嘧啶的位置内掺入生物素dCTP。在磁珠上捕获含有生物素的部分(其代表含有甲基化胞嘧啶和与Csp61位点毗邻存在的分子)并且随后将所述部分扩增用高通量测序。该操作方案的细节如下:1.2ug基因组DNA如实施例1中那样超声处理以产生大小范围90至1000bp的DNA片段,最大分子在100-230bp之间。使用End-it试剂盒(EpicentreBiotechnologies),对DNA进行末端修复以确保平末端和5'磷酸化用于高效连接。反应在1End-it缓冲液、1mMATP、0.25mM每种dNTP和1μLEnd-it酶混合物(T4DNA聚合酶和多核苷酸激酶)中进行。在室温孵育45分钟后,将反应加热至70℃持续10分钟以失活T4DNA聚合酶。2.将修复的DNA用QiagenMinElute反应清洁试剂盒纯化和浓缩。将DNA洗脱于2x16.5μLQiagen洗脱缓冲液(EB)中。将洗脱物用含有200μMdATP的NEBuffer2(50mMNaCl,10mMTris-HCl,10mMMgCl2,1mM二硫苏糖醇,pH7.9@25℃)调节至50μl并且与孵育50单位3′→5′核酸外切酶N端截短的DNA聚合酶Klenow片段(NewEnglandBiolabs)。通过在75℃加热20分钟终止反应。3.修复的尾部加A的DNA与复性的接头SOLP2-AB/SOLP2-BP连接。这种接头从SOLiD高通量测序系统中所用的AppliedBiosystemsP2接头改造而来,SolP2-BP中加下划线的碱基已经替换原始序列中存在的胞嘧啶。SolP2-BP序列不含胞嘧啶,从而后续的生物素dCTP掺入将限于插入物序列。SolP2-AB5'CCTACCCCACATTCCTCATTCTCTSEQIDNO:11SolP2-BP3'TTGGATGGGGTGTAAGGAGTAAGAGpSEQIDNO:12互补性寡核苷酸在0.2mLPCR管中与Quick连接酶缓冲液(NewEnglandBiolabs)合并以产生500μM终浓度。通过使用如AppliedBiosystemsSOLiD文库制备物附件中所指定的热循环仪,使寡核苷酸复性。使用每40μL反应1μLQuick连接酶(NewEnglandBiolabs),在Quick连接酶缓冲液(66mMTris-HCl,10mMMgCl2,1mM二硫苏糖醇,1mMATP,7.5%w/v聚乙二醇6000,pH7.5@25℃)中进行DNA连接。接头对DNA片段末端的比率是大约10或15比1。使用QiaQuickPCR纯化试剂盒(Qiagen)移除接头,并且将DNA洗脱于40μL或50μLEB中。4.在第一接头连接后,用留下5'-TA-3'突出端的限制性酶Csp61(G'TAC)切割DNA。将DNA在供应商提供的限制性酶缓冲液(Fermentas,缓冲液B)中用10UCsp6I过夜切割。这些末端随后与半甲基化SolP1接头连接,在所述接头中正义链SolP1-AM上的胞嘧啶已经由5-甲基胞嘧啶替换(显示为“M”),并且将5'-TA-3'突出端(加下划线)添加至原始SolP2-B序列。SolP1-AM5'MMAMTAMGMMTMMGMTTTMMTMTMTATGGGMAGTMGGTGATSEQIDNO:13SolP1-BC3'CGGTGATGCGGAGGCGAAAGGAGAGATACCCGTCAGCCACTAATSEQIDNO:145.在P1接头连接后,将DNA变性并且使用MethylEasy试剂盒(HumanGeneticSignatures),以亚硫酸氢钠处理并且重悬于30μLHGS试剂3中。在正义链中,P1接头中的甲基胞嘧啶受到保护免于转化,并且P2接头链不含胞嘧啶,从而使C至U转化限于插入区域。归因于单链切刻,在变性后,仅正义链将在两个末端具有衔接子。6.使用引物SolP2-AB来引发和延伸以合成转化的DNA的拷贝。简而言之,亚硫酸氢盐处理的DNA(1μg)与含有50μMdNTP,2.5mMMgCl2和500nmolSolP2-AB引物的25μLPlatinumTaq缓冲液中的InvitrogenPlatinumTaqDNA聚合酶(1μL,5单位)孵育。在94℃加热3分钟后,将反应在65℃孵育15分钟。25μL引发链反应具有添加的2.5μLArctic磷酸酶缓冲液连同5UArctic磷酸酶(以除去dNTP汇集物)。在37℃孵育30分钟,随后在65℃使热敏磷酸酶变性8分钟。7.在合成互补链后,通过使用在尿嘧啶碱基位置处切割DNA的USER酶混合物处理,降解亚硫酸氢盐处理的原始链。随后使用剩余链作为模板用于合成与亚硫酸氢盐处理的原始链相对应的链,同时掺入生物素-dCTP以便特异性标记甲基化位点。将反应管冷却并且添加试剂的混合物以补足体积至50μL,各组分的终浓度如下:100μM脱氧腺苷三磷酸,100μM脱氧鸟苷三磷酸,100μM脱氧胸苷三磷酸和50μM生物素-14-脱氧胞苷-三磷酸,连同500nMSolP1-A引物,1U热启动Taq,2U尿嘧啶特异性切除试剂,USER酶混合物(NewEnglandBiolabs)和1×Taq缓冲液。将反应在37℃孵育10分钟以允许尿嘧啶DNA糖基化酶降解含有亚硫酸氢盐处理的尿嘧啶的DNA,此后在94℃变性2分钟,并且在65℃延伸模板10分钟。随后添加含有2.5nmol未标记的脱氧胞苷的最终等分试样在65℃孵育另外5分钟。将产物使用QiaQuickPCR纯化试剂盒(Qiagen)纯化并且洗脱于200μLEB中。8.DNA随后与链霉亲和素珠孵育,以便结合用生物素标记的物质。一系列洗涤步骤选择性地富集这种结合的物质。在水中的热变性允许回收富集的物质。使用牛血清白蛋白封闭剂并且在洗涤步骤中使用表面活性剂来增加富集的严格性。简而言之,将InvitrogenM-270链霉亲和素磁珠根据制造商的说明书制备,随后在500μL0.1mg/ml牛血清白蛋白中洗涤,之后,重悬于200μL2×结合及洗涤(B&W)缓冲液(2mol/LNaCl,20mmol/LTris-HCl[pH7.2],2mmol/LEDTA和0.2%v/vTween80)中,并且添加等体积的纯化的标记DNA溶液。在一些情况下,也添加10pg每种退火的对照寡核苷酸DNA作为内标。将400μL混合溶液在37℃孵育30分钟,伴以柔和振摇。在吸出并保存上清液之前,将管置于磁体上3分钟。进行两次额外洗涤-第一次用500μL1×B&W缓冲液并且第二次用550μL水。随后将珠子重悬于45μL水中,并且将管加热至90℃持续2'和立即置于磁体上。一旦从溶液中清除磁珠,尽快吸出加热的水,将5μL100mMTris-HClpH8.0,1mMEDTA溶液添加至该管。吸出捕获和释放的级分,所述部分经乙醇沉淀并重悬于50μL10mMTris-HClpH8.0,0.1mMEDTA中。9.将捕获的DNA在1000nM标准SOLiDP1和P2引物存在下用热启动Taq聚合酶扩增有限的循环次数。使用反向引物用来修饰扩增子序列以匹配原始AppliedBiosystems引物2序列的扩增子序列。在头几个扩增循环中的非法错配引发要求较低的复性温度。扩增使用在94℃10秒变性步骤和在72℃30秒延伸步骤,对于前4个循环,复性步骤在50℃进行,此后对于后续循环,转移至62℃复性温度。将PCR产物纯化并定量,随后用100μLPhusionTaq高保真缓冲液中的2UPhusionTaq(Finnzymes)、1000nM引物和98℃10秒变性步骤、62℃30秒复性步骤和72℃30秒延伸步骤,进行另外几个最终轮次的PCR。10.反应产物在Low-Range琼脂糖(Biorad)凝胶上分离,用SYBRGold(Invitrogen)染色,并且在SafeImager(Invitrogen)上在蓝光下用解剖刀从琼脂糖切下125-200核苷酸DNA。切下的琼脂用WizardSV凝胶提取和PCR清洁试剂盒(Promega)根据制造商的说明书处理,除了琼脂糖在室温溶解之外。将PCR产物使用QiagenMinElute试剂盒纯化,用分光光度计(Nanodrop)定量并且在AppliedBiosystemsSOLiD设备上使用SOLiD化学第3版测序。将亚硫酸氢盐测序读数与人类基因组比对,并且对于每份DNA样品,测定在Csp61位点的每侧上50碱基读出距离范围内CpG读数的数目。亚硫酸氢盐测序读数中每个CpG读数对应于原始DNA中的甲基化CpG。对于每份DNA样品,计算在基因的最上游的已解读转录起始位点上游2kb至下游1kb的区域内甲基化CpG位点读数的总数。比较每一种结肠癌细胞系DNA与血液DNA,这允许鉴定其中存在显著差异性甲基化的基因和启动子区。从分析8种汇集的癌DNA样品和8种汇集的正常DNA样品所获得的这些基因的亚硫酸氢盐标签甲基化概况(图2)随后用来形成在临床样品中也显示明显差异性甲基化的基因的列表,其中所述基因通过生物素捕获法鉴定(表4)。在表4中,在第一栏中显示基因或基因座名称。在随后两栏中显示相关基因的染色体位置,并且第四栏和第五栏给出了生物素捕获分析中所测序的第一和最末CpG位点的位置。在后续栏中提供所分析的CpG位点的数目和每份DNA样品中计数的甲基化CpG的总数。这些区域内结肠癌细胞系DNA和血液DNA之间甲基化水平的清晰差异是显而易见的。值得注意地,使用亚硫酸氢盐标签方法用于初级筛查,已经将表4中用星号确定的5个基因IRX1、DLX5、SALL1、SLC32A1和ZNF471鉴定为高度差异性甲基化的基因。还值得注意地,通过一种或两种方法发现与正常组织相比,相同基因家族的相关成员在结肠癌中是差异性甲基化的。这包括IRX家族基因IRX1和IRX2、FOXD家族基因FOXD2和FOXD3、HOXA家族基因HOXA2和HOXA5和NKX2家族基因NKX2-2、NKX2-3和NKX2-6。实施例3结直肠癌DNA和正常组织DNA中所选择基因的DNA甲基化概况设计引物用于甲基化状态非依赖性扩增基因和/或先前实施例中所鉴定的基因集合的启动子区。表5中显示扩增子的基因坐标、引物坐标和染色体坐标。引物用于从10份结直肠癌标本、其匹配正常组织的亚硫酸氢盐处理的DNA和正常血液DNA中进行PCR。使用PromegaGoTaq主混合物(无SybrGreen)、4mMMgCl2并以200nM的引物和10ng输入DNA进行扩增。循环条件是95℃2分钟(1个循环),随后50个以下循环:95℃15秒;N℃30秒;72℃30秒,其中表5中显示每个扩增子的复性温度N。对于一些扩增子,添加额外的200μMdATP和dTTP以便能够可比较地扩增甲基化和非甲基化DNA序列。纯化扩增的DNA条带并且将等量的源自每份DNA样品的独立扩增子汇集并且与接头连接以便在Roche454TitaniumFLX系统上测序。来自独立患者的癌DNA或正常DNA的样品和血液DNA样品分别与加条码的“MID”接头(Roche目录号05619211001)连接,从而可以将序列读数稍后分配给各个样品用于序列比对和评分。将文库按照Roche文库制备试剂盒和试剂提供的操作方案制备并且在流动小室的两个半侧上测序;一半含有全部癌样品并且一半含有以同等方式加条码的正常样品。使用加条码的序列,将亚硫酸氢盐测序读数分配给各份样品并且与每个扩增子的亚硫酸氢盐转化的序列比对。在最佳比对后,对每份样品确定每个潜在CpG甲基化位点处胞嘧啶的分数。在图3-26中显示遍及各个扩增子的概况。表6中汇总了代表24个基因或区域的57个扩增子的数据。该表显示遍及各份癌样品A-J的每个扩增子的在CpG位点处甲基化水平的大致范围和10份匹配的正常DNA的合并数据。表栏显示居首位的m/10和p/10,10份样品中遍及扩增子显示高水平甲基化(>60%)或部分甲基化(30-60%)的癌样品数目。先前已经在结直肠癌中报道这些基因中两者ADAMTS1和TMEFF2的甲基化,并且它们分别在9或10份癌样品显示部分甲基化或高水平甲基化。在检验的23个新基因当中,仅FGFR2基因在癌样品和正常样之间未显示差异性甲基化。大部分基因在高比例的样品中显示差异性甲基化。9个基因-DLX5、FOXD2、IRX1、MEIS1、MMP2、NPY、PDX1、SUSD5和TCF21-在全部10份样品中显示高度或部分甲基化,9个基因-COL1A2、COL41、EFEMP、FGF5、FOXF1、GRASP、SDC2、SOX21和ZNF471-在9份样品中FOXB1在8份样品中显示高度或部分甲基化、PPP1R14A在7份样品中显示高度或部分甲基化,FBN1和EDIL3在6份样品中显示高度或部分甲基化并且MEIS在3份样品中显示高度或部分甲基化。在一些情况下,例如EDIL3、FBN1、GRASP区域2、MEIS1和SDC2,匹配的正常结肠组织中的甲基化水平总是非常低。对于其他基因或区域,例如DLX5、GRASP区域3、IRX1、MMP2、NPY、PDX1和TCF21,显著的甲基化水平是在匹配的正常组织中明显的,但是甲基化总是在癌组织中显著地增加。数据也显示对于给定的基因,并非全部区域均显示同等的癌特异性甲基化。例如,对于COL4A基因,区域1和5在10份癌样品中的9份中显示高度或部分甲基化,而区域2和3分别仅在4或2份样品中是甲基化的。COL4A区域1位于COL4A1基因内部,而COL4A区域5位于相邻的差异性转录的COL4A2基因内部。测序数据因此显示:23个新基因和特定区域的结直肠癌特异性DNA甲基化可以用于开发区分癌DNA与正常DNA的测定法。实施例4使用甲基化选择性PCR分析临床样品中的DNA甲基化从结肠组织标本提取DNA,所述标本包括10份腺瘤、15份I期、18份B期、28份C期、7份IV期、6份匹配的正常结肠标本和7份其他的正常结肠组织。使用ZymoEZGold亚硫酸氢盐转化试剂盒,如制造商推荐那样,将分离的DNA进行亚硫酸氢盐转化。在15uL反应混合物中进行PCR测定法,所述反应混合物含有终浓度200nM的寡核苷酸和如表7中所示的MgCl2和MolecularProbeSYBRGreen(Invitrogen)的1:120,000稀释物。使用0.15μLPlatinumTaqDNA聚合酶(Invitrogen),在1xPlatinum缓冲液(Invitrogen)中进行GRASP和NPY扩增。使用0.1μL(0.5单位)的AmpliTaqGold(ApplliedBiosystems),在Amplitaq,Taqman缓冲液A中进行COL4A和SDC2扩增。使用384孔平板,使用如表7中对每个扩增子所显示的循环条件,在RocheLightCycler480实时PCR仪中进行PCR扩增。使用40pg至5ng充分甲基化的DNA的标准曲线,将甲基化水平定量,其中所述充分甲基化的DNA与外周血白细胞DNA混合以产生5ng总输入量。通过从充分甲基化DNA的标准曲线计算的甲基化DNA的量除以输入DNA的量确定样品中甲基化DNA的比例。表7如果甲基化DNA的分数对于GRASP而言>1%或对于NPY、SDC2和COL4A1而言>2%,则将DNA样品评定为阳性。表8中显示每种生物标记测定法的阳性样品的数目和%。对于癌DNA样品,高比例的样品(范围从88%至94%)对每种标记的甲基化为阳性。相反,匹配的正常对照当中阳性样品的比例低(0-25%)。在正常DNA样品内部,与癌DNA样品的甲基化水平相比,由MSP测定法测量的甲基化水平在数量上低。实施例5分析从血浆分离的DNA中GRASP和COL4A1基因的甲基化也在血浆DNA样品上进行GRASP和COL4A1基因的测定法,其中所述血浆DNA样品来自如结肠镜检查所确定的具有结直肠癌、结直肠腺瘤的患者或如无结直肠瘤形成的患者。使用QIAmp从血清分离游离循环型核酸的方法(QIAGEN),从4mL人血浆提取DNA。使用Zymo亚硫酸氢盐转化试剂盒,如制造商推荐那样,将分离的DNA进行亚硫酸氢盐转化。从4mL血浆抽取总计36uL亚硫酸氢盐转化的DNA。使用实施例4中所述的MSP测定法确定甲基化COL4A1序列的存在,例外是包含100nM的特异性检测探针COL4A1探针BS1,HEX-5'CTAAACCCGTCCGCCTACCCCTC-BHQ(SEQIDNO:80)。使用半巢式PCR检测甲基化的GRASP序列。在由终浓度1xPlatinumTaq缓冲液、0.1μLPlatinumTaqDNA聚合酶(Invitrogen)、3.3mMMgCl2、200uMdNTP(NewEnglandBioLabs)和33nM寡核苷酸组成的30μL(2.5uL亚硫酸氢盐转化的DNA输入物)中进行第一轮PCR。第一轮扩增使用正向引物GrspA-F15'-CGGATTTTCGATTCGGAAGT(SEQIDNO:81)和来自实施例4表7的GRASPMSPR1。循环条件是95℃2分钟,随后以下11个循环:92℃15秒;60℃30秒和72℃30秒。PCR扩增在PALM终点PCR循环仪中使用96孔板进行。第二轮PCR使用来自实施例4表7的引物和反应条件并且对来自第一轮PCR的1uL材料进行,至15μL总PCR反应。使用40pg至5ng充分甲基化的DNA的标准曲线,将甲基化水平定量,其中所述充分甲基化的DNA与外周血白细胞DNA混合以产生5ng总输入量。对于COL4A1,标准曲线基于进入单轮次的输入量,或对于GRASP,标准曲线基于进入第一轮中的输入量。表9中显示在至少2或3个一式三份PCR中评定为阳性的血浆DNA样品的比例。数据显示两者表9本领域技术人员将理解除了具体描述的那些内容之外,本文中所述的本发明易于进行变化和修饰。应当理解本发明包括全部此类变化和修改。本发明也分别或总体地包括在本发明中提及或显示的全部步骤、特征、组合物和化合物,以及任意两个或多个所述步骤或特征的任何和全部组合。参考书目Abrams和Stanton,MethodsEnzymol.,212:71-74,1992Adorjan等人,Nucl.AcidsRes.,30:e21,2002Alon等人,Proc.Natl.Acad.Sci.USA:96:6745-6750,June1999Ammerpohl等人,BiochimBiophysActa.1790:847-62,2009Ausubel,F.等人,“CurrentProtocolsinMolecularBiology”,JohnWiley&Sons,(1998)Beaucage等人,TetrahedronLetters22:1859-1862,1981Bianco等人,Hum.Mutat.,14:289-293,1999Bonner和Laskey,Eur.J.Biochem.46:83,1974Bresslauer等人,Proc.Natl.Acad.Sci.USA,83:3746-3750,1986“Cancer”NationalCancerInstitute2009.http://www.cancer.gov/cancertopics/commoncancersCaruthers等人,MethodsinEnzymology,Vol.154,pp.287-314(1988)Chen和Kwok,NucleicAcidsRes.25:347-353,1997Clark等人,NatProtoc.1:2353-64,2006Cottrell等人,Nucl.AcidsRes.32:e10,2003DeGraves等人,Biotechniques34(1):106-10,112-5(2003)DeimanB等人,Mol.Biotechnol.20(2):163-79(2002)Deng等人,Chin.J.CancerRes.,12:171-191,2000Dieffenbach和Dveksler(Eds)(In:PCRPrimer:ALaboratoryManual,ColdSpringHarborLaboratories,NY,1995Eads等人,CancerRes.59:2302-2306(1999)Eads等人,Nucl.AcidsRes.28:E32,2000Egholm等人,Am.Chem.Soc.,114:1895,1992Egholm等人,Nature,365:566,1993Fodor等人,Science767-773,1991Frommer等人,Proc.Natl.Acad.Sci.USA89:1827-1831(1992)Gibson等人,GenomeResearch6:995-1001(1996)Golub等人,Science,286:531-537,1999Gonzalgo和Jones,NucleicAcidsRes.25:2529-2531(1997)Gonzalgo等人,CancerRes.57:594-599,1997Herman等人,Proc.Natl.Acad.Sci.USA93:9821-9826,(1996)Holland等人,Proc.Natl.Acad.Sci.USA,88:7276-7280,1991Kawai等人,Mol.Cell.Biol.14:7421-7427,1994Kristensen和HansenClinChem.55:1471-83,2009Kuppuswamy等人,Proc.Natl.Acad.Sci.USA88:1143-1147,1991Landegren等人,GenomeRes.,8(8):769-776,1998Lee等人,NucleicAcidRes.21:3761-3766,1993Markowitz和Bertagnolli(2009).N.Engl.J.Med.361(25):2449–60Marmur和Doty,J.Mol.Biol.5:109,1962Messing,MethodsEnzymol,101,20-78,1983Mhlanga和Malmberg,Methods25:463-471,2001Moore等人,BBA,1402:239-249,1988Narang等人,Meth.Enzymol68:90,1979Nielsen等人,J.Chem.Soc.PerkinTrans.,1:3423,1997Olek等人,Nat.Genet.17(3):275-6(1997)Orum等人,Clin.Chem.45:1898-1905,1999Orum等人,Nucl.AcidsRes.,21:5332,1993PCTPublicationNo.WO00/70090Rand等人,Epigenetics1:94-100,2006Rand等人,Nucl.AcidsRes.33:e127,2005Rein等人,NucleicAcidsRes.26(10):2255-64(1998)Robinson等人,Epigenomics2:587-98(2010)Sadri和Hornsby,Nucl.AcidsRes.24:5058-5059(1996)Sambrook等人,MolecularCloning,ALaboratoryManual(2ndEd.,CSHP,NewYork1989)SantaLucia,Proc.Natl.Acad.Sci.USA,95:1460-1465,1995Shames等人,CancerLett.251:187-98,2007Simeonov和Nikiforov,NucleicAcidsResearch,30(17):1-5,2002Singer-Sam等人,Nucl.AcidsRes.18,687,1990Singer-Sam等人,Nucl.AcidsRes.18:687,1990Singer-Sam等人,PCRMethodsAppl.1:160-163,1992Singh和Wengel,Chem.Commun.1247,1998Southern等人,Genomics,13:1008-1017,1992Szabo和Mann,GenesDev.9:3097-3108,1995Toyota等人,CancerRes.59:2307-12(1999)美国专利号5,786,146美国专利公开2005/0069879Uhlmann等人,Electrophoresis,23:4072-4079,2002Wedemeyer等人,ClinicalChemistry48:91398-1405,2002Weissleder等人,NatureMedicine6:351-355,2000WeitzelJN(1999).Cancer86(11Suppl):2483–92Worm等人,Clin.Chem.,47:1183-1189,2001Xiong和Laird,NucleicAcidsRes.25:2532-2534(1997)Zyskind等人,RecombinantDNALaboratoryManual,(Acad.Press,1988)当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1