一种同时高效检测转基因大豆MON87701和MON87708品系特异性基因的双重荧光PCR方法与流程
本发明涉及生物检测领域,特别涉及检测转基因大豆MON87701和MON87708的双重荧光PCR方法。
背景技术:
2015年是转基因作物商业化20周年,全球转基因作物种植面积高达1.797亿公顷,比1996年商业化初期增长了100余倍,已成为现代农业史上采用最为迅速的作物技术。目前商业化种植的转基因作物主要有大豆、玉米、棉花、油菜等,其中全球种植面积最大的为转基因大豆,约占全球转基因作物总面积的一半。虽然我国还没有批准任何转基因大豆品系进行商业化种植,但我国已经成为转基因大豆的使用与消费大国,产品越来越多地进入了我国的食品生产与消费链,2015年转基因大豆的进口总量已达到8000万吨。
转基因大豆MON87701和MON87708都是美国孟山都公司近年来研发的新品种,其中MON87701为一种抗虫转基因大豆,已被我国政府批准进口用作加工原料,而MON87708为一种耐除草剂转基因大豆新品种,也正在申请进口。针对转基因大豆MON87701和MON87708开展高效精准的检测方法研究,是转基因生物安全管理相关法律法规顺利实施的技术支撑和保障。
目前,国内外针对转基因大豆的检测方法多采用单重荧光PCR技术,该技术在特异性、灵敏度、重现性等方面具有较大的优势,成为该领域的主要技术之一,但国内针对转基因大豆MON87701和MON87708品系的检测鲜有报道,目前只有极少量环介导等温核酸扩增(LAMP)技术的检测方法正在专利申请阶段,而使用LAMP技术检测转基因大豆的引物的敏感性和特异性仍然不高,无法满足实际检测的需要。目前还没有能同时检测转基因大豆MON87701和MON87708品系特异性基因的多重荧光PCR技术的方法。
技术实现要素:
本发明要解决的技术问题是提供一种灵敏、准确、高效且能同时检测检测转基因大豆MON87701和转基因大豆MON87708的双重荧光PCR方法,本发明还提供了用于该方法的特异性好、灵敏度高、检测效率高和适用范围广的引物对和探针组合,以及含有该引物对和探针组合的试剂盒及其应用。
为了解决上述技术问题,本发明通过如下技术方案实现:
本发明第一方面提供了引物对和探针组合,其中一组引物对包含SEQ ID NO:1和SEQ ID NO:2所示的核苷酸序列,与这组引物对相对应的探针包含SEQ ID NO:3所示的核苷酸序列;另一组引物对包含SEQ ID NO:4和SEQ ID NO:5所示的核苷酸序列,与这组引物对相对应的探针包含SEQ ID NO:6所示的核苷酸序列。
本发明第二方面提供了所述的引物对和探针组合在检测或辅助检测转基因大豆MON87701和转基因大豆MON87708,或制备检测或辅助检测转基因大豆MON87701和转基因大豆MON87708的产品中的应用。
本发明第三方面提供了一种试剂盒,包括所述的引物对和探针组合。
在一优选例中,还包括荧光定量PCR扩增试剂;
在一优选例中,所述荧光定量PCR扩增试剂包括dNTPs、Mg2+、PCR反应缓冲液和Taq DNA聚合酶中的至少一种;
在一优选例中,所述dNTPs、Mg2+、PCR反应缓冲液和Taq DNA聚合酶均来源于Takara公司的货号为RR390A的试剂盒中所包含的试剂;
在一优选例中,还包括DNA提取试剂盒;
在一优选例中,所述DNA提取试剂盒包括来自达安基因的货号为DA-Z146的核酸提取试剂盒、Promega公司的货号为A1120的Wizard Genomic DNA purification kit或TaKaRa公司的货号为9781的MiniBEST Plant Genomic DNA Extraction Kit中所包含的试剂;
在一优选例中,还包括阳性对照和阴性对照。
本发明第四方面提供了所述的试剂盒在检测或辅助检测转基因大豆MON87701和转基因大豆MON87708,或制备检测或辅助检测转基因大豆MON87701和MON87708的产品中的应用。
本发明第五方面提供了一种检测或辅助检测转基因大豆MON87701和转基因大豆MON87708的双重荧光PCR方法,包括使用所述的引物对和探针组合或所述试剂盒的步骤。
在一优选例中,所述方法包括如下步骤:
1)双重荧光PCR扩增
以生物样品含有的DNA为模板与所述的引物对和探针组合或所述试剂盒进行双重荧光PCR扩增;
2)根据双重荧光PCR扩增的结果判断生物样品是否为转基因大豆MON87701或转基因大豆MON87708,或生物样品是否含有转基因大豆MON87701和/或转基因大豆MON87708的品系特异性基因成分;
在一优选例中,在步骤1)之前还包括在生物样品中提取DNA的步骤;
在一优选例中,所述在生物样品中提取DNA是采用达安基因的货号为DA-Z146的核酸提取试剂盒、Promega公司的货号为A1120的Wizard Genomic DNA purification kit或TaKaRa公司的货号为9781的MiniBEST Plant Genomic DNA Extraction Kit进行。
在一优选例中,所述双重荧光PCR扩增的反应体系如下:
Probes Master 2×conc 10μL
SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:4和SEQ ID NO:5
10μmol/L,0.4~0.6μL
SEQ ID NO:3和SEQ ID NO:6 10μmol/L,0.05~0.3μL
DNA模板 100~300ng/μL,1~2μL
ddH2O 补足至20μL;
所述Probes Master 2×conc来源于Takara公司的货号为RR390A的试剂盒。
在一优选例中,所述双重荧光PCR扩增的反应体系如下:所述SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:4和SEQ ID NO:5的用量均为0.5μL,所述SEQ ID NO:3和SEQ ID NO:6的用量分别为0.2μL和0.1μL;
在一优选例中,所述双重荧光PCR扩增反应条件:95℃3min;95℃、5~10s,59℃、25~40s,40循环。
在一优选例中,所述双重荧光PCR扩增反应条件:95℃3min;95℃、5s,59℃、30s,40个循环。
本发明的生物样品为转基因作物或含有转基因成分的加工品如食品等。
本发明的有益效果包括:
(1)本发明针对两种转基因大豆设计的多条多重引物、探针进行了大量筛选,综合其特异性、灵敏度、配对复合扩增的相互影响、以及不同引物探针组合与荧光PCR扩增试剂盒的适配性,最终筛选出特异性好、灵敏度高、适用性广且可同时检测转基因大豆MON87701和转基因大豆MON87708的引物对和探针组合。
(2)本发明针对在前述引物对和探针组合的基础上建立了转基因大豆MON87701和转基因大豆MON87708的双重荧光PCR检测方法,可同时对转基因大豆MON87701和转基因大豆MON87708进行定性和定量检测,且特异性好、通量高、快速,提高了检测效率,为转基因大豆MON87701和转基因大豆MON87708的同时检测提供了更有效的方法。
附图说明
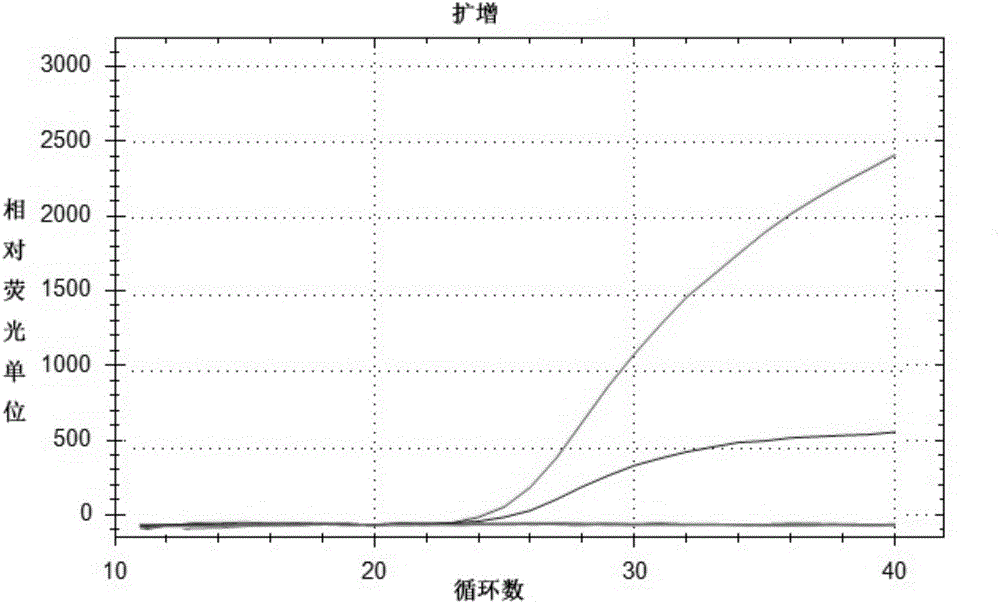
图1是本发明实施例5中利用引物对和探针组合同时检测转基因大豆MON87701和转基因大豆MON87708的双重荧光PCR方法的特异性验证结果。其中A、B两条典型S曲线分别为以转基因大豆MON87701和转基因大豆MON87708的基因组DNA为模板进行双重荧光PCR扩增得到的扩增产物的荧光曲线,其余为以转基因大豆GTS-40-3-2、转基因大豆DAS81419、转基因大豆DAS-44406-6、转基因大豆DP305423、转基因大豆A2704-12、转基因大豆FG72、非转基因大豆的基因组DNA为模板进行双重荧光PCR扩增得到的扩增产物的荧光曲线。
图2是本发明实施例6中利用引物对和探针组合同时检测转基因大豆MON87701和转基因大豆MON87708的双重荧光PCR方法的灵敏度验证结果。其中1~4分别对应稀释度依次为100到10-3的转基因大豆MON87701的基因组DNA的双重荧光PCR反应结果,5~8分别对应稀释度依次为100到10-3的转基因大豆MON87708的基因组DNA的双重荧光PCR反应结果,其余为稀释度为10-4的转基因大豆MON87701的基因组DNA、稀释度为10-4的转基因大豆MON87708的基因组DNA和阴性对照的双重荧光PCR反应结果。
具体实施方式
除非特殊说明,本发明所用术语具有本发明所属领域中的一般含义。
下面参考具体实施例和附图,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,均按照常规实验条件,如Sambrook等分子克隆实验手册(Sambrook J&Russell DW,Molecular cloning:alaboratory manual,2001),或按照制造厂商说明书建议的条件。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
本实施例提供了引物对和探针组合及其应用。
两组引物对的筛选方法为:针对转基因大豆MON87701和转基因大豆MON87708的品系特异性基因,设计不同的引物和探针组合并进行了优化筛选,综合其特异性、灵敏度、配对复合扩增的相互影响、以及不同引物探针组合与荧光PCR扩增试剂盒的适配性,最终筛选出特异性好、重复性好且灵敏度高的如下可同时检测转基因大豆MON87701、MON87708的双重荧光PCR的引物对和探针组合:
所述的引物对和探针组合的核苷酸序列如下:
MON87701-F::5’-ATTTCCCGGACATGAAGCC-3’(SEQ ID NO:1);
MON87701-R:5’-TGGTTAGTGAGTGGCAGTAATCG-3’(SEQ ID NO:2);
MON87701的探针序列为:5’-HEX-CAAGCTAATTCAAGAAAGTGAAGGCACG-BHQ1-3’(SEQ ID NO:3)
MON87708-F:5’-GCTTATCCGATTTGAGCATTG-3’(SEQ ID NO:4);
MON87708-R:5’-CGTTTCCCGCCTTCAGTTT-3’(SEQ ID NO:5);
MON87708的探针序列为:5’-FAM-ATGAGCCATTTAGTCTCACCTTCAAACA-BHQ1-3’(SEQ ID NO:6)
其中HEX、FAM为荧光基团,BHQ1为淬灭基团。
上述引物对和探针由上海生工生物技术有限公司合成。
利用上述引物对和探针可同时针对转基因大豆MON87701和转基因大豆MON87708进行双重荧光PCR扩增。
在应用上,上述引物对和探针组合可应用于检测或辅助检测转基因大豆MON87701和转基因大豆MON87708上;还可以用来制备检测或辅助检测转基因大豆MON87701和转基因大豆MON87708的产品。
实施例2
本实施例提供了一种试剂盒及其应用,所述试剂盒包括:
(1)SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6(来自实施例1);
(2)dNTPs、Mg2+、PCR反应缓冲液、Taq DNA聚合酶中的至少一种。
上述dNTPs、Mg2+、PCR反应缓冲液、Taq DNA聚合酶优选来源于TaKaRa公司的货号为RR060A的试剂盒。
进一步优选包括DNA提取试剂盒,所述DNA提取试剂盒优选包括来自达安基因的货号为DA-Z146的核酸提取试剂盒、Promega公司的货号为A1120的Wizard Genomic DNA purification kit或TaKaRa公司的货号为9781的MiniBEST Plant Genomic DNA Extraction Kit中所包含的试剂。
进一步优选包括阳性对照和阴性对照。
实验证明,上述DNA提取试剂盒、TaKaRa公司的货号为RR060A的试剂盒,以及与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6的联合使用,效果更加优越,具体表现在特异性强、重复性好和灵敏度高。
在应用上,上述试剂盒可应用于检测或辅助检测转基因大豆MON87701和转基因大豆MON87708上;还可以用来制备检测或辅助检测转基因大豆MON87701和转基因大豆MON87708的产品。
实施例3
本实施例提供了一种检测或辅助检测转基因大豆MON87701和转基因大豆MON87708的方法,例如根据双重荧光PCR扩增的结果判断生物样品是否为转基因大豆MON87701或转基因大豆MON87708,或生物样品是否含有转基因大豆MON87701和/或转基因大豆MON87708的品系特异性基因成分;该方法使用了实施例1的引物对和探针组合或实施例2的试剂盒。
上述方法包括如下步骤:
步骤一:双重荧光PCR扩增
以生物样品的DNA为模板,采用引物对和探针进行双重荧光P CR扩增,同时设置并设去离子水为阴性对照。
双重荧光PCR扩增反应体系如表1所示。其中,Probes Master 2×conc(包含有dNTP,Mg2+,Taq酶等)(来自Takara公司的货号为RR390A的试剂盒)10μL,10μmol/L的实施例1的引物SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:4和SEQ ID NO:5各0.4~0.6μL,10μmol/L的实施例1的探针SEQ ID NO:3和SEQ ID NO:6各0.05~0.3μL,DNA模板1~2μL(浓度100~300ng/μL),超纯水补至20μL。
优选的,上述引物SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:4和SEQ ID NO:5的添加量均为0.5μL、探针SEQ ID NO:3和SEQ ID NO:6的添加量分别为0.2μL和0.1μL。
双重荧光PCR扩增反应条件:95℃3min;95℃、5~10s,59℃、25~40s,40循环。
双重荧光PCR扩增反应条件可进一步优选为:95℃3min;95℃、5s,59℃、30s,40个循环。
步骤三:双重荧光PCR扩增产物的荧光检测
在每个循环的59℃阶段结束后收集FAM和HEX的荧光信号。
所述双重荧光PCR扩增的结果判断的标准如表1所示。
表1
表1中“+”代表Ct值≤35为阳性,“-”代表Ct值>35为阴性。
如果生物样品还未提取DNA,上述方法步骤(1)双重荧光PCR扩增之前还可以包括使用来自达安基因的货号为DA-Z146的核酸提取试剂盒、Promega公司的货号为A1120的Wizard Genomic DNA purifi cation kit或TaKaRa公司的货号为9781的MiniBEST Plant Genomic DNA Extraction Kit按照试剂盒说明书对生物样品中的DNA进行提取的步骤。
实施例4
本实施例对实施例3建立的检测或辅助检测转基因大豆MON87701和转基因大豆MON87708的方法进行了有效性验证,所用的供试材料如下:转基因大豆MON87701粉末、转基因大豆MON87708粉末,均购自American Oil Chemists'Society(AOCS,深圳远扬生物技术公司代理)。
步骤一:基因组DNA的提取
取转基因大豆MON87701粉末和转基因大豆MON87708粉末各10mg于1.5mL离心管内,采用试剂盒法(MiniBEST Plant Genomic DNA Extraction Kit,TaKaRa:9781)提取基因组DNA,最终DNA的定容体积为50μL。
步骤二:双重荧光PCR扩增
以转基因大豆MON87701和转基因大豆MON87708提取的基因组DNA混合液为模板,进行双重荧光PCR扩增,同时设置并设去离子水为阴性对照。
双重荧光PCR扩增反应体系:Probes Master 2×conc(包含有dNTP,Mg2+,Taq酶等)(来自Takara公司的货号为RR390A的试剂盒)10μL,10μmol/L的实施例1的引物SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:4和SEQ ID NO:5各0.5μL,10μmol/L的实施例1的探针SEQ ID NO:3和SEQ ID NO:6分别为0.2μL和0.1μL,DNA模板1μL(浓度100~300ng/μL),超纯水补至20μL。
双重荧光PCR扩增反应条件:95℃3min;95℃、5s,59℃、30s,40循环。
步骤三:双重荧光PCR扩增产物的荧光检测
在每个循环的59℃阶段结束后收集FAM和HEX的荧光信号。
结果分析:
由结果可知,FAM通道下Ct值为24.51,表明该样品中含有转基因大豆MON87708品系特异性基因,HXE通道下Ct值为24.13,表明该样品中含有转基因大豆MON87701品系特异性基因。说明本发明的基于实施例1的引物对和探针以及实施例2的试剂盒建立的检测或辅助转基因大豆MON87701和转基因大豆MON87708的方法可以有效检测转基因大豆MON87701和转基因大豆MON87708。
实施例5
本实施例对实施例1的引物对和探针组合进行了特异性验证,所用的供试材料如下:转基因大豆MON87701(AOCS,American Oil Chemists'Society美国油化学家学会)、转基因大豆MON87708(AOCS,American Oil Chemists'Society美国油化学家学会)、转基因大豆GTS-40-3-2(欧盟标准物质和测量研究所,IRMM)、转基因大豆DAS81419(保存于中国检验检疫科学研究院)、转基因大豆DAS-44406-6(欧盟标准物质和测量研究所,IRMM)、转基因大豆DP305423(欧盟标准物质和测量研究所,IRMM)、转基因大豆A2704-12(AOCS,American Oil Chemists'Society美国油化学家学会)、转基因大豆FG72(AOCS,American Oil Chemists'Society美国油化学家学会)、非转基因大豆(本地农贸市场,经鉴定为非转基因大豆)。
步骤一:基因组DNA的提取
采用实施例4的步骤一的基因组DNA的提取方法分别提取转基因大豆MON87701、转基因大豆MON87708、转基因大豆GTS-40-3-2、转基因大豆DAS81419、转基因大豆DAS-44406-6、转基因大豆DP305423、转基因大豆A2704-12、转基因大豆FG72和非转基因大豆的基因组DNA。
步骤二:双重荧光PCR扩增
分别以步骤一的各转基因大豆的基因组DNA为模板,进行双重荧光PCR扩增,双重荧光PCR扩增的方法同实施例4的步骤二。
步骤三:双重荧光PCR扩增产物的荧光检测
在每个循环的59℃阶段结束后收集FAM和HEX的荧光信号。
结果分析:
结果如图1所示,A、B两条典型S曲线分别为以转基因大豆MON87701和转基因大豆MON87708的基因组DNA为模板进行双重荧光PCR扩增得到的扩增产物的荧光曲线,其余为以转基因大豆GTS-40-3-2、转基因大豆DAS81419、转基因大豆DAS-44406-6、转基因大豆DP305423、转基因大豆A2704-12、转基因大豆FG72、非转基因大豆的基因组DNA为模板进行双重荧光PCR扩增得到的扩增产物的荧光曲线。即转基因大豆MON87701和转基因大豆MON87708有扩增能顺利检出,其余转基因大豆和非转基因大豆均无扩增,由此证明本发明实施例1的引物对和探针具有高特异性;进一步的,本发明基于引物对和探针及试剂盒建立的检测或辅助转基因大豆MON87701和转基因大豆MON87708的方法能够准确的对转基因大豆MON87701和转基因大豆MON87708进行检测。
实施例6
本实施例对实施例1的引物对和探针组合进行了灵敏度验证,所用的供试材料如下:转基因大豆MON87701、转基因大豆MON87708,均购自American Oil Chemists Society(AOCS,深圳远扬生物技术公司代理)。
步骤一:基因组DNA的提取
基因组DNA的提取方法见实施例4的步骤一。测试核酸浓度后将提取的基因组DNA混合,再用去离子水进行梯度稀释,分别得到稀释度均分别为100、10-1、10-2、10-3、10-4的转基因大豆MON87701(对应浓度分别为260ng/μL、26ng/μL、2.6ng/μL、0.26ng/μL和.0.026ng/μL)和转基因大豆MON87708(对应浓度分别为240ng/μL、24ng/μL、2.4ng/μL、0.24ng/μL和0.024ng/μL)的混合基因组DNA,即五组:
组1:260ng/μL的转基因大豆MON87701的基因组DNA和240ng/μL的转基因大豆MON87708的基因组DNA的混合液;
组2:26ng/μL的转基因大豆MON87701的基因组DNA和24ng/μL的转基因大豆MON87708的基因组DNA的混合液;
组3:2.6ng/μL的转基因大豆MON87701的基因组DNA和2.4ng/μL的转基因大豆MON87708的基因组DNA的混合液;
组4:0.26ng/μL的转基因大豆MON87701的基因组DNA和0.24ng/μL的转基因大豆MON87708的基因组DNA的混合液;
组5:0.026ng/μL的转基因大豆MON87701的基因组DNA和0.024ng/μL的转基因大豆MON87708的基因组DNA的混合液。
步骤二:双重荧光PCR扩增
采用步骤一的不同浓度的转基因大豆MON87701的基因组DNA和转基因大豆MON87708的基因组DNA的混合液(即组1-组5)作为模板,进行双重荧光PCR扩增,双重荧光PCR扩增的方法同实施例4的步骤二。每个稀释度作3个重复,并设去离子水为阴性对照。
步骤三:双重荧光PCR扩增产物的荧光检测
在每个循环的59℃阶段结束后收集FAM和HEX的荧光信号。
结果分析:
结果如图2所示,其中1~4分别对应稀释度依次为100到10-3的转基因大豆MON87701的基因组DNA的双重荧光PCR反应结果,5~8分别对应稀释度依次为100到10-3的转基因大豆MON87708的基因组DNA的双重荧光PCR反应结果,其余为稀释度为10-4的转基因大豆MON87701与MON87708的混合基因组DNA和阴性对照的双重荧光PCR反应结果。由此可知其检测低限可达10-4,即可同时检测转基因大豆MON87701和转基因大豆MON87708的基因组DNA中0.26ng和0.24ng的品系特异性基因,相当于可检测含量约0.1%的对应目标转基因成分。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!