一种西红花酸衍生物GX‑Ring及其制备方法、以及在预防或治疗心脑血管疾病中的应用与流程
本发明涉及一种新的西红花酸衍生物,具体涉及西红花酸的可药用酰胺及其制备方法,以及该衍生物在预防和治疗心脑血管疾病中的应用。
背景技术:
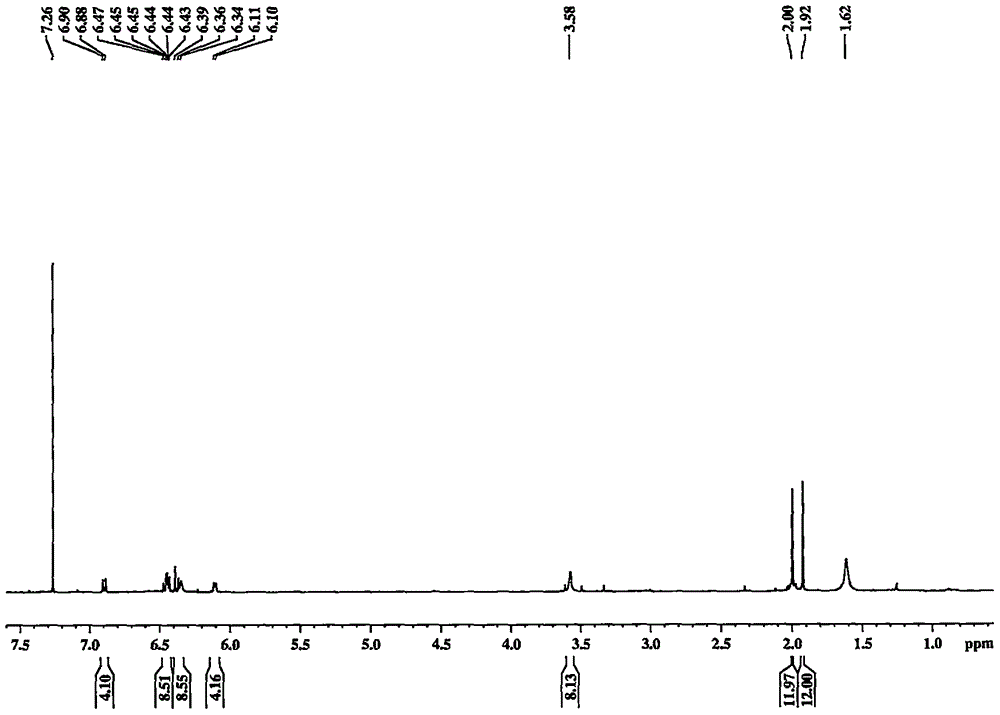
:西红花(CrocussativusL.)又称藏红花,是鸢尾科番红花属植物番红花CrocussativusL.的干燥柱头。西红花是一种名贵的中药材,在治疗或预防心脑血管疾病,以及肿瘤、炎症、疼痛抑制及对肝脏、肾脏、神经系统的保护作用等方面临床应用广泛,且疗效显著。西红花的主要药效物质包括西红花酸、藏红花素、西红花酸二甲酯、西红花苦素等,此外还含有桉脑、蒎烯、多种维生素。国内外现代研究表明,西红花酸(crocetin)是西红花在体内发挥心脑血管疗效的主要活性组分。西红花酸具有多不饱和共轭烯酸结构,属类胡萝卜素物质,在抗心血管系统疾病、抗氧化、抗动脉粥样硬化、防治糖尿病并发症等方面有明确的生物活性。近年来,西红花酸在心血管系统疾病中的防治作用成为许多学者的研究热点,大量研究成果也表明西红花酸具有很好的心血管保护作用,且其作用是多靶点、多途径的。这些研究成果预示着西红花酸有良好的开发前景,很有希望开发成为新型的防治心血管系统疾病的药物,值得深入研究。然而,西红花酸的脂溶性和水溶性较差,极难溶于水以及除吡啶和与吡啶相似的有机碱以外的常用有机溶剂,难以达到较高的药物浓度及给药剂量,另外,由于药物脂溶性较高才能容易被胃肠道上皮细胞黏膜所吸收,而西红花酸由于其脂溶性极差,从而造成生物利用度低,临床应用受到极大的限制。同时,通过西红花酸衍生物解决溶解性问题,仍有许多技术难点,比如衍生物结构不稳定,活性降低等问题。为此,本研究以西红花酸为基础进行结构修饰,以期获得到溶解性较好,且心脑血管活性与西红花酸本体相当甚至更优的新药先导化合物。技术实现要素:本发明目的在于提供一种西红花酸酰胺类衍生物以及其制备方法与用途。本发明的技术方案如下:一种西红花酸酰胺衍生物GX-Ring,其结构式如下所示:一种制备西红花酸酰胺GX-Ring的方法,包括下列步骤:(1)取西红花酸、CH2Cl2于反应瓶中;冰浴条件下,加入草酰氯、DMF(化学名N,N-二甲基甲酰胺),室温搅拌反应4-6小时。继续加入有机胺类化合物进行反应,室温过夜,加入H2O搅拌反应1-5小时后,停止反应。(2)将反应液过滤,除去溶剂,加入EA溶解,洗涤;除去溶剂后,得到粗品。(3)将粗品用硅胶柱进行分离,洗脱,得到产物。具体地,步骤(1)中有机胺类化合物为乙二胺和三乙胺混合溶液。具体地,步骤(1)中反应的西红花酸与乙二胺的摩尔比为1∶1-5,西红花酸与三乙胺的摩尔比为1∶8。优选地,步骤(1)中反应的西红花酸与乙二胺的摩尔比为1∶1。具体地,步骤(1)反应加入的DMF为1-2滴。具体地,步骤(2)反应中的洗涤方法为:依次用盐酸、碳酸氢钠、水洗涤,分别洗涤2-5次;优选地,步骤(2)反应中的洗涤方法为:依次用盐酸、碳酸氢钠、水洗涤,分别洗涤3次。具体地,步骤(3)中洗脱的方法为:先用CHCl3洗脱,再用CHCl3∶CH3OH=10∶1进行洗脱。目前,西红花酸存在脂溶性极低的问题,0.1g西红花酸不溶于1000ml乙醇、氯仿-乙醇等有机溶剂,导致西红花酸生物利用度极低,临床应用受限。西红花酸GX-1结构如下所示:本发明通过筛选大量的西红花酸衍生物,用以解决西红花酸脂溶性低导致的生物利用度降低的问题。本发明合成了一系列西红花酸衍生物,如GX-M、GX-N等。西红花酸酰胺GX-M,其结构式如下所示:西红花酸酰胺GX-N,其结构式如下所示:本发明涉及的西红花酸酰胺衍生物GX-Ring,与同类西红花酸衍生物GX-M、GX-N相比,在相同药物浓度下,通过线粒体活性试剂检测,GX-Ring活性明显优于GX-M、GX-N,甚至优于西红花酸GX-1,对缺氧小室诱导H9c2心肌细胞缺氧损伤有明显的保护作用,可以有效预防或治疗心脑血管疾病。本发明涉及的西红花酸酰胺衍生物GX-Ring,脂溶性也远高于西红花酸GX-1,更容易被胃肠道上皮细胞黏膜所吸收,生物利用度相比于西红花酸而言得到极大提升。本发明涉及的西红花酰胺衍生物GX-Ring通过小鼠急毒、慢性毒性实验证明该化合物安全有效,GX-Ring脂溶性提升的同时生物活性并没有降低,甚至优于西红花酸,克服了西红花酸脂溶极低导致的生物利用度低的问题,GX-Ring可以制备成片剂、缓释片剂、颗粒剂、混悬剂等口服制剂用于预防或治疗心脑血管疾病,其临床应用更为广泛。附图说明图1、GX-Ring的高分辨MS图谱:GX-RingC44H56N4O4;Found:[M+H]+705.4372;Calcd:[M+H]+705.4374(0.33ppm)图2、GX-Ring的高分辨NMR图谱:GX-Ring:1HNMRspectrum图3、GX-Ring的高分辨NMR图谱:GX-Ring:13CNMRspectrum具体实施例实施例1制备西红花酸衍生物GX-Ring取GX-1(购自于Sigma公司)(0.25mmol,80mg)于100ml反应瓶。加入CH2Cl220ml,在冰浴条件下,加入草酰氯(0.1mmol,100μl)并加入DMF1-2滴,室温搅拌反应4h。当溶液颜色深红,基本澄清时,加入乙二胺(0.25mmol)和三乙胺(2.0mmol,)进行反应,室温反应过夜,加入100μlH2O搅拌反应5小时后停止反应,利用TLC和LC-MS检测产物是否生成。将反应液过滤,真空除去溶剂,加入EA20ml溶解,依次用2%HCl,5%NaHCO3,H2O各20ml分别洗涤3次,真空除去溶剂得到粗品。将GX-Ring用硅胶柱进行分离,先2-3柱体积的CHCl3进行洗脱,然后加大洗脱剂极性CHCl3∶CH3OH=10∶1进行洗脱,得到含少量杂质的GX-Ring,然后再次硅胶柱分离,用2-3柱体积溶剂(石油醚∶乙酸乙酯=10∶1)进行洗脱。并用NMR表征其结构。黄色粉末,产率:52%。实施例2:制备西红花酸衍生物GX-M:分别取西红花酸GX-1(购自于Sigma公司)(0.5mmol,164mg),EDCI(1.25mmol,239mg),HOBt(1.25mmol,169mg)于25ml反应瓶。在冰浴条件下,加入Et3N(2.5mmol,350μl)及CH2Cl220ml,最后加入4-氟苯甲胺(1.1mmol,125μl),在0℃条件下反应4h,然后室温反应过夜。利用TCL和LC-MS检测产物是否生成,确定反应完全后,停止反应。将反应液过滤,真空除去溶剂,加入10mlEA溶解,依次用2%HCl,5%NaHCO3,H2O各10ml分别洗涤3次,最后真空除去溶剂EA得到粗品。将得到的粗产物用硅胶柱进行分离,用三个柱体积的CHCl3进行洗脱。得到产物GX-M粗品,然后再次硅胶柱分离,用两个柱体积的溶剂(石油醚∶乙酸乙酯=20∶1)进行洗脱,最终得到产物GX-M,并用NMR表征其结构,产率:75%。实施例3:制备西红花酸衍生物GX-N:分别取西红花酸GX-1(购自于Sigma公司)(0.5mmol,164mg),EDCI(1.25mmol,239mg),HOBt(1.25mmol,169mg)于25ml反应瓶。在冰浴条件下,加入Et3N(2.5mmol,350μl)及CH2Cl220ml,最后加入3,5-二氟苄胺(1.1mmol,130μl),在0℃条件下反应4h,然后室温反应过夜。利用TCL和LC-MS检测产物是否生成,确定反应完全后,停止反应。将反应液过滤,真空除去溶剂,加入10mlEA溶解,依次用2%HCl,5%NaHCO3,H2O各10ml分别洗涤3次,最后真空除去溶剂EA得到粗品。将得到的粗产物用硅胶柱进行分离,用三个柱体积的CHCl3进行洗脱。得到产物GX-N粗品,然后再次硅胶柱分离,用两个柱体积的溶剂(石油醚∶乙酸乙酯=10∶1)进行洗脱。最终得到产物GX-N,并用NMR表征其结构,产率:68%。实施例4:制备西红花酸衍生物GX-Ring取GX-1(购自于Sigma公司)(0.25mmol,80mg)于100ml反应瓶。加入CH2Cl220ml,在冰浴条件下,加入草酰氯(0.1mmol,100μl)并加入DMF1-2滴,室温搅拌反应6h。当溶液颜色深红,基本澄清时,加入三乙胺(2.0mmol)和乙二胺(0.5mmol)进行反应,室温反应过夜,加入100μlH2O搅拌反应5个小时后停止反应,利用TLC和LC-MS检测产物是否生成。将反应液过滤,真空除去溶剂,加入EA20ml溶解,依次用2%HCl,5%NaHCO3,H2O各20ml分别洗涤5次,真空除去溶剂得到粗品。将GX-Ring用硅胶柱进行分离,先2-3柱体积的CHCl3进行洗脱,然后加大洗脱剂极性CHCl3∶CH3OH=10∶1进行洗脱,得到含少量杂质的GX-Ring,然后再次硅胶柱分离,用2-3柱体积溶剂(石油醚∶乙酸乙酯=10∶1)进行洗脱。并用NMR表征其结构。黄色粉末,产率:50%。实施例5:制备西红花酸衍生物GX-Ring取GX-1(购自于Sigma公司)(0.25mmol,80mg)于100ml反应瓶。加入CH2Cl220ml,在冰浴条件下,加入草酰氯(0.1mmol,100μl)并加入DMF1-2滴,室温搅拌反应5h。当溶液颜色深红,基本澄清时,加入三乙胺(2.0mmol)和乙二胺(0.75mmol)进行反应,室温反应过夜,加入100μlH2O搅拌反应1个小时后停止反应,利用TLC和LC-MS检测产物是否生成。将反应液过滤,真空除去溶剂,加入EA20ml溶解,依次用2%HCl,5%NaHCO3,H2O各20ml分别洗涤2次,真空除去溶剂得到粗品。将GX-Ring用硅胶柱进行分离,先2-3柱体积的CHCl3进行洗脱,然后加大洗脱剂极性CHCl3∶CH3OH=10∶1进行洗脱,得到含少量杂质的GX-Ring,然后再次硅胶柱分离,用2-3柱体积溶剂(石油醚∶乙酸乙酯=10∶1)进行洗脱。并用NMR表征其结构。黄色粉末,产率:47%。实施例6:制备西红花酸衍生物GX-Ring取GX-1(购自于Sigma公司)(0.25mmol,80mg)于100ml反应瓶。加入CH2Cl220ml,在冰浴条件下,加入草酰氯(0.1mmol,100μl)并加入DMF1-2滴,室温搅拌反应4h。当溶液颜色深红,基本澄清时,加入三乙胺(2.0mmol)和乙二胺(1.0mmol)进行反应,室温反应过夜,加入100μlH2O搅拌反应5个小时后停止反应,利用TLC和LC-MS检测产物是否生成。将反应液过滤,真空除去溶剂,加入EA20ml溶解,依次用2%HCl,5%NaHCO3,H2O各20ml分别洗涤3次,真空除去溶剂得到粗品。将GX-Ring用硅胶柱进行分离,先2-3柱体积的CHCl3进行洗脱,然后加大洗脱剂极性CHCl3∶CH3OH=10∶1进行洗脱,得到含少量杂质的GX-Ring,然后再次硅胶柱分离,用2-3柱体积溶剂(石油醚∶乙酸乙酯=10∶1)进行洗脱。并用NMR表征其结构。黄色粉末,产率:43%。实施例7:制备西红花酸衍生物GX-Ring取GX-1(购自于Sigma公司)(0.25mmol,80mg)于100ml反应瓶。加入CH2Cl220ml,在冰浴条件下,加入草酰氯(0.1mmol,100μl)并加入DMF1-2滴,室温搅拌反应6h。当溶液颜色深红,基本澄清时,加入三乙胺(2.0mmol)和乙二胺(1.25mmol)进行反应,室温反应过夜,加入100μlH2O搅拌反应5个小时后停止反应,利用TLC和LC-MS检测产物是否生成。将反应液过滤,真空除去溶剂,加入EA20ml溶解,依次用2%HCl,5%NaHCO3,H2O各20ml分别洗涤5次,真空除去溶剂得到粗品。将GX-Ring用硅胶柱进行分离,先2-3柱体积的CHCl3进行洗脱,然后加大洗脱剂极性CHCl3∶CH3OH=10∶1进行洗脱,得到含少量杂质的GX-Ring,然后再次硅胶柱分离,用2-3柱体积溶剂(石油醚∶乙酸乙酯=10∶1)进行洗脱。并用NMR表征其结构。黄色粉末,产率:45%。实施例8:西红花酸及其系列衍生物抗心肌细胞缺氧作用实验1、取GX-1、GX-Ring、GX-M、GX-N适量,制备方法如实施例1-3,用无水乙醇配制成1mM浓度,贮存于-20℃。KRBculturalbuffer(NaCl115mM,KCl4.7mM,CaCl22.5mM,NaHCO324mM,KH2PO41.2mM,MgSO4·7H2O1.2mM,HEPES10mM,0.01%BSA),KRBwashbuffer(KRBculturalbufferwithoutFBS),使用前氮气平衡过夜;MTT,购自于Sigma公司;线粒体活性测定试剂盒,购自于Abcam公司;DMEM培养基及胎牛血清均购自与Gibco公司。RSE为人参提取物(澳门科技大学中药质量研究国家重点实验室自制),该样品已被证实在该模型上具有缺氧损伤心肌细胞保护作用。2、细胞培养:实验用心肌细胞选用大鼠成纤维心肌细胞,H9c2(CRL-1446),购自于ATCC公司。取出培养中的细胞,倾去培养基,用PBS润洗一遍,倾去PBS,加入1ml的胰蛋白酶,37℃消化1min,加入培养基中止消化,1000rpm离心5min,弃上清液,加入培养基重悬细胞。用细胞计数板调整细胞浓度为5×104/ml,将细胞悬液加入96孔板中,每孔100μl,放入CO2培养箱(5%CO2,37℃)中培养48h。3、实验分组:将H9c2心肌细胞分为正常对照组、缺氧模型组(心肌细胞缺氧诱导损伤模型组)、RSE阳性对照组(人参提取物RSE作为阳性对照组)、GX-1组、GX-B组、GX-D组及GX-Ring组。正常对照组不做任何处理,其余各组倾去培养基,加入KRBwashbuffer润洗一次,倾去KRBwashbuffer,加入含药KRBculturalbuffer:RSE阳性对照组中RSE终浓度为200μg/ml,GX各组终浓度均为10nM。4、心肌细胞缺氧诱导损伤:各组给药后,立即将96孔板置入缺氧小室(billups-rothenberg,Inc.),用氮气饱和缺氧小室5min,密封缺氧小室,使其内部形成低氧环境,并将其置入37℃CO2培养箱中,开始缺氧。3h后,将96孔板从缺氧小室中取出,倾去含药KRBculturalbuffer,加入100μl培养基。5、细胞活性及线粒体活性检测:细胞活性检测:每孔加入10μlMTT,37℃避光孵育4h,再加入10%SDS-HCL(0.01M)过夜,570nm波长下检测。线粒体活性检测:每孔加入100μl线粒体活性测定试剂,37℃避光孵育4h,检测荧光强度(激发波长:550nm,发射波长590nm)。结论:通过检测表明,与正常对照组(100%±0.04)相比,缺氧小室诱导缺氧显著降低了H9c2心肌细胞存活率(18.9%±0.03,p<0.001);阳性对照RSE200μg/ml组H9c2心肌细胞存活率(33.5%±0.01)较缺氧损伤组有显著提高(p<0.001)。结果显示缺氧损伤心肌细胞模型成功。GX-Ring对缺氧诱导心肌细胞损伤保护作用具体如下表1所示:表1:GX四种化合物对缺氧诱导心肌细胞损伤保护作用(线粒体活性试剂检测结果)序号组别H9c2心肌细胞线粒体存活率1NORMAL(正常对照组)1.002HYPOXIA(缺氧模型组)0.423GX-10.654GX-M0.295GX-N0.396GX-Ring0.75结论:线粒体活性试剂检测结果如表1所示,GX系列化合物在1μM剂量下分别呈现对缺氧心肌细胞的不同作用,在相同药物浓度下,GX-Ring活性明显优于藏红花酸GX-1,同时与藏红花酸衍生物GX-M、GX-N相比,GX-Ring的活性更优,对缺氧小室诱导H9c2心肌细胞缺氧损伤有明显的保护作用。实施例9:GX-1、GX-Ring溶解性实验比较取0.1g固体试样(西红花酸(GX-1)及其衍生物GX-Ring))于试管中,加1mL乙醇/氯仿-甲醇(10∶1)振荡后,如不溶解可加至100mL和1000mL观察是否溶解,具体结果如下表2所示:表2试验报告表注:表中“+”表示溶解;“-”表示不溶解;若介于溶解和不溶解之间的现象,则用符号“±”表示;“/”表示不需试验的项目。结论:由上述表2的实验结果可以看出,经过结构修饰后的GX-Ring的脂溶性显著优于西红花酸。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1