一种新的呋喃香豆素类化合物及其制备方法和医药用途与流程
本发明属于药物技术领域,具体涉及从干燥的独活中分离得到的一种呋喃香豆素类化合物,含其的药物组合物及其制备方法和应用。
背景技术:
独活为伞形科植物重齿毛当归angelicapubescensmaxim.f.biserratashanetyuan的干燥根。春初苗刚发芽或秋末茎叶枯萎时采挖,除去须根及泥沙,烘至半干,堆置2~3天,发软后再烘至全干。性微温,味辛、苦,归肾、膀胱经。有祛风除湿、通痹止痛、解表之功效,临床上主要用于治疗风寒湿痹、腰膝疼痛、风寒挟湿表证、少阴伏风头痛等证。始载于《神农本草经》,列为上品,言其“味苦,平。主风寒所击,金疮止痛,奔豚,痫痉,女子疝瘕。服轻身耐老”。主产于湖北、四川、陕西、浙江等地,又称川独活、资丘独活、巴东独活、恩施独活、肉独活、浙独活、绩独活、香独活等,以根条粗壮,油润,质软,香气浓者为佳。
目前从各种不同品种独活中已分离出香豆素、萜类、挥发油、有机酸和糖类等多种化学成分。香豆素是独活重要的活性成分。香豆素(coumarin)是具有苯骈α-吡喃酮结构的一类化合物。可看作是顺式邻羟基桂皮酸脱水而形成的内酷,绝大多数在c7位有羟基或烃基,具有芳香气味。
现代研究证实,独活具有镇静催眠、镇痛、抑制血小板聚集、抗氧化、抗衰老、抗肿瘤、抗血管生成等药理作用。
技术实现要素:
本发明的目的是提供一种从干燥的独活中分离得到的一种呋喃香豆素类化合物,含其的药物组合物及其制备方法和应用。
本发明的上述目的是通过下面的技术方案得以实现的:
具有下述结构式的化合物(ⅰ):
所述的化合物(ⅰ)的制备方法,包含以下操作步骤:(a)将干燥的独活粉碎,用70~80%乙醇热回流提取,合并提取液,浓缩至无醇味,依次用石油醚、乙酸乙酯和水饱和的正丁醇萃取,分别得到石油醚萃取物、乙酸乙酯萃取物和正丁醇萃取物;(b)步骤(a)中乙酸乙酯萃取物用大孔树脂除杂,先用10%乙醇洗脱6个柱体积,再用70%乙醇洗脱8个柱体积,收集70%洗脱液,减压浓缩得70%乙醇洗脱浓缩物;(c)步骤(b)中70%乙醇洗脱浓缩物用正相硅胶分离,依次用体积比为85:1、50:1、25:1、10:1和1:1的二氯甲烷-甲醇梯度洗脱得到5个组分;(d)步骤(c)中组分4用正相硅胶进一步分离,依次用体积比为15:1、10:1和5:1的二氯甲烷-甲醇梯度洗脱得到3个组分;(e)步骤(d)中组分2用十八烷基硅烷键合的反相硅胶分离,用体积百分浓度为70%的甲醇水溶液等度洗脱,收集8~12个柱体积洗脱液,洗脱液减压浓缩得到纯的化合物(ⅰ)。
进一步地,步骤(a)中,用75%乙醇热回流提取,合并提取液。
进一步地,所述大孔树脂为d101型大孔吸附树脂。
一种药物组合物,其中含有治疗有效量的所述的化合物(ⅰ)和药学上可接受的载体。
所述的化合物(ⅰ)在制备血管保护的药物中的应用。
所述的药物组合物在制备血管保护的药物中的应用。
本发明化合物用作药物时,可以直接使用,或者以药物组合物的形式使用。
该药物组合物含有治疗有效量的本发明化合物(ⅰ),其余为药物学上可接受的、对人和动物无毒和惰性的可药用载体和/或赋形剂。
所述的可药用载体或赋形剂是一种或多种选自固体、半固体和液体稀释剂、填料以及药物制品辅剂。将本发明的药物组合物以单位体重服用量的形式使用。本发明药物可通过口服或注射的形式施用于需要治疗的患者。用于口服时,可将其制成片剂、缓释片、控释片、胶囊、滴丸、微丸、混悬剂、乳剂、散剂或颗粒剂、口服液等;用于注射时,可制成灭菌的水性或油性溶液、无菌粉针、脂质体或乳剂等。
附图说明
图1为化合物(ⅰ)结构式;
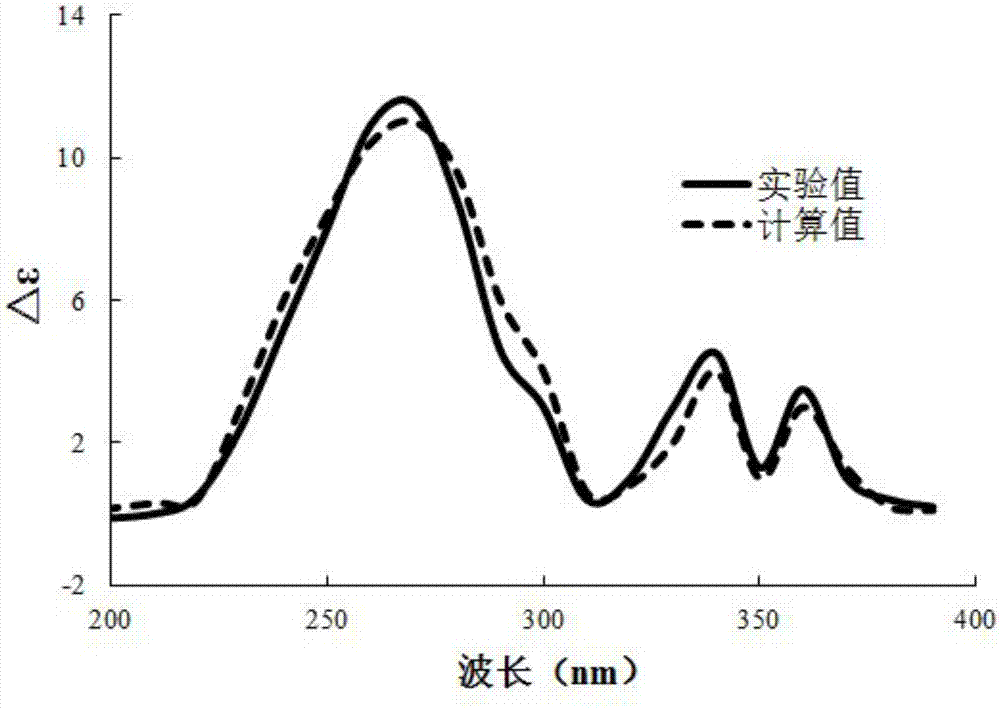
图2为化合物(ⅰ)计算ecd和实验ecd图。
具体实施方式
下面结合实施例进一步说明本发明的实质性内容,但并不以此限定本发明保护范围。尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
主要材料、试剂来源及仪器类型:
乙醇、石油醚、乙酸乙酯、正丁醇、二氯甲烷为分析纯,购自上海凌峰化学试剂有限公司,甲醇,分析纯,购自江苏汉邦化学试剂有限公司。
实施例1:化合物(ⅰ)分离制备及结构确证
(a)干燥的独活(10kg)粉碎,用75%乙醇热回流提取(30l×3次),合并提取液,浓缩至无醇味(6l),依次用石油醚(6l×3次)、乙酸乙酯(6l×3次)和水饱和的正丁醇(6l×3次)萃取,分别得到石油醚萃取物、乙酸乙酯萃取物(381g)和正丁醇萃取物;(b)步骤(a)中乙酸乙酯萃取物用d101大孔树脂除杂,先用10%乙醇洗脱6个柱体积,再用70%乙醇洗脱8个柱体积,收集70%洗脱液,减压浓缩得70%乙醇洗脱浓缩物(131g);(c)步骤(b)中70%乙醇洗脱浓缩物用正相硅胶分离,依次用体积比为85:1(8个柱体积)、50:1(8个柱体积)、25:1(8个柱体积)、10:1(10个柱体积)和1:1(8个柱体积)的二氯甲烷-甲醇梯度洗脱得到5个组分;(d)步骤(c)中组分4(27g)用正相硅胶进一步分离,依次用体积比为15:1(8个柱体积)、10:1(8个柱体积)和5:1(6个柱体积)的二氯甲烷-甲醇梯度洗脱得到3个组分;(e)步骤(d)中组分2(18g)用十八烷基硅烷键合的反相硅胶分离,用体积百分浓度为70%的甲醇水溶液等度洗脱,收集8~12个柱体积洗脱液,洗脱液减压浓缩得到纯的化合物(ⅰ)(230mg)。
结构确证:浅黄色油状物;hr-esims显示[m+na]+为m/z375.1224,结合核磁特征可得分子式为c21h20o5,不饱和度为12。核磁共振氢谱数据δh(ppm,dmso-d6,500mhz):h-3(6.34,d,j=10.0),h-4(8.06,d,j=10.0),h-5(7.58,s),h-2’(8.02,d,j=1.5),h-3’(7.01,d,j=1.5),h-1”(4.87,d,j=7.0),h-2”(5.46,t,j=7.0),h-4”(6.53,m),h-5”(6.52,m),h-6”(6.71,d,j=8.5),h-8”(3.88,dd,j=12.5,5.0),h-8”(3.74,dd,j=12.5,5.0),h-9”(1.57,s),h-10”(1.55,s);核磁共振碳谱数据δc(ppm,dmso-d6,125mhz):159.3(c,2-c),113.5(ch,3-c),144.8(ch,4-c),115.7(c,4a-c),113.6(ch,5-c),125.2(c,6-c),147.4(c,7-c),130.1(c,8-c),142.7(c,8a-c),147.3(ch,2’-c),106.6(ch,3’-c),68.9(ch2,1”-c),121.1(ch,2”-c),137.1(c,3”-c),135.4(ch,4”-c),125.6(ch,5”-c),124.8(ch,6”-c),135.2(c,7”-c),59.4(ch2,8”-c),16.5(ch3,9”-c),20.7(ch3,10”-c);碳原子标记参见图1。ir光谱表明该化合物含有羟基(3396cm-1),内酯(1725cm-1)和芳香环(1622和1586cm-1)基团。1hnmr谱显示两种截然不同的对双峰信号:δh6.34和8.06(各1h,j=10.0hz)为香豆素核h-3和h-4的信号;δh8.02和7.01(各1h,j=1.5hz)为呋喃环h-2’和h-3’的信号。此外,还有一个单峰信号δh7.58(h-5)。上述信息表明该化合物含有呋喃骨架。13c-nmr谱显示了一个含有十碳侧链的呋喃结构,侧链包括两个甲基,两个含氧亚甲基,两个三取代双键,以及一个二取代双键。hmbc谱中,h-1”(δh4.87)与c-8(δc130.1)的相关性表明侧链位于c-8位上。hmbc谱中,h-1”(δh4.87)与c-2”(δc121.1)和c-3”(δc137.1),me-9”(δh1.57)与c-2”(δc121.1),c-3”(δc137.1)和c-4”(δc135.4),me-10”(δh1.55)与c-6”(δc124.8)和c-7”(δc135.2),以及h-8”(δh3.88和3.74)与c-6”(δc124.8),c-7”(δc135.2)和c-10”(δc20.7)的相关性表明十碳侧链为[-och2-ch=c(ch3)-ch=ch-ch=cch3(ch2-oh)]。noesy谱中,h-1”与h-9”,以及h-6”与h-10”的相关性表明两个三取代双键的构型分别为2”e和6”z;此外h-4和h-5之间的相关性也验证了十碳侧链位于c-8位。综合氢谱、碳谱、hmbc谱和noesy谱,以及文献关于相关类型核磁数据,可基本确定该化合物如图1所示,立体构型进一步通过ecd试验确定,理论值与实验值基本一致(图2)。
实施例2:化合物(ⅰ)药理作用试验
一、材料和仪器
血管内皮细胞(ecv-304)由山东大学医学院免疫教研室馈赠。化合物(ⅰ)自制,制备方法见实施例1,hplc归一化纯度大于98%。rpmi-1640干粉培养基、胰蛋白酶购于美国gibeo公司。胎牛血清购于天津tbd公司。mtt、琼脂糖、annexinv-fitc购于美国sigma公司。ldh、mda、sod、gsh-px测定试剂盒购于南京建成生物工程研究所。dmso购于中国医药(集团)上海化学试剂有限公司。苏木素购于福州迈新生物技术有限公司。rhodamine123购于美国solarbic公司。阳性药川芎嗪购自上海源叶生物科技有限公司。
倒置光学显微镜(日本olympus公司),二氧化碳培养箱(美国formascientific公司),电子分析天平(er-182a型)(日本a&d公司),超净工作台(zhjh-1209型)(上海智城分析仪器制造有限公司),流式细胞仪(facsvantage型)(美国beetondiehnson公司),恒温振荡器(江苏太仓市实验设备厂),1420vietor3多标记分析仪(美国perkinelmerlifescience公司),721型可见紫外光栅分光光度计(上海精密科学有限公司),电热恒温水浴箱(上海医疗仪器三厂生产),酶联免疫检测仪(mk3multiskan)(上海thermolabsystem分析仪器公司)。
二、试验方法
1、细胞培养
ecv-304细胞以rpmi-1640培养基于37℃,5%co2培养箱中传代培养。镜下观察,待细胞汇合率达到70%以上时用胰蛋白酶消化传代,以生长稳定的第3-5代细胞制备细胞悬液。
2、细胞分组及处理
取生长良好的ecv-304细胞制成细胞悬液,接种于96孔、24孔、6孔细胞培养板或培养皿中,37℃,5%co2培养24h。随机分为六组:①正常组;②h2o2模型组(150μmol/l);③川芎嗪(tmp)(50μmol/l)+h2o2组;④化合物(ⅰ)(10μmol/l)+h2o2组;⑤化合物(ⅰ)(50μmol/l)+h2o2组;⑥化合物(ⅰ)(100μmol/l)+h2o2组。
3、实验项目及检测指标
3.1mtt法检测细胞活力
将生长良好的ecv-304细胞制备成5×104/ml的细胞悬液,按每孔100μl接种于96孔板,置37℃,5%co2孵育24h。细胞分组及处理上。继续培养6h和12h后,每孔加入10μlmtt溶液(终浓度0.5mg/l)置37℃,5%co2培养箱孵育4h后,每孔加入100μldmso,静置10min后振荡60s,30min内置酶联免疫检测仪上检测570nm处吸光度值(od570)。
按公式:细胞损伤抑制率=(用药组od570-模型组od570)/(正常组od570-模型组od570)×100%,计算细胞损伤抑制率。
3.2ldr释放率测定
取生长良好的ecv-304细胞制成l×105/ml的细胞悬液接种于24孔板,置37℃,5%co2孵育24h。细胞分组及处理同上。继续培养6h和12h,收集培养上清液。pbs洗涤2次后,每孔加入0.5ml细胞裂解液(150mmol/lnacl,150mmol/ltris-hci,lmmol/ledta,1%tritonx-100),于4℃静置15min后振荡数分钟,10000rpm,4℃离心10min收集细胞裂解液,参照ldh试剂盒说明书分别测定上清液和细胞裂解液中的ldh活性。
按公式:ldh释放率=上清液中ldh活性/(上清液中ldh活性+细胞裂解液中ldh活性)`×100%,计算ldh释放率。
3.3酶生化法测定mda含量、sod活力、gsh-px活力
取生长良好的ecv-304细胞制成1×105/ml的细胞悬液接种于24孔板,置37℃,5%co2孵育24h。细胞分组及处理同上。继续培养12h,收集培养上清液。按mda、sod、gsh-px检测试剂盒说明书测定细胞mda含量、sod活力、gsh-px活力。
4、数据处理
microsoftexcel自带的统计软件进行处理,实验数据以
三、结果及结论
1、化合物(ⅰ)对h2o2损伤ecv-304细胞生存率的影响
正常活细胞线粒体能量代谢过程中产生琥珀酸脱氢酶,可将淡黄色mtt还原成不溶于水的蓝紫色的甲腊结晶,结晶数量与活细胞数成正比。本实验结果显示:ecv-304细胞经h2o2(150μmol/l)氧化损伤6h和12h后,细胞od值明显降低且与正常组相比具有统计学意义(p<0.01),表明细胞活力下降。而化合物(ⅰ)对细胞具有保护作用,能显著抑制h2o2对细胞的氧化损伤,提高存活率。作用6h,50、100μmol/l化合物(ⅰ)对细胞损伤抑制率分别为16.67%(p<0.05)和28.21%(p<0.01)。作用12h,10、50、100μmol/l化合物(ⅰ)对细胞损伤抑制率提高为24.85%(p<0.05),29.64%(p<0.01)和38.47%(p<0.01)。见表1(**p<0.01vsnormal;#p<0.05,#p<0.01vsh2o2group;▲p<0.05,▲▲p<0.01vstmpgroup,下同)。
2、化合物(ⅰ)对h2o2损伤ecv-304细胞ldh释放率的影响
乳酸脱氢酶能催化乳酸生成丙酮酸,丙酮酸与2,4-二硝基苯肼反应生成丙酮酸二硝基苯腙,在碱性溶液中呈棕红色,通过比色测定反应产物可间接求出乳酸脱氢酶活力。结果表明:与正常组相比,模型组ecv-304细胞ldh释放率显著增高(p<0.01)。与模型组比,化合物(ⅰ)各组细胞ldh释放率均减少:10、50、100μmol/l化合物(ⅰ)作用6h,细胞的ldh释放率降为20.54%(p<0.01)和21.22%(p<0.01);50、100μmol/l化合物(ⅰ)作用12h,细胞的ldh释放率降为33.64%(p<0.01)和29.53%(p<0.01)。化合物(ⅰ)随浓度的增加,对氧化损伤ecv-304细胞的保护作用也逐渐增强,呈现出一定的量效关系。结果见表2。
3、化合物(ⅰ)对h2o2损伤ecv-304细胞mda含量、sod、gsh-px活力的影响
实验结果表明:与正常组比模型组ecv-304细胞培养液中mda含量显著增高(p<0.01)。与模型组相比,10、50、100μmol/l化合物(ⅰ)组细胞mda生成量均明显减少,分别为3.00±0.79nmol/ml(p<0.05),2.86±0.75nmol/ml(p<0.05)和2.69±0.45nmol/ml(p<0.01)。化合物(ⅰ)各浓度组组间对照显示,随浓度的增加,化合物(ⅰ)对ecv-304细胞脂质过氧化损伤的保护作用也逐渐增强,呈现一定的量效关系。结果见表3。
实验结果表明:与正常组相比,模型组ecv-304细胞sod活性显著降低(p<0.01)。与模型组相比,50、100μmol/l化合物(ⅰ)均可增强ecv-304细胞的sod活性,sod活性分别提高为17.9±l.34u/ml(p<0.05)和19.25±0.81u/ml(p<0.01)。且随浓度的增加,细胞的sod活性也逐渐提高,表明化合物(ⅰ)可增强ecv-304细胞的抗氧自由作用,具一定量效关系;10μmol/l化合物(ⅰ)虽也可提高sod活性,但不具有显著统计学意义。见表3。
实验结果表明:与正常组相比,模型组ecv-304细胞培养液中gsh-px活性显著降低(p<0.01)。与模型组相比,10、50、100μmol/l化合物(ⅰ)组细胞gsh-px活性均显著提高,分别为73.8±10.3u/ml(p<0.05),92.2±8.5u/ml(p<0.01)和102.5±10.3u/ml(p<0.01)。且随化合物(ⅰ)浓度的增加,ecv-304细胞的gsh-px活性也逐渐提高,表明细胞抗氧化作用的能力也逐渐增强,呈现一定的量效关系。结果见表3。
总结:本实验采用h2o2作为外源性自由基生成系统,能够诱导血管内皮细胞(ecv-304)氧化应激损伤,促进细胞凋亡。通过mtt法和ldh活性检测证实化合物(ⅰ)对h2o2氧化损伤细胞具有保护作用;通过细胞上清液mda含量、sod活性、gsh-px活性的测定,证实化合物(ⅰ)有清除自由基和活性氧的抗氧化特性。
表1化合物(ⅰ)对h2o2损伤ecv-304细胞生存率的影响(
表2化合物(ⅰ)对h2o2损伤ecv-304细胞ldh释放率的影响(
表3化合物(ⅰ)对h2o2损伤ecv-304细胞mda含量、sod、gsh-px活力的影响(
实施例3
片剂的制备:按实施例1方法先制得化合物(i),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按其与赋形剂重量比为1:7的比例加入赋形剂,制粒压片。
实施例4
口服液的制备:按实施例1方法先制得化合物(i),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按常规口服液制法制成口服液。
实施例5
胶囊剂或颗粒剂的制备:按实施例1方法先制得化合物(i),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按其与赋形剂重量比为1:9的比例加入赋形剂,制成胶囊或颗粒剂。
实施例6
注射液的制备:按实施例1方法先制得化合物(i),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按常规加注射用水,精滤,灌封灭菌制成注射液。
实施例7
无菌粉针的制备:按实施例1方法先制得化合物(i),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,将其溶于无菌注射用水中,搅拌使溶,用无菌抽滤漏斗过滤,再无菌精滤,分装于安瓿中,低温冷冻干燥后无菌熔封。
上述实施例的作用在于说明本发明的实质性内容,但并不以此限定本发明的保护范围。本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和保护范围。
- 还没有人留言评论。精彩留言会获得点赞!