一种胎盘绒毛板间充质干细胞及临床化制备方法与流程
本发明涉及间充质干细胞的制备技术领域,具体涉及一种胎盘绒毛板间充质干细胞及临床化制备方法。
背景技术:
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有多向分化潜能的成体干细胞,在特定的诱导条件下可以分化形成多种组织来源的细胞,如脂肪细胞、成骨细胞、成软骨细胞和成神经细胞等。间充质干细胞不仅具有多向分化潜能,而且还具有自我更新、归巢、免疫调节、造血支持、分泌多种细胞因子、促进干细胞移植等多种生物学特性,是参与组织损伤修复和组织再生的重要细胞组成部分。目前,可以从多种成体组织(如骨髓)或围产期组织(如胎盘)提取间充质干细胞。
骨髓组织因其间充质干细胞含量少(约为骨髓单个核细胞的0.0001~0.001%),给供者造成巨大伤害等因素使其在临床应用中受到限制。胎盘是胎儿发育期的一个附属组织,在胎儿生产后被当作医疗垃圾废弃掉,不仅对环境造成污染而且对医学资源也造成重大浪费。胎盘由绒毛板、绒毛层、蜕膜构成,绒毛板外层由羊膜覆盖、内层由滋养层细胞覆盖,而脐带末梢血管则穿行其中,因此绒毛板在组织结构上保持相对独立性,是一种较易分离的胎盘组织。研究表明胎盘绒毛板中含有大量的间充质干细胞,所以从胎盘绒毛板分离提取间充质干细胞将会为间充质干细胞的实验研究和临床应用开辟一条崭新的道路。
从实体组织提取间充质干细胞的方法主要采用酶消化法。酶消化法是一种快速从实体组织提取间充质干细胞的方法,但这种方法获得的细胞包含多种细胞成分,往往采取多种方法加以纯化,如密度梯度离心法、流式细胞仪分选、磁珠分选、血细胞裂解液去除血细胞等纯化方法。不仅酶的种类和酶溶液的配方影响酶消化法的作用效果,而且酶的使用还会引入多种外源干扰因素。因此,酶消化法不仅增加了生产成本,而且使工艺变得复杂,从而影响工艺的稳定性。
现有的胎盘间充质干细胞制备工艺存在诸多不足,如工艺复杂、生产成本高、较多的外源干扰因素等。如中国专利CN101270349A公开了胎盘间充质干细胞分离和体外扩增培养方法,该方法采用Ⅳ型胶原酶消化母体侧蜕膜胎盘组织,接着扩增获得分离得到的细胞,然后用正负磁珠进行分选纯化得到胎盘间充质干细胞。中国专利CN102586184A公开了建立胎盘间充质干细库的方法,该方法采用组织消化酶液(含dispase、胰酶、脱氧核糖核酸酶I、胶原酶Ⅳ、透明质酸酶)消化胎盘小叶组织,通过克隆挑取扩增获得胎盘间充质干细胞,上述方法在工艺简化和生产成本降低方面还有待进一步提高。
技术实现要素:
针对于现有技术中存在的上述问题,本发明提供了一种胎盘绒毛板间充质干细胞及临床化制备方法,本发明以胎盘绒毛板为材料提取间充质干细胞,提取过程中无需分选,无需浸泡,无需过滤和梯度离心,在较低代次即可得到较多细胞,大大降低了成本消耗,降低了分离时间,提高了间充质干细胞的产率和纯度。
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
一种胎盘绒毛板间充质干细胞的临床化制备方法,包括以下步骤:
(1)采集母血,并进行传染病检测,然后取出胎盘,弃去覆盖在外侧的羊膜,用无菌手术剪取胎盘绒毛板;
(2)使用无菌组织镊剔除附着在胎盘绒毛板上的血管和绒毛组织;
(3)用无菌生理盐水清洗步骤(2)所得的胎盘绒毛板至没有血色;
(4)使用无菌手术剪将清洗后的绒毛板剪成1-5mm2的组织块,然后用无菌生理盐水清洗2-5次;
(5)将步骤(4)中的组织块接种于完全培养基中,然后置于37℃、5%CO2潮湿培养箱中培养;其中完全培养基成分为:无血清培养基(Cellgenix)、30ng/mL bFGF(Cellgenix)、体积浓度为2%的GlutaMAX(invitrogen);
(6)每隔5-10天更换一次培养基,当细胞融合度达到70-80%时,用TrypLETMSelect消化细胞;
(7)传代培养:消化后进行离心处理,2000r/min离心3min,收集细胞,按1×104-2×104个细胞/cm2的密度(此处密度为细胞个数与培养瓶底表面积的比计算得来)接种于T175培养瓶中,然后添加20mL完全培养基传代培养,得胎盘绒毛板间充质干细胞;
(8)针对步骤(7)所得的胎盘绒毛板间充质干细胞,检测以下项目中的至少一项:细胞活性、无菌检测、细胞表面标志物检测、核性检测、HLA-ABC/DR配型;
(9)冻存:将传代培养后的胎盘绒毛板间充质干细胞按2×106-8×106个细胞/mL密度冻存于1mL冻存液中,冻存细胞经程序降温至-80℃后转入液氮罐中长期保存;
(10)建立包含以上信息的胎盘干细胞的数据库,并使该数据库与步骤(9)的冻存细胞进行关联。
进一步地,步骤(1)中对胎盘的处理需在采集后72h内进行。
进一步地,步骤(5)中组织块与完全培养基的w/v为(0.5-2.0:10-15)g/mL。
进一步地,步骤(7)传代培养过程中细胞密度为1×104个细胞/cm2。
进一步地,步骤(9)中所述冻存液由以下组分组成且各组分的质量分数为:80%无血清培养基(Cellgenix)、13%人血白蛋白(Sigma)、7%二甲基砜(Origen)。
进一步地,步骤(9)中冻存时细胞密度为2×106个细胞/mL。
根据上述任一项方法制备得的胎盘绒毛板间充质干细胞。
本发明提供的一种胎盘绒毛板间充质干细胞及临床化制备方法,具有以下几种有益效果:
(1)本发明使用的提取方法,步骤简单,分离得到胎盘绒毛板组织块后只需直接贴壁培养即可得到纯度高的间充质干细胞,不仅简化了工艺流程,而且避免引入较多外源干扰因素,使得工艺稳定性较易控制。
(2)本发明以胎盘绒毛板为材料提取间充质干细胞,提高了从胎盘中提取间充质干细胞的产率。
(3)提取过程中无需分选,无需浸泡,大大降低了成本消耗。
(4)本发明针对提取胎盘间充质干细胞耗时较长的问题,提供了一种无需过滤,无需梯度离心的组织贴壁法,大大降低了分离时间,减少了此过程中的细胞消耗。
(5)本发明在较低代次即可得到较多细胞,避免多次传代造成的间充质干细胞干性降低,提高了间充质干细胞的纯度。
附图说明
图1为组织贴壁法培养细胞情况的SEM图;其中图1-1为贴壁培养7天后的细胞情况;图1-2为贴壁培养14天后的细胞情况。
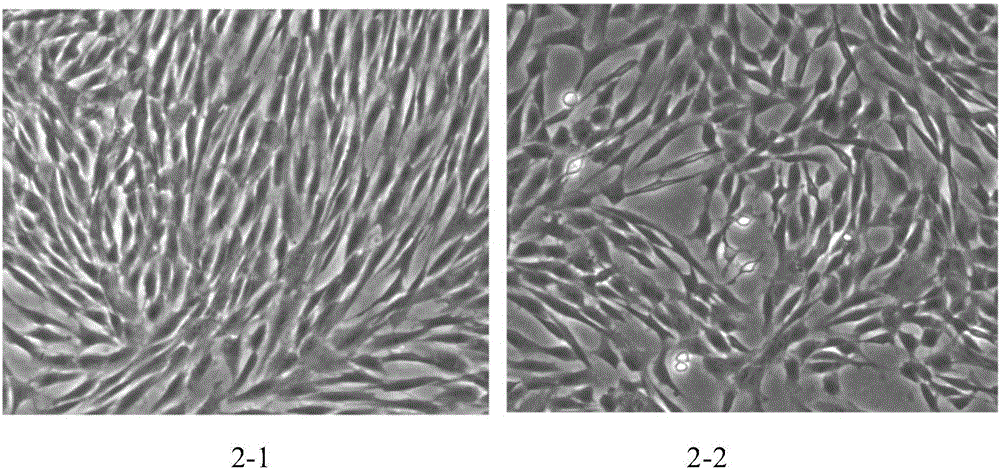
图2为胎盘绒毛板间充质干细胞传代培养情况的SEM图;其中图2-1为P1代胎盘绒毛板间充质干细胞;图2-2为P2代胎盘绒毛板间充质干细胞。
图3为胎盘绒毛板间充质干细胞多向诱导分化图;其中图3-1为对照组;图3-2为成脂诱导分化;图3-3为成软骨诱导分化;图3-4为成骨诱导分化。
图4为胎盘绒毛板间充质干细胞表面标志物检测结果图。
图5为胎盘绒毛板间充质干细胞核型分析图;其中图5-1为P3代细胞核型分析;图5-2为P15代细胞核型分析。
图6为胎盘绒毛板间充质干细胞干性标志物检测结果图。
图7为胎盘绒毛板间充质干细胞分泌的细胞因子检测结果图。
图8为P1-P3代细胞生长特性测定结果图。
图9为P1-P10代细胞倍增时间的测定结果图。
具体实施方式
实施例1胎盘绒毛板间充质干细胞的分离
(1)与供者签订知情同意书,采集足月胎盘,72h内对其进行如下处理:用无菌止血钳剥离覆盖绒毛板外侧的羊膜;用无菌手术剪剪取足量的胎盘绒毛板组织;
(2)使用无菌组织镊剔除附着在胎盘绒毛板上的血管和绒毛组织;
(3)用无菌生理盐水清洗步骤(2)所得的胎盘绒毛板至没有血色;
(4)使用无菌手术剪将清洗后的绒毛板组织剪成2mm2的组织块,用无菌生理盐水清洗2-5次,清洗过程中避免使用抗生素;
(5)收集步骤(4)中的组织块,将2g组织块接种于T175培养瓶中,加入15mL完全培养基,然后置于5%CO2、37℃培养箱中培养,每5天更换一次培养基;完全培养基成分为:无血清培养基(Cellgenix)、30ng/mL bFGF(Cellgenix)、体积浓度为2%的GlutaMAX(invitrogen);组织贴壁培养结果见图1。
由图1可知,贴壁培养7天后有少量细胞爬出组织块,培养14天后有大量细胞爬出组织块。
实施例2胎盘绒毛板间充质干细胞的传代培养及冻存
将分离出的胎盘绒毛板间充质干细胞培养至细胞融合度达到70%-80%后,用TrypLETM Select(Gibco)进行消化处理,2000r/min离心3min,然后收集细胞,检测细胞活率,并进行细胞计数,按照1×104个细胞/cm2密度接种于T175培养瓶中,并加入20mL完全培养基进行传代培养,然后将传代后的细胞按密度2×106个细胞/mL重悬于冻存液(成分及质量分数:80%无血清培养基(Cellgenix)、13%人血白蛋白(Sigma)、7%二甲基砜(Origen))中,冻存体积为1mL,然后经程序降温到-80℃后放置于液氮罐中长期保存。传代培养结果见图2。
实施例3胎盘绒毛板间充质干细胞生物学特性鉴定
1、多向诱导分化潜能的鉴定
将P3代胎盘绒毛板间充质干细胞接种于六孔板中,每孔接种1×105个细胞,每孔加入2mL完全培养基,每个样本设置3个重复,每两天更换一次培养基,待细胞融合度为70%时分别加入成骨、成脂、成软骨诱导培养基(Cyagen)各2mL,以添加完全培养基作为空白对照,每2-3天更换一次诱导培养基,持续培养2-3周后,去除诱导培养基并用PBS清洗一次,加入2mL多聚甲醛溶液(4%,v/v)固定30min,然后去除多聚甲醛溶液并用PBS清洗两次,采用染色液染色,成骨诱导、成软骨诱导染色时间为2-3min;成脂诱导染色时间为30min,然后移除染色液并加入1mL PBS溶液清洗一次,最后置于倒置显微镜下观察、拍摄照片,结果见图3。
由图3可知,经过2-3周的诱导培养,胎盘绒毛板间充质干细胞能够进行成脂、成骨、成软骨诱导分化。
2、表面标志物检测
将融合度为90%的P3代胎盘绒毛板间充质干细胞用TrypLETM Select消化处理后,计数并调节成密度为1×106个细胞/mL的细胞悬浮液,100μm细胞筛网过滤后,分别加入10μL荧光标记的细胞表面标志物抗体于1mL细胞悬液中,置于4℃、避光条件下孵育20min,并以未进行抗体标记的等量细胞悬液作为空白对照;所使用的抗体有:CD11b-FITC、CD19-ECD、CD29-FITC、CD34-PE、CD44-FITC、CD45-PC7、CD73-PE、CD90-FITC、CD105-PE、HLA-DR-PC7、HLA-G-PE抗体;孵育完成后,用冷的生理盐水(4℃)清洗一次,1200r/min离心5min,弃上清,加入250μL生理盐水混匀,并加入250μL的1%多聚甲醛固定,标记后的细胞采用Beckman公司的流式细胞分析仪进行检测分析,结果见图4。
由图4可知,表面含标志物的细胞率分别为:CD11b:0.70%;CD19:0.00%;CD34:1.4%;CD45:3.0%;HLA-DR:1.6%;HLA-G:25.6%;CD29:99.90%;CD44:98.60%;CD73:99.80%;CD90:93.20%;CD105:99.60%。
经流式检测分析发现胎盘绒毛板间充质干细胞不表达造血细胞表面标志如CD19,几乎不表达CD11b、CD34、CD45、HLA-DR;表达间充质干细胞阳性标志物如CD29、CD44、CD73、CD90、CD105;同时还低表达一类具有免疫调节作用的Ⅰ类白细胞抗原分子(HLA-G)。
3、胎盘绒毛板间充质干细胞核型分析
将5×105个P3代细胞、5×105个P15代细胞分别接种于T75培养瓶中,胎儿性别为男性,然后加入10mL完全培养基,放置于37℃、5%CO2培养箱内,培养46-72小时后收获,收获前加入0.2%浓度的秋水仙素,37℃,孵育4小时后收获,收获后通过离心、弃上清、低渗、固定、滴片,最后染色显带,结果见图5。
经核型分析,胎盘绒毛板来源的间充质干细胞在连续传代后均未出现明显的染色体核型异常,所测胎盘干细胞均为胎儿来源的细胞成份,而无母体来源细胞的污染。
4、胎盘绒毛板间充质干细胞干性标志物检测
将P3代胎盘绒毛板间充质干细胞接种于六孔板中,每孔接种1×105个细胞,每孔加入2mL完全培养基,每两天更换一次培养基,待细胞融合度达到80-90%时,去掉培养基并用PBS清洗一次后加入0.5mL RNAiso Plus,从细胞中提取总RNA,通过反转录试剂盒将RNA反转录成cDNA,设定反应体积为25μL、模板含量为100ng、2×Pfu PCR MasterMix 12.5μL、待测基因正反引物各1μL,其余为去离子水,β-Actin作为内参;PCR反应程序设置为:94℃预变性3min;94℃变性30s,适合温度退火30s,72℃延伸1min,共35个扩增循环;72℃延伸5min。
其中,待测基因有Oct-4、Nanog、Sox2、TERT、β-Actin,
Oct-4的引物:
F(正向引物)5’-3’:AGTGAGAGG CAACCTGGAGA;具体见SEQ IDNO:1;
R(反向引物)5’-3’:GTGAAGTGAGGGCTCCCATA;具体见SEQ IDNO:2;
退火温度为54℃,产物大小为273bp;
Nanog的引物:
F(5’-3’):TTCTTGACTGGGACCTTGTC;具体见SEQ IDNO:3;
R(5’-3’):GCTTGCCTTGCTTTGAAGCA;具体见SEQ IDNO:4;
退火温度为54℃,产物大小为260bp;
Sox2的引物:
F(5’-3’):GGGCAGCGTGTACTTATCCT;具体见SEQ IDNO:5;
R(5’-3’):AGAACCCCAAGATGCACAAC;具体见SEQ IDNO:6;
退火温度为52℃,产物大小为200bp;
TERT的引物:
F(5’-3’):GAGCTGACGTGGAAGATGAG;具体见SEQ IDNO:7;
R(5’-3’):CTTCAAGTGCTGTCTGATTCCAATG;具体见SEQ IDNO:8;
退火温度为55℃,产物大小为300bp;
β-Actin的引物:
F(5’-3’):TCCTTCTGCATCCTGTCAGCA;具体见SEQ IDNO:9;
R(5’-3’):CAGGAGATGGCCACTGCCGCA;具体见SEQ IDNO:10;
退火温度为58℃,产物大小为300bp。
取5μL扩增后的PCR产物进行琼脂糖凝胶电泳(1.5%,g/v)。电泳结束后将凝胶置于紫外照射仪上观察,拍照,结果见图6。
由结果可知,胎盘绒毛板间充质干细胞表达干性标志物如Oct-4、Nanog、Sox2、TERT。
5、胎盘绒毛板间充质干细胞分泌的细胞因子检测
按每个T175培养瓶接种2×106个P3代胎盘绒毛板间充质干细胞,加入20mL完全培养基,置于37℃、5%CO2培养箱中培养,待细胞融合度达到85%时去除培养基,加入10mL DMEM(Hyclone)并放置于37℃、5%CO2培养箱中培养24h,收集培养液,20℃、4000r/min离心20min,吸取上清液,参照ELISA检测试剂盒说明书(R&D)检测各个细胞因子(IGF-1、PDGF-AA、HGF、EGF、FGF、VEGF)的表达量,结果见图7。
由结果可知,绒毛板来源的胎盘间充质干细胞分泌较高的HGF(肝细胞因子),少量分泌PDGF-AA(血小板生长因子AA)、FGF(成纤维细胞生长因子)、VEGF(血管内皮生长因子),仅能检测到极少量的IGF-1(胰岛素样生长因子)和EGF(表皮生长因子)。
6、胎盘绒毛板间充质干细胞生长特性测定
将P1、P2、P3代细胞分别接种于T75细胞培养瓶中,每瓶接种细胞量为1×105个细胞,并加入12mL完全培养基,每3天更换一次培养基,连续培养3周,其中每3天检测一次培养瓶中细胞的数量,每个检测样本重复3次,结果见图8。
将1×106个胎盘绒毛板间充质干细胞P1-P10代分别接种于T75细胞培养瓶中,加入12mL完全培养基,待细胞融合度达到85-90%时消化细胞,计算细胞的倍增时间,每个检测样本重复3次。细胞倍增时间计算公式为T=t×ln2/(lnNt-lnN0),其中t为细胞接种到细胞收获的时间,N0为接种时的细胞数量,Nt为收获时的细胞数量,结果见图9。
由结果可知,胎盘绒毛板间充质干细胞(P1-P3为代表)的生长对数期约为3-5天,而P1-P10为代表细胞的倍增时间为25-40小时。
实施例4胎盘绒毛板间充质干细胞数据库的建立
1、细胞活性的检测
利用台盼蓝染色法计数冻存前后活细胞的数目。
2、细胞感染的检测
利用少量细胞培养,检测细胞是否受到真菌和细菌的污染。利用病原学方法,检测细胞是否受到乙肝两对半(HbsAg、HbsAb、HBcAb、HbeAg、Hbe Ab)、丙肝(HCVAb)、艾滋(HIV-1/2Ab)、巨细胞病毒(CMV-IgA)、EB病毒和梅毒感染。
3、遗传病的检测
利用分子遗传学的方法,检测冻存细胞是否存在遗传病。
4、HLA-ABC/DR配型
检测细胞HLA-ABC/DR表型,并记录在案。
5、细胞来源的调查
记录胎儿及其父母的详细资料,并记录在案。
6、胎盘绒毛板间充质干细胞数据库的建立
在保存正常的胎盘绒毛板间充质干细胞后,建立胎盘绒毛板间充质干细胞的数据库,其中包括前五项资料,并建立与冻存细胞的关联。
- 还没有人留言评论。精彩留言会获得点赞!