与大豆蛋白质含量相关的QTL及分子标记的获得方法、分子标记和应用与流程
本发明属于分子生物学领域,具体涉及与大豆蛋白质含量相关的QTL及分子标记的获得方法、分子标记和应用。
背景技术:
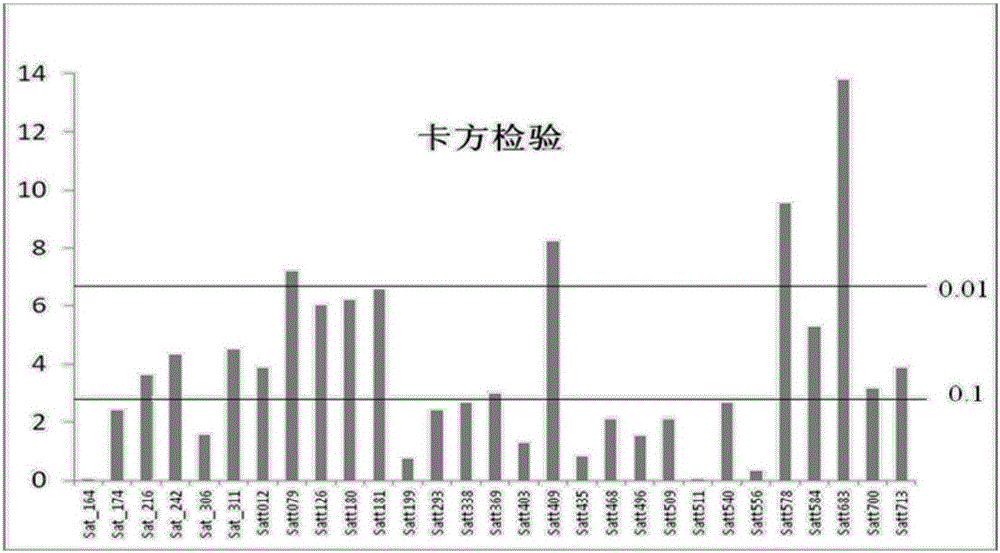
:大豆是在中国乃至世界范围当中都是重要的经济作物,其原因就在于大豆是人们日常生活中需要的植物蛋白的主要来源之一,同时大豆又是畜牧养殖业的重要的饲料作物。因此,大豆子粒当中的蛋白质含量成为衡量大豆品种的重要指标之一。然而,目前我国主要生产的高蛋白品种大豆无法满足人们日常生产生活需要。因此,利用现代化分子育种技术提高现有大豆品种蛋白质含量成为当代育种科研人员的主要任务。大豆蛋白含量属于多基因控制的数量性状遗传,对这一性状进行QTL分析和定位,可以发掘有利用价值的SSR位点,以培育优质高产的新品种。国内外对于大豆蛋白QTL做过大量分析,但是没有对高效位点进行有效确定,也没有明确位点的真实作用,从而无法直接应用到实际育种当中,并且可能出现重要位点的丢失。近年来分子标记辅助育种已经得到了一定的发展,但是却有一些不足之处。首先,大豆蛋白质是由多基因控制的数量性状遗传,这一遗传方式是由多基因控制的,因为单一位点对性状的影响很小,必须由多个基因对其操控才行,再加上环境因子对于表型的影响也很大,所以单一位点的作用很难被直接评估出来,导致无法应用在实际育种当中。对于数量性状遗传的最初步认识,是将微效多基因看成一个整体用生物统计法来分析。后来又出现了微效多基因假说,认为数量遗传是有多个微效基因共同控制。最新的研究成果已经证实这一假设是有缺陷的。数量性状遗传是有一个主效基因和多个微效基因共同调控,而且基因与环境互作对表型的影响很大。可以说数量性状的表现就是有主效位点、微效位点和环境因子共同影响下完成的。因此从基因的层面上来讲,判断出各个位点对蛋白质含量的效应值就显得极为重要。另外分层评价是以卡方检验和T检验为手段的一种统计方法,用于分析一组影响因子对某一效应产生的效应值。是一种以综合评判标准分析某一性状的统计方法。目前为止分层评价在生物领域当中的应用并不多见。目前,国内外众多大豆育种学者都在研究大豆的数量遗传性状。目前已发表的有关MAS和QTL定位的文章多为研究的标记和位点的潜在应用价值,很少将其真正应用到实际育种中,更少有人对数量遗传基因的效应值给出结论,在大豆子粒蛋白质含量这一方面也是一个空白。众所周知,大豆子粒蛋白质含量是数量性状遗传,由多基因控制。在这些基因中必然有的基因对该性状的影响较大,有些则影响较小。在得知各个基因对蛋白质含量这一性状的具体影响之前,很难将这些直接应用于实际育种当中。采取分层评价是一个比较有效的解决手段。技术实现要素:针对上述问题,本发明通过分层评价等统计分析方法,提供5种与大豆中大豆蛋白质含量密切相关的QTL,并准确的验证出各个大豆蛋白质含量相关QTL的效应值以及作用方式,通过变化率的计算发现3个关键QTL能够增加蛋白质含量,2个关键QTL能够降低大豆蛋白质含量。从而将其直接应用于实际分子育种当中。本发明提供的五个QTL中,Satt683属于大豆子粒蛋白质含量的主效QTL。Satt409、Satt180、Satt584、Satt181属于高效QTL。其中包含的等位基因Satt683-3、Satt409-2和Satt584-5对于大豆蛋白含量这个性状表现的是正相关,即其对应的等位基因在大豆子粒中的作用是促进大豆蛋白质含量增加,而Satt181-2和Satt180-5对于大豆蛋白含量这个性状表现为负相关,即其对应的等位基因在大豆子粒中的作用是抑制大蛋白质含量增加。3个对大豆蛋白质性状相关的QTL的信息见表1,其中列出的等位基因为与性状正相关的等位基因。表13个对大豆蛋白质性状相关的QTL2个对大豆蛋白质性状相关的QTL的信息件表2,其中列出的等位基因为与性状负相关的等位基因。表22个对大豆蛋白质性状相关的QTL可以直接用引物扩增,鉴定待测品种是否含有该等位基因,用于分子标记辅助选择。(一)、本发明提供一个与大豆蛋白质含量相关的QTL:位于连锁群N上,在公共图谱的基因组位置为27.787cM,由分子标记Satt683定位;分子标记Satt683的5’-3’引物如SEQIDNO.1所示,3’-5’引物如SEQIDNO.2所示。该QTL包含效应值为12%的等位基因Satt683-3,该等位基因与大豆蛋白质含量正相关。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记的获得方法:该分子标记的5’-3’引物如SEQIDNO.1所示,3’-5’引物如SEQIDNO.2所示;以大豆品种北豆5号为轮回亲本,与天鹅蛋ZDD02114杂交,共经过两次杂交和两次回交之后获得的大豆个体基因组DNA为模板;用上述5’-3’引物和3’-5’引物对上述模板进行PCR扩增,其PCR扩增体系为10μL,包括1.5ng/μL的DNA模板0.8μL,0.5μmol/L的5’-3’引物、3’-5’各0.5μL,200mmol/L的dNTP0.6μL,5U/μL的Taq酶0.05μL,10XBuffer1μL,阳离子采用MgCl2终浓度1.5-2.0mmol/L,其余用超纯水补足;PCR扩增程序为预变性94℃5分钟;变性94℃40秒、退火47℃40秒、延伸72℃40秒,循环35次;延伸72℃5分钟;4℃结束反应。将上述PCR扩增得到的产物经PCR产物变形程序:94℃5分钟,电泳分离后,得到的大小为450bp、430bp或410bp的扩增片段,即为目标分子标记。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记:该分子标记的5’-3’引物如SEQIDNO.1所示,3’-5’引物如SEQIDNO.2所示。本发明还提供上述的分子标记用于大豆分子育种的方法:该分子标记的5’-3’引物如SEQIDNO.1所示,3’-5’引物如SEQIDNO.2所示;用其5’-3’引物和3’-5’引对待测大豆品种的基因组DNA进行PCR扩增,其PCR扩增体系为10μL,包括1.5ng/μL的DNA模板0.8μL,0.5μmol/L的5’-3’引物、3’-5’各0.5μL,200mmol/L的dNTP0.6μL,5U/μL的Taq酶0.05μL,10XBuffer1μL,阳离子采用MgCl2终浓度1.5-2.0mmol/L,其余用超纯水补足;PCR扩增程序为预变性94℃5分钟;变性94℃40秒、退火47℃40秒、延伸72℃40秒,循环35次;延伸72℃5分钟;4℃结束反应。将上述PCR扩增得到的产物经PCR产物变形程序:94℃5分钟,电泳分离后,如果扩增产物中存在大小为450bp、430bp或410bp的扩增片段,则该待测大豆品种具有与大豆蛋白质含量相关的QTLSatt683,若扩增产物中存在大小为410bp的扩增片段,则该待测大豆品种为具有与大豆蛋白质含量相关的QTLSatt683中的增加大豆蛋白质含量的等位基因Satt683-3的品种,否则,待测品种不具有该QTL或该等位基因。(二)、本发明提供的另一个与大豆蛋白质含量相关的QTL:位于连锁群A2上,在公共图谱的基因组位置为145.565cM,由分子标记Satt409定位,分子标记Satt409的5’-3’引物如SEQIDNO.3所示,3’-5’引物如SEQIDNO.4所示。该QTL包含效应值为10%的等位基因Satt409-2,该等位基因与大豆蛋白质含量正相关。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记的获得方法:该分子标记的5’-3’引物如SEQIDNO.3所示,3’-5’引物如SEQIDNO.4所示;以大豆品种北豆5号为轮回亲本,与天鹅蛋ZDD02114或中黄杂交,共经过两次杂交和两次回交之后获得的大豆个体基因组DNA为模板;用上述5’-3’引物和3’-5’引物对上述模板进行PCR扩增,其PCR扩增体系和程序同(一);将上述PCR扩增得到的产物经电泳分离后,得到的大小为360bp、330bp或300bp的扩增片段,即为目标分子标记。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记:该分子标记的5’-3’引物如SEQIDNO.3所示,3’-5’引物如SEQIDNO.4所示。本发明还提供上述的分子标记用于大豆分子育种的方法:该分子标记的5’-3’引物如SEQIDNO.3所示,3’-5’引物如SEQIDNO.4所示;用其5’-3’引物和3’-5’引对待测大豆品种的基因组DNA进行PCR扩增,其PCR扩增体系和程序同(一);将上述扩增产物经电泳分离后,如果扩增产物中存在大小为360bp、330bp或300bp的扩增片段,则该待测大豆品种具有与大豆蛋白质含量相关的QTLSatt409,若扩增产物中存在大小为330bp的扩增片段,则该待测大豆品种为具有与大豆蛋白质含量相关的QTLSatt409中的增加大豆蛋白质含量的等位基因Satt409-2的品种,否则,待测品种不具有该QTL或该等位基因。(三)、本发明提供的另一个与大豆蛋白质含量相关的QTL:位于连锁群N上,在公共图谱的基因组位置为29.37cM,由分子标记Satt584定位,分子标记Satt584的5’-3’引物如SEQIDNO.5所示,3’-5’引物如SEQIDNO.6所示。该QTL包含效应值为10%的等位基因Satt584-5,该等位基因与大豆蛋白质含量正相关。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记的获得方法:该分子标记的5’-3’引物如SEQIDNO.5所示,3’-5’引物如SEQIDNO.6所示;以大豆品种北豆5号为轮回亲本,与天鹅蛋ZDD02114杂交,共经过两次杂交和两次回交之后获得的大豆个体基因组DNA为模板;用上述5’-3’引物和3’-5’引物对上述模板进行PCR扩增,其PCR扩增体系和程序同(一);将上述PCR扩增得到的产物经电泳分离后,得到的大小为400bp、350bp或300bp的扩增片段,即为目标分子标记。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记:该分子标记的5’-3’引物如SEQIDNO.5所示,3’-5’引物如SEQIDNO.6所示。本发明还提供上述的分子标记用于大豆分子育种的方法:该分子标记的5’-3’引物如SEQIDNO.5所示,3’-5’引物如SEQIDNO.6所示;用其5’-3’引物和3’-5’引对待测大豆品种的基因组DNA进行PCR扩增,其PCR扩增体系和程序同(一);将上述扩增产物经电泳分离后,如果扩增产物中存在大小为400bp、350bp或300bp的扩增片段,则该待测大豆品种具有与大豆蛋白质含量相关的QTLSatt584,若扩增产物中存在大小为300bp的扩增片段,则该待测大豆品种为具有与大豆蛋白质含量相关的QTLSatt584中的增加大豆蛋白质含量的等位基因Satt584-5的品种,否则,待测品种不具有该QTL或该等位基因。(四)、本发明提供的另一个与大豆蛋白质含量相关的QTL:位于连锁群C1上,在公共图谱的基因组位置为105.092cM,由分子标记Satt181定位,分子标记Satt181的5’-3’引物如SEQIDNO.7所示,3’-5’引物如SEQIDNO.8所示。该QTL包含效应值为8%的等位基因Satt181-2,该等位基因与大豆蛋白质含量负相关。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记的获得方法:该分子标记的5’-3’引物如SEQIDNO.7所示,3’-5’引物如SEQIDNO.8所示;以大豆品种北豆5号为轮回亲本,与大明白豆子或艾卡166杂交,共经过两次杂交和两次回交之后获得的大豆个体基因组DNA为模板;用上述5’-3’引物和3’-5’引物对上述模板进行PCR扩增,其PCR扩增体系和程序同(一);将上述PCR扩增得到的产物经电泳分离后,得到的大小为300bp、280bp或180bp的扩增片段,即为目标分子标记。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记:该分子标记的5’-3’引物如SEQIDNO.7所示,3’-5’引物如SEQIDNO.8所示。本发明还提供上述的分子标记用于大豆分子育种的方法:该分子标记的5’-3’引物如SEQIDNO.7所示,3’-5’引物如SEQIDNO.8所示;用其5’-3’引物和3’-5’引对待测大豆品种的基因组DNA进行PCR扩增,其PCR扩增体系和程序同(一);将上述扩增产物经电泳分离后,如果扩增产物中存在大小为300bp、280bp或180bp的扩增片段,则该待测大豆品种具有与大豆蛋白质含量相关的QTLSatt181,若扩增产物中存在大小为280bp的扩增片段,则该待测大豆品种为具有与大豆蛋白质含量相关的QTLSatt181中的减少大豆蛋白质含量的等位基因Satt181-2的品种,否则,待测品种不具有该QTL或该等位基因。(五)、本发明提供的另一个与大豆蛋白质含量相关的QTL:位于连锁群H上,在公共图谱的基因组位置为87.597cM,由分子标记Satt180定位,分子标记Satt180的5’-3’引物如SEQIDNO.9所示,3’-5’引物如SEQIDNO.10所示。该QTL包含效应值为8%的等位基因Satt180-5,该等位基因与大豆蛋白质含量负相关。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记的获得方法:该分子标记的5’-3’引物如SEQIDNO.9所示,3’-5’引物如SEQIDNO.10所示;以大豆品种北豆5号为轮回亲本,与Biogedulote或艾卡166或瑞丰2号杂交,共经过两次杂交和两次回交之后获得的大豆个体基因组DNA为模板;用上述5’-3’引物和3’-5’引物对上述模板进行PCR扩增,其PCR扩增体系和程序同(一);将上述PCR扩增得到的产物经电泳分离后,得到的大小为350bp、340bp或300bp的扩增片段,即为目标分子标记。本发明还提供上述与大豆蛋白质含量相关的QTL的分子标记:该分子标记的5’-3’引物如SEQIDNO.9所示,3’-5’引物如SEQIDNO.10所示。本发明还提供上述的分子标记用于大豆分子育种的方法:该分子标记的5’-3’引物如SEQIDNO.9所示,3’-5’引物如SEQIDNO.10所示;用其5’-3’引物和3’-5’引对待测大豆品种的基因组DNA进行PCR扩增,其PCR扩增体系和程序同(一);将上述扩增产物经电泳分离后,如果扩增产物中存在大小为350bp、340bp或300bp的扩增片段,则该待测大豆品种具有与大豆蛋白质含量相关的QTLSatt180,若扩增产物中存在大小为300bp的扩增片段,则该待测大豆品种为具有与大豆蛋白质含量相关的QTLSatt180中的减少大豆蛋白质含量的等位基因Satt180-5的品种,否则,待测品种不具有该QTL或该等位基因。上述电泳分离,为聚丙烯酰胺凝胶电泳或毛细管电泳。了解了蛋白相关基因的效应值,我们就可以通过检验某大豆品种当中是否有高效位点来判断该品种的大豆是否是蛋白含量高的优质大豆,这样就实现该基因在分子辅助育种当中的实际应用。本发明在已知的大量大豆蛋白质相关QTL中确定重要的、效应大的QTL,并确定各个基因对大豆蛋白质形状的具体影响:是正相关还是负相关,并利用这些QTL实现以分子标记为手段进行育种。附图说明图1大豆Satt683在表1所示的250份资源大豆中的编号1-61中的带型;图2卡方分析资源等位基因的分层分析;图3T-测验的资源等位基因的分层分析;图4等位基因在群体的SSR分析;图5卡方分析群体等位基因的分层分析;图6T-测验的群体等位基因的分层分析;图7各个等位基因在资源和北豆群体中变化率;图8Satt683的引物对母本为北豆5号父本为天鹅蛋ZDD02114的群体的基因组DNA扩展产物毛细管电泳图;图9Satt409的引物对母本为北豆5号父本为天鹅蛋ZDD02114或中黄的群体的基因组DNA扩展产物毛细管电泳图;图10Satt584的引物对母本为北豆5号父本为天鹅蛋ZDD02114的群体的基因组DNA扩展产物毛细管电泳图;图11Satt181的引物对母本为北豆5号父本为大明白豆子或艾卡166的群体的基因组DNA扩展产物毛细管电泳图;图12Satt180的引物对母本为北豆5号父本为Biogedulote或艾卡166或瑞丰2号的群体的基因组DNA扩展产物毛细管电泳图。具体实施方式以下实施例中:大豆蛋白质含量测定全部使用FOSSInfratec1241谷物分析仪;毛细管电泳分析全部使用全自动毛细管电泳仪,AdvancedAnalyticalTechnologies(美国AATI公司),型号FragmentAnalyzerTM。实施例1实验材料的种植和蛋白质含量检测:(1)实验材料的种植和采样资源材料:选取的是250份中国地区的主栽大豆品种。表1是250份资源的品种名称及子粒蛋白质含量。种植场所:吉林省农科院。种植方法:1m行长,每行21粒种子。管理方法:同大田管理。采样方法:营养生长阶段,取植株顶端最幼嫩处叶片用于提取DNA、PCR反应。收获时按单株收取大豆子粒用于测定蛋白质含量。验证材料:是以黑龙江省主栽大豆品种北豆5号作为轮回亲本,与多马卡·托利萨、坡黄、Harosoy、绿75、中特1号、NOVA、Century、东农163、杜纳吉卡、Amsoy、中豆27、95-5383、艾卡166、大明白豆子、东山69、瑞丰2号、中黄、Biogedulote和天鹅蛋ZDD02114这19个品种的大豆分别杂交,总共经过两次杂交和两次回交之后收获BC2F2。群体总共330个个体。种植场所:黑龙江省农垦科研育种中心。种植方法:5m行长,每行100粒种子。管理方法:同大田管理。采样方法:营养生长阶段,取植株顶端最幼嫩处叶片用于提取DNA、PCR反应。收获时按单株收取大豆子粒用于测定蛋白质含量。(2)蛋白质含量的测定:分别测定上述资源材料和验证材料中每种大豆的子粒蛋白质含量。使用步骤1)打开Infratec1241谷物分析仪的电源。2)当仪器进行完自检预热好之后,从应用模型列表栏中通过上下键找到所需的模型。应用模型名称中有附加的“STM”的。3)将大豆子粒倒入样品槽,之后支架装入对接单元,注意有齿轮条的一侧在右边。向下轻轻按支架,以确保齿轮条和齿轮正确啮合。将样品槽支架放入对接单元,这时候要小心,以免损坏内部的小齿轮。4)在键盘区按下分析键开始分析。FOSSInfratec1241谷物分析仪测出的数据是“.crd“格式。需要先转换成EXCEL格式才能打开。导出数据步骤:IFT文件夹中包含Disk1,Disk2两个目录和一个说明文件,运行Disk1目录下的setup.exe。开始→FOSS→IFT;ResultData/CRD→TXT-format(columns)。在Sourcefolder中选择20071030.crd的路径,并在文件前选中√。再选择输出路径,如Desktop,点击Convertselected。为文件起名,保存。退出IFT。得到一个TXT文件。新建一个Excel,打开TXT文件,在文本导入向导中选择“分隔符号”点击下一步,选择“Tab键”和“逗号”,点击下一步,点击完成。就可以将FOSSInfratec1241谷物分析仪测得的大豆蛋白质含量的数据用Excel格式打开。表1250份大豆资源名称及其子粒蛋白质含量实施例2DNA提取和PCR扩增:(1)大豆叶片DNA的提取(250份资源大豆与验证材料330个个体均提取,每种大豆分别提取)1)将实施例1中取得的用于提取DNA、PCR反应的新鲜叶片置于1.5ml离心管中,将离心管放在浸于液氮中的离心管架上,用塑料钻头低温钻磨,直至样品变为白色细粉末为止。2)打开水浴锅预热至65℃,同时将CTAB提取液(按照40ml:10μl加入巯基乙醇)加热至65℃。温度达到之后将每个离心管中加入0.7mlCTAB提取液,充分混匀之后,水浴40分钟,并且间歇轻摇。3)将水浴之后的离心管中加入等体积氯仿,然后8000(转/分)离心20分钟。取上清液,再次加入等体积氯仿。离心8000(转/分)20分钟。4)取上清液加至预先预冷的0.7ml异丙醇中,直至DNA析出。5)用无水乙醇冲洗DNA,之后晾干,以80μl超纯水溶解。6)1%琼脂糖凝胶电泳检测。电压100V电流100A运行20分钟。注意事项:1)移液器黄色枪头的尖端部分减去一小部分,防止剪切力破坏DNA结构)2)移液以及冲洗DNA的时候一定要缓慢轻柔,以免损坏DNA结构表2用于提取大豆叶片DNA的CTAB提取液配方药品名称用量(200ml)CTAB4gNaCl13.364gEDTA1.48gTris-HCl(pH8.0)20ml超纯水定容至200ml(2)PCR反应选取分布在大豆DNA13个连锁群上的29对引物(见表3),利用选取的29对SSR引物对250份资源大豆的基因组DNA进行PCR扩增,并通过电泳分析:在表4所示体系中,按以下程序分别进行扩增,引物由上海生工合成。PCR程序:预变性94℃5分钟;变性94℃40秒,退火47℃40秒,延伸72℃40秒,循环35次;延伸72℃5分钟;4℃结束反应。表3在大豆DNA13个连锁群上选取的29对引物位置和序列表4PCR反应(10μl体系)选取原则:1)尽量在13个连锁群每条上都选取SSR引物2)一条连锁群上选取的几个引物遗传距离尽量远(3)聚丙烯酰胺凝胶电泳:上述步骤(2)得到的扩增产物分别进行聚丙烯酰胺凝胶电泳检测,得到表1所示的250个资源品种大豆和验证资源330个个体的DNA的29对引物的PCR扩增产物带型,部分带型见图1。表5聚丙烯酰胺凝胶电泳药品聚丙烯酰胺凝胶电泳步骤将大板用酒精擦干净,再均匀涂抹亲和硅烷(酒精:亲和硅烷:冰乙酸=5ml:50μl:50μl)将耳板放入抽风橱内,用酒精擦干净,再均匀涂抹剥离硅烷。将干净的边条放在大板两侧,再盖上耳板。两块板涂抹硅烷的一面要朝里。用夹子固定。将配置好的6%PA胶内加入200μlAPS和50μlTEMED。均匀灌入大板和耳板之间,注意不要出现气泡。将齿梳平滑一面朝里插入两板之间5mm左右。调水平。静置一小时左右即可使用上板,夹紧,将电泳槽内倒入缓冲液TBE(上槽为1倍TBE,下槽为1/3倍TBE)。点样槽里滴入少量染色剂,1800V电压预电泳10分钟左右。期间对PCR产物内加入染色剂并作变性处理。将齿梳插入点样槽(齿朝下),点样,1800V电压运行90分钟。下板。取下耳板和边条。银染:1500ml蒸馏水中加入1500μl硝酸银溶液。将大板浸泡在银染溶液里20~30分钟。蒸馏水冲洗半分钟。10)显影:1500ml蒸馏水,加入1500μl甲醛、3%NaOH和6.25gNa2CO3。将大板浸泡在银染溶液里20~30分钟。11)统计带型,记录数据,扫描。表6分层中的部分引物扩增出的片段大小实施例3大豆蛋白质含量相关等位基因分层评价:(1)大豆蛋白质含量相关等位基因分层评价将实施例1得到的表1所示的250个资源品种中每个品种的蛋白质含量的数据与实施例2(3)中得到的其带型数据一一对应,选取蛋白质含量前40%和后40%利用MATLABR2009a卡方检验分析等位基因的效应值。以alpha=0.01和0.1作为分层的阈值,将结果分为3个层次。其中当检验P值小于0.01时,我们认为该位点为主效位点,而P值大于0.1时,认为是微效位点,参考图2,P值小于0.01水平(极显著)的等位基因有Satt683-3、Satt578-4、Satt409-2和Satt079-1。显著水平在0.1和0.01之间的有Satt181-2、Satt180-5、Satt126-1、Satt578-2、Satt584-5、Satt409-10、Sat_311-2、Sat_242-2、Satt578-6、Satt584-6、Satt713-1、Satt012-5、Sat_216-2、Sat_216-3、Satt584-2、Satt700-2和Satt369-2,其余的等位基因其显著水平均大于0.1。经过Minitab14.12T检验之后参照图3,显著水平小于0.01的共有十个等位基因,与之前的卡方检验到的4个极显著等位基因对比之下可以发现共有三个等位基因在卡方检验和T检验检测下,均表现为极显著,分别是Satt683-3、Satt578-4和Satt409-2。除了这三个极显著水平的等位基因,其余的等位基因要么表现为一般显著或是不显著,要么就是在两种检验方法中的显著水平不一致。可以初步区分出主效基因和微效基因。(2)关键等位基因在北豆5号群体中的验证根据资源分层数据,选出极显著水平的全部引物以及其他显著水平较高的引物。进行卡方检验和T检验。同时为了验证分层效果的成立,再选择一个显著性水平极低的引物。同样进行两种分析。选取极显著水平的等位基因Satt683-3、Satt578-4和Satt409-2,选取卡方检测一般显著而T检测极显著的等位基因Satt180-5、Satt181-2和Satt584-5,选取卡方检测和T检测都不显著的等位基因Sat_174-2共7个等位基因的引物(表3),以北豆5号为轮回亲本的群体的330个个体的基因组DNA为模板,在表4所示体系中,按以下程序分别进行PCR扩增,并通过电泳分析。引物由上海生工合成。部分电泳图见图4。统计带型。PCR程序:预变性94℃5分钟;变性94℃40秒,退火47℃40秒,延伸72℃40秒,循环35次;延伸72℃5分钟;4℃结束反应。与本实施例(1)对资源的带型数据处理方法相同,对7对引物在北豆5号群体中的带型数据进行卡方检验和T检验:将北豆5号导入系群体个体(验证资源330个个体)的蛋白质含量的数据与带型数据一一对应以蛋白质含量为关键字全排序。选出前40%和后40%利用MATLABR2009a进行卡方检验打开Minitab14.12进行T检验。验证卡方检验结果。结果如图5和图6。从以上两张图可以看出,Satt683-3在两种检测中依然都是极显著,说明该等位基因确实属于大豆子粒蛋白质含量的主效基因。Satt409-2在T检验中仍是极显著,尽管卡方检验结果有所下降,但是仍然保持在较高的水平。Satt180-5和Satt584-5却表现出在两种检验中都为极显著,再加上同上一轮分层评价表现一致的Satt181-2,可以判断出这四种等位基因应该属于高效基因,只是其作用效果不如Satt683-3明显。而Sat_174-2则与上一轮的结果完全一致,都为不显著,说明该基因确实在增加蛋白质含量这方面效应值很低。意外的是在资源中显著水平极高的引物Satt578的各等位基因在北豆群体中显著水平极低,甚至未发现等位基因Satt578-4。这个极个别现象产生原因可能是北豆5号导入系群体的20个亲本的基因组当中没有该基因,另外测量仪器不够准确等原因产生的系统误差也可能造成这种极个别现象发生。因此,虽然两个群体中的分层评价略有出入,但差异并不大,总体上的层次还是比较明显,那就是在资源中显著水平较高的,在北豆5号群体中依然较高,不同引物的等位基因在两个群体中的作用是一致的。这样就可以认为,对于这29个引物的等位基因分层评价其结论是准确的。实施例4利用表型变化率验证分析等位基因加性效应:本发明通过变化率来表示是否含有该等位基因的变化,这种变化率是基于资源或群体中个体成熟期后表型值差异,若某个等位基因对大豆子粒蛋白质含量有正方向的加性效应,那么含有该等位基因的资源或群体个体的表型数据要比不含有该等位基因的资源或个体的要高,但是不排除标记之间的互作和等位基因间的互作的影响。上述变化率的计算方法为:Rateofchange=ValueA-ValueBValueB×100%.]]>其中Rateofchange是变化率,ValueA代表含有A等位基因的个体或资源的蛋白质含量表型值的平均值,ValueB代表含有B等位基因或不含有A等位基因的个体或资源的蛋白质含量表型值的平均值。利用表型变化率进一步验证关键等位基因加性效应从理论上讲,存在某等位基因的大豆品种其蛋白质含量如果高于不存在该等位基因的大豆品种,那么则说明该等位基因对于蛋白质含量这一数量性状表现为正向调控的正相关基因。反之,该等位基因则是负相关的基因。本发明选择了经过两次分层评价筛选得到的5条极显著等位基因,选出含有这5条等位基因的北豆5号小群体(表7)。通过重要引物等位基因在资源和北豆5号群体中对蛋白质含量产生的变化率来进行验证。结果如图7。筛选之后得到几个引物及等位基因相应的验证群体。群体的母本是北斗5号,父本见表7。表7筛选得到群体用于关键等位基因从表中可以明确看出这5个等位基因对资源和群体中大豆子粒蛋白质含量的影响效果是一致的。Satt683-3、Satt409-2和Satt584-5这三条等位基因在两个群体中的变化率都是正的,说明他们对于大豆蛋白含量这个性状表现的是正相关,即该等位基因在大豆子粒中的作用是促进大豆蛋白质含量增加。而Satt181-2和Satt180-5在两个群体中的变化率都是负的,证明这两个等位基因对于大豆蛋白含量这个性状表现为负相关,即该等位基因在大豆子粒中的作用是抑制大蛋白质含量增加。实施例5等位基因位点在分子标记育种中的应用QTL位点Satt683的引物(SEQIDNO.1、SEQIDNO.2)、QTL位点Satt409的引物(SEQIDNO.3、SEQIDNO.4)、QTL位点Satt584的引物(SEQIDNO.5、SEQIDNO.6)、QTL位点Satt181的引物(SEQIDNO.7、SEQIDNO.8)、QTL位点Satt180的引物(SEQIDNO.9、SEQIDNO.10),以北豆5号为轮回亲本的群体的330个个体的基因组DNA为模板,在表4所示体系中,按以下程序分别进行PCR扩增,并通过毛细管电泳分析(步骤和参数参照仪器说明)。引物由上海生工合成。PCR程序:预变性94℃5分钟;变性94℃40秒,退火47℃40秒,延伸72℃40秒,循环35次;延伸72℃5分钟;4℃结束反应。毛细管电泳分析结果表明,Satt683的引物对母本为北豆5号父本为天鹅蛋ZDD02114的群体的基因组DNA扩展出了大小为410bp的分子标记片段(图8),说明该群体基因组DNA中含有提高大豆蛋白含量的Satt683-3等位基因;Satt409的引物对母本为北豆5号父本为天鹅蛋ZDD02114或中黄的群体的基因组DNA扩展出了大小为330bp的分子标记片段(图9),说明该群体基因组DNA中含有提高大豆蛋白含量的Satt409-2等位基因;Satt584的引物对母本为北豆5号父本为天鹅蛋ZDD02114的群体的基因组DNA扩展出了大小为300bp的分子标记片段(图10),说明该群体基因组DNA中含有提高大豆蛋白含量的Satt584-5等位基因;Satt181的引物对母本为北豆5号父本为大明白豆子或艾卡166的群体的基因组DNA扩展出了大小为280bp的分子标记片段(图11),说明该群体基因组DNA中含有降低大豆蛋白含量的Satt181-2等位基因;Satt180的引物对母本为北豆5号父本为Biogedulote或艾卡166或瑞丰2号的群体的基因组DNA扩展出了大小为300bp的分子标记片段(图12),说明该群体基因组DNA中含有降低大豆蛋白含量的Satt180-5等位基因。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1