一种用于降低奶牛泰勒虫病辅助选择的分子标记及其检测方法与流程
本发明属于生物技术领域,涉及一种利用基因的单核苷酸多态性来判定奶牛泰勒虫病感染率,并用于降低奶牛泰勒虫病辅助选择的分子标记及其检测方法。
背景技术:
牛瑟氏泰勒虫(Theilefia sergenti)是经过蜱传播的寄生于红细胞和淋巴细胞内的血液原虫[1]。牛瑟氏泰勒虫的子孢子(Sporozoite)随蜱的唾液腺进入牛体内,在巨唾细胞和淋巴细胞内进行裂殖生殖后,再进入红细胞内反复分裂后发育成血液型虫体[2]。虽然这个过程历时非常短暂,但是在红细胞内的梨浆虫阶段可能是致病的。
泰勒虫在牛体寄生阶段,寄生于红细胞内时,会影响牛体相应的血液型及免疫学指标的变化,因此可通过监测这些指标的变化来初步鉴定该虫体或者监测患病牛康复状态[3-4]。据报道,感染环形泰勒虫的奶牛与正常奶牛相比,各项生理生化指标差异极显著,表现为体温升高,心率、呼吸次数、白细胞总数、血清胆红素、谷丙转氨酶增加;血红蛋白、红细胞及其压积随染虫率的上升不断下降,血清总蛋白、白蛋白、胆固醇和甘油脂均明显减少[5-8]。临床上常用红细胞C3b受体花环率及红细胞免疫复合物花环率,作为评价动物红细胞免疫功能的主要指标,以T淋巴细胞转化率的高低来反映机体细胞免疫水平。李明祯等于2012年首次通过以上指标的变化探讨环形泰勒虫对奶牛免疫水平的影响,结果显示患病牛的红细胞免疫功能及细胞免疫能力下降,说明环形泰勒虫侵入机体后,可通过损伤免疫器官来引发免疫抑制,造成活化的T淋巴细胞数量减少,机体的细胞免疫紊乱,免疫水平低下,最终导致机体抵抗力下降[9]。
牛泰勒虫病具有明显的地区性和季节性。外地牛、纯种牛和改良杂种牛对该病的易感性明显高于当地牛,即使红细感染虫率很低,亦出现明显的临床症状,在不加任何治疗时其发病率和致死率均可达90%以上。长期以来,瑟氏泰勒虫免疫学诊断因抗原不足而技术的发展受到制约,因此许多学者力求寻找出一种方法适合瑟氏泰勒虫体外培养,以排除某些不利的因素。该病主要呈地方性流行,发病率高达36%~100%,死亡率高达17.8%~75.4%。该病危害严重,可引起犊牛和外地引进牛大量死亡,Tsuji等[10]、Hagiwara等[11]、张守发等[12]先后应用严重免疫缺陷(SCID)鼠成功建立瑟氏泰勒虫动物模型,这些方法的建立对瑟氏泰勒虫免疫学技术进一步发展。Takahashi等[13]于1957年在日本牛红细胞内提取瑟氏泰勒虫特异性蛋白,第一个在世界上建立了瑟氏泰勒虫病IFA诊断技术。Matsuba等[14]于1993年以含有P32基因的cDNA为探针,通过Southern杂交分析得出至少有三种基因不同的种群可以共存,并且处于优势种群的寄生虫转换可能发生在宿主持续感染期间,从而可能逃避宿主的免疫应答。
虽然牛泰勒虫的检测技术国内外取了一些进展,但生产中很少有人使用,也没有对牛泰勒虫抗性进行系统的选育。目前,我国奶牛群体泰勒虫感染率仍维持较高水平,平均为25%左右[15]。因此,急需一种能用于奶牛泰勒虫病辅助选择的分子标记及其检测方法,并结合传统的奶牛育种、人工授精等技术,从而降低我国奶牛泰勒虫病的感染率,提高奶牛养殖的终生产值和牛场的经济效益。
硬脂酰辅酶A去饱和酶(stearoy1CoA desaturease,SCD)是合成单不饱和脂肪酸(MUFA)的限速酶,催化饱和脂肪酸(SFA)的脂酰辅酶A脱氢,其首选底物是软脂酰和硬脂酰辅酶A,分别在C9-C10脱氢转化生成棕榈油酸(palmitoleate)(△916:1)与油酸(Oleate)(△918:1),两者是合成膜磷脂、胆固醇酯和三酰甘油的底物[16-17],对牛脂肪组织中脂肪酸的组成以及肌肉间脂肪沉积有着重要影响。研究[18]表明,大理石花纹评分性状在三种基因型(CC、CT和TT)间表现出一定的差异性:参照评分标准,CC型个体评分值分别高于CT和TT型个体0.03和0.06个评分值,说明CC型个体肌间脂肪含量相对较高。另外,研究[19]还表明,SCD1基因C878T位点突变对中国荷斯坦奶牛脂肪相关性状有较大的遗传效应。
参考文献
[1]Jeong W,Kweon CH,Kang SW,et al.Adjuvant effect of bovine heat shock protein 70 onpiroplasm surface protein,p33of Theileria.sergenti[J].Biologicals.2009;37:282-287.
[2]北京农业大学主编。家畜寄生虫学[M].中国农业出版社.2003年,第三版.
[3]Tait A,Hall F R.Theileria annulata:control measures,diagnosis and the potential use of subunit vaccines[J].Rev Sci Tech,1990,9(2):387-403.
[4]Maxie M G,Dolan T T,Jura W G,et al.A comparative study of the disease in cattle caused by Theileriaparva or T.lawrencei:II.Hematology,clinical chemistry,coagulation studies and complement[J].VetParasitol,1982,10(1):1-19.
[5]Singh A,Singh J,Grewal A S,et al.Studies on some blood parameters of crossbred calves with experimental Theileria annulata infections[J].Vet Res Commun,2001,25(4):289-300.
[6]史晓,常国新,吴韶儒,等.环形泰勒焦虫对奶牛生理生化水平的影响[J].上海畜牧兽医通讯,2012(6):24-25.
[7]Ramin A G,Asri-Rezaie S,Hemati M,et al.Evaluation of the erythrocytes and leucocyte alterations in cows infected with Theileria annulata[J].Acta veterinaria,2011,61:561-574.
[8]李明祯,毕可东,赵忠玲,等.环形泰勒焦虫对奶牛免疫水平的影响[J].中国畜牧兽医,2009,36(7):141-142.
[9]罗金,刘光远,田占成,谢俊仁,张萍.基于18Sr RNA基因序列的我国马梨形虫分类学地位分析[J].动物分类学报,2011,36(1):99-103.
[10]Tsuji M,Hagiwara K,Takahashi K,et al.Theileria sergenti proliferates in SCID mice with bovine erythrocyte transfusion[J].J Parasitol.1992,78(4):750-752.
[11]Hagiwara K,Tsuji M,Ishihara C,et al.Theileria sergenti infection in the Bo-RBC-SCID mouse model[J].ParasitoI Res.1993,79(6):466-470.
[12]张守发,鞠玉琳,姜铁民.牛瑟氏泰勒虫实验动物模型的研究[J].畜牧与兽医.2003,35(9):29-30.
[13]Takahashi K,Yamashita S,Shimizu Y.Role of antibody detected by the indirect fluorescent antibody test in the clinical signs of cattle infected with Theileria sergenti[J].Nihon Juigaku Zasshi.1975,37(5):295-301.
[14]Matusba T,Kubota H,Tanaka M.et al.Analysis of mixed parasite populations of Theileria sergenti using cDNA probes encoding a major piroplasmsurface protein[J].ParasitoIogy.1993,107(4):3 69-3 77.
[15]许应天,张守发,等.牛泰勒虫病的诊断及预防研究进展[J].延边大学农学学报,1997,19(4):271-275.
[16]Mele M,Conte G,Castiglioni B,et al.Stearoyl-coenzyle A desaturase gene polymorphism and milk fatty acid composition in Italian Holsteins[J].J Dairy Sci,2007,90(9):4458-4465.
[17]Enoch H G,Catala A,Strittmatter P.Mechanism of rat microsomal stearoyl-CoA desaturase[J],J Biol Chem,1976,251:5095-5103.
[18]王小龙,常玲玲,陈莹,等.中国荷斯坦牛SCD1外显子5基因多态性及其对乳中脂肪酸组成的影响[J].中国农业科学,2014,47(9):1858-1864.
[19]武秀香,施雪奎,常玲玲,等.牛SCD1基因C878T位点遗传多态性与中国西门塔尔牛部分脂肪相关性状的效应分析[J].畜牧兽医学报,2011,42(3):363-368.
技术实现要素:
本发明的目的在于提供一种能用于降低奶牛泰勒虫病的辅助选择的分子标记及其检测方法,并结合传统的奶牛育种、人工授精等技术,对种牛进行选种选配,从而降低我国奶牛泰勒虫病的感染率,提高奶牛养殖的终生产值和牛场的经济效益。
本发明的基本思路是:基于现有技术状况,如:1)奶牛泰勒虫病的主要传播动物为蜱虫,蜱虫会选择奶牛皮肤较薄的位置寄生,从而传播泰勒氏虫病,因此,奶牛脂肪沉积与皮下脂肪厚度对蜱虫的传播有一定的影响;2)前期研究表明,SCD对牛脂肪组织中脂肪酸的组成以及脂肪沉积有着重要影响。基于以上技术现状,本发明着重研究了SCD1不同基因型与奶牛泰勒虫病的感染率的关联。通过以866头奶牛个体为研究对象,采用PCR-SSCP、直接测序和飞行质谱法分析SCD1基因遗传多态性,结合其泰勒虫病感染与淘汰等信息,经Logstic分析,最终发现了与奶牛泰勒虫病感染显著相关的SCD1基因上的SNP突变,即SCD1基因C878T SNP位点。SCD1基因878位点SNP对奶牛泰勒虫感染的影响达到显著水平(P=0.011),TT型奶牛感染泰勒虫的概率仅为CC型个体的39%(详见表2);并以此发现为基础,建立了奶牛辅助育种选择分子遗传标记及其检测方法。
为了实现上述目的,本发明的技术方案如下:
本发明提供了一种用于降低奶牛泰勒虫病辅助选择的分子标记,其特征在于,硬脂酰辅酶A去饱和酶SCD1基因(NC_007327)在8586bp的一个碱基C→T的SNP突变,导致蛋白质肽链中878位氨基酸-丙氨酸(alanine)突变为缬氨酸(valine)。
本发明还提供了一种用于降低奶牛泰勒虫病辅助选择的分子标记的检测方法,其特征在于,包括以下步骤:
1)以从样品中提取的DNA为样本,使用用于降低奶牛泰勒虫病辅助选择的分子标记引物进行PCR扩增;
2)检测步骤1)中的PCR产物的序列,根据分子标记,即:SCD1基因(NC_007327)在8586bp的SNP突变,判定其样品的基因型为CC,CT或者TT型,对降低奶牛泰勒虫病进行辅助选择,其中CC型感染率最高,TT型感染率最低。
可选地,步骤2)中的检测方法可以是普通测序法,此时步骤1)中使用的用于降低奶牛泰勒虫病辅助选择的分子标记引物的核苷酸序列为:
F1:5’-ACCTGGCTGGTGAATAGTGC-3’;
R1:5’-TGACATATGGAGAGGGGTCA-3’。
可选地,步骤2)中的检测方法也可以采用飞行时间质谱法。此时使用的用于降低奶牛泰勒虫病辅助选择的分子标记引物的核苷酸序列为:
F2:5’-ACGTTGGATGACCCCCGAGAGAATATTCTG-3’;
R2:5’-ACGTTGGATGTAAGCAGCAGACCACTAGAC-3’;
U:5’-ggGGTTTCCCTGGGAGCTG。
本发明还提供了如上所述的用于降低奶牛泰勒虫病辅助选择的分子标记以及检测方法在与降低奶牛泰勒虫病相关的判定或者检测中的应用。
本发明的技术方案达到了如下的有益效果:
1)本发明中所使用的分子标记SCD1基因878位点SNP对奶牛泰勒虫感染的影响达到显著水平(P=0.011)(见表2),验证了该SNP突变标记点与奶牛泰勒虫病的感染显著相关,使得分子标记具有更高的准确性和可信度;
2)此外,该分子标记在辅助育种中的应用,使得对种牛在奶牛泰勒虫易感性方面的选择更有效和更具针对性,从而达到降低牛场泰勒虫病的发病率和感染率,减少该病对奶牛生产的影响,同时可减少因淘汰奶牛而购买其他奶牛所产生的费用,提高奶牛生产效率和经济价值。
附图说明
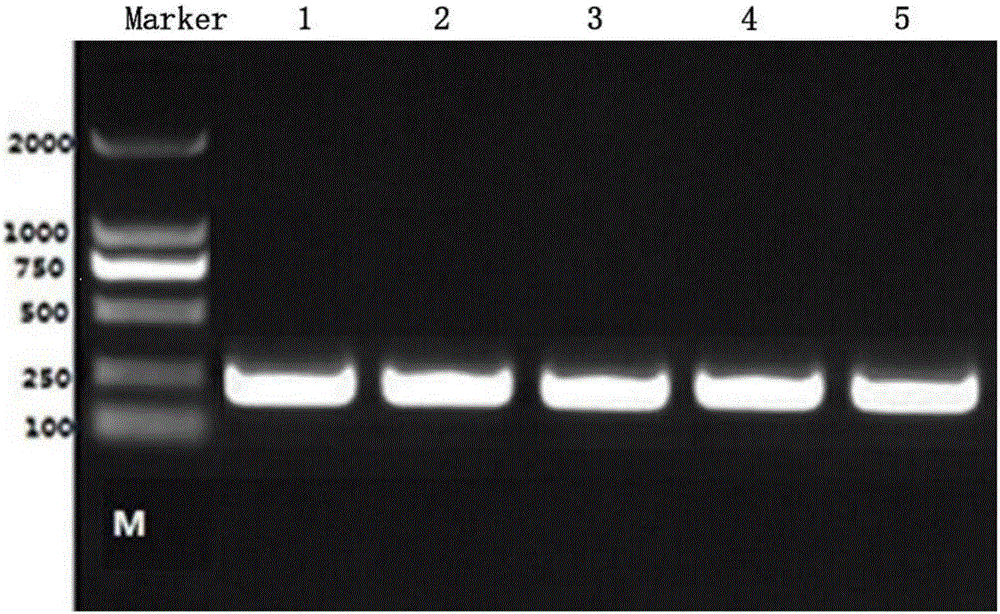
图1是SCD1基因878位点PCR扩增图。
图2是中国荷斯坦奶牛SCD1基因的PCR-SSCP结果。
图3是中国荷斯坦奶牛SCD1不同基因型测序图。
图4是SCD1-878位点飞行时间质谱检测图。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方式对本发明做进一步的介绍。
实施例1
(1)样品采集:从奶牛静脉采抗凝血10mL,用常规方法提供其DNA;
(2)引物设计:根据GenBank公布的牛的SCD1基因DNA序列(NC_007327),用Primer5.0设计如下引物,用于扩增外显子5部分片段引物序列:
F1:ACCTGGCTGGTGAATAGTGC
R1:TGACATATGGAGAGGGGTCA
(3)PCR扩增:
PCR反应体系如下:总体积20μL,10x buffer 2.0μL,25mmol·L-1Mg2+1.5μL,dNTP(10mmol·L-1)0.5μL,Taq DNA聚合酶(5U·μL-1)0.3μL,上下游引物各(10pmol·μL-1)1.0μL,模板DNA(100ng·μL-1)1.0μL,ddH2O 12.7μL。
PCR循环参数如下:
扩增片段大小为212bp(见图1)。
(4)对步骤(3)中获得的PCR产物,进行测序:
直接用ABI 9700型测序仪进行测序。对测序所得结果,用DNAMAN和Chromas软件,与参考序列(登录号:NC_007327)进行比对,并判定其基因型,结果见图2。
利用本专利设计的引物,经SSCP检测,SCD1基因在随机样品中表现出3种基因型(图2),分别命名为CC、CT和TT基因型,然后分别对不同基因型个体测序(图3)。在SCD1基因(NC_007327)在8586bp处发现一个碱基C→T的突变(C878T),导致蛋白质肽链中878位氨基酸-丙氨酸(alanine)突变为缬氨酸(valine)。根据PCR-SSCP结合质谱分析结果,以866头中国荷斯坦母牛为基础进行统计分析,CC、CT和TT的基因型频率分别为0.50、0.41和0.09,等位基因C和T的频率分别为0.703和0.297(见表1)。
表1中国荷斯坦牛SCD1 878位点基因基因频率和基因型频率分布:
实施例2
采用飞行时间质谱法(MALDI-TOF System)对以上SNP进行检测。也可采用飞行质谱方法进行快速大批量检测,且价格便宜。
此时使用分子标记引物的核苷酸序列为:
F2:ACGTTGGATGACCCCCGAGAGAATATTCTG
R2:ACGTTGGATGTAAGCAGCAGACCACTAGAC
U:ggGGTTTCCCTGGGAGCTG
PCR扩增体系及PCR扩增程序如下:
其中,所有需要分型的DNA样本都稀释到5ng/μl,取1μl DNA样本,将其与0.95μl水、0.625μl PCR缓冲液(含15mM MgCl2)、1μl 2.5mM dNTP、0.325μl的25mM MgCl2、1μl PCR引物以及0.1μl HotStar Taq酶(Qiagen)混合在一起。PCR扩增的反应条件为:94℃15分钟;94℃20秒,56℃30秒,72℃1分钟,共45个循环;最终72℃3分钟。
采用飞行质谱方法检测以上步骤中所获得的PCR产物,方法如下:
PCR扩增后,剩余的dNTP将被去磷酸消化掉,反应体系包括1.53μl水、0.17μl SAP缓冲液、0.3单位碱性磷酸酶(Sequenom)。该反应在37℃进行40分钟,然后85℃5分钟使酶失活。碱性磷酸酶处理后,针对SNP的单碱基延伸引物在下列反应体系中进行:0.755μl水、0.2μl 10X iPLEX缓冲液、0.2μl终止混合物、0.041μl iPLEX酶(Sequenom),0.804μl 10μM的延伸引物。
单碱基延伸反应在下列条件下进行:94℃30秒;94℃5秒,52℃5秒,80℃5秒5个循环,共40个循环;最后72℃3分钟。在终止反应物中加入6mg阳离子交换树脂(Sequenom)脱盐,混合后加入25μl水悬浮。使用MassARRAY Nanodispenser(Sequenom)将最终的分型产物点样到一块384孔的spectroCHIP(Sequenom)上,并用基质辅助激光解吸电离飞行时间质谱进行分析。最终结果由MassARRAY RT软件系统(版本号3.0.0.4)实时读取,并由MassARRAY Typer软件系统(版本号3.4)完成基因分型分析(见图4)。图3中,横座标为质谱分子量单位(道尔顿),纵座标为不同等位基因光强度值。SCD1-878位点检测范围在6000-6300道尔顿间,其中C基因检测分子量为6050左右,T基因检测分子量为6250左右。如在相应检测分子量处有较高的光强度值,则表示该个体具有该等位基因。如在这2个分子量处有双峰,则该个体为杂合子。如上3张图分别表示SCD1-878位点3种不同的基因型(CC、CT和TT)。
结合其泰勒虫易感性及淘汰等信息,进行Logstic回归,发现SCD1基因对奶牛泰勒虫病的易感性的影响达到极显著水平。
在全国各种公牛站进行常规奶牛育种工作中,增加本研究发现的分子标记SCD1基因C878T SNP检测,筛选其中TT型个体公牛,并与母牛进行配种,可增加其后代母牛SCD1基因C878T TT和CT型个体比例,逐渐淘汰CC型母牛个体,从而提高奶牛对泰勒虫病的抵抗性,减少该病对奶牛生产的影响,提高奶牛生产效率和经济价值。
通过logistic回归分析不同SCD1-878位点基因型与奶牛泰勒氏虫感染率的关系,结果如表2所示:
表2奶牛SCD1-878位点不同基因型泰勒虫感染情况对照表:
通过本研究结果可以看出:SCD1基因878位点SNP对奶牛泰勒虫感染的影响达到显著水平(P=0.011),CC为优势等位基因型,基因型频率为0.50;C为优势等位基因,等位基因频率计算为0.703。同时,TT型奶牛感染泰勒虫的概率仅为CC型个体的39%。
本发明首次披露了SCD1基因C878T的SNP突变位点的基因型在对奶牛泰勒虫病进行辅助选择方面的应用。相比于现有技术,本发明设计分子标记引物时使用的SCD1基因与奶牛生产性能、免疫等性状密切相关,其SNP突变标记点与奶牛泰勒虫病的感染显著相关,具有更高的准确性和可信度,因而可以有效地针对奶牛泰勒虫病的易感性对种牛进行辅助选择,以降低后代奶牛的发病率,并间接提高产值。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!