基于GSH响应的诊治一体化有机分子探针及其制备方法与流程
本发明属于有机化合物技术领域,尤其涉及一种基于GSH响应的诊治一体化有机分子探针及其制备方法。
背景技术:
目前很多药物载体都是基于EPR效应建立起来的,如聚合物纳米粒子、脂质体、二氧化硅介孔材料等;这种被动的靶向方式可以使药物更多地聚集在肿瘤组织部位,提高药效减少副作用,但却很难控制药物在肿瘤组织中的自由扩散过程,无法规避肿瘤潜在的抗药机制。此外,生物标记物的靶向配体(抗体、核酸适配体、多肽等)也已广泛应用于药物载体上;通过配体与生物标记物的特异结合作用,提高肿瘤部位药物的浓度;然而,很多肿瘤标记物在肿瘤细胞和正常细胞中均表达,且由于肿瘤的异质性,生物标记物在同一肿瘤组织的不同细胞之间的表达存在差异,将导致药物对正常细胞造成毒副作用,且不能杀死全部肿瘤细胞。此外,该类药物载体的制备过程繁琐,药物在体内的释放和作用过程周期长。因此,亟需一种不依赖被动滞留和内源性生物标记物且制备简便,药物释放快速的药物载体。肿瘤的发生和转移与肿瘤细胞的微环境有着密切关系,肿瘤与正常细胞的微环镜有较大差异,且微环境的差异是肿瘤细胞的共性,将其应用于药物输送系统的构建已受到越来越多的关注。人体中有众多含巯基的还原性化合物,如GSH,半胱氨酸,高半胱氨酸等。其中GSH含量最高,是人体内一种非常重要的还原性物质。它能抵抗氧化剂对巯基的破坏作用,保护细胞膜中含巯基的蛋白质和酶不被氧化。GSH的含量差异是肿瘤细胞与正常细胞微环境的差异之一。人体血浆中的GSH浓度较低,为1~2μM,正常组织中GSH浓度为2~20μM,肿瘤组织的GSH浓度一般比正常组织高至少2倍,在一些耐药肿瘤中,GSH过度表达可以达到约10倍。肿瘤细胞内GSH浓度更高,约为10mM,这也使得肿瘤细胞的胞质保持强的还原性环境。
但是目前的肿瘤药物载体存在却很难控制药物在肿瘤组织中的自由扩散过程,无法规避肿瘤潜在的抗药机制,对正常细胞的毒副作用较大。
技术实现要素:
本发明的目的在于提供一种基于GSH响应的诊治一体化有机分子探针及其制备方法,旨在解决但是目前的肿瘤药物载体存在却很难控制药物在肿瘤组织中的自由扩散过程,无法规避肿瘤潜在的抗药机制,对正常细胞的毒副作用较大的问题。
本发明是这样实现的,一种基于GSH响应的诊治一体化有机分子探针,所述基于GSH响应的诊治一体化有机分子探针通式如下:
其中:
Dye为花菁、罗丹明、荧光素、量子点、香豆素中的一种;
Drug为吉西他滨、阿霉素、喜树碱、紫杉醇中的一种;
R1为(CH2)p、(CH2)qO、(CH2)qNH中的一种;
R2为CH2、O、NH中的一种;
R3为CH2、O、NH中的一种;
R4为(CH2)p、O(CH2)q、NH(CH2)q中的一种;
n1、n2为1~6的整数;
(CH2)p中p为1~6的整数;
(CH2)qO、(CH2)qNH、O(CH2)q和NH(CH2)q中q为0~6的整数;
进一步,所述基于GSH响应的诊治一体化有机分子探针为一类对称五甲川菁染料CyIC,其结构式为:
其中,R5为C1-6烷基、(CH2)mOR7、(CH2)mC6H5中的一种,m为1~6的整数,R7为氢或C1-6烷基;R6为氢、甲基、羟基、卤素、硝基、苄氧基、烷氧基、水溶性基团SO3R8中的一种,所述水溶性基SO3R8中R8为氢或钠离子或钾离子;Y-为卤素离子、PF6-或TsO-中的一种;(CH2)mOR7或(CH2)mC6H5中m为1~6的整数。
本发明的另一目的在于提供一种所述基于GSH响应的诊治一体化有机分子探针的制备方法,所述基于GSH响应的诊治一体化有机分子探针的制备方法包括以下步骤:
步骤一,将巯基化合物A与巯基化合物B在碘的氧化作用下发生反应制得二硫化物C,减压旋除溶剂,高效液相色谱仪分离;其中A与B的摩尔投料比为1:5,反应温度为25℃,反应时间为15小时,反应溶剂为二氯甲烷和甲醇;
步骤二,将对称五甲川菁染料CyIC与N-羟基琥珀酰亚胺NHS在N,N’-二异丙基碳二亚胺DIC的催化条件下避光反应制得中位带活性琥珀酰亚胺的对称五甲川菁染料CyIC-NHS,用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,真空干燥即得CyIC-NHS;其中CyIC、NHS与DIC的摩尔投料比为1:40:40,反应温度为25℃,反应时间为4小时,反应溶剂为二氯甲烷和二甲基亚砜;
步骤三,将步骤一制得的二硫化物C与步骤二制得的CyIC-NHS在三乙胺的催化条件下反应制得含二硫键的五甲川菁染料CyIC-S,其中当取代基R10为羟基时,产物为CyIC-S-OH;当取代基R10为羧基时,产物取名为CyIC-S-COOH;产物用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,真空干燥即得;其中二硫化物C与CyIC-NHS的摩尔投料比为3:1,反应温度为25℃,反应时间为12小时,反应溶剂为二甲基亚砜;
步骤四,将步骤三制得的CyIC-S-OH与三光气在N,N-二异丙基乙胺DIEA的催化条件下常温反应30分钟后,加入抗肿瘤药物吉西他滨制得CyIC-GEM-1,用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,高效液相色谱仪分离;其中CyIC-S-OH、三光气与吉西他滨的摩尔投料比为3:1:3.2,反应时间为24小时,反应溶剂为四氢呋喃、N-甲基吡咯烷酮;
步骤五,将步骤三制得的CyIC-S-COOH与O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸TBTU在N,N-二异丙基乙胺DIEA的催化条件下常温反应30分钟后,加入抗肿瘤药物吉西他滨制得CyIC-GEM-2,用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,高效液相色谱仪分离;其中CyIC-S-COOH、TBTU与吉西他滨的摩尔投料比为1:3:3,反应时间为15~18小时,反应溶剂为二甲基亚砜。
进一步,所述步骤一的反应方程式为:
进一步,所述步骤二的反应方程式为:
进一步,所述步骤三的反应方程式为:
进一步,所述步骤四的反应方程式为:
所述步骤五的反应方程式为:
本发明的另一目的在于提供一种包含所述基于GSH响应的诊治一体化有机分子探针的药物载体制备方法。
本发明的另一目的在于提供一种包含所述基于GSH响应的诊治一体化有机分子探针的肿瘤药物载体制备方法。
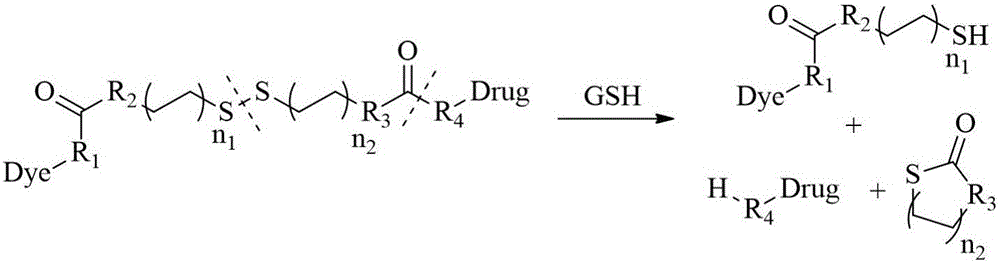
本发明提供的基于GSH响应的诊治一体化有机分子探针及其制备方法,基于二硫键(-S-S-)容易被巯基还原切断,以及肿瘤细胞与正常细胞GSH含量差异显著的特点,设计构建一类基于近红外荧光染料和肿瘤微环境的诊治一体化的分子影像探针,GSH可通过氧化还原作用切断该探针中的二硫键,释放出活性药物,可达到监测药物的传输与释放的目的。本发明合成的分子影像探针,合成过程相对简单快速,具有巨大的应用潜力;提供的一类诊治一体化有机小分子荧光探针的制备方法,其思路新颖可行、反应步骤简单、操作流程清晰,并且将分子影像探针与抗癌前药相结合,通过设计合理的结构,既可实现对肿瘤的靶向检测,也能实现靶向治疗肿瘤的效果,同时能监测前药在生物体内的生物分布,以及活性药物的释放过程,对研究药物的作用机制、肿瘤的抗药性机理等具有重大意义。本发明的制备思路及方法为肿瘤的原位实时诊疗提供一类新型的荧光探针,通过氧化还原作用,肿瘤组织内高浓度的还原型谷胱甘肽(GSH)可切断该探针中的二硫键,释放出活性药物SN-38,并引发花菁染料的荧光变化,从而实现肿瘤诊治一体化的目的,为研究肿瘤的抗药性机制以及抗癌药的作用机理提供巨大帮助。
附图说明
图1是本发明实施例提供的基于GSH响应的诊治一体化有机分子探针的制备方法流程图。
图2是本发明实施例提供的GSH切断诊治一体化探针中的二硫键并释放药物及荧光基团的原理图。
图3是本发明实施例提供的2-((2-氨基乙基)二硫基)-1-乙醇(化合物C1)质谱分析图。
图4是本发明实施例提供的2-((2-氨基乙基)二硫基)-1-乙酸(化合物C2)质谱分析图。
图5是本发明实施例提供的CyIC-S-OH质谱分析图。
图6是本发明实施例提供的CyIC-S-COOH质谱分析图。
图7是本发明实施例提供的CyIC-GEM-1质谱分析图。
图8是本发明实施例提供的CyIC-GEM-2质谱分析图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
本发明实施例的基于GSH响应的诊治一体化有机分子探针具有如下结构通式Ⅰ:
其中:
Dye为花菁、罗丹明、荧光素、量子点或香豆素等荧光标记染料,如CyIC、Cy3、Cy5、Cy5.5、Cy7、ICG、ICG-Der-01、ICG-Der-02、ICG-Der-03、IR820、Alexa Fluor 750、Alexa Fluor 700、Alexa Fluor 680、Alexa Fluor 660、Alexa Fluor 647、Alexa Fluor 635、Alexa Fluor 633、Alexa Fluor 610、Alexa Fluor 594、Alexa Fluor 568、Alexa Fluor 555、Alexa Fluor 546、Alexa Fluor 532、Alexa Fluor 514、Alexa Fluor 500、Alexa Fluor 488、FITC等。
Drug为吉西他滨、阿霉素、喜树碱、紫杉醇等抗肿瘤药物。
R1为(CH2)p、(CH2)qO或(CH2)qNH。
R2为CH2、O、NH。
R3为CH2、O、NH。
R4为(CH2)p、O(CH2)q或NH(CH2)q。
R5为C1-6烷基、(CH2)mOR7或(CH2)mC6H5。
R6为氢、甲基、羟基、卤素、硝基、苄氧基、烷氧基或水溶性基团SO3R8。
R7为氢或C1-6烷基。
水溶性基SO3R8中R8为氢或钠离子或钾离子。
Y-为卤素离子、PF6-或TsO-。
n1、n2为1~6的整数。
(CH2)p中p为1~6的整数。
(CH2)qO、(CH2)qNH、O(CH2)q和NH(CH2)q中q为0~6的整数。
(CH2)mOR7或(CH2)mC6H5中m为1~6的整数。
Dye为花菁荧光标记探针。
花菁荧光标记探针为一类对称五甲川菁染料CyIC。
Drug为吉西他滨。
R1为(CH2)p;(CH2)p中p为1;R2为NH;R3为CH2、O;R4为O(CH2)q或NH(CH2)q;O(CH2)q或NH(CH2)q中q为0;R5为C1-6烷基;C1-6烷基为CH3、CH2CH3、CH2CH2CH3;R6为水溶性基团SO3R8;水溶性基团SO3R8的R8为钾离子K+。
如图1所示,本发明实施例的基于GSH响应的诊治一体化有机分子探针的制备方法包括以下步骤:
S101:将巯基化合物A与巯基化合物B在碘的氧化作用下发生反应制得二硫化物C,减压旋除溶剂,高效液相色谱仪分离;其中A与B的摩尔投料比为1:5,反应温度为25℃,反应时间为15小时,反应溶剂为二氯甲烷和甲醇;
S102:将对称五甲川菁染料CyIC与N-羟基琥珀酰亚胺NHS在N,N’-二异丙基碳二亚胺DIC的催化条件下避光反应制得中位带活性琥珀酰亚胺的对称五甲川菁染料CyIC-NHS,用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,真空干燥即得CyIC-NHS,;其中CyIC、NHS与DIC的摩尔投料比为1:40:40,反应温度为25℃,反应时间为4小时,反应溶剂为二氯甲烷和二甲基亚砜;
S103:将步骤S101制得的二硫化物C与步骤S102制得的CyIC-NHS在三乙胺的催化条件下反应制得含二硫键的五甲川菁染料CyIC-S,其中当取代基R10为羟基时,产物进一步取名为CyIC-S-OH;当取代基R10为羧基时,产物取名为CyIC-S-COOH。产物用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,真空干燥即得;其中二硫化物C与CyIC-NHS的摩尔投料比为3:1,反应温度为25℃,反应时间为12小时,反应溶剂为二甲基亚砜;
S104:将步骤S103制得的CyIC-S-OH(此处取代基R10为羟基)与三光气在N,N-二异丙基乙胺DIEA的催化条件下常温反应30分钟后,加入抗肿瘤药物吉西他滨制得CyIC-GEM-1,用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,高效液相色谱仪分离;其中CyIC-S-OH、三光气与吉西他滨的摩尔投料比为3:1:3.2,反应时间为24小时,反应溶剂为四氢呋喃、N-甲基吡咯烷酮;
S105:将步骤S103制得的CyIC-S-COOH(此处取代基R10为羧基)与O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸TBTU在N,N-二异丙基乙胺DIEA的催化条件下常温反应30分钟后,加入抗肿瘤药物吉西他滨制得CyIC-GEM-2,用无水乙醚与干燥的乙酸乙酯洗涤3~5次得沉淀,高效液相色谱仪分离;其中CyIC-S-COOH、TBTU与吉西他滨的摩尔投料比为1:3:3,反应时间为15~18小时,反应溶剂为二甲基亚砜;
下面结合具体实施例对本发明的应用原理作进一步的描述。
实施例1
化合物C1和化合物C2的制备:
(1)2-((2-氨基乙基)二硫基)-1-乙醇(化合物C1)的合成,反应方程式为:
在100mL茄形瓶中加入1.5g(19.48mmol)β-巯基乙醇,30mL甲醇,30mL二氯甲烷,然后逐批加入7.5g(97.5mmol)2-氨基乙基硫醇,室温搅拌3h,然后加入用甲醇溶解的0.75g(2.95mmol)碘,室温搅拌12小时,减压旋除溶剂,高效液相色谱仪分离,得黄色油状物质即为产物,产率为37.2%。产物结构鉴定的质谱如图3所示,数据分析如下:
化合物C1:Calculated Mr=153for C4H11NOS2,found m/z=154([Mr+H+])。
(2)2-((2-氨基乙基)二硫基)-1-乙酸(化合物C2)的合成反应方程式为:
在100mL茄形瓶中加入0.5g(6.50mmol)2-氨基乙基硫醇,15mL甲醇,15mL二氯甲烷,然后逐批加入2.8mL(32.5mmol)巯基丙酸,室温搅拌3h,然后加入用甲醇溶解的0.25g(0.98mmol)碘,室温搅拌12小时,减压旋除溶剂,高效液相色谱仪分离,得白色粉末状物质即为产物,产率为18.7%。产物结构鉴定的质谱如图4所示,数据分析如下:
化合物C2:Calculated Mr=181for C5H11NO2S2,found m/z=182([Mr+H+])。
实施例2
中位带活性琥珀酰亚胺的对称五甲川菁染料CyIC-NHS的制备:
将2.0mg(2.28μmol)CyIC,11.5mg(91.2μmol)N,N’-二异丙基碳二亚胺,10.5mg(91.2μmol)N-羟基琥珀酰亚胺,加入2mL冻存管中,溶剂选用超干二甲基亚砜与二氯甲烷,溶液总体积600μL,室温避光搅拌4小时。反应结束后,向溶液中加入无水乙醚,有沉淀析出,离心,倒去上清液,再用经过无水硫酸镁干燥的乙酸乙酯洗涤沉淀3~5次,真空干燥即得CyIC-NHS,产率为95%。
实施例3
化合物CyIC-S-OH的制备:
将1.11mg(1.14μmol)CyIC-NHS,0.52mg(3.42μmol)2-((2-氨基乙基)二硫基)-1-乙醇(化合物C1),加入2mL冻存管中,溶剂选用超干二甲基亚砜,再加入10μL三乙胺催化,溶液总体积600μL,室温避光搅拌12小时。反应结束后,向溶液中加入无水乙醚,有沉淀析出,离心,倒去上清液,再用经过无水硫酸镁干燥的乙酸乙酯洗涤沉淀3~5次,真空干燥即得CyIC-S-OH。产率64.2%。产物结构鉴定的质谱如图5所示,数据分析如下:
CyIC-S-OH:Calculated Mr=808 for C36H46N3O8S5,found m/z=810([Mr+2H+])。
实施例4
化合物CyIC-S-COOH的制备:
将1mg(1.05μmol)CyIC-NHS,0.64mg(3.15μmol)2-((2-氨基乙基)二硫基)-1-乙酸(化合物C2),加入2mL冻存管中,溶剂选用超干二甲基亚砜,再加入10μL三乙胺催化,溶液总体积500μL,室温避光搅拌12小时。反应结束后,向溶液中加入无水乙醚,有沉淀析出,离心,倒去上清液,再用经过无水硫酸镁干燥的乙酸乙酯洗涤沉淀3~5次,真空干燥即得CyIC-S-COOH。产物结构鉴定的质谱如图6所示,数据分析如下:
CyIC-S-COOH:Calculated Mr=808 for C36H46N3O8S5,found m/z=810([Mr+2H+])。
实施例5
诊治一体化有机小分子荧光探针CyIC-GEM-1的制备:
将实施例3制得的1.02mg(1μmol)CyIC-S-OH溶于200μL N-甲基吡咯烷酮,加入0.5μL的N,N-二异丙基乙胺DIEA,在氮气保护下滴加入溶于四氢呋喃的三光气(0.10mg,0.33μmol)常温反应30分钟后,加入0.28mg(1.07μmol)吉西他滨室温避光反应24小时。反应结束后,向溶液中加入无水乙醚,有沉淀析出,离心,倒去上清液,再用经过无水硫酸镁干燥的乙酸乙酯洗涤沉淀3~5次,高效液相色谱仪分离,真空干燥即得CyIC-GEM-1。产物结构鉴定的质谱如图7所示,数据分析如下:
CyIC-GEM-1:Calculated Mr=1097for C46H55F2N6O13S5,found m/z=1097(Mr)。
实施例6
诊治一体化有机小分子荧光探针CyIC-GEM-2的制备:
将实施例4制得的1.05mg(1μmol)CyIC-S-COOH溶于200μL二甲基亚砜,加入1mg(3μmol)O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸TBTU和0.5μL的N,N-二异丙基乙胺DIEA,常温反应30分钟后,加入0.75mg(3μmol)吉西他滨室温避光反应18小时。反应结束后,向溶液中加入无水乙醚,有沉淀析出,离心,倒去上清液,再用经过无水硫酸镁干燥的乙酸乙酯洗涤沉淀3~5次,高效液相色谱仪分离,真空干燥即得CyIC-GEM-2。产物结构鉴定的质谱如图8所示,数据分析如下:
CyIC-GEM-2:Calculated Mr=1053 for C44H51F2N6O12S5,found m/z=1093([Mr+K++H+])。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!