部分中性单链寡核苷酸的制作方法
本发明涉及一种分子检测技术。更确切地说,本发明涉及部分中性单链寡核苷酸。
背景技术:
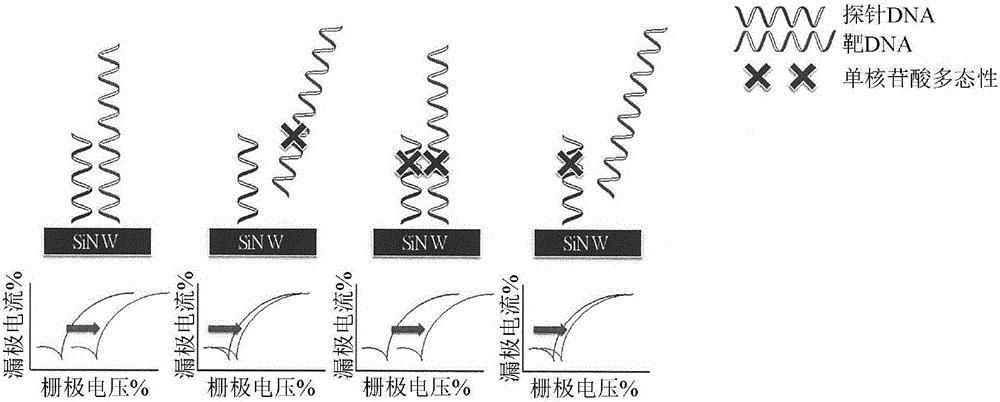
:分子检测在临床诊断和分子生物学研究方面起重要作用。已研发出若干系统来进行分子检测,以便检测和/或鉴别样品中的靶生物分子。其中,根据沃森-克里克碱基配对规则,在检测和/或鉴别具有特异性核苷酸序列的标靶时使用单链寡核苷酸。详细地说,标靶的检测和/或鉴别通常涉及区分单一碱基变异体的能力。通常,为了在一个操作中进行多次检测和/或鉴别,在一个微阵列衬底上涂布若干单链寡核苷酸以杂交荧光标记的样品混合物。在此类微阵列中,在每次检测和/或鉴别中必须调节操作条件,如用于杂交各单链寡核苷酸的温度。此外,灵敏度和特异性对于微阵列避免任何假信号来说是重要的。增强灵敏度和特异性的最适用的途径是提高杂交温度,其与单链寡核苷酸的熔融温度(Tm)高度相关。熔融温度定义为一半寡核苷酸链呈随机卷曲或单链状态所处的温度。熔融温度取决于寡核苷酸和其特异性核苷酸序列的长度。已研发出若干经修饰的寡核苷酸来提高熔融温度。举例来说,已经公开肽核酸(PNA)(尼耳森(Nielsen)PE,埃格霍尔姆(Egholm)M,伯格(Berg)RH,布恰特(Buchardt)O,1991.“通过经胸腺嘧啶取代的聚酰胺的链置换的DNA序列选择性识别(Sequence-selectiverecognitionofDNAbystranddisplacementwithathymine-substitutedpolyamide).”科学(Science)254(5037):1497-500),并且PNA的主链包含通过肽键连接的重复N-(2-氨基乙基)-甘氨酸单元。各种嘌呤和嘧啶碱基通过亚甲基桥(-CH2-)和羰基(-(C=O)-)连接到主链。因为PNA主链不含带负电的磷酸酯基,由于不具有静电排斥力,PNA与DNA链之间的结合比DNA与DNA链之间的结合更强。不幸的是,这也使得其实际上是疏水性的,从而使其难以溶液状态施加。此外,鉴于带有替代磷酸酯键的肽键的PNA,因为肽键具有双键的特征,PNA的结构灵活性受限制。当将PNA与针对各种应用的不同靶分子结合时,难以实现稳定构象。还研发出吗啉基,也被称作吗啉基寡聚物和二氨基磷酸盐吗啉基寡聚物(PMO)(萨默顿(Summerton),J;威勒(Weller)D,1997.“吗啉基反义寡聚物:设计、制备和特性(MorpholinoAntisenseOligomers:Design,PreparationandProperties).”反义和核酸药物研发(Antisense&NucleicAcidDrugDevelopment)7(3):187-95)。PMO的结构具有含亚甲基吗啉环和二氨基磷酸盐键的主链。因为是完全非天然主链,PMO无法被细胞蛋白质,如酶识别,中的其限制涉及蛋白质结合以及酶识别的应用。锁核酸(LNA)以经修饰的RNA核苷酸形式提供(奥比卡聪(SatoshiObika);南部代数(DaishuNanbu);哈里能幸(YoshiyukiHari);森尾健一郎(Ken-ichiroMorio);寅康子(YasukoIn);石田敏正(ToshimasaIshida);今西武(TakeshiImanishi),1997.“合成2'-O,4'-C-亚甲基尿苷和胞苷(Synthesisof2'-O,4'-C-methyleneuridineand-cytidine).具有固定C3'-内糖褶皱的新颖双环核苷(NovelbicyclicnucleosideshavingafixedC3'-endosugarpuckering).”四面体通讯(TetrahedronLett.)38(50):8735-8)。LNA核苷酸的核糖部分用连接2'氧和4'碳的额外桥修饰。桥“锁住”3'-内(北)构象中的核糖,其通常见于A形式双螺旋体中。锁定的核糖构象增强碱基堆叠和主链预组织。这显著提高了寡核苷酸的熔融温度。然而,LNA的普及性受到其合成化学和设计并合成LNA的价格限制。US2014/0235465A1公开了中和DNA(nDNA)。磷酸酯主链上所有的带电氧离子(O-)都已经烷基化,以使得主链是完全电中性的。这一修饰提高了互补单链DNA之间的杂交效率并且使杂交所需的盐减到最少,使得检测灵敏度更高。然而,施加到杂交的nDNA未产生令人满意的特异性,并且在针对规则DNA杂交条件的盐浓度下发生非特异性杂交。已使用场效应晶体管(FET)来检测和/或鉴别靶寡核苷酸以及抗体-抗原结合,其两者都受益于不存在试剂标记要求和FET传感器的市售制造来源的简便可用性。FET传感器的灵敏度高度取决于晶体管表面与实际检测分子之间的检测距离(德拜长度(debye))。在灵敏度方面,大多数现用类型的FET作为基因检测装置是不能令人满意的。这主要是由于对DNA/DNA或DNA/RNA杂交的相对较高盐浓度的要求。带较多电荷的生物分子的杂交需要适当的离子强度来抑制电荷排斥力。不幸的是,杂交缓冲液中的离子也会减小FET德拜长度并且因此削弱检测灵敏度。在抗体-抗原结合检测的情况下,相比于其它生物分子,尺寸较大的抗体也会降低FET的检测灵敏度。抗体的表面电荷分布和结合的抗体的结合定向使得难以解决FET检测和定量分析。另外,结合缓冲液中的盐的介质浓度也会减小德拜长度,并且转而还会降低检测灵敏度。技术实现要素:为了改进检测灵敏度和特异性,提供一种无标记检测方法。本发明提供一种部分中性单链寡核苷酸,其包含至少一个电中性核苷酸和至少一个带负电核苷酸。本发明还提供包含如上文所提及的部分中性单链寡核苷酸的检测单元。本发明还提供包含多个如上文所提及的检测单元的检测系统。本发明还提供一种检测方法,其包含用如上文所提及的检测单元进行检测。在以下部分中详细描述本发明。本发明的其它特征、目的和优点可发现于具体实施方式和权利要求书中。附图说明图1显示根据本发明的电中性核苷酸的一个优选实施例。图2显示在用于杂交检测的FET中使用部分中性单链寡核苷酸的示意图。图3显示在用于杂交检测的FET中使用部分中性单链寡核苷酸作为回收探针的示意图。图4显示在用于杂交检测的FET中使用部分中性单链寡核苷酸作为回收探针和纳米金粒子作为信号放大器的示意图。图5显示在FET中根据本发明的部分中性单链寡核苷酸的离子强度作用结果。图6显示在FET中在检测不同靶浓度时,根据本发明的部分中性单链寡核苷酸的结果。图7显示在FET中在检测超低靶浓度时,根据本发明的部分中性单链寡核苷酸的结果。图8A和8B显示使用DNA(8A)和根据本发明的部分中性单链寡核苷酸(8B)的聚合酶链反应的结果。图9显示使用DNA和根据本发明的部分中性单链寡核苷酸的定量聚合酶链反应的结果。图10A到10C显示通过原位杂交,使用DNA(miR-524-5pDNA探针)检测miRNA的结果。图10A显示在1.5ng/μl浓度下的细胞表达阴性miRNA和miR-524-5pDNA探针。图10B和图10C显示在0.3ng/μl(图10B)和1.5ng/μl(图10C)的浓度下的细胞表达模拟miR-524-5p和miR-524-5p探针。图11A到11C显示通过原位杂交,使用nDNA(miR-524-5p全(All)nDNA探针)检测miRNA的结果。图11A显示在1.5ng/μl浓度下的细胞表达阴性miRNA和miR-524-5pnDNA探针。图11B和图11C显示在0.3ng/μl(图11B)和1.5ng/μl(图11C)的浓度下的细胞表达模拟miR-524-5p和miR-524-5p探针。图12A到12C显示通过原位杂交,使用部分中性单链寡核苷酸(miR-524-5p7nDNA探针)检测miRNA的结果。图12A显示在1.5ng/μl浓度下的细胞表达阴性miRNA和miR-524-5p7nDNA探针。图12B和图12C显示在0.3ng/μl(图12B)和1.5ng/μl(图12C)的浓度下的细胞表达模拟miR-524-5p和探针。图13A到13C显示通过原位杂交,使用LNA(miR-524-5pLNA探针)检测miRNA的结果。图13A显示在1.5ng/μl浓度下细胞表达阴性miRNA和miR-524-5pLNA探针。图13B和图13C显示在0.3ng/μl(图13B)和1.5ng/μl(图13C)的浓度下的细胞表达模拟miR-524-5p和探针。图14显示通过FET,在miRNA检测中,根据本发明的部分中性单链寡核苷酸的结果。具体实施方式本发明提供一种部分中性单链寡核苷酸,其包含至少一个电中性核苷酸和至少一个带负电核苷酸。如本文所使用,术语“寡核苷酸”是指核苷酸寡聚物。术语“核苷酸”是指由含氮碱基、糖和一或多个磷酸酯基;优选一个磷酸酯基构成的有机分子。含氮碱基包括嘌呤或嘧啶的衍生物。嘌呤包括经取代或未经取代的腺嘌呤和经取代或未经取代的鸟嘌呤;嘧啶包括经取代或未经取代的胸腺嘧啶、经取代或未经取代的胞嘧啶和经取代或未经取代的尿嘧啶。糖优选是五碳糖,更优选经取代或未经取代的核糖或经取代或未经取代的去氧核糖。磷酸酯基与糖的2碳、3碳或5碳;优选与5碳位点形成键。为了形成寡核苷酸,通过磷酸二酯桥,将一个核苷酸的糖与相邻糖接合。可以基于本发明的公开内容,按需要选择部分中性单链寡核苷酸的恰当形式。优选地,部分中性单链寡核苷酸是DNA或RNA;更优选是DNA。根据本发明的部分中性单链寡核苷酸包含至少一个电中性核苷酸和至少一个带负电核苷酸。使核苷酸呈电中性的方式不受限制。在本发明的一个实施例中,电中性核苷酸包含经烷基取代的磷酸酯基。优选地,烷基是C1-C6烷基;更优选地,烷基是C1-C3烷基。C1-C3烷基的实例包括(但不限于)甲基、乙基和丙基。图1显示根据本发明的电中性核苷酸的一个优选实施例。磷酸酯基中的带负电氧原子改变为不具有电荷的中性原子。用烷基取代磷酸酯基的方式可以根据普通化学反应应用。根据本发明的带负电核苷酸包含具有至少一个负电荷的磷酸酯基。未经修饰的核苷酸优选是不具有修饰或取代的天然存在的核苷酸。在本发明的一个优选实施例中,带负电核苷酸包含未经取代的磷酸酯基。根据本发明的部分中性单链寡核苷酸被部分赋予电中性。序列或长度不受限制,并且部分中性单链寡核苷酸的序列或长度可以根据靶分子,基于本发明的公开内容进行设计。电中性核苷酸和带负电核苷酸的数目取决于部分中性单链寡核苷酸的序列和待检测反应所处的条件。电中性核苷酸和带负电核苷酸的位置也取决于部分中性单链寡核苷酸的序列和待检测反应所处的条件。可以根据可用信息,基于本发明的公开内容,设计电中性核苷酸和带负电核苷酸的数目和位置。举例来说,可以通过基于双链(ds)结构能量的分子建模计算设计任何探针中的电中性核苷酸的数目和位置,并且可以接着参考结构能量测定dsDNA/DNA或dsDNA/RNA的熔融温度(Tm)。在本发明的一个优选实施例中,部分中性单链寡核苷酸包含多个电中性核苷酸,并且至少一个带负电核苷酸安置在两个电中性核苷酸之间;更优选地,至少两个带负电核苷酸安置在两个电中性核苷酸之间。在本发明的一个优选实施例中,当在检测和/或鉴别单一碱基变异体过程中应用根据本发明的部分中性单链寡核苷酸时,靠近单一碱基变异体安置至少一个电中性核苷酸;更优选地,靠近单一碱基变异体安置2、3、4或5个电中性核苷酸。在另一个方面中,至少一个电中性核苷酸安置在单一碱基变异体的下游或上游位点;优选地,至少一个电中性核苷酸安置在单一碱基变异体的下游和上游位点。通过引入电中性核苷酸,相比于常规DNA探针,根据本发明的部分中性单链寡核苷酸的完美匹配双链寡核苷酸与不匹配双链寡核苷酸之间的熔融温度差异更高。不受理论限制,可推测,两条链之间的静电排斥力通过引入中性寡核苷酸而减小,并且熔融温度从而升高。通过控制电中性核苷酸的数目和位置,将熔融温度差异调节到所需点,提供较佳工作温度或温度范围以区分完美匹配和不匹配寡核苷酸,从而改进检测特异性。此类设计有益于整合到一个芯片或阵列中的不同部分中性单链寡核苷酸的熔融温度的一致性。待检测反应数目可以随着较高特异性而显著升高,并且更多检测单元可以并入到单一检测系统中。所述设计提供较佳微阵列操作条件。本发明还提供包含如上文所提及的部分中性单链寡核苷酸的检测单元。如本文所使用,术语“检测”是指发现或测定靶分子的存在(existence或presence)的方法,并且优选地,鉴别靶分子的方法。在本发明的一个优选实施例中,检测包含定量样品中的靶分子。检测中应用的反应包括(但不限于)寡核苷酸分子之间的杂交、蛋白质-蛋白质相互作用、受体-配体结合、寡核苷酸-蛋白质相互作用、多糖-蛋白质相互作用或小分子-蛋白质相互作用。本发明还提供包含多个如上文所提及的检测单元的检测系统。如本文所使用,术语“单元”是指用于进行检测中应用的反应的组件。优选地,所述单元用于进行单一反应。在本发明的一个优选实施例中,一个系统中所含有的若干单元在一个操作中进行若干检测。举例来说,多个检测单元可以并入在一个检测系统中。优选地,检测系统是微阵列或芯片。如本文所使用,术语“分子”是指小分子或大分子。优选地,分子为大分子,如蛋白质、肽、核苷酸、寡核苷酸或聚核苷酸。分子是天然存在的或人工的。在另一个方面中,分子经纯化或与其它内容物混合。在本发明的一个优选实施例中,分子的表达模式在正常条件与异常条件(如疾病)下不同。在本发明的另一个优选实施例中,分子的表达模式在不同细胞类型中不同。在本发明的又一个优选实施例中,分子为DNA分子、RNA分子、抗体、抗原、酶、底物、配体、受体、细胞膜相关蛋白或细胞表面标记物。DNA分子优选为基因或未转录区。RNA分子优选为mRNA、微RNA、长非翻译RNA、rRNA、tRNA或siRNA。本文所使用的术语“靶分子”是指待从分子库中检测或鉴别出的指定分子。根据本发明的样品衍生自天然存在的来源或衍生自人工操作。优选地,样品衍生自天然存在的来源,如提取物、体液、组织活检、液体活检、细胞培养物。在另一个方面中,样品根据检测所需的反应处理。举例来说,可以调节样品的pH值或离子强度。检测单元中根据本发明的部分中性单链寡核苷酸可以溶液形式呈现或连接到载体上。在本发明的一个优选实施例中,检测单元进一步包含固体表面;并且部分中性单链寡核苷酸连接在所述固体表面上或位于所述固体表面附近。如本文所使用,术语“固体表面”是指固体载体,包括(但不限于)聚合物、纸、织物或玻璃。采用的固体表面取决于待检测的反应信号而变化。举例来说,当检测采用场效应晶体管监测信号时,固体表面是场效应晶体管的晶体管表面;当检测采用表面等离子体共振时,固体表面是表面等离子体共振的金属表面;当检测采用微阵列检测系统时,固体表面是微阵列的衬底表面。在本发明的一个优选实施例中,固体表面的材料是硅;优选多晶硅或单晶硅;更优选多晶硅。多晶硅比单晶硅更便宜,但由于多晶具有更多晶界,通常在晶界中出现阻碍电子转导的缺陷。此类现象使得固体表面不均匀并且难以定量。此外,离子可能穿透到多晶的晶界中并且引起溶液中的检测失效。另外,多晶硅在空气中不稳定。然而,上述缺点将不会干扰根据本发明的检测单元的功能。在本发明的一个实施例中,检测单元进一步包含信号检测组件。应用信号检测组件以便检测在部分中性单链寡核苷酸与靶分子之间是否发生杂交和/或结合。优选地,检测组件是场效应晶体管、表面等离子体共振、显微镜、光谱仪、电泳装置或电化学传感器。在本发明的一个实施例中,参考图2,当DNA或RNA的靶分子与部分中性单链寡核苷酸杂交以形成复合物时,电荷相比于部分中性单链寡核苷酸发生改变,因为DNA或RNA的靶分子带有丰富的负电荷。如果部分中性单链寡核苷酸与靶分子之间发生不匹配,如单核苷酸多态性检测,那么不会形成复合物。信号检测组件用于检测电荷改变并且监测杂交是否发生。信号检测组件通常与固体表面整合以便于检测固体表面的电压。本领域技术人员能够设计根据本发明的检测组件。在本发明的一个优选实施例中,部分中性单链寡核苷酸包含连接到固体表面的第一部分;第一部分的长度是部分中性单链寡核苷酸的总长度的约50%;并且第一部分包含至少一个电中性核苷酸和至少一个带负电核苷酸;更优选地,第一部分的长度是部分中性单链寡核苷酸的总长度的约40%;再更优选地,第一部分的长度是部分中性单链寡核苷酸的总长度的约30%。在本发明的一个优选实施例中,部分单链核苷酸进一步包含靠近第一部分的第二部分。第二部分位于相对于固体表面的远端。第二部分包含至少一个电中性核苷酸和至少一个带负电核苷酸。电中性核苷酸和带负电核苷酸的描述与第一部分的描述相同并且在本文中不再重复。连接部分中性单链寡核苷酸和固体表面的方式取决于固体表面的材料和部分中性单链寡核苷酸的类型。在本发明的一个实施例中,部分中性单链寡核苷酸经由共价键连接到固体表面。共价键的实例包括(但不限于)以下方法,其取决于固体表面化学性质和寡核苷酸的修饰。在本发明的一个实施例中,当使用氧化硅作为固体表面时,固体表面通过使用(3-氨丙基)三乙氧基硅烷(APTES)修饰。APTES的分子中的硅原子进行与羟基的氧原子的共价结合并且其将表面的硅烷醇基团(SiOH)转化成胺;接着部分中性单链寡核苷酸的5'-氨基通过戊二醛与固体表面胺基共价结合(罗伊以利拿单(RoeyElnathan),莫里亚奎亚特(MoriaKwiat),亚历山大佩夫兹纳(AlexanderPevzner),约尼恩格尔(YoniEngel),拉里萨伯斯坦(LarisaBurstein)阿尔蒂姆卡其托林茨(ArtiumKhatchtourints),阿米尔利希滕斯坦(AmirLichtenstein),赖莎坎塔艾夫(RaisaKantaev)和费尔南多帕托斯基(FernandoPatolsky),生物识别层工程改造:克服基于纳米线的FET装置的筛选限度(BiorecognitionLayerEngineering:OvercomingScreeningLimitationsofNanowire-BasedFETDevices),纳米快报(Nanoletters),2012,12,5245-5254)。在本发明的一个其它实施例中,固体表面修饰为自组装单层分子,所述分子具有用于通过各种化学反应共价连接到部分中性单链寡核苷酸的不同官能基的不同官能基(斯里瓦塔萨文卡塔苏巴劳(SrivatsaVenkatasubbarao),微阵列状态和展望(Microarrays-statusandprospects),生物技术趋势(TRENDSinBiotechnology)第22卷第12期2004年12月;金基秀(KiSuKim),李贤胜(Hyun-SeungLee),杨晶雅(Jeong-AYang),周文浩(Moon-HoJo)以及韩赛光(SeiKwangHahn),适体官能化Si-纳米线FET生物传感器的制造、表征和应用(Thefabrication,characterizationandapplicationofaptamer-functionalizedSi-nanowireFETbiosensors),纳米技术(Nanotechnology)20(2009))。在本发明的一个其它优选实施例中,部分中性单链寡核苷酸位于固体表面附近。鉴于应用检测组件以便监测固体表面的电压变化,部分中性单链寡核苷酸并不必须直接结合到固体表面,其限制条件是部分中性单链寡核苷酸与固体表面之间的距离足够短以允许检测组件检测电压变化。优选地,固体表面与部分中性单链寡核苷酸之间的距离为约0到约10nm;更优选约0到约5nm。在本发明的一个优选实施例中,根据本发明的检测单元进一步包含信号放大器。根据本发明的信号放大器优选是指增强固体表面的电压变化的检测的组件。举例来说,信号放大器是连接到部分中性单链寡核苷酸一端的纳米金粒子。在本发明的一个优选实施例中,检测单元进一步包含离子强度低于约50mM;更优选低于约40mM、30mM、20mM或10mM的缓冲液。不受理论限制,可推测,通过应用部分中性单链寡核苷酸,部分中性单链寡核苷酸与靶DNA或RNA分子之间的杂交可以发生,而不需要抑制部分带电半中性单链寡核苷酸与其标靶之间的静电排斥力。接着通过每条链的碱基配对和堆叠力驱动杂交。因此,杂交可以在较低盐条件下进行。在FET的情况下,较低离子强度提高检测长度(德拜长度),并且转而增强检测灵敏度。在本发明的一个优选实施例中,检测单元进一步包含用于扩展检测单元应用的生物分子。生物分子的实例包括(但不限于)单链DNA分子、单链RNA分子、多肽或蛋白质。在本发明的一个更优选实施例中,检测单元进一步包含连接到部分中性单链寡核苷酸的蛋白质。本领域技术人员可以例如通过特异性亲和性结合完成蛋白质与部分中性单链寡核苷酸之间的连接。经由连接到各种蛋白质,检测系统用作对于检测与所连接的蛋白质的靶相互作用具有改进的杂交特异性的蛋白质芯片。在本发明的另一个实施例中,参考图3,检测单元进一步包含单链DNA作为直探针,并且部分中性单链寡核苷酸用作回收探针。作为直探针的单链DNA可以是经修饰的信号链DNA或未经修饰的单链DNA;优选为部分中性单链DNA。回收探针和直探针都对标靶具有结合亲和性;更优选地,回收探针与直探针相比,对标靶具有更高亲和性。回收探针与直探针竞争用直探针和标靶形成的复合物。此类置换可以例如用场效应晶体管容易地观测到。在本发明的一个实施例中,直探针经设计以检测标靶的存在,并且回收探针经设计以检测单核苷酸多态性与不匹配核苷酸的存在。直探针首先与标靶形成复合物,并且回收探针接着结合到复合物中的标靶。监测信号以检测回收探针与标靶之间是否存在不匹配。在本发明的一个更优选实施例中,参考图4,回收探针连接到用于扩增信号的纳米金粒子。本发明还提供一种检测方法,其包含用如上文所提及的检测单元进行检测。提供根据本发明的方法的各种应用。检测包括(但不限于)非标记基因表达、聚合酶链反应、原位杂交、单核苷酸多态性(SNP)检测、RNA检测、DNA结合蛋白质和蛋白质检测。确切地说,通过应用根据本发明的检测单元,可以在不扩增聚合酶链反应中的靶分子的情况下在样品中检测到极少量的靶分子。检测优选包含在样品中检测小于10-9摩尔浓度的标靶,并且方法不含聚合酶链反应。在本发明的一个实施例中,相比于常规检测,主要在FET检测的两个方面中可见基因检测的改进的杂交特异性。第一,完美匹配与不匹配之间的熔融温度差异更高。第二,缓冲液具有较低盐条件,并且FET检测长度(德拜长度)增加。这些差异都导致检测灵敏度的改进。在本发明的再另一个实施例中,被设计在场效应晶体管微阵列或表面等离子体共振微阵列上的部分中性单链寡核苷酸以非标记并且高通量方式提供定量的基因表达、蛋白质和SNP检测。提供以下实例来帮助本领域技术人员实践本发明。实例实例1:合成部分中性单链寡核苷酸脱氧胞苷(n-ac)对甲氧基亚磷酰胺、胸苷对甲氧基亚磷酰胺、脱氧鸟苷(n-ibu)对甲氧基亚磷酰胺和脱氧腺苷(n-bz)对甲氧基亚磷酰胺(全部购自美国化学基因公司(ChemGenesCorporation,USA))用于根据基于固相磷酸三酯合成的给定顺序或通过应用生物系统公司(AppliedBiosystems)3900高通量DNA合成器(由Biosci&Tech或使命生物技术(MissionBiotech)提供)合成寡核苷酸。合成的寡核苷酸以弱碱性在甲苯中在室温下反应24小时,并且样品经受离子交换色谱以将pH值调节到7。在样品经浓缩和干燥之后,获得部分中性单链寡核苷酸。实例2:FET检测中应用的部分中性单链寡核苷酸互补H1:5'-CCATTGTGACTGTCCTCAAGTAGGTTGACAGAGTGTG-3'(SEQIDNo.1)非互补H5:5'-TGATAACCAATGCAGATTTG-3'(SEQIDNo.2)DNA探针:5'-NH2-C6-CACACTCTGTCAACCTAC-3'(SEQIDNo.3)nDNA探针:5'-NH2-C6-CACACTCTGTCAACCTAC-3'(全部中性)(SEQIDNo.4)部分中性单链探针1(下文称为“经修饰的1”):5'-NH2-C6-CnACnACnTCnTGnTCAACCTAC-3'(SEQIDNo.5)部分中性单链探针2(下文称为“经修饰的2”):5'-NH2-C6-CnACAnCTCnTGTnCAACCTAC-3'(SEQIDNo.6)上标n表示电中性核苷酸。用于探针固定的表面修饰通过SiNW表面层(SiO2)的官能化进行探针固定。首先,使用(3-氨丙基)三乙氧基硅烷(APTES)来修饰表面。APTES分子中的硅原子进行与羟基的氧的共价结合并且将表面的硅烷醇基团(SiOH)转化成胺。将样品浸没在2%APTES(99%EtOH)中30分钟,并且接着加热到120℃10分钟。这一步骤后,胺基(NH2)为来自表面的末端单元。随后,戊二醛用作DNA固定的接枝剂。戊二醛结合经由其醛基(COH)实现以确保与APTES的氨基的共价结合。对于这一步骤,在室温下将样品浸没在12.5%戊二醛液体(10mM磷酸钠缓冲液)中1小时。为了固定探针,将DNA链的5'-氨基连接到连接基团的醛基。将500μL1μmolDNA探针的滴落溶液沉积到NW上18小时。靶DNA杂交和感测在探针固定之后,研发出PDMS(聚二甲基硅氧烷)流体系统以便将DNA标靶泵送到纳米线表面,从而与DNA探针杂交。使用互补和非互补标靶,其经双-三丙烷[1,3-双(三(羟基甲基)甲氨基)丙烷]溶液的稀释而具有各种浓度。杂交30分钟后,用双-三缓冲液洗涤样品10分钟以去除过量标靶。最终,使用吉时利(Keithley)2400来检测NWFET电特征(Id与Vg曲线)。离子强度作用的结果显示于图5中。较低盐浓度下的nDNA和部分中性单链DNA在较高盐浓度下的DNA的ΔV方面具有更高FET灵敏度。含3'末端修饰的部分中性单链DNA具有最高FET灵敏度。在1mM双-三下不同标靶浓度的检测结果显示于图6中。nDNA和部分中性单链DNA探针具有更高浓度灵敏度(V的斜率与浓度),尤其在较低标靶浓度范围内。在1mM双-三下超低标靶浓度的检测结果显示于图7中。在FET上,用部分中性单链DNA探针可以检测到低至0.1fM的标靶浓度。如果与H5T的非特异性杂交发生,那么分析特异性。结果显示于表1中。表1:H5TΔV/mVH1TΔV/mVDNA(在100mM下)73.64mVnDNA(在1mM下)218.1mV269.3mV经修饰的1(n-X-n)(在1mM下)39.11mV173.34mV经修饰的2(n-X-X-n)(在1mM下)25.8mV205.11mV如表1中所指示,当使用nDNA作为探针时,H5T的ΔV/mV(指示非特异性杂交)更高。当在较低盐浓度下使用部分中性DNA探针时,非特异性杂交减少。实例3:聚合酶链反应中应用的部分中性单链寡核苷酸在SYBRTM格林(Green)系统的聚合酶链反应(PCR)和定量的聚合酶链反应(qPCR)中应用部分中性单链寡核苷酸。模板:pUC19产物长度:202bp表2:引物序列名称序列(5'到3')SEQIDNo.FP_RTTAGCTCACTCATTAGGCAC7RP_RGGGCCTCTTCGCTATTACGC8FP_R_m12CTCACTCCTTAGGCAC9FP_n10,14CTCACTnCATTnAGGCAC10FP_m12_n10,14CTCACTnCCTTnAGGCAC11FP_n11,13CTCACTCnATnTAGGCAC12FP_m12_n11,13TTAGCTCACTCnCTnTAGGCAC13上标n表示电中性核苷酸;“_”表示不匹配的核苷酸表3:PCR程序:表4:qPCR程序:PCR结果显示于图8A和8B中。比较使用DNA的结果和使用部分中性单链寡核苷酸(图8A:规则DNA引物(表2的FP-R和RP-R)与中和DNA修饰引物(表2的FP-n10、14);图8B:规则DNA引物(表2的FP-R和RP-R)与中和DNA修饰引物(表2的FP-n11、13))的那些结果,部分中性单链寡核苷酸的引物特异性明显改进。qPCR结果显示于图9和表5中。表5:比较使用DNA的结果和使用部分中性单链寡核苷酸的那些结果,部分中性单链寡核苷酸的引物特异性明显改进。实例4:在通过原位杂交检测miRNA中应用部分中性单链寡核苷酸测试细胞:经模拟miR-524-5p转染的SKMEL19细胞和经miR-67转染的SKMEL19细胞(阴性对照)探针:阴性对照miRNA(Cel-miR-67):TCACAACCTCCTAGAAAGAGTAGA(SEQIDNo.14)模拟miR-524-5p:CUACAAAGGGAAGCACUUUCUC(SEQIDNo.15)MiR-524-5pLNA探针:EX-38630-05-LNA检测探针,hsa-miR-524-5p,250pmol3`-DIG标记的MiR-524-5p7N-DNA探针:5'-GAnGAAnAGTnGCTnTCCnCTTnTGTnAG-3'Dig(SEQIDNo.16)上标n表示电中性核苷酸。MiR-524-5p全nDNA探针:5'GAGAAAGTGCTTCCCTTTGTAG/3'Dig/(SEQIDNo.17)MiR-524-5pDNA探针:5'-GAGAAAGTGCTTCCCTTTGTAG-3'Dig(SEQIDNo.18)根据ISHyb原位杂交套组的制造商说明书(美国加利福尼亚州纽瓦克的博诚公司(BioChain,Newark,CA,USA))进行原位杂交。用4%多聚甲醛(DEPC-PBS)使测试细胞固定化20分钟并且接着用DEPC-PBS洗涤三次(每次5分钟)。测试细胞用蛋白酶(10μg/ml)处理8分钟并且用DEPC-PBS洗涤5分钟。细胞进一步用4%PFA(DEPC-PBS)固定化15分钟,接着用DEPC-PBS洗涤三次(每次5分钟)。在65℃下,用预杂交溶液(美国加利福尼亚州纽瓦克的博诚公司)处理经洗涤的测试细胞4小时。接着添加不同浓度的探针以便在55℃下反应12到16小时。在45℃下用2×SSC洗涤样品10分钟,在45℃下用1.5×SSC洗涤10分钟,并且接着在37℃下用0.2×SSC洗涤20分钟。用1×阻断溶液(美国加利福尼亚州纽瓦克的博诚公司)阻断杂交1小时。添加抗体溶液(1:200)(美国加利福尼亚州纽瓦克的博诚公司)以便反应4小时,并且测试细胞用DEPC-PBS洗涤三次(每次10分钟),并且接着用碱性磷酸酶缓冲液(美国加利福尼亚州纽瓦克的博诚公司)洗涤两次(每次5分钟)。接着添加NBT/BCIP(硝基蓝四唑/5-溴-4-氯-3吲哚基磷酸酯)6.6μlNBT+3.3μlBCIP)溶液持续2到20小时。样品用水洗涤并且在显微镜下观测。结果显示于图10A到13C中。更高浓度的探针可以产生与这四个不同探针(DNA、全nDNA、7nDNA、LNA)中的较低浓度探针相比更佳的染色图像。这些结果指示所有四个探针可以特异性检测到细胞中的miR-524-5p表达。应注意,与LNA、全nDNA和DNA探针相比,7nDNA探针产生对miR-524-5p表达的最大灵敏度,因为相比于相同浓度的LNA或nDNA探针,当在7nDNA探针中施用细胞时,观测到更强强度的图像。实例5:检测miRNA中应用的部分中性单链寡核苷酸靶miRNA:miR107(1pM):AGCAGCAUUGUACAGGGCUAUCA(SEQIDNo.19)miR579-3p(1pM):UUCAUUUGGUAUAAACCGCGAUU(SEQIDNo.20)miR885-5p(1pM):UCCAUUACACUACCCUGCCUCU(SEQIDNo.21)探针显示于表6中。表6:名称序列(5'到3')SEQIDNo.探针107(DNA)NH2-C6-TGATAGCCCTGTACAATGCTGCT22探针107(经修饰的2)NH2-C6-TnGATnAGCnCCTnGTACAATGCTGCT23探针579-3p(DNA)NH2-C6-AATCGCGGTTTATACCAAATGAA24探针579-3p(经修饰的2)NH2-C6-AnATCnGCGnGTTnTATACCAAATGAA25探针885-5p(DNA)NH2-C6-AGAGGCAGGGTAGTGTAATGGA26探针885-5p(经修饰的2)NH2-C6-AnGAGnGCAnGGGnTAGTGTAATGGA27用于探针固定的表面修饰如实例2中所描述。将一种于双-三丙烷缓冲液中的1pMmiRNA(与探针互补)添加到探针固定化芯片中以便反应30分钟。芯片用双-三丙烷缓冲液洗涤10分钟。如实例2中所描述监测信号。结果显示于图14中。部分单链寡核苷酸探针的ΔV/mV高于DNA探针的ΔV/mV。部分中性单链探针具有更高灵敏度。尽管已结合上文阐述的特定实施例描述本发明,对于其的许多替代方案和其修饰和变化将对所属领域的技术人员显而易见。所有此类替代方案、修改和变化被视为落入本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1