一种分离出的胚乳不表达启动子SAFES6及其应用的制作方法
本发明涉及生物技术和作物基因工程技术领域。具体而言,本发明涉及一种水稻胚乳不表达启动子SAFES6及其应用。
背景技术:
作物基因工程的目标之一是培育具有农业所需特征或性状的植物。基因工程的技术发展使研究人员能够获得所需的目的基因并转化植物,获得具有所需性状和特征的转基因植物。一方面,可以促使基因在通常不表达这类基因的植物细胞或植物组织中表达从而赋予这些植物所需的表型。另一方面,基因或部分基因在反义方向的转录可以阻止或抑制内源基因的表达从而达到所需的目标。利用启动子直接控制目的基因的转录,是调控目的基因表达最为经济有效的手段,也是控制表达风险的可行路径。
自1983年首例烟草转基因作物在美国诞生以来,截止到目前,转基因作物已在全球范围内种植,被批准可使用的产品有1000多种。目前这些作物的遗传改良大多数集中在提高产量、缩短育种周期、增强抗病虫性、改善农产品营养成分、增加生物多样性方面。许多转基因作物及其产品都进入食品流通市场,走进了千家万户的餐桌。水稻是世界主要粮食作物之一,世界上有三分之一以上人口以稻米为主食。中国是人口大国,水稻在我国的国民经济中占有相当重要的地位,为提高水稻产量、抗性和品质,可利用基因工程技术将外源目标基因导入栽培稻中,创造转基因水稻。这在很大程度上为解决粮食紧缺和人口日益增长这一矛盾开辟了一条新的途径。
纵观转基因水稻的研究发展历程,水稻转基因工程所改良的性状主要涉及抗病、抗除草剂、品质改良以及抗虫等。
在抗病方面,主要是转入抗水稻真菌性、细菌性、线虫病毒基因。Christou等将Xa21基因导入水稻后,显著提高了水稻对白叶枯病和稻瘟病的抗性。何迎春等将烟草几丁质酶基因导入水稻获得了高抗纹枯病和稻瘟病转基因植物。四川农业大学将抗病和抗虫基因导入杂交稻的恢复系中,获得了转基因的双抗杂交稻。
20世纪80年代,美国孟山都公司以其拥有广谱、高效除草剂农达(草甘膦)的优势,率先开展除草剂抗菌性基因的研究和抗性品种的开发。中国用于水稻抗除草剂的基因主要是编码PAT的bar基因。
在品质改良方面,富脯氨酸基因、富甲硫氨酸和赖氨酸基因、八氢番茄合成酶及其脱氢酶基因、大豆球蛋白基因和高赖氨酸基因等都已被成功地导入水稻并获得了转基因植株,对于开发利用稻米产品具有非常重要的意义。
从苏云金杆菌分离的苏云金杆菌杀虫结晶蛋白基因(Bt基因)、昆虫蛋白抑制剂(PI基因)、植物凝集素基因都已成功应用于水稻抗虫改良上。
然而任何事物都具有两面性,转基因作物在给人类带来惊喜和福音的同时,也带来了疑惑和风险。转基因水稻可能带来的生物安全性问题已经成为国际社会关注的焦点。
从微观的角度来看,启动子的导入也可能给转基因植物带来安全隐患。比如,启动子插入到原来整合到植物基因组中的隐性病毒基因旁,可能会重新活化病毒;启动子插入到某一编码毒素蛋白的基因上游,可能会增强该毒素的合成;当转基因植物被动物或人类食用时,启动子可能会通过基因的水平插入到某一致癌基因上游,活化并导致癌症的发生。在宏观的食品安全问题上,人们关注的焦点是转基因及其产物在食用时是否有毒性或者会引起过敏反应;其次,当转基因产品所携带的选择标记基因是编码某些应用于临床或肠道抗生素的抗性物时,它们是否可能被转移到微生物中,从而增强病原微生物的抗药性,引起抗生素失效(Ebinuma等,2001;Hohn等,2001)。
水稻作为主要的粮食之一,水稻食用部位精米即胚乳。在转基因水稻中尤以外源蛋白在胚乳中的积累及其可能造成的食用安全风险,成为制约商业化进程的重要因素。针对这一问题,利用启动子策略即选用诱导型、组织特异性及时间依赖型启动子,使外源基因只在非食用部分表达,保证食用部分不含有外源基因表达的产物,降低其对人类健康带来的潜在风险,是促进转基因水稻的商业化进程的一条有效途径。目前,已发现的非胚乳表达的启动子主要包括茎特异性启动子、叶肉细胞特异性启动子、根特异性启动子等等。如shi等发现的在韧皮部特异性表达的启动子RSs1;美国农业部研究局Roger Thilmony领导的作物改良与利用研究小组近日发现一种组织特异性启动子LP2,其属于光合作用组织中的受体基因,在转基因水稻的叶中高度活跃,在种子和花中未被检测到;Varvara等发现的发根农杆菌的rolD启动子,仅在根中表达并转入到目的植物番茄中。然而,目前在国内研究中,非胚乳表达启动子的发明和研究鲜有报道,仅见于杨剑波等发明的水稻非胚乳表达启动子OsTSP I即只在水稻非胚乳组织(根、茎、叶等)中表达,在胚乳中不表达。以及Meng Cai等发现的仅在水稻绿色组织部位表达的启动子PD540等。
基因工程可以从本质上改变生物体的构造,这是科学史上的重大进步,同样也可能会给人类社会带来某种程度的隐患。尽管转基因作物的确存在潜在的食品安全和环境安全等问题,但绝不能成为阻碍其发展的理由,而应该发现问题和努力解决问题。如果转基因水稻不能最终实现商品化应用于生产,那么再好的研究成果也没有任何应用价值。因此,利用启动子策略,使外源基因只在非食用部分表达,保证食用部分不含有外源基因表达的产物,即大力开展功能基因组的研究,大量挖掘和分离具有实用价值的非胚乳表达启动子,可以降低转基因水稻对人类健康带来的潜在风险,消除公众对转基因水稻的偏见和顾虑,充分发挥转基因育种的优势,培育出更多更好的新品种。从而引导转基因作物在我国健康、有序地发展。
技术实现要素:
本发明希望提供一种在水稻胚乳不表达的启动子,本发明还提供包含该启动子的表达盒、重组表达载体、转基因植物或植物部分。在本文公开的一个实施方案中,启动子连接至异源可转录多核苷酸序列。本文还提供制造和使用本文公开的启动子的方法,包括包含启动子的表达盒、重组表达载体,和包含连接至异源可转录多核苷酸序列的启动子的转基因植物或植物部分。
因此,一方面,本发明提供一种分离出的胚乳不表达启动子SAFES6,其特征在于,所述胚乳不表达启动子SAFES6包含下列多核苷酸序列中的至少一种:
(a)包含序列表中SEQ ID NO:1所示核苷酸序列的多核苷酸序列;
(b)与序列表中SEQ ID NO:1所示核苷酸序列具有至少85%同源性并且具有相同功能的核苷酸序列;
(c)在序列表中SEQ ID NO:1所示的核苷酸序列中添加、取代或缺失一个或多个核苷酸后所获得的、与序列表中SEQ ID NO:1所示核苷酸序列具有相同功能的核苷酸序列;以及
(d)与包含序列表中SEQ ID NO:1所示核苷酸序列互补的核苷酸序列,
其中所述胚乳不表达启动子SAFES6能够连接至异源可转录多核苷酸序列并且能够引导所述异源可转录多核苷酸序列在非胚乳组织中的转录。
另一方面,本文提供一种表达盒,其包含所述的启动子和与所述启动子连接的异源可转录的多核苷酸序列。其中所述启动子能够引发所述异源可转录多核苷酸序列在用所述表达盒转化的植物非胚乳组织中的转录和表达。所述的异源可转录多核苷酸序列是具有改变作物性状功能的基因。其中所述的异源可转录多核苷酸序列以正义方向插入该表达盒中。或者,所述的异源可转录多核苷酸序列以反义方向插入该表达盒中。在某些实施方案中,可转录多核苷酸序列转录抗昆虫蛋白质。
另一方面,本文提供一种重组表达载体,其包含所述的启动子或所述的表达盒,所述启动子能够连接到异源的可转录多核苷酸序列。其中所述的异源可转录多核苷酸序列是具有改变作物性状功能的基因。
另一方面,本发明提供一种在不改变植物胚乳性状情况下改良植物生长特性的方法,其特征在于,所述方法包括:
(1)、获取权利要求1中所述的胚乳不表达启动子SAFES6;
(2)、将所述胚乳不表达启动子SAFES6与具有改变作物性状功能的基因相连接,获得相应重组载体;
(3)将所述重组载体转入目标植物的细胞中;
(4)利用所述细胞培育相应转基因植物;
(5)从所获得的转基因植株中选择所述具有改变作物性状功能的基因在非胚乳部位表达,而在胚乳部位未表达的植株,该植株在非胚乳部位的性状获得改良,而胚乳部位不受影响。
再一方面,本发明提供一种转化植物或植物部分的方法,所述方法包括用所述的表达盒或所述的重组表达载体稳定地对所述植物或植物部分进行转化。所述的植物部分是选自由以下各部分组成的群组:细胞、原生质体、细胞组织培养物、愈伤组织、细胞块、胚芽、花粉、胚珠、花瓣、花柱、雄蕊、叶、根、根尖及花药。所述的植物是选自由以下各部分组成的群组:粮食作物、蔬菜作物、花卉作物、能源作物。在具体实施方案中,植物部分是水稻愈伤组织,植物是水稻。
再一方面,本发明提供一种指导可转录的多核苷酸序列在植物细胞中表达的方法,其包括将所述的启动子连接至异源可转录多核苷酸序列构建重组表达载体,并将重组表达载体转化植物细胞以产生转化植物细胞并再生转基因植物。
提供以下定义和方法是为了更好地界定本发明以及指导一般技术人员实践本发明。除非另外指出,否则术语应按照相关技术领域的普通技术人员的常规用法来理解。
术语“DNA序列”、“核酸序列”和“核酸分子”指基因组或合成来源的双链DNA分子。
术语“表达”指基因的转录产生相应的mRNA,该mRNA翻译产生相应的基因产物(即肽、多肽或蛋白质)。
术语“表达盒”是指包含连接至一个或多个调控元件,可转录DNA分子的DNA分子。
术语“重组表达载体”是指一类按特殊要求设计构建的,具有调节外源基因正确表达信号,并能使克隆基因在转化的寄主细胞中得到有效表达的专门载体。载体通常包括一个或多个表达盒。包含在没有人为干预的情况下完全不会自然出现的组合DNA分子的DNA分子。术语“重组载体”指诸如质粒、粘粒、病毒、自我复制序列、噬菌体或线性单链、环状单链、线性双链或环状双链DNA或RNA核苷酸序列。重组载体可是任何来源的,并能够发生基因组整合或自我复制。
术语“反义RNA的表达”指同某种天然mRNA反向互补的RNA分子。它由双链DNA中的无义链转录产生的,可以用来阻止被其转化的细胞中存在的与之互补的mRNA的转译活性。使用编码反义RNA的基因,来阻断目的基因(即与反义RNA互补的)的mRNA转译成蛋白质的表达。
术语“序列同源性”是指两个最佳比对DNA序列相同的程度。例如,参考序列和另一个DNA序列,序列比对中最大限度地提高核苷酸匹配的数目。如本文使用,术语“参考序列”是指SEQ ID NO:1的DNA序列。
术语“异源”“外源”指两个或多个不同来源的核酸或蛋白质序列之间的相互关系。例如,启动子与编码序列之间的组合在自然界通常不存在,则两者彼此异源。此外,特定序列可以相对于它所插入的细胞或生物体是外源的(即在自然条件下其通常不存在于特定细胞或生物体中)。
术语“连接”指两个或多个核苷酸区域或核苷酸序列的功能性空间排列。如,启动子区与核酸序列的位置关系使得核酸序列可由该启动子区调控而引导转录。此时,启动子区与核酸序列属于“连接”。
术语“可转录多核苷酸序列”是指能够转录至RNA分子的任何DNA分子,包括但不限于,具有蛋白质编码序列的那些分子和产生具有序列适用于基因抑制的RNA分子的那些分子。DNA分子类型可包括,但是不限于,来自相同植物的DNA分子,来自另一种植物的DNA分子,来自不同生物体的DNA分子,或合成DNA分子,如含有基因的反义信息的DNA分子,或编码人工、合成或另外修饰型式的转基因的DNA分子。并入本发明的重组表达载体中的示例性可转录DNA分子包括,报告基因GUS,密码子优化的合成的Bt(Bacillus thuringiensis苏云金芽孢杆菌)蛋白编码基因mCry1Ab。
术语“启动子”或“启动子区”指位于基因5’-末端上游外侧,紧邻转录起始位点的一段具特殊功能的非编码的核苷酸序列。RNA聚合酶通过与它结合作用而启动基因的转录。启动子或启动子区提供RNA聚合酶或其它为转录起始因子的识别位点。启动子的强度或活性可通过它转录产生的RNA的量来衡量,或通过蛋白在细胞或组织中的积聚量来衡量,或是相对于与其比较的其它启动子的转录活性进行确定。
术语“转化”指外源DNA导入细胞的过程,即将核酸导入到受体宿主中。术语“宿主”指细菌细胞、真菌、动物或动物细胞、植物或种子、或任何植物部分或组织,包括植物细胞、原生质体、愈伤组织、根、块茎、种子、茎、叶、苗、胚和花粉。
术语“转基因植物”指导入的核酸稳定地整合到其基因组的植物。例如整合到核基因组中。
术语“具有改变作物性状功能的基因”是指表达于具体植物组织、细胞或细胞类型中,赋予植物所需特性的可转录DNA分子。具有改变作物性状功能的基因的产物可在植物中起作用使得植物形态学、生理学发生改变。在本发明的一个实施例中,本发明的启动子并入重组表达载体以使得启动子连接至具有改变作物性状功能的基因的可转录DNA分子中。在含有这类重组表达载体的转基因植物中,具有改变作物性状功能的基因的表达可赋予植物有利的性状。有利性状可包括,例如但是不限于,除草剂耐性、抗虫性、抗病性、抗逆性、改良植物生长和发育、改良产量、改良蛋白质含量、改良果实成熟、生物聚合物产生、改进风味、杂种种子繁育效用。
本发明中,本申请的发明人发现日本晴水稻(Oryza sativa L cv.Nipponbare)基因组中一段1931bp的具有转录调控活性的DNA序列,具有驱动目标基因在水稻非胚乳组织表达的作用。并且分离克隆得到了序列表中SEQ ID No:1所示的DNA序列。命名为SAFES6或启动子SAFES6。
需要说明的是:SEQ ID No:1的启动子的DNA序列中,序列开头的序列“gcattcaaga aagcaatcag cc”为获得启动子过程中使用的正向引物的留存序列,共计22bp;序列末尾的序列“ggcgaccgat cgattagcta gc”为获得启动子过程中使用的反向引物的留存序列(该留存序列与反向引物的相应序列互补),共计22bp。需要强调的是,本文中所提到的启动子既可以指上述整个DNA序列,也可以指去除上述引物留存序列后的DNA序列。即便本领域技术人员在本发明的基础上,采用其他引物获得了类似序列,其也落入本发明的保护范围之内。
本发明的重组表达载体称为pCAMBIA1391-SAFES6,该重组表达载体为将SEQ ID No:1所示的序列即SAFES6或启动子SAFES6构建于pCAMBIA1391中得到的重组表达载体,本文中称为pCAMBIA1391-SAFES6。发明人将启动子SAFES6序列经酶切后连接到作物双元表达载体pCAMBIA1391上,获得相应的重组质粒(即重组表达载体),SAFES6驱动GUS基因表达。利用该重组质粒转化根癌农杆菌菌株EHA105,然后用农杆菌介导的方法进行水稻的转化,得到转基因水稻植株。对获得的转基因水稻进行组织化学检测发现,转基因植株在根、茎、叶鞘、叶、胚中有GUS强表达,胚乳中不表达。从而证明该1931bp的序列具有驱动基因特异的在非胚乳组织中表达的活性。
GUS基因定量分析表明,水稻SAFES6启动子在叶和叶鞘组织中表达明显强于基因工程中常用的水稻组成型启动子ACTIN启动子;在根和茎组织中,两启动子活性基本相当;在花组织中,SAFES6启动子活性略弱于ACTIN启动子;而在胚乳中,SAFES6启动子无活性。
在pCAMBIA1391-SAFES6中,用mCry1Ab(苏云金芽孢杆菌Bacillus thuringiensis即Bt蛋白编码基因,安徽省农业科学院自主设计,ZL 2009 1 0185774.5)替代GUS基因,获得由SAFES6驱动Bt的表达载体,命名为SAFES6-BT。在相关转基因株系中,相对于ACTIN启动子驱动Bt的株系,SAFES6-BT植株在叶和根组织中Bt表达水平略强或水平相当,而在胚乳中,ACTIN-BT存在表达,而SAFES6-BT则检测不到(低于检出线)。
技术效果
本发明所克隆的胚乳不表达启动子SAFES6能够调控基因在植株中非胚乳部位集中表达,在实际应用中具有显著价值。如通过该启动子调控目标基因在绿色组织和根中表达活性,而在胚乳中不表达,改善水稻的生长性能,同时降低了水稻的食用安全风险,有助转基因水稻的商业推广。
序列表简述
SEQ ID NO:1表示SAFES6启动子。
SEQ ID NO:2-11表示引物序列。
附图说明
图1为SAFES6启动子及其PCR扩增引物序列,其中示出了具有PCR引物的SAFES6启动子,1943个碱基对,还示出了HindIII位点:1-6,EcoRI位点:1938-1943;
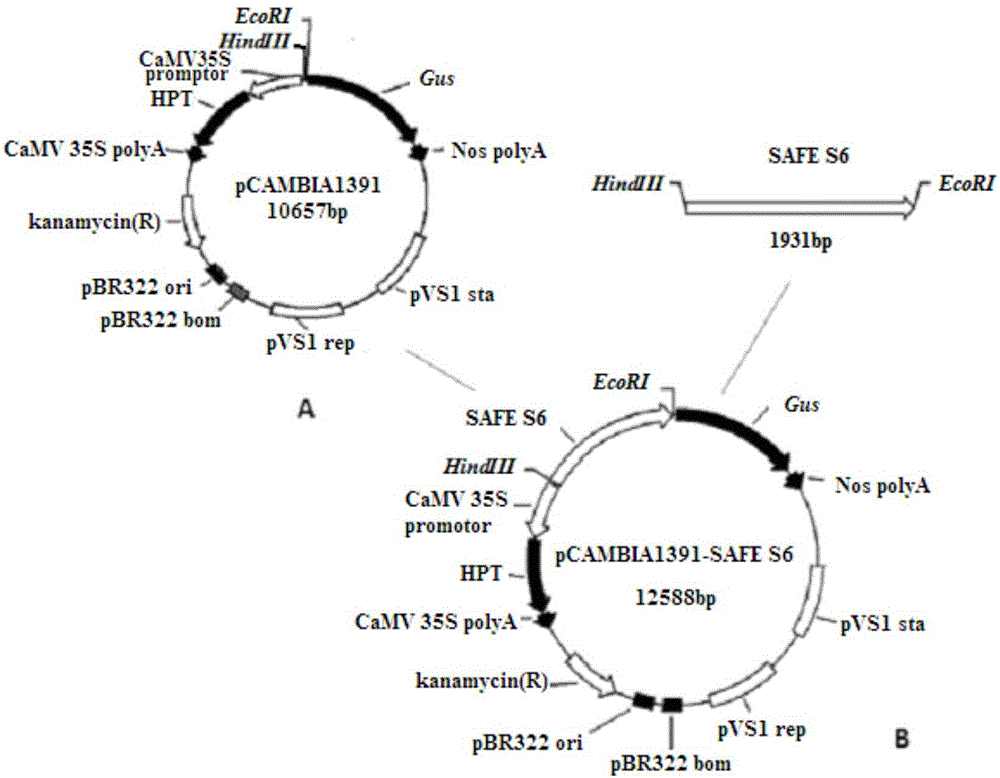
图2为将SAFES6启动子构建于pCAMBIA1391载体质粒中的示意图,图中A为pCAMBIA1391示意图,B为pCAMBIA1391-SAFES6示意图,其中示出了利用SAFES6启动子驱动位于其下游的Gus基因表达。
图3为对本发明的启动子进行酶切验证的结果示意图。
图4为利用SAFES6启动子驱动Gus基因表达的结果示意图,图中示出了水稻各部位Gus染色结果,Gus基因在根(a)、茎(b)、叶鞘(c)、叶(d)、胚(e)中强表达,在胚乳中不表达,图中标尺=2.5mm。
图5为pCAMBIA1391-SAFES6与pCAMBIA1391-ACTIN植株GUS定量分析结果图。
图6为SAFES6-BT表达盒示意图。该表达盒包含两个表达框,即由CaMV35S启动子、hyg基因、CaMV终止子组成的表达框,及SAFES6启动子、mCry1Ab基因、NOS终止子组成的表达框。其中,LB:左边界;CaMV terminator:CaMV终止子,长0.22kb;Hyg:潮霉素基因hygromycin,长1.86Kb;CaMV35S promoter:CaMV35S启动子,长0.53Kb;SAFES6promoter:SAFES6启动子,长1.96Kb;mCry1Ab:Bacillus thuringiensis(Bt)蛋白编码基因,长1.84Kb;NOS terminator:NOS终止子,长0.25Kb;RB:右边界。
图7为ACTIN-BT表达盒示意图。该表达盒包含两个表达框,即由CaMV35S启动子、hyg基因、CaMV终止子组成的表达框,及ACTIN启动子、mCry1Ab基因、NOS终止子组成的表达框。其中,LB:左边界;CaMV terminator:CaMV终止子,长0.22kb;Hyg:潮霉素基因hygromycin,长1.86Kb;CaMV35S promoter:CaMV35S启动子,长0.53Kb;ACTIN promoter:ACTIN启动子,长1.3Kb;mCry1Ab:Bacillus thuringiensis(Bt)蛋白编码基因,长1.84Kb;NOS terminator:NOS终止子,长0.25Kb;RB:右边界。
具体实施方式
本发明提供以下实施例以对本发明进行更好地阐述,除非有特殊说明,下述实施例仅用于说明而非限制本发明。本领域技术人员应当了解在下面的实施例中公开的技术代表本发明者发现的在实践中起较好作用的技术。但是,本领域技术人员应该了解,基于本发明的构思,本领域技术人员可以在公开的具体实施方案的基础上进行许多变化,并且仍然获得同样或类似的结果,而不背离本发明的精神和范围,因此,附图中提出或示出的所有事项应理解为示例性的,而不具有限制意义。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的生化试剂,载体耗材等,如无特殊说明,均为市售购买产品。
实施例1、SAFES6启动子的获得
步骤1、引物的设计
根据NCBI中提供的水稻品种日本晴(Oryza sativa L cv.Nipponbare)全基因组序列,依据水稻启动子SAFES6(即序列表中SEQ ID No:1所示序列)的序列设计扩增引物,并根据选用的载体及靶标基因的特点,设计引物的酶切位点。本发明中所用到的水稻品种日本晴的种子获取自安徽省农业科学院水稻研究所种子库。
本实施例中以水稻双元表达载体pCAMBIA1391(图2中A部分,来自于CAMBIA,为公开使用载体,安徽省农业科学院农业部转基因生物产品成分监督检验测试中心水稻组保存)为例,目的基因为Gus基因,具体设计的引物为:正向引物(SEQ ID No:2)5’端带酶切位点HindIII
(AAGCTT),反向引物(SEQ ID No:3)5’端带酶切位点EcoRI(GAATTC),引物序列如下:
正向引物:5’-AAGCTTGCATTCAAGAAAGCAATCAGCC-3’
反向引物:5’-GAATTCGGCGACCGATCGATTAGCTAGC-3’
由深圳华大基因公司合成。
步骤2、启动子SAFES6的获得
以水稻品种日本晴DNA为模板,利用正向引物、反向引物扩增启动子SAFES6,按常规PCR体系(采用常规的PCR扩增方法,该扩增方法的具体细节可以参考文献:Bachmann H S,Siffert W,Frey U H.Successful amplification of extremely GC-rich promoter regions using a novel'slowdown PCR'technique.Pharmacogenetics,2003,13(12):759-66.)采用如下扩增程序:
在95℃时,对模板DNA进行预变性5min。随后进入变性-退火-延伸循环即:95℃变性30s,模板DNA双链解开成单链;58℃退火30s,引物与DNA单链模板杂交,形成DNA模板-引物复合物;72℃延伸2min30s,DNA模板-引物复合物在Taq DNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条与模板DNA链互补的新链。共35个循环。最后在72℃下延伸10min。
回收PCR扩增的目的片段(见图1,图1中示出了该启动子的序列、5’端和3’端的酶切位点),将其连接到PGEM-T-Easy载体质粒(购自Promega公司,按载体说明书中的比例混合)上,通过热激法将带有目的片段的PGEM-T-Easy载体转化到大肠杆菌XL-Blue感受态细胞中。将大肠杆菌菌液均匀涂布在LB平板培养基上,37℃培养24小时。利用克隆启动子的正反向引物,对得到的单个大肠杆菌细胞克隆进行菌落PCR验证,筛选出其中的阳性克隆。随后,挑取2个阳性细胞克隆,进行液体培养过夜,收集菌体,用于提取含有启动子SAFES6片段的PGEM-T-Easy载体质粒。用HindIII和EcoRI对得到的质粒进行双酶切验证,如图3所示。将经过菌落PCR验证和酶切验证双重鉴定的阳性克隆送交Invitrogen公司测序。验证正确的克隆即为所要获得的启动子SAFES6,其核酸序列如SEQ ID No:1所示。
实施例2、作物表达载体的构建和农杆菌的转化
从上面“启动子SAFES6的获得”过程中获得的大肠杆菌阳性克隆中,提取含有启动子SAFES6片段的PGEM-T-Easy载体质粒,并用HindIII和EcoRI进行双酶切,回收启动子SAFES6片段。同时利用HindIII和EcoRI对作物表达载体pCAMBIA1391进行酶切、回收酶切后的pCAMBIA1391片段。pCAMBIA1391载体上含有无启动子驱动的报告基因Gus(本发明中将要研究的启动子插入在Gus基因上游,用于驱动Gus基因的表达,以Gus基因的表达特点反映被研究的的启动子的性质)将上述回收的SAFES6片段和pCAMBIA1391片段用T4DNA连接酶(购于TaKaRa公司)进行连接,得到启动子SAFES6与Gus基因融合的作物表达载体pCAMBIA1391-SAFES6(图2B)。参考Hofgen等(Hofgen R,Willmitzer L.Storage of competent cells for Agrobacterium transformation.1988.Nucleic Acids Res 16:9877.)提出的冻融法,将作物表达载体转入根癌农杆菌(Agrobacterium tumefaciens)EHA105(安徽省农业科学院农业部转基因生物产品成分监督检验测试中心水稻组保存)。
实施例3、启动子SAFES6驱动Gus报告基因的表达
步骤1:农杆菌介导的水稻遗传转化
将成熟日本晴水稻种子去掉颖壳后,用70%酒精浸泡种子1min,倒掉酒精。用含有1滴Tween 20的50%次氯酸钠(原液有效氯浓度大于4%)溶液浸泡种子40min,并于摇床上摇晃均匀(150r/min)。倒掉次氯酸钠,用无菌水洗5遍至溶液澄清,无次氯酸钠味道。无菌水浸泡种子过夜。用解剖刀沿种子的糊粉层将胚剥下,将胚接种于愈伤诱导培养基上。30℃下暗培养11天后将愈伤与胚乳及胚芽分离,将去芽的状态良好、分裂旺盛的初级愈伤组织进行预培养3~5天后用于农杆菌转化。
采用上述“作物表达载体的构建和农杆菌的转化”过程中转入了重组表达载体的根癌农杆菌进行农杆菌介导的遗传转化,该遗传转化、转化子筛选及转基因植株再生等参照Yongbo Duan(Yongbo Duan,Chenguang Zhai,et al.An efficient and high-throughput protocol for Agrobacterium mediated transformation based on phosphomannose isomerase positive selection in Japonica rice(Oryza sativa L.)[J].Plant Cell Report,2012.DOI 10.1007/s00299-012-1275-3.)等提出的方法。该方法大致分为以下几个步骤:(1)愈伤组织诱导:消毒后的种子用无菌水在30℃黑暗条件下浸泡过夜,用解剖刀将胚剥下置于诱导培养基上。每皿(规格为100×25mm的一次性塑料培养皿,内含50mL诱导培养基)均匀放置12个胚,在30℃黑暗条件下放置2~3周诱导愈伤组织,至长出淡黄色颗粒状愈伤。(诱导培养基成分为:N6majors,MS iron salts,B5minors,B5vitamins,500mg/L proline,500mg/L glutamine,300mg/L casein enzymatic hydrolysate,30g/L sucrose,2mg/L 2,4-D,3g/L phytagel,pH 5.8)
(2)预培养:从诱导培养基上挑选颗粒状的愈伤组织置于新的诱导培养基上,于30℃黑暗条件下培养3~5天。
(3)侵染及共培养:将预培养的愈伤组织转移至50mL无菌管中,加入农杆菌菌液(OD600=0.2)浸泡20min,倒出菌液,并用无菌滤纸将愈伤上的残余菌液吸干。将愈伤均匀撒在共培养培养基上,于23℃黑暗下培养2~3天。(共培养基成分为:N6majors,MS iron salts,B5minors,B5vitamins,500mg/L proline,500mg/L casein enzymatic hydrolysate,30g/L sucrose,2mg/L2,4-D,3g/L phytag-el,100μL/L acetosyingone,4g/L phytagel,pH 5.2)
(4)恢复:将共培养的愈伤转移至恢复培养基上,30℃黑暗培养3~5天。(恢复培养基成分为:N6majors,MS iron salts,B5minors,B5vitamins,500mg/L proline,500mg/L glutamine,500mg/L casein enzymatic hydrolysate,30g/L sucrose,2mg/L 2,4-D,250mg/L carbenicillin,3g/L phytagel,pH 5.8)
(5)筛选:从筛选培养基上挑选不带菌斑颜色鲜亮呈淡黄色颗粒状的胚性愈伤组织,接种于筛选培养基上,每皿30粒。30℃黑暗培养2~3周,至长出新的抗性颗粒状愈伤。(筛选培养基成分为:N6majors,MS iron salts,B5 minors,B5vitamins,500mg/L proline,500mg/L glutamine,500mg/L casein enzymatic hydrolysate,10g/L sucrose,20g/L Mannose,2mg/L 2,4-D,3g/Lphytagel,250mg/L carbenicillin,25mg/L hygromycin,pH 5.8)
(6)分化:每一转化事件挑选三个独立的胚性愈伤到分化培养基某一区域,30℃光照培养室(16h光照/8h黑暗)条件下培养3~4周,待幼苗长出。(分化培养基成分为:N6majors,MS iron salts,B5minors,B5vitamins,1g/Lcasein enzymatic hydrolysate,30g/L sucrose,30g/L sorbitol,500mg/L MES,2.5mg/L CuSO4,0.5mg/L KT,AA amino acids,2g/L phytagel,pH 5.8)
(7)生根:每一区域挑选两棵健壮的幼苗移栽至生根培养基,30℃组织培养室光周期(16h光照/8h黑暗)培养三周左右,进行鉴定并移栽至田间。(生根培养基成分为:1/2MS basal salts(2.165g/L),B5vitamins,1.0g/Lcasein enzymatic hydrolysate,20g/L sucrose,0.2mg/L NAA,125mg/Lcarbenicillin,3.5g/L phytagel,25mg/L hygromycin,pH5.8)
最终得到含有pCAMBIA1391-SAFES6表达载体的水稻植株,我们称之为pCAMBIA1391-SAFES6植株。
步骤2、GUS组织化学染色
参照Jefferson(Jefferson RA et al.GUS fusion:β-Glucuronidase as a sensitive and versatile gene fusion marker in higher plant[J].EMBO J.,1987,6:3901-3907)等提出的方法,对农杆菌转化后的组织进行GUS组织化学染色。将需要染色的组织抽真空,然后浸入染色液中,37℃染色24小时。然后进行脱色,脱色时将组织浸泡在95%乙醇中,至绿色组织材料呈白色,染色结果见图4,从图中可以看出GUS在根(a)、茎(b)、叶鞘(c)、叶(d)、胚(e)中强表达,在胚乳(e)中不表达。
实施例4、启动子SAFES6活性的定量分析
取pCAMBIA1391-SAFES6植株和作为对照的pCAMBIA1391-ACTIN植株(pCAMBIA1391-ACTIN植株是通过直接种植相应种子获得的,含pCAMBIA1391-ACTIN的种子来自于来自于美国康奈尔大学,由目前基因工程中常用的组成型启动子水稻ACTIN驱动Gus基因,安徽省农业科学院农业部转基因生物产品成分监督检验测试中心保存)叶、鞘、茎、根、花、胚乳样本,使用天根生化科技有限公司的植物总RNA提取试剂盒提取每种样品中的总RNA,再使用天根生化科技有限公司的FastQuant RT试剂盒将所提取的总RNA反转录为cDNA,以从每种样品获得的cDNA为模板,分别以ACTIN基因为内参基因,以天根生化科技有限公司的SuperReal PreMixPlus实时荧光定量PCR预混液为反应试剂,在ABI公司的PRISM 7500荧光PCR仪上,通过qRT-PCR反应检测pCAMBIA1391-SAFES6、pCAMBIA1391-ACTIN转基因植株中各个组织部位中报告基因Gus的表达强度,该表达强度反映相应启动子活性。其中,用于标定内参基因ACTIN的定量qRT-PCR引物为(SEQ ID No:4-5):
ACTIN上游引物:5'-CCTTCAACACCCCTGCTATG-3’
ACTIN下游引物:5'-CAATGCCAGGGAACATAGTG-3’
用于检测Gus基因表达的qRT-PCR引物为(SEQ ID No:6-7):
Gus上游引物:5'-TACGGCAAAGTGTGGGTCAATAATCA-3’
Gus下游引物:5'-CAGGTGTTCGGCGTGGTGTAGAG-3’
定量分析结果表明如图5所示,从图中可以看出,水稻SAFES6启动子在叶和叶鞘组织中表达活性明显强于基因工程中常用的水稻组成型启动子ACTIN启动子;在根和茎组织中,两启动子活性基本相当;在花组织中,水稻SAFES6启动子略弱于ACTIN启动子;而在胚乳中,水稻SAFES6启动子无活性。
实施例5、启动子SAFES6驱动BT的活性分析
1、SAFES6-BT和ACTIN-BT表达载体的构建
根据载体pCAMBIA1391-SAFES6、pCAMBIA1391-ACTIN和基因mCry1Ab(Bacillus thuringiensis(Bt)蛋白编码基因,安徽省农业科学院自主设计,在专利ZL 2009 1 0185774.5中公开)的序列设计带酶切位点的引物,正向引物5’端带酶切位点EcoRI(GAATTC),反向引物5’端带酶切位点SpeI(ACTAGT),引物序列如下(SEQ ID No:8-9):
引物序列如下:
BT FP:GAATTCATGGACAACAACCCGAACATCA
BT RP:ACTAGTTCAGTACTCGGCCTCGAAGGTC
用这对引物扩增基因mCry1Ab,用EcoRI和SpeI对扩增片段和载体pCAMBIA1391-SAFES6、pCAMBIA1391-ACTIN进行双酶切,分别回收酶切后的mCry1Ab片段、pCAMBIA1391-SAFES6载体大片段及pCAMBIA1391-ACTIN载体大片段,用T4DNA连接酶分别对mCry1Ab片段和pCAMBIA1391-SAFES6载体大片段,及mCry1Ab片段和pCAMBIA1391-ACTIN载体大片段进行连接,获得用mCry1Ab替代Gus基因、由SAFES6驱动Bt的表达载体,命名为SAFES6-BT(图6);由ACTIN驱动Bt的表达载体命名为ACTIN-BT(图7)。
2、BT的定量分析
利用冻融法将SAFES6-BT载体和ACTIN-BT载体转入根癌农杆菌(Agrobacterium tumefaciens)EHA105中,采用农杆菌介导的水稻遗传转化方法,得到相应载体的转基因植株,称之为SAFES6-BT植株和ACTIN-BT植株。具体方法参照“实施例3中的步骤1”。提取SAFES6-BT植株和ACTIN-BT植株的叶、根、胚乳样本RNA,并反转录成cDNA。通过qRT-PCR反应检测两种植株的不同部位cDNA中的BT基因的相对表达量。用于标定内参基因ACTIN的定量qRT-PCR引物如前所述(SEQ ID No:4-5)。用于检测BT基因表达的qRT-PCR引物为(SEQ ID No:10-11):
BT上游引物:5’-ATCCCGCCGCAGAACA-3’
BT下游引物:5’-GAGCGGAACATGGACACG-3’
定量分析的结果见表1,在SAFES6-BT植株和ACTIN-BT植株中,相对于ACTIN启动子驱动Bt的株系,SAFES6-BT植株在叶和根组织中Bt表达水平略强或水平相当,而在胚乳中,ACTIN-BT存在表达,而SAFES6-BT则检测不到(低于检出线)。说明本发明的胚乳不表达启动子SAFES6在胚乳中不驱动Bt表达或表达量很低,可以忽略不计。
表1
N.D.,non-detected(低于检出线)
虽然上面结合本发明的优选实施例对本发明的原理进行了详细的描述,本领域技术人员应该理解,上述实施例仅仅是对本发明的示意性实现方式的解释,并非对本发明包含范围的限定。实施例中的细节并不构成对本发明范围的限制,在不背离本发明的精神和范围的情况下,任何基于本发明技术方案的等效变换、简单替换等显而易见的改变,均落在本发明保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!