耐碳青霉烯类抗生素病菌的荧光探针及合成方法与应用与流程
本发明涉及化合物制备技术领域,具体地说,是一种耐碳青霉烯类抗生素病菌的荧光探针及其合成方法以及所述荧光探针在检测碳青霉烯酶和含有碳青霉烯耐药菌中的应用。
背景技术:
β-内酰胺类抗生素是目前治疗感染性疾病使用的最为广泛的一类抗生素。但是,这些抗生素也并非万能的,一些致病细菌,如肺结核菌(TB),由于自身带有耐β-内酰胺类抗生素的基因,因此,β-内酰胺类抗生素对之常常无效。更为严重的是,如果人们大量使用甚至滥用抗生素,会使一些病菌迅速适应存在抗生素的环境从而具有耐药性,会不利于对某些疾病的治疗,危及人们的健康。有报道,全世界每年有大约有50%的抗生素被滥用,而在中国,这一滥用的比例甚至能接近80%。由于滥用抗生素情况的存在,中国也成为了致病菌耐药性最为严重的国家之一。据不完全统计,目前在中国有近30%的住院感染患者是由耐药菌造成的。耐药菌的大量存在不仅加重了病人的治疗负担,更严重影响到临床的治疗效率。
研究发现,致病细菌产生耐药性的一个主要原因是因为细菌体内产生了一种叫β-内酰胺酶(β-lactamase)抗生素灭活酶,这种酶能迅速水解常用的β-内酰胺类抗生素,从而使抗生素失去药效。所述β-内酰胺酶可以分为A、B、C、D四个类型(Ambler分类),其中A、C、D三个类型为含丝氨酸的β-内酰胺酶,B类为含金属的β-内酰胺酶。
碳青霉烯类抗生素是一类具有特殊结构的β-内酰胺类抗生素,由于其拥有广泛的抗菌活性以及能强烈抑制或杀灭不同类型细菌的能力(J. Antimicrob. Agents. 1999, 11, 93; Antimicrob. Agents Chemother. 2011, 55, 4943.),成为治疗严重细菌性感染的最后一道防线。但是,随着碳青霉烯类抗生素的广泛使用,近年来在世界范围内逐渐出现了对碳青霉烯类抗生素具有耐药性的细菌。研究发现,革兰氏阴性菌对碳青霉烯类抗生素产生耐药性的主要原因如前所述,是其体内产生了能够水解、破坏碳青霉烯类抗生素的β-内酰胺酶,这类β-内酰胺酶也被称为碳青霉烯酶(carbapenemase)。所述碳青霉烯酶一般能水解碳青霉烯抗生素甚至几乎所有的β-内酰胺类抗生素。按照Ambler分类法,碳青霉烯酶包括A类KPC类型的β-内酰胺酶;含金属的B类β-内酰胺酶(MBLs),如VIM、IMP、新德里含金属β-内酰胺酶(NDM)以及比较少见的D类OXA-48类型碳青霉烯酶。有越来越多的报道显示:碳青霉烯酶是目前医院及社区医疗中心对获得性感染疾病治疗失败的主要原因,其中对含金属的B类β-内酰胺酶(MBLs)的菌株的抑制或杀灭,由于其存在不同菌株之间的基因转移而在临床上缺乏相应的抑制药剂。因此,在临床医疗中能及时检测碳青霉烯酶的情况对医生判断病情、确定细菌、确定致病菌对不同抗生素的抗药和敏感程度、提出相应的治疗方案具有重要的意义,也能够在医疗中不用或者少用抗生素药物。
目前,检测有碳青霉烯酶表达的细菌的方法主要有两种:一是表型检测法;二是基因检测法。所述表型检测法通常是通过测定细菌对碳青霉烯抗生素(如亚胺培南、美罗培南或厄他培南)的敏感性来检测的,它包括琼脂扩散测试法、最小抑菌浓度测定(MIC)法、双纸片协同测试法(DDST)。现在推荐用于检测克雷伯氏菌表达的碳青霉烯酶的方法是修饰的霍奇检测法(MHT)。但是,霍奇检测法缺乏良好的专一性和灵敏性,且消耗时间长,通常需要24~48小时,对于生长缓慢的细菌,比如结核分支杆菌,需要的时间更长,因此需要尽快了解细菌抗药性的情况,例如败血症病人的治疗,这类方法无法及时提供选择抗生素的必要信息。所述基因检测法主要是通过聚合酶链反应(PCR)来进行检测。这一检测方法具有很高的精确性和灵敏度,但是,它的仪器昂贵、花费高且不能检测到碳青霉烯酶新的基因。
除了表型检测法和基因检测法以外,现在通过质谱检测碳青霉烯酶的方法也有了一定的发展。1972年通过比色原理用头孢硝基噻吩(Nitrocefin)成功地检测了β-内酰胺酶,其设计原理为:头孢硝基噻吩的β-内酰胺环能被β-内酰胺酶快速水解而开环,从而使其颜色由黄色变成红色。但是,仅通过颜色的变化来进行检测虽然操作简单,方便使用,但在很大程度制约了其检测的灵敏度。
近年来,荧光探针——由于其具有背景信号低、灵敏度高、对样品预处理的要求低等诸多优点,在分析测试领域,尤其是在生物医药领域受到了人们广泛的关注。目前,已有较多的荧光探针化合物用于高灵敏度和实时的对β-内酰胺酶的检测。然而,这些化合物不具有选择性,即不可能区分普通β-内酰胺酶和碳青霉烯酶。国际专利申请WO 2012/003955A1公开了一种“基于碳青霉烯母核结构设计的具有一定荧光性能的碳青霉烯酶荧光探针”,但是它没有明确所述荧光探针的光学性能和对酶检测的生物学性质。2014年,Rao等人报道了用于检测对碳青霉烯具有耐药性的肠科杆菌的荧光探针(Angew. Chem. Int. Ed. 2014, 53, 8113–8116)。所述荧光探针是基于常见的头孢菌素母核,将6,7-位的构象由trans转变为cis构象,合成一系列的化合物,从而实现对β-碳青霉烯酶及表达有碳青霉烯酶细菌的选择性检测。但是,所述荧光探针在荧光性能方面都具有一些不足,例如波长短、灵敏度和选择性存在不足等问题。因此,研究和开发一种具有精确性和灵敏度、有高选择性、且使用费用低、简单可行的快速检测有碳青霉烯酶表达的细菌及其耐药菌的方法具有非常重要的意义,也为尽可能的减少抗药性细菌的出现和延长现有抗生素的使用寿命,防止抗生素的滥用和误用提供一个有效的手段。
技术实现要素:
本发明的目的在于要解决上述问题,提供一类耐碳青霉烯类抗生素病菌的荧光探针,它们是基于碳青霉烯类抗生素设计的用于检测产生碳青霉烯酶的荧光探针化合物,可用于检测产生碳青霉烯酶的耐药菌并具有精确性和灵敏度、有高选择性、且使用费用低、简单可行。本发明的第二目的是,提供所述荧光探针的合成方法。本发明的第三目的是,提供所述荧光探针在检测碳青霉烯酶和含有碳青霉烯耐药菌中的应用。
为实现上述目的,本发明采取了以下技术方案。
一种耐碳青霉烯类抗生素病菌的荧光探针,其特征在于,所述荧光探针的结构通式为:
,
在结构通式中:
X为碳原子或硫原子;当X为CH时,R1为甲基,能够为R或S构型;或者X为CH2或S;
Y荧光基团芳香环上的氧原子、硫原子或连接基团(linker),包括4-羟甲基苄基或4-羟基或巯基苄基或氨基甲酸酯连接基团。
进一步,所述荧光基团(fluorophore)为吸收和发射的荧光基团,如7-羟基香豆素、荧光素、萘酰亚胺类染料或菁染料。
进一步,所述荧光探针包括其羧酸酯或者羧酸盐(R3为氢原子或者烷基),所述荧光探针化合物能与生物标记物碳青霉烯酶选择性识别,从而起到检测碳青霉烯酶的作用。
一类耐碳青霉烯类抗生素病菌的荧光探针,其特征在于,所述荧光探针是在培南类(penem)抗生素母核的3’-位引入具有离去功能性的荧光基团或者发色基团,在碳青霉烯酶(carbapenemase)的作用下使β-内酰胺环开环,从而释放出荧光基团或者发色基团,产生光学性质的变化,使所述荧光探针具有用于检测青霉烯酶及其耐药菌的性质,其结构通式的表示为:
,
在结构通式中:
X为碳原子或硫原子;当X为CH时,R1为甲基,能够为R或S构型;或者X为CH2或S;
Y荧光基团芳香环上的氧原子、硫原子或连接基团(linker),包括4-羟甲基苄基或4-羟基或巯基苄基或氨基甲酸酯连接基团。
为实现上述第二目的,本发明采取了以下技术方案。
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其特征在于,包括以下步骤:
(1)化合物2的制备
在氩气保护下,将叔丁基二甲基氯硅烷(TBDMSCl)与咪唑依次加入到美罗培南中间体F9的干燥DMF溶液中;在20℃反应5小时后加入乙酸乙酯,用水和饱和食盐水洗涤,再用无水硫酸钠(Na2SO4)干燥、浓缩,经硅胶柱柱层析纯化后得到白色固体的化合物2;
(2)中间体3,4的制备
将步骤(1)得到的化合物 2及四醋酸铑(Rh2(OAc)4加入到干燥二氯化锌(ZnCl2)的二氯甲烷体系中,在氩气保护下,将反应体系加热回流90分钟;通过薄层色谱(TLC)监测反应完全后即可得到中间体3;
将反应体系冷却至-55℃,将2,2,6,6-四甲基哌啶与二异丙基乙二胺混合后滴加到反应体系;然后,滴加三氟甲磺酸酐(Tf2O);反应完全后,将反应液经硅胶柱柱层析纯化后得到白色固体的中间体4;
(3)化合物5的制备
将ZnCl2与N,N-甲基吡咯烷酮(NMP)体系在真空状态下脱气置换氩气(Ar);之后依次加入中间体4、三(2-呋喃)磷、三(二亚苄基丙酮)二钯(Pd2dba3),将所得溶液在25℃下搅拌10min,然后缓慢地加入三丁基乙烯基锡;将反应体系在30℃下反应10消失后用乙酸乙酯稀释,再用水洗两次以及用饱和食盐水洗一次,将有机相用无水硫酸钠干燥、浓缩;经硅胶柱柱层析纯化后得到白色固体的化合物5;
(4)化合物6的制备
将步骤(3)得到的化合物5溶解于四氢呋喃(THF)与水中,加入四氧化锇(OsO4)水溶液,同时加入高碘酸钠(NaIO4)和高碘酸(H5IO6);将反应体系在25℃室温下搅拌25min,之后倒入到10%的硫代硫酸钠(Na2S2O3)水溶液中,用乙酸乙酯萃取,无水硫酸钠干燥、浓缩,经硅胶柱柱层析纯化后得到黄色固体的化合物6;
(5)化合物7的制备
在氩气保护下,向反应瓶中加入步骤(4)得到的化合物6及干燥的四氢呋喃,冷却到-15℃后加入硼烷-四氢呋喃复合物,将反应体系在-15℃温度下搅拌10min,之后向反应体系中加入冰冷乙酸乙酯与水,用乙酸乙酯萃取,用无水硫酸钠干燥、浓缩,得到化合物7(产率约85%的粗产物),无需纯化直接进行下一步反应;
(6)化合物8的制备
在氩气保护下,在反应瓶中加入步骤(5)得到的化合物7及二氯甲烷, 冷却到 0℃后缓慢加入吡啶及异丁基氯甲酸酯,在0℃条件下反应4h,经硅胶柱柱层析纯化后得到化合物8;
(7)化合物9的制备
在氩气保护下,在反应瓶中加入步骤(5)得到的化合物8及甲苯和四氢呋喃,将所述溶液在液氮乙醇体系中冷却到-60℃,脱除溶液中的气体;加入(二亚苄基丙酮)二钯-氯仿加合物(Pd2dba3-CHCl3)和亚磷酸三乙酯;将反应体系在25℃室温下搅拌2h,之后加入步骤(5)得到的化合物8和7-羟基香豆素;将反应体系再脱气后,在30℃条件下反应18小时;将反应液去除溶剂后,用石油醚、乙酸乙酯作为流动相在硅胶柱上纯化得到白色固体的化合物9;
(8)化合物10的制备
将步骤(7)得到的化合物9溶解于N-甲基吡咯烷酮与N,N-二甲基甲酰胺的混合液中,N-甲基吡咯烷酮与N,N-二甲基甲酰胺的质量比为1:3,加入二氟化氢铵,在室温下反应40h,之后加入乙酸乙酯稀释反应体系,将乙酸乙酯相用水洗,再用饱和食盐水洗,用无水硫酸钠干燥、浓缩;将所得混合物用石油醚与乙酸乙酯作为流动相经硅胶柱柱层析纯化后得到化合物10 ;
(9)化合物CPC-1的制备
将步骤(9)得到的化合物10溶解于四氢呋喃中,加入pH为7.0 的0.2M磷酸盐缓冲液(PB)以及5%的铂碳催化剂(Pt/C),置换氢气后在25℃下反应2h;将反应液过滤除掉铂碳后加入去离子水,用乙酸乙酯萃取,将水相用反相C18制备柱纯化,冷冻干燥,得到白色固体的化合物CPC-1,即所述的荧光探针:
所述荧光探针(CPC-1)的合成路径及结构通式为:
。
进一步,所述化合物8为关键中间体,以此为衍生物能够合成其他荧光基团的荧光探针化合物,或者是以4-羟基、氨基甲酸酯为连接基团的荧光探针化合物。
为实现上述第三目的,本发明采取了以下技术方案。
所述耐碳青霉烯类抗生素病菌的荧光探针在检测碳青霉烯酶和含有碳青霉烯耐药菌以及在生物、预防保健、临床诊断各领域的应用。
进一步,所述荧光探针能制成试纸、试剂盒或者检测芯片用于检测。
进一步,所述应用的方法包括以下步骤:
(1)将本发明的荧光探针与待测样品在一定条件下混合,形成具有光学性质的化合物;
(2)测量具有光学性质的化合物的光学信号变化,从而确定待测样品中碳青霉烯酶或者含有碳青霉烯耐药菌的含量或浓度。
本发明的积极效果是:
(1)提供了一类耐碳青霉烯类抗生素病菌的荧光探针,可用于检测碳青霉烯酶和含有碳青霉烯耐药菌并具有精确性和灵敏度、有高选择性、且使用费用低、简单可行。
(2)提供了所述荧光探针的合成方法。
(3)提供的荧光探针可应用于临床耐药菌检测,可快速检测有碳青霉烯酶表达的细菌及其耐药菌,对在医疗中不用或者少用抗生素药物具有非常重要的意义。
附图说明
图1为本发明耐碳青霉烯类抗生素病菌的荧光探针的合成方法的流程框图。
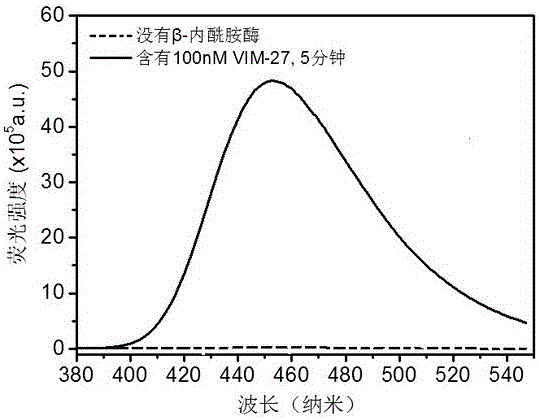
图2为本发明的荧光探针在碳青霉烯酶VIM-27下荧光变化图。
图3为本发明的荧光探针在一定浓度的酶下随时间的荧光变化图。
图4为待检测细菌样品与荧光探针混合培养2小时后的荧光成像图。
具体实施方式
以下结合附图具体介绍本发明的具体实施方式和相关检测效果。但是需要指出,本发明的实施不限于以下的实施方式,实施例中未注明具体条件的实验方法,通常是按照常规条件,或者是按照制造厂商所建议的条件。
本发明提供的荧光探针,是在培南类(penem)抗生素母核的3’-位引入具有离去功能性的荧光基团或者发色基团,在碳青霉烯酶(carbapenemase)的作用下使β-内酰胺环开环,从而释放出荧光基团或者发色基团,产生光学性质的变化,使所述荧光探针具有用于检测青霉烯酶及其耐药菌的性质,其结构通式为:
,
在结构通式中:
X为碳原子或硫原子;当X为CH时,R1为甲基,能够为R或S构型;或者X为CH2或S;
Y荧光基团芳香环上的氧原子、硫原子或连接基团(linker),包括4-羟甲基苄基或4-羟基或巯基苄基或氨基甲酸酯连接基团。
以下介绍本发明的耐碳青霉烯类抗生素病菌的荧光探针的合成方法的具体实施方式(参见图1)。
说明:在本发明的实施中,1H-NMR用Bruker 400Mz型仪器测定,测定溶剂为氘代三氯甲烷(CDCl3),内标为四甲基硅烷(TMS);所有溶剂均为色谱纯、分析纯或化学纯,所使用的无水溶剂均是按标准方法干燥处理获得的。除另有说明的以外,所有反应均是在氩气保护下进行并用TLC跟踪;产品的纯化除另有说明的以外均使用硅胶柱色谱法,所使用的硅胶为200-300目。
实施例1
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物2的制备方法为:
在氩气保护下,在反应瓶(schlenk)中加入美罗培南中间体F9的干燥DMF20毫升溶液,然后依次加入叔丁基二甲基氯硅烷TBDMSCl3.62g(2mmol,4当量equiv)和咪唑2.45g (36mmol, 6equiv);在20℃条件下反应5h后加入乙酸乙酯,用水和饱和食盐水洗涤,无水硫酸钠干燥,浓缩后用硅胶柱柱层析得到白色固体的化合物2共2.95g,产率为98%;
其合成路径及结构通式为:
。
实施例2
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其中间体3,4的制备方法为:
取二氯化锌68mg(0.5mmol)置于反应瓶瓶中,干燥后加入二氯甲烷,加入实施例1制备的化合物 2及四醋酸铑(Rh2(OAc)4,在氩气保护下,将反应体系加热回流90分钟;通过薄层色谱(TLC)监测反应完全后得到中间体3的溶液。
将7.6g(15mmol)重氮化合物 2、67mg(0.15mmol)Rh2(OAc)4、40mL干燥的二氯甲烷依次加入到反应瓶中,在氩气保护下,将反应体系加热至回流90min,通过TLC监测反应完全后,冷却至-55℃,将2,2,6,6-四甲基哌啶3.03mL(18mmol)与二异丙基乙二胺1.4mL (7.65mmol)混合后滴加15min以上时间;然后,滴加三氟甲磺酸酐(Tf2O)2.6mL(15.75mmol) 40min以上时间;滴加完毕后,再在-50℃下反应1h;将反应液通过硅胶柱纯化后得到白色固体的中间体4共8.99g, 产率为98%;
其合成路径及结构通式为:
。
实施例3
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物5的制备方法为:
将ZnCl2 3.38g(24mmol,1.8equiv) 置于反应瓶中,在真空下用电烤枪烘烤反应管;冷却后,加入20mL氮甲基吡咯烷酮(NMP),待体系冷却后,在真空状态下脱气置换Ar三次;之后依次加入实施例2制备的中间体4共8.15g(13.5mmol)、三(2-呋喃)磷275mg、Pd2dba3 275mg(1.2mmol);将所得溶液在25℃室温下搅拌10min,然后缓慢地加入三丁基乙烯基锡4.8mL(16.8mmol);将反应体系在30℃条件下反应10h后用150mL乙酸乙酯稀释,分别用水洗两次及饱和食盐水洗一次,有机相用无水硫酸钠干燥,最后通过柱层析后得到白色固体的化合物5 共6.1g, 产率为93%;
其合成路径及结构通式为:
。
1H NMR (400 MHz, CDCl3) δ 8.21 (d, J = 8.6 Hz, 2H), 7.66 (d, J = 8.5 Hz, 1H), 7.36 (dd, J = 17.8, 11.1 Hz, 1H), 5.56 (d, J = 17.8 Hz, 1H), 5.48 (d, J = 11.2 Hz, 1H), 5.44 (d, J = 13.9 Hz, 1H), 5.26 (d, J = 13.9 Hz, 1H), 4.30 – 4.22 (m, 1H), 4.20 (dd, J = 9.4, 2.6 Hz, 1H), 3.44 – 3.33 (m, 1H), 3.23 (dd, J = 5.5, 2.7 Hz, 1H), 1.25 (d, J = 6.2 Hz, 3H), 1.21 (d, J = 7.3 Hz, 3H), 0.84 (s, 9H), 0.07 (s, 3H), 0.06 (s, 3H). 13C NMR (101 MHz, CDCl3) δ = 173.01, 160.88, 149.10, 147.67, 143.03, 129.03, 128.20, 125.81, 123.82, 121.92, 65.96, 65.33, 59.23, 56.20, 38.98, 25.77, 22.53, 18.03, 16.86, -4.12, -4.90.
实施例4
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物6的制备方法为:
将实施例3制备的化合物5溶解于27mL THF和37mL H2O中,加入63mgOsO4 (1.5%W/V水溶液),之后立即同时加入NaIO4和H5IO6;将反应体系在25℃室温下搅拌25 min,而后倒入10%的Na2S2O3水溶液中,用乙酸乙酯萃取(65mL×2),无水硫酸钠干燥,浓缩,经硅胶柱纯化后得到黄色固体的化合物6共1.08g, 产率为45%;
其合成路径及结构通式为:
。
1H NMR (400 MHz, CDCl3) δ 10.36 (s, 1H), 8.23 (d, J = 8.7 Hz, 2H), 7.66 (d, J = 8.6 Hz, 2H), 5.49 (d, J = 13.7 Hz, 1H), 5.36 (d, J = 13.7 Hz, 1H), 4.36 (dd, J = 10.4, 3.3 Hz, 1H), 4.33 – 4.24 (m, 1H), 3.55 – 3.44 (m, 1H), 3.41 (t, J = 3.9 Hz, 1H), 1.26 – 1.18 (m, 6H), 0.84 (s, 9H), 0.07 (s, 3H), 0.06 (s, 3H). 13C NMR (101 MHz, CDCl3) δ 189.06, 172.95, 159.36, 147.95, 143.19, 141.82, 140.14, 128.50, 123.95, 66.51, 65.16, 60.97, 56.21, 38.08, 25.73, 22.14, 18.04, 16.39, -4.12, -5.05.
实施例5
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物7的制备方法为:
在氩气保护下,向反应瓶中加入实施例4制备的化合物6共62mg(1.37mmol)及12mL干燥的THF,冷却到-15℃后加入硼烷-四氢呋喃复合物(1.0Min THF;1.4mL),反应体系在-15℃温度下搅拌10min,而后向反应体系中加入比例为1:1的冰冷乙酸乙酯与水(≈40mL ),用乙酸乙酯萃取 (40mL×2),无水Na2SO4干燥,浓缩,HPLC分析得到化合物7粗产物,产率85%,无需纯化直接用于下一步反应;
其合成路径及结构通式为:
。
实施例6
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物8的制备方法为:
在氩气保护下,在反应瓶中加入实施例5制备的化合物7为768mg(1.57 mmol)及10mL二氯甲烷, 冷却到 0℃后缓慢加入吡啶510μL( 6.3mmol)及异丁基氯甲酸酯622μL(4.8 mmol),在0℃下反应4h,而后经硅胶柱纯化得到化合物8共0.66g,两步的产率为71%;
其合成路径及结构通式为:
。
1H NMR (400 MHz, CDCl3) δ 8.20 (d, J = 8.5 Hz, 2H), 7.64 (d, J = 8.5 Hz, 2H), 5.57 (d, J = 14.4 Hz, 1H), 5.44 (d, J = 13.9 Hz, 1H), 5.25 (d, J = 13.8 Hz, 1H), 4.80 (d, J = 14.4 Hz, 1H), 4.30 – 4.17 (m, 2H), 3.93 (d, J = 6.7 Hz, 2H), 3.38 – 3.28 (m, 1H), 3.28 – 3.22 (m, 1H), 2.04 – 1.89 (m, 1H), 1.22 (d, J = 6.2 Hz, 3H), 1.19 (d, J = 7.3 Hz, 3H), 0.94 (s, 3H), 0.93 (s, 3H), 0.84 (s, 9H), 0.06 (s, 3H), 0.05 (s, 3H). 13C NMR (101 MHz, CDCl3) δ 174.93, 160.46, 155.09, 147.72, 145.53, 142.67, 128.42, 128.20, 123.81, 74.59, 65.75, 65.59, 61.72, 60.67, 55.74, 40.29, 27.85, 25.74, 22.38, 18.93, 18.01, 15.47, -4.16, -4.95.
研究中我们发现,本发明的合成方法制备的化合物8是一个关键的中间体,能够以此为衍生物合成其他荧光基团的荧光探针化合物,或者是以4-羟基、氨基甲酸酯为连接基团的荧光基团的荧光探针化合物。
实施例7
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物9的制备方法为:
在氩气保护下,将16mL甲苯和8mL四氢呋喃加入到反应瓶中,将溶液在液氮乙醇体系中冷却到-60℃,用氩气/真空置换三次脱除溶液中的气体;将42.5mg Pd2dba3-CHCl3(0.04mmol) 和46μL亚磷酸三乙酯(0.28mmol)加入到反应瓶中,将反应液在25℃室温下搅拌2h,而后加入实施例6制备的化合物8为417mg(0.7mmol)及7-羟基香豆素113mg(0.7mmol);将反应体系再脱气几分钟之后在30℃条件下反应18小时;反应液旋掉溶剂后,用石油醚、乙酸乙酯作为流动相在硅胶柱上纯化得到白色固体的化合物9共293mg, 产率为60%;
其合成路径及结构通式为:
。
1H NMR (400MHz, CDCl3) δ 8.21(d,J = 8.7Hz, 2H), 7.67(d, J = 8.7Hz, 2H), 7.64 (d, J = 9.6Hz,1H), 7.38(d, J = 8.5Hz,1H), 6.87 – 6.81 (m, 2H), 6.26 (d, J = 9.5Hz,1H), 5.54 (d, J = 14.4Hz,1H), 5.48 (d, J = 13.9Hz,1H), 5.29 (d, J = 13.9Hz,1H), 4.78 (d, J = 14.4Hz,1H), 4.32–4.22 (m,2H), 3.45–3.35 (m,1H), 3.31 (dd, J = 4.9, 3.3Hz,1H), 1.24 (d, J = 7.8Hz,3H), 1.22 (d, J = 6.4Hz,3H), 0.85 (s,10H), 0.07 (s,3H), 0.06 (s, 3H). 13C NMR (101MHz, CDCl3) δ 175.18, 161.25, 161.04, 160.75, 155.78, 147.66, 146.91, 143.31, 142.51, 129.05, 128.13, 127.87, 123.78, 113.58, 113.10, 112.53, 101.82, 65.65, 65.50, 63.00, 60.75, 55.43, 40.33, 25.70, 22.28, 17.96, 15.49, -4.24, -4.99.
实施例8
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物10的制备方法为:
将实施例7制备的化合物9共 31mg(0.049mmol)溶解于0.6mL的N-甲基吡咯烷酮/N,N-二甲基甲酰胺中,化合物9 与N-甲基吡咯烷酮/N,N-二甲基甲酰胺的体积比为1:3,之后加入11.4mg二氟化氢铵(0.2mmol),在25℃室温下反应40h,而后加入乙酸乙酯稀释反应体系,乙酸乙酯相分别用水洗,饱和食盐水洗,无水硫酸钠干燥后浓缩;将得到的混合物以石油醚、乙酸乙酯体系作为流动相在硅胶柱上纯化得到化合物10共(17.4mg, 产率为68%;
其合成路径及结构通式为:
。
实施例9
一种耐碳青霉烯类抗生素病菌的荧光探针的合成方法,其化合物CPC-1的制备方法为:
将实施例8制备的化合物10共33.8mg(0.065mmol) 溶解于1mL THF,加入0.5mL的0.2M、pH=7.0的磷酸盐缓冲液以及15mg、5%的铂碳(Pt/C),置换氢气后在25℃室温下反应2h;反应液经过过滤除掉铂碳后,加入 4mL去离子水、4mL乙酸乙酯萃取,剩余水相经过反相C18制备柱纯化,冷冻干燥得到白色固体的化合物CPC-1、即所述荧光探针化合物16.4mg;
其合成路径及结构通式为:
。
1H NMR (400 MHz, D2O) δ 7.94 (d,J = 9.5 Hz,1H), 7.56 (d,J = 8.7 Hz,1H), 6.97 (d, J=9.2 Hz,1H), 6.90 (s,1H), 6.30 (d,J=9.4 Hz,1H), 5.45(d,J = 13.3 Hz,1H), 4.79 (s, 2H), 4.24–4.17(m,1H), 4.14(dd,J = 10.0,2.3 Hz,1H), 3.44(d,J=5.1Hz,1H), 3.363.26 (m, 1H),1.27(d,J=6.1Hz,3H), 1.17(d,J=7.3 Hz,3H).
本发明的合成方法制备的荧光探针可制成试纸、试剂盒或者检测芯片应用于检测碳青霉烯酶和含有碳青霉烯耐药菌以及在生物、预防保健、临床诊断各领域。以下提供3个应用实施例对本发明所述的应用进行说明。
应用实施例1
本发明制备的荧光探针化合物在碳青霉烯酶及耐药菌检测中的应用,包括以下步骤:
(1)将本发明的荧光探针化合物与待测样品在一定条件下混合,形成具有光学性质的化合物。
(2)测量具有光学性质的化合物的光学信号变化,从而确定待测样品中碳青霉烯酶或者含有碳青霉烯耐药菌的含量或浓度。
应用实施例2
测试碳青霉烯酶为含有锌离子的B类重组表达的碳青霉烯酶:VIM-27,IMP-1,A类重组表达的碳青霉烯酶:KPC-3。
(1)测定荧光探针化合物在碳青霉烯酶VIM-27下荧光变化(参见图2)
将检测样品(β-内酰胺酶酶或耐药菌)混在磷酸盐缓冲液{1X PBS,pH=7.4, 0.1%表面活性剂〔CHAPS,3-[3-(胆酰胺丙基)二甲基铵]-1-丙磺酸内盐〕}中置于酶标微板内,在25℃下通过酶标仪测量荧光强度的变化,激发波长为365nm,发射波长为460nm,监测20min时间左右。(参见图3,荧光探针在一定浓度的酶下随时间的荧光变化图)。从图中可以看出荧光探针(CPC-1)在低浓度的碳青霉烯酶(IM-27,IMP-1,KPC-3)的作用下即可发生明显的荧光强度的变化,而荧光探针(CPC-1)在没有酶的作用下荧光强度并不发生明显的变化,因而,这一荧光强度变化与否的现象说明本发明制备的荧光探针能用于检测或区分碳青霉烯酶。
应用实施例2只是检测样品的通用条件。需要指出的是:应用实施中使用的检测样品(酶样、菌样、血液样品、尿液样品等)、各种试剂(缓冲体系、酶稳定剂等)、检测条件(酸碱度、温度等)并不局限于上述待检测样品和通用条件。
应用实施例3
本发明制备的荧光探针在检测表达有重组碳青霉烯酶的大肠埃希菌和临床菌中的应用
将表达有不同重组β-内酰胺酶(VIM-27、IMP-1、KPC-3、TEM-1)的大肠埃希菌在LB培养基中37℃过夜生长,之后将细菌悬浮液进行低温离心(转速10000rpm、温度4℃、离心时间5min),去除上清液,将菌饼再悬浮于PBS中,通过测量600nm处的吸光度得到相应的细菌数量并用CFU/mL(每毫升的菌落形成单位)进行表示。对于每个用于研究的菌株按照1︰10的四个梯度进行一系列的稀释;将细菌检测实验在黑色384孔板上进行(总体积为15μL)。在所述384孔板上的每个孔内同时加入5μL的梯度稀释的细菌,然后加入10μL的15μM荧光探针(CPC-1),将得到的待检测样品在25℃室温下培养2h后通过酶标仪监测荧光强度的变化(参加图4,待检测细菌样品与荧光探针化合物混合培养2h后的荧光成像图)。检测结果为:从图4中可以看到,只有表达有碳青霉烯酶的大肠杆菌(VIM-27,IMP-1,KPC-3)能对荧光探针CPC-1产生响应,产生的荧光信号明显,而对照组非碳青霉烯酶的大肠杆菌(TEM-1)以及野生型大肠杆菌不能对荧光探针CPC-1产生响应,几乎没有荧光信号产生。
应用实施例1-3的结构证明:本发明所述的耐碳青霉烯类抗生素病菌的荧光探针能够在检测碳青霉烯酶和含有碳青霉烯耐药菌以及在生物、预防保健、临床诊断各领域的进行应用,可通过所述荧光探针在荧光强度上变化与否的现象来检测或者区分碳青霉烯酶,进而可快速检测有碳青霉烯酶表达的细菌及其耐药菌,指导在医疗临床上合理使用抗生素药物。
- 还没有人留言评论。精彩留言会获得点赞!