异喹啉衍生物及其制备方法和应用与流程
本发明涉及一种具有治疗NK/T细胞恶性肿瘤作用的异喹啉衍生物及其盐,以及该异喹啉衍生物的制备方法。
背景技术:
自然杀伤/T细胞淋巴瘤(NK/T细胞淋巴瘤,NKTCL)属于非霍奇金淋巴瘤(NHL)中较罕见的亚型,大部分恶性细胞来源于NK细胞,但也有很少一部分来源于表达EBV+、CD56-的细胞毒性T细胞。NKTCL多发于亚洲及拉丁美洲,在我国约占T-细胞非霍奇金淋巴瘤(T-NHL)的30.1%。结外NKTCL在临床上以青年男性多见,其病程进展较快,对化疗不敏感,晚期预后差。据文献报道,NKTCL的完全缓解率为44.8~56.0%,5年总生存率(OS)18~50%。NKTCL病变常为局限性Ⅰ期或Ⅱ期,初诊时大多有淋巴结转移。
90%以上的鼻NK/T细胞淋巴瘤有EBV感染。在WHO分类(2008)中,鼻腔NKTCL定义为上呼吸道来源,而鼻腔外NKTCL定义为上呼吸道外NKTCL。后者最常见的原发结外部位包括韦氏环、皮肤、胃肠道、睾丸、肾和软组织等,我国以韦氏环最为常见。
准确分期对选择最佳治疗方案非常重要。联合放、化疗对于局限期(Ⅰ期或Ⅱ期)NKTCL具有较好的疗效;但对于Ⅲ/Ⅳ期患者,无论是鼻腔,还是非鼻腔的及侵袭性的亚型,尽管高强度化疗是其主要治疗方法,但预后不良。虽然综合治疗可使部分NKTCL患者预后改善,但总的生存期并没有明显延长,例如高强度的化疗联合放疗及L-门冬酰胺酶的使用均可使患者受益。虽然有文献报道,大剂量化疗联合造血干细胞移植也可以作为治疗其复发难治晚期的一种补救方法,但大多数患者并不适用。研究新型、毒副作用小和疗效确切的治疗药物,是我国NK/T细胞淋巴瘤(白血病)的当务之急。
对于早期NKTCL患者,没有标准的治疗方案,不同医生之间在其治疗方面有较大差别。治疗方式包括单纯化疗、单纯放疗、放疗后化疗、化疗后放疗或同步放化疗。现有的证据表明,对于早期鼻腔和韦氏环NKTCL,放射治疗是主要治疗手段。单纯放疗的总体有效率(ORR)为77~100%,完全缓解率(CR)52~100%,放疗无效的病人低于17%,绝大部分低于10%。但遗憾的是,很多患者在确诊时候多为晚期,早期患者所占比例很小。
晚期NK /T细胞淋巴瘤的治疗包括以下几方面:左旋门冬酰胺酶、硼替佐米化疗,造血干细胞移植治疗。
虽然国内外最新研究发现,放疗加左旋门冬酰胺酶(L-ASP)的化疗方案对早期和晚期NKTCL都显示出较好的疗效,但所有这些研究均为小样本(多项研究均不到50例),虽近期反应率有所提高,但总生存期并未见延长,且该方案毒副作用严重,72.3%的患者会发生严重的白细胞减少,还有近10%患者死于治疗。此外,用左旋门冬酰胺酶化疗的患者可能会出现过敏反应,严重者甚至出现过敏性休克。
硼替佐米作为第一个应用于临床的蛋白酶体抑制剂,通过影响多种细胞周期调控蛋白及NF-KB活性发挥抗肿瘤作用。最近研究表明,联合硼替佐米+CHOP方案治疗晚期T细胞淋巴瘤或NKTCL淋巴瘤患者,硼替佐米最大量用到1.6mg/m2,总体CR率61.5%,但NKTCL组的OR率为33.3%,是所有亚组中最低的。该研究仅为I期临床研究,纳入的患者数较少。
采用造血干细胞移植治疗NKTCL目前仍处于探索阶段,大多数研究包括的病例数很少。此外,由于患者异质性、试验入组标准、最佳移植时机、预处理方案、造血干细胞来源等情况的不同,造血干细胞移植在NKTCL治疗中的疗效很难评价。
总之,迄今尚未有标准的NKTCL治疗方法。对于早期的鼻型NKTCL,倾向于局部放疗,可联合非蒽环类化疗药物化疗;对晚期或复发患者可用一些较新的化疗方案。但如何进一步提高NKTCL的疗效,仍然是一个重要的课题。
技术实现要素:
本发明的目的是提供一种异喹啉衍生物,以及该衍生物的制备方法。本发明制备的异喹啉衍生物具有治疗NK/T细胞恶性肿瘤的作用。
本发明提供了一种由下述通式(I)表示的异喹啉衍生物或其药学上可接受的盐:
其中:
Y代表羰基或磺酰基;
R代表C1-C4烷基;C1-C10烷基羰基;芳基;N、O或S杂芳基;N、O或S取代的环烷基;或环烷基取代的C1-C4烷基。
具体地,所述的R可以表示为甲基、乙基、异丙基、叔丁基等饱和烷基,或者环己烷基甲基、环戊烷基乙基等环烷基取代的烷基;也可以表示为甲酰基、乙酰基、丙酰基、丁酰基、2-甲基丁酰基、2-丙基戊酰基等烷基羰基;还可以表示为苯基、对甲苯基、对甲氧苯基、邻甲苯基、卤代苯基、萘基等芳基,或者吡啶基、呋喃基、吡喃基、咪唑基、异恶唑基等含有N、O或S原子的杂芳基;还可以是哌啶基、哌嗪基、吗啉基等N、O或S取代的环烷基。
本发明还提供了所述通式(I)表示的异喹啉衍生物的制备方法,所述方法包括:
1)以通式(II)表示的化合物为原料,与二氯亚砜进行卤代反应合成通式(III)表示的化合物;
2)再由通式(III)表示的化合物与高哌嗪进行胺化反应得到通式(IV)表示的化合物;
所述方法还包括:
3)以下述任意一种方法制备得到通式(I)表示的异喹啉衍生物:
3-1)由通式(IV)表示的化合物与RX进行卤代反应;
3-2)由通式(IV)表示的化合物与RCOOH进行缩合反应。
上述通式(II)、(III)和(IV)中的Y代表羰基或磺酰基。
所述化合物RX和RCOOH中,R代表C1-C4烷基;C1-C10烷基羰基;芳基;N、O或S杂芳基;N、O或S取代的环烷基;或环烷基取代的C1-C4烷基。
其中的X为卤素。
本发明上述制备方法可以用如下反应方程式表示。
其中,具体地,所述步骤1)的卤代反应优选在N,N-二甲基甲酰胺溶剂体系中进行,反应温度80~120℃。
更具体地,所述步骤1)的卤代反应中,各原料的用量摩尔比为:通式(II)表示的化合物∶N,N-二甲基甲酰胺∶二氯亚砜=1∶1∶(10~20),反应时间3~6小时。
进而,所述步骤2)的胺化反应中,优选采用二氯甲烷作为溶剂体系,通式(III)表示的化合物与高哌嗪的用量摩尔比为1∶(2~5),所述胺化反应优选在20~40℃条件下进行,反应时间24~48小时。
本发明所述步骤3)可以选择采用RX或RCOOH与通式(IV)表示的化合物进行反应以得到目标产物。具体选择哪一种方法,一般是优先考虑原料获取的难易程度,其次再考虑原料成本。例如,当目标产物所述取代基R为乙酰基时,选择乙酰氯或乙酸进行反应都是可行的,但从成本考虑,应优选使用乙酰氯为原料的卤代反应。但当取代基R为2-丙基戊酰基时,由于原料2-丙基戊酸是容易得到的,但难以获得商品化的2-丙基戊酰氯产品,因此应该优选采用2-丙基戊酸为原料的缩合反应。
进一步地,当所述步骤3)采用缩合反应时,优选使用DMAP(4-二甲氨基吡啶)与EDCI(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)的混合催化剂,在三乙胺溶剂体系中进行反应。所述反应在常温下进行,反应时间48~72小时。
更进一步地,在上述反应体系中,优选的原料用量摩尔比为通式(IV)表示的化合物∶RCOOH∶DMAP∶EDCI∶三乙胺=1∶(1~2)∶(1~2)∶(1~2)∶(3~5)。
优选地,本发明所述异喹啉衍生物或其药学上可接受的盐中,所述的R为2-丙基戊酰基。
更优选地,本发明所述异喹啉衍生物或其药学上可接受的盐中,所述的Y为磺酰基,R为2-丙基戊酰基,其结构式如下所示。
该化合物的分子式为C22H31N3O3S,化学名称1-(4-(异喹啉-5-磺酰基)-1,4-二氮卓-1-基)-2-丙戊酰胺,分子量417.6,油状化合物,易溶于二氯甲烷、乙醇、甲醇、乙腈等溶剂中。
该化合物的制备过程如下。
本发明还提供了所述异喹啉衍生物或其药学上可接受的盐在制备治疗NK/T细胞恶性肿瘤的药物中的应用。
所述治疗NK/T细胞恶性肿瘤的药物中包含有药物有效量的异喹啉衍生物或其药学上可接受的盐,以及常规的药用载体。
以本发明所述异喹啉衍生物作用于悬浮Jurkat细胞系,能够观察到随着异喹啉衍生物作用浓度的增加,对Jurkat细胞的抑制作用明显增加。
附图说明
图1是实施例1制备产物的核磁共振氢谱图。
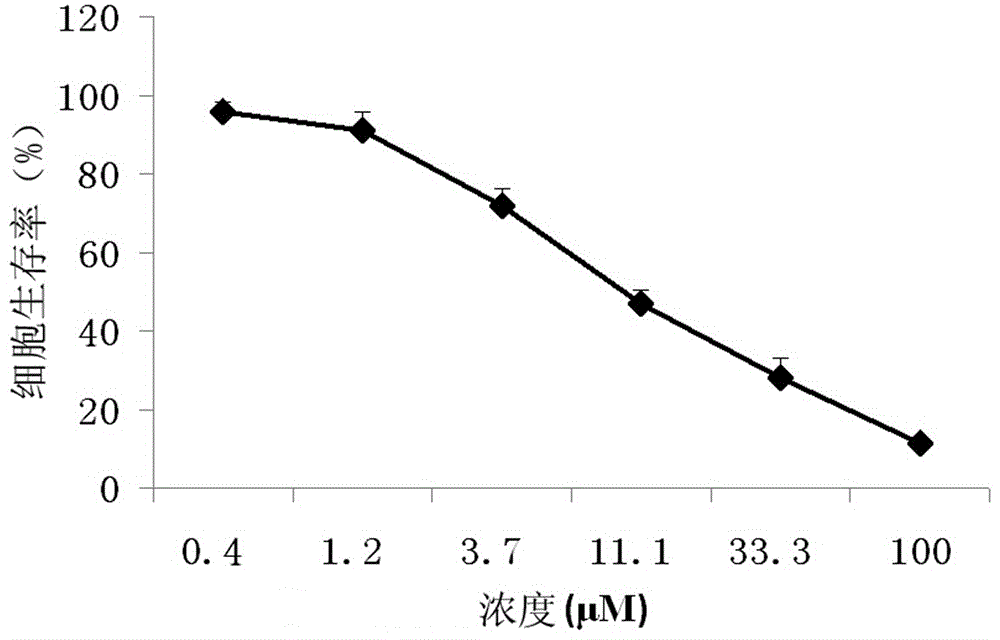
图2是实施例1制备产物对悬浮Jurkat细胞的抑制作用曲线图。
具体实施方式
下述实施例仅为本发明的优选技术方案,并不用于对本发明进行任何限制。对于本领域技术人员而言,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
实施例1
称取5g原料A(5-磺酸基异喹啉),置于50ml圆底烧瓶中,依次加入0.5ml DMF,25ml二氯亚砜,80℃回流反应3h。降至室温,减压蒸干二氯亚砜和DMF,加乙酸乙酯20ml溶解、过滤,蒸干溶剂乙酸乙酯,得到中间产物B(5-磺酰氯异喹啉)5.1g。
将加有8.8g高哌嗪的250ml圆底烧瓶置于冰浴下,加入100ml二氯甲烷,将中间产物B 5.1g溶于50ml二氯甲烷中,缓慢滴加入上述高哌嗪的二氯甲烷溶液中,室温下反应24h,加水50ml停止反应。用二氯甲烷/H2O(V/V)=20∶1的萃取液100ml萃取反应液,收集萃取液并减压蒸干,上硅胶层析柱,以二氯甲烷/甲醇(V/V)=50∶1~20∶1洗脱,洗脱液蒸干得到3.1g中间产物C(六氢-1-(5-异喹啉磺酰基)-1H-1,4-二氮杂卓),产率44.5%。
在250ml圆底烧瓶中加入中间产物C 3.1g、2-丙基戊酸1.84g、DMAP 1.599g、EDCI 2.446g、三乙胺5.8ml,室温反应48h。减压蒸干溶剂,用二氯甲烷/H2O(V/V)=20∶1共100ml进行萃取,减压蒸干,上硅胶层析柱,以二氯甲烷/甲醇(V/V)=120∶1~100∶1洗脱,洗脱液蒸干,得产物D(1-(4-(异喹啉-5-磺酰基)-1,4-二氮卓-1-基)-2-丙戊酰胺)棕色油状液体2g,产率45%。
产物D的核磁共振氢谱图如图1所示,其中:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.82-3.65 (m, 4H), 3.51-3.32 (m, 4H), 2.55 (dtd, J = 13.7, 8.2, 5.5 Hz, 1H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.67-1.51 (m, 2H), 1.39 (dddd, J = 15.5, 12.9, 8.3, 6.0 Hz, 2H), 1.29-1.16 (m, 4H), 0.87 (td, J = 7.3, 2.1 Hz, 6H),证明确实合成了目标结构化合物。
实施例2~7
实施例2~7分别合成了下表结构式表示的目标化合物,其中合成步骤1)与步骤2)与实施例1相同,步骤3)使用的原料及反应条件如表中所述。
各实施例的核磁共振氢谱数据如下。
实施例2:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.82 - 3.65 (m, 4H), 3.51 - 3.32 (m, 4H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.90(s, 3H)。
实施例3:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.82 - 3.65 (m, 4H), 3.51 - 3.32 (m, 4H), 2.18(q,2H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.10(t,3H)。
实施例4:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.82 - 3.65 (m, 4H), 3.51 - 3.32 (m, 4H), 2.90(t, 2H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H) , 1.68(m, 2H),0.98(t, 3H)。
实施例5:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.82 - 3.65 (m, 4H), 3.51 - 3.32 (m, 4H), 2.55 (dtd, J = 13.7, 8.2, 5.5 Hz, 1H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.72(m, 2H), 1.21(d, 3H), 0.76(t, 3H)。
实施例6:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.82 - 3.65 (m, 4H), 3.51 - 3.32 (m, 4H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 2.53(q,2H),1.03(t,3H)。
实施例7:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 7.25(m,2H), 6.92(m, 2H), 6.84(tt, 1H), 3.82 - 3.65 (m, 4H), 3.51 - 3.32 (m, 4H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H)。
应用例1:Jurkat细胞系抑制实验
采用CCK-8检测试剂盒,检测不同浓度的实施例1制备产物对人急性T淋巴细胞白血病细胞株Jurkat细胞活性的抑制作用。
被试细胞系:Jurkat细胞系(购自南京科佰生物科技有限公司)。
在96孔板上接种培养好的Jurkat悬浮细胞液,每孔上液量200μl,含细胞7×103个/孔。在孔内加入不同量的被测药物,使其综浓度分别为0.4μM、1.2μM、3.7μM、11.1μM、33.3μM和100μM,置于37℃、5%CO2饱和湿度培养箱内培养72小时。每个浓度设置3个复孔,同时设置空白组。
丢弃每个孔内的200μl陈旧液,再加入100μl工作液(90μl培养基+10μl CCK-8原液),置于培养箱内约1小时,取出,以酶标仪检测各孔内细胞液在450nm波长处的吸光度。检测时,每孔加10μl CCK-8,培养2~3小时。
根据检测结果,计算经被测药物作用后的Jurkat细胞生存率,以被测药物浓度为横坐标,细胞生存率为纵坐标作图,得到图2所示的曲线图。根据图2可以看出,随着药物浓度的增加,Jurkat细胞的生存率显著下降,呈现出药物剂量与效应的相关性,证明本发明药物对Jurkat细胞具有显著的抑制作用。
实施例8
称取5g原料A(异喹啉-5-甲酸),置于50ml圆底烧瓶中,依次加入0.5ml DMF,25ml二氯亚砜,80℃回流反应3h。降至室温,减压蒸干二氯亚砜和DMF,加乙酸乙酯20ml溶解、过滤,蒸干溶剂乙酸乙酯,得到中间产物B(异喹啉-5-甲酰氯)5.1g。
将加有8.8g高哌嗪的250ml圆底烧瓶置于冰浴下,加入100ml二氯甲烷,将中间产物B 5.1g溶于50ml二氯甲烷中,缓慢滴加入上述高哌嗪的二氯甲烷溶液中,室温下反应24h,加水50ml停止反应。用二氯甲烷/H2O(V/V)=20∶1的萃取液100ml萃取反应液,收集萃取液并减压蒸干,上硅胶层析柱,以二氯甲烷/甲醇(V/V)=50∶1~20∶1洗脱,洗脱液蒸干得到3.8g中间产物C(六氢-1-(5-异喹啉甲酰基)-1H-1,4-二氮杂卓),产率57%。
在250ml圆底烧瓶中加入中间产物C 3.8g、2-丙基戊酸1.84g、DMAP 1.599g、EDCI 2.446g、三乙胺5.8ml,室温反应48h。减压蒸干溶剂,用二氯甲烷/H2O(V/V)=20∶1共100ml进行萃取,减压蒸干,上硅胶层析柱,以二氯甲烷/甲醇(V/V)=120∶1~100∶1洗脱,洗脱液蒸干,得产物D(1-(4-(异喹啉-5-磺酰基)-1,4-二氮卓-1-基)-2-丙戊酰胺)棕色油状液体4.1g,产率72%。
实施例9~14
实施例9~14分别合成了下表结构式表示的目标化合物,其中合成步骤1)与步骤2)与实施例8相同,步骤3)使用的原料及反应条件如表中所述。
各实施例的核磁共振氢谱数据如下。
实施例9:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.84 - 3.62 (m, 4H), 3.49 - 3.30 (m, 4H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.90(s, 3H)。
实施例10:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.84 - 3.62 (m, 4H), 3.49 - 3.30 (m, 4H), 2.18(q,2H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.10(t,3H)。
实施例11:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.84 - 3.62 (m, 4H), 3.49 - 3.30 (m, 4H), 2.90(t, 2H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H) , 1.68(m, 2H),0.98(t, 3H)。
实施例12:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.84 - 3.62 (m, 4H), 3.49 - 3.30 (m, 4H), 2.55 (dtd, J = 13.7, 8.2, 5.5 Hz, 1H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 1.72(m, 2H), 1.21(d, 3H), 0.76(t, 3H)。
实施例13:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 3.84 - 3.62 (m, 4H), 3.49 - 3.30 (m, 4H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H), 2.53(q,2H),1.03(t,3H)。
实施例14:1H NMR (500 MHz, Chloroform-d) δ 9.37 (d, J = 4.0 Hz, 1H), 8.71 (t, J = 5.6 Hz, 1H), 8.41 (t, J = 5.7 Hz, 1H), 8.34 (ddd, J = 11.2, 7.4, 1.1 Hz, 1H), 8.22 (dd, J = 8.2, 4.9 Hz, 1H), 7.71 (td, J = 7.8, 4.5 Hz, 1H), 7.25(m,2H), 6.92(m, 2H), 6.84(tt, 1H), 3.84 - 3.62 (m, 4H), 3.49 - 3.30 (m, 4H), 2.00 (dt, J = 10.2, 6.2 Hz, 2H)。
- 还没有人留言评论。精彩留言会获得点赞!