多重PCR检测七种腹泻病毒用引物组和试剂盒及其检测方法与流程
本发明涉及生物
技术领域:
,具体地,涉及多重PCR检测七种腹泻病毒用引物组和试剂盒及其检测方法。
背景技术:
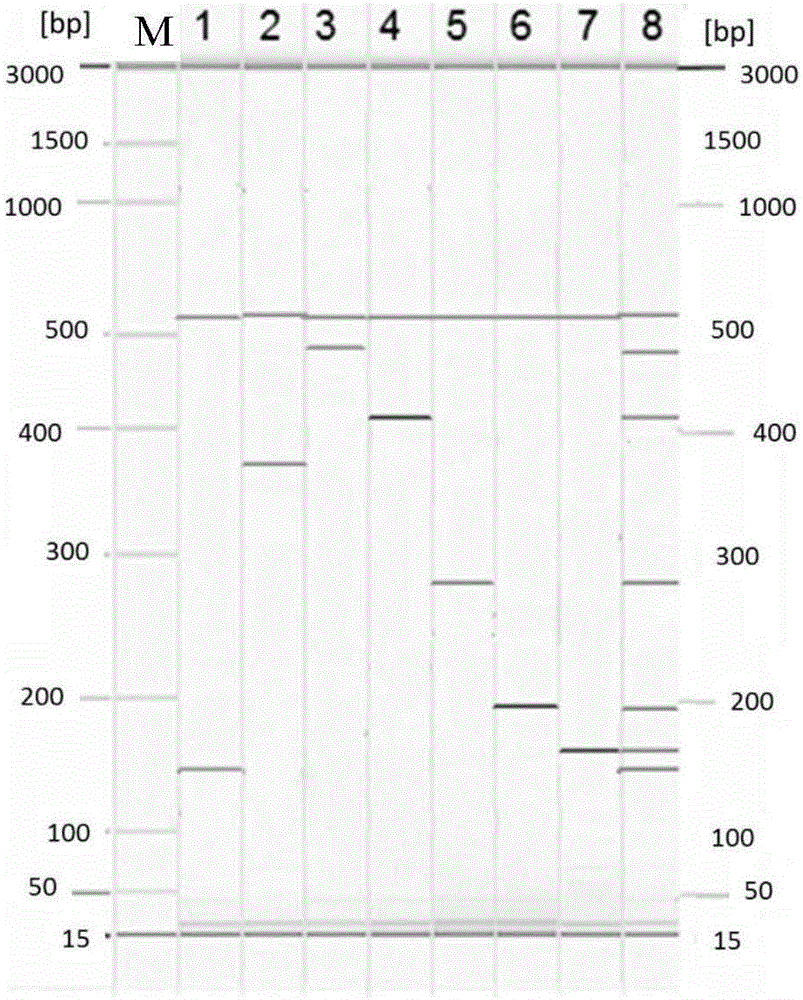
:腹泻病毒感染是危害人类健康的常见病。在发展中国家,已成为导致婴幼儿死亡的主要病因。其中,轮状病毒A组、诺如病毒GI型、诺如病毒GII型、札如病毒、星状病毒、肠道腺病毒、博卡病毒等是引起腹泻的最常见原因。且与细菌、寄生虫引起的腹泻不同,对于病毒性腹泻,目前尚无有效的药物治疗。但由于临床上抗生素的习惯性应用,不仅无法杀灭腹泻病毒,还会杀死肠道中的正常菌群,造成菌群紊乱进而使腹泻时间延长。在对病毒性腹泻的防控中,疫苗接种是最有潜力的方法,因此必须对病毒性腹泻的流行病学特征有充分的认识。所以迫切需要简便、快捷、自动化的腹泻病毒多重检测方法。因大多数腹泻病毒不能分离培养,所以主要采用形态学、免疫学和分子生物学的方法进行检测。最初,腹泻病毒的鉴定主要依赖形态学的方法,如电镜。但电镜法存在仪器设备昂贵、敏感性差的问题。随着免疫学和分子生物学方法的发展,陆续出现了一系列酶免疫和PCR方法用于腹泻病毒的鉴定。其中,对于轮状病毒A组的检测,目前仍主要采用胶体金技术进行检测,但胶体金检测存在灵敏度低、假阳性高的问题。对于其他腹泻病毒,更多采用巢式PCR和单重实时荧光PCR方法进行检测。巢式PCR虽有较高敏感性,但因采用两轮PCR对待检目标进行扩增,存在较高的实验室污染风险。单重实时荧光PCR方法需要对一系列的腹泻病毒进行逐一检测,费时费力。目前也有一些采用多重PCR技术筛检腹泻相关病毒的报道,如中国专利申请号为CN201310033219.7的发明专利公布了一种同步检测十三种腹泻病毒的试剂盒及其检测方法。其特点是反转录引物包括十一种腹泻RNA病毒与人RNA内参的RT扩增引物,并公布了引物序列。但该检测需要在GeXP遗传分析仪上实现结果判定,对仪器平台的要求高,且易出现非特异性条带,干扰了结果的判定。且该专利将逆转录和PCR反应分开进行,增加了操作步骤和反应时间。不利于实验室快速获取准确的结果判定。中国专利申请号为CN20131012328.9的发明专利公布了一种腹泻病毒检测试剂盒及其方法,还包含了针对札如病毒1型及2、4型、诺如病毒1型、诺如病毒2型、轮状病毒、腺病毒、星状病毒的引物对及探针序列,可一次性检测其中与腹泻相关的病毒。但该方法采用探针复合编码的方法,不能将不同腹泻病毒的混合感染与单重感染进行有效区分。如诺如病毒2型感染会有FAM和HEX两种信号同时释放,但如果样本为札如病毒和轮状病毒的双重感染,则同样会释放出FAM和HEX两种信号,这对于依赖荧光信号进行结果判定的实时荧光技术平台,会出现结果无法准确判定的难题。其他一些关于腹泻病毒检测的报道,普遍存在未能充分考虑我国主要的流行型别的问题,引物和(或探针)的设计不能够全面覆盖待测目标的问题,假阴性结果的出现导致检出率显著降低的问题。因此现有的腹泻病毒的检测方式存在操作复杂且特异性和敏感性较低等缺陷。技术实现要素:本发明的目的在于解决现有腹泻病毒检测技术中存在的仪器平台昂贵、耗时长、敏感性和特异性差、检出率低和覆盖度差的问题,提供一种新的腹泻病毒检测引物和方法。为达到以上目的,本发明提供了一种多重PCR检测七种腹泻病毒用引物组,其中,该引物组包括SEQIDNO.1和3-16所示的引物;所述七种腹泻病毒包括轮状病毒A组、诺如病毒GI型、诺如病毒GII型、札如病毒、星状病毒、肠道腺病毒和博卡病毒。本发明还提供了一种多重PCR检测七种腹泻病毒的检测方法,该方法包括如下步骤:(1)提取待测样本的总核酸;(2)对所述总核酸进行逆转录获得PCR模板;用本发明所述的引物组对所述PCR模板进行多重PCR扩增,获得多重PCR扩增后的物料;(3)对所述多重PCR扩增后的物料进行核酸电泳检测,得到核酸电泳检测的结果;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有139bp的扩增产物,则指示所述待测样本中含有轮状病毒A组;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有364bp的扩增产物,则指示所述待测样本中含有诺如病毒GI型;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有487bp的扩增产物,则指示所述待测样本中含有诺如病毒GII型;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有415bp的扩增产物,则指示所述待测样本中含有札如病毒;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有282bp的扩增产物,则指示所述待测样本中含有星状病毒;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有200bp的扩增产物,则指示所述待测样本中含有肠道腺病毒;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有166bp的扩增产物,则指示所述待测样本中含有博卡病毒。本发明还提供了检测7种腹泻病毒的试剂盒,所述试剂盒包括本发明所述的多重PCR引物组、逆转录酶和DNA聚合酶;所述七种腹泻病毒包括轮状病毒A组、诺如病毒GI型、诺如病毒GII型、札如病毒、星状病毒、肠道腺病毒和博卡病毒。另一方面,本发明还提供了如上所述的引物组在制备检测七种腹泻病毒的试剂盒中的用途;其中,所述七种腹泻病毒包括轮状病毒A组、诺如病毒GI型、诺如病毒GII型、札如病毒、星状病毒、肠道腺病毒和博卡病毒。通过上述技术方案本发明建立了常见七种腹泻病毒多重PCR检测引物组和检测方法,能够实现形态学、免疫学以及单重实时荧光检测所无法完成的快速、全面、敏感、特异、自动的结果判定,显著地提高了对七种腹泻病毒同时进行检测的敏感性、特异性和简便性。本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。附图说明附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:图1是实施例1中16种无关病原体样本的总核酸与等量的阳性内对照混合后按照本发明所提供的方法进行检测,多重PCR全部扩增到了532bp的阳性内对照条带,但除532bp的阳性内对照条带外,均没有扩增出其它条带的毛细管电泳图谱;其中,M为SizeMarker,1为16种无关病原体样本的总核酸与等量的阳性内对照混合样本。图2是实施例1中37个亚型的标准品质粒在20拷贝/μL的浓度下(以PCR模板的浓度计)均能扩增出各自对应的目的条带和阳性内对照条带的毛细管电泳图谱;其中,M为SizeMarker,泳道1为轮状病毒A组标准品质粒,泳道2为诺如病毒GI型标准品质粒,泳道3为诺如病毒GII型标准品质粒,泳道4为札如病毒标准品质粒,泳道5为星状病毒标准品质粒,泳道6为肠道腺病毒标准品质粒,泳道7为博卡病毒标准品质粒,泳道8为7种腹泻病毒共计37个亚型的标准品质粒与阳性内对照的混合物。图3是对比例1的对比引物组1-7的特异性、敏感性和覆盖率均差于实施例1的引物组的毛细管电泳图谱;其中,M为SizeMarker,泳道1为轮状病毒A组标准品质粒,泳道2为诺如病毒GI型标准品质粒,泳道3为诺如病毒GII型标准品质粒,泳道4为札如病毒标准品质粒,泳道5为星状病毒标准品质粒,泳道6为肠道腺病毒标准品质粒,泳道7为博卡病毒标准品质粒,泳道8为7种腹泻病毒共计37个亚型的标准品质粒与阳性内对照的混合物,泳道9为16种无关病原体样本的总核酸与等量的阳性内对照的混合样本。具体实施方式以下结合附图对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。本发明提供了一种多重PCR检测七种腹泻病毒用引物组,其中,该引物组包括SEQIDNO.1和3-16所示的引物;所述七种腹泻病毒包括轮状病毒A组(Rotavirus,groupA)、诺如病毒GI型(Norovirus-GI)、诺如病毒GII型(Norovirus-GII)、札如病毒(Sapovirus)、星状病毒(Astrovirus)、肠道腺病毒(Adenovirus)和博卡病毒(Bocavirus)。其中,优选地,所述引物组还包括SEQIDNO.17-18所示的引物。SEQIDNO.17-18所示的引物是以pET28a质粒为模板设计的一对引物,作为阳性内对照。本发明的多重PCR引物组检测目标基因包括轮状病毒A组的VP6基因、诺如病毒GI型的orf1-orf2基因、诺如病毒GⅡ型的orf1-orf2基因、札如病毒的orf1-orf2基因、星状病毒的orf1a基因、肠道腺病毒的Hexon基因、博卡病毒的Ns1基因。具体地,腹泻病毒多重PCR检测目标基因和主要流行株的型/亚型如表1所示。表1腹泻病毒多重PCR检测目标基因和主要流行株的型/亚型SEQIDNO.3-18所示的引物的序列中,均含有LHP序列(基于连接序列的同源通用引物(basedonligation-sequencehomogenousPrimer,LHP)。LHP序列如SEQIDNO.2所示。具体地,SEQIDNO.1-18的信息如表2所示。表2引物信息表其中,SEQIDNO.1是同源通用引物,该引物与连接序列CATTAA相连,构成LHP序列(基于连接序列的同源通用引物(basedonligation-sequencehomogenousPrimer,LHP))。本发明还提供了七种腹泻病毒的检测方法,该方法包括如下步骤:(1)提取待测样本的总核酸;(2)对所述总核酸进行逆转录获得PCR模板;用本发明所述的引物组对所述PCR模板进行多重PCR扩增,获得多重PCR扩增后的物料;(3)对所述多重PCR扩增后的物料进行核酸电泳检测,得到核酸电泳检测的结果;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有139bp的扩增产物,则指示所述待测样本中含有轮状病毒A组;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有364bp的扩增产物,则指示所述待测样本中含有诺如病毒GI型;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有487bp的扩增产物,则指示所述待测样本中含有诺如病毒GII型;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有415bp的扩增产物,则指示所述待测样本中含有札如病毒;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有282bp的扩增产物,则指示所述待测样本中含有星状病毒;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有200bp的扩增产物,则指示所述待测样本中含有肠道腺病毒;如果核酸电泳检测的结果显示所述多重PCR扩增后的物料中含有166bp的扩增产物,则指示所述待测样本中含有博卡病毒。其中,优选地,SEQIDNO.3-16所示的引物的最终使用浓度各自为0.1-0.8μM,SEQIDNO.1所示的引物的最终使用浓度为0.4-0.8μM。其中,优选地,步骤(2)的反应条件包括如下a-i的程序:a:49-51℃,28-32min;b:94-96℃,13-18min;c:94-96℃,28-32s,d:54-56℃,28-32s,e:71-73℃,58-62s,进行10个c-e的循环;f:94-96℃,28-32s,g:49-51℃,28-32s,h:71-73℃,59-61s,进行30个f-h的循环;i:71-73℃,5-10min。其中,在上述程序中,程序a为对总核酸进行逆转录获得PCR模板的过程,逆转录的目的是将总核酸中的RNA逆转录为cDNA,而在逆转录过程中总核酸中的DNA不会受到影响,逆转录过程结束后,逆转录获得的cDNA和总核酸中的DNA共同作为PCR模板进行下一步的多重PCR扩增。在本公开所提供的方法中,反应体系的组成成分包括待测样本的总核酸、多重PCR引物组、逆转录酶、DNA聚合酶、PCR反应缓冲液和dNTP,在同一个反应体系中进行逆转录过程和多重PCR扩增反应。其中,所述待测样本可以包括但不限于食品、药品、排泄物、呕吐物和体液中的至少一种。优选地,本发明的多重PCR检测七种腹泻病毒的检测方法不用于诊断。或者说,七种腹泻病毒的定性与定量结果与腹泻是否发生没有一一对应的相关性,也就是七种腹泻病毒的定性与定量结果不属于诊断结果,但是七种腹泻病毒的定性与定量的检测结果能够作为中间信息,供临床医生参考。其中,优选地,所述核酸电泳检测包括核酸凝胶电泳和/或核酸毛细管电泳。在本发明的一种实施方式中,采用QIaxcel全自动毛细管电泳分析仪作为结果分析的平台。基于QIaxcel的全自动操作和设定的智能化结果分析程序,从而实现结果的自动判定分析。本发明还提供了一种多重PCR检测7种腹泻病毒的试剂盒,所述试剂盒包括本发明所述的多重PCR引物组、逆转录酶和DNA聚合酶;所述七种腹泻病毒包括轮状病毒A组、诺如病毒GI型、诺如病毒GII型、札如病毒、星状病毒、肠道腺病毒和博卡病毒。其中,优选地,所述试剂盒还包括PCR反应缓冲液和dNTP。另一方面,本发明还提供了如上所述的引物组在制备检测七种腹泻病毒的试剂盒中的用途;其中,所述七种腹泻病毒包括轮状病毒A组、诺如病毒GI型、诺如病毒GII型、札如病毒、星状病毒、肠道腺病毒和博卡病毒。特别地,本发明的技术方案可以达到如下的检测效果:(一)多重检测本发明所建立的检测方法能够在一次PCR反应中鉴定腹泻相关的七种病毒,快速获得检测结果,节省时间、人力和物力成本。(二)特异性高本发明所建立的检测方法的特异性主要体现在一整套特异性引物的特异性,以及全自动结果判定的有效性。所有引物都经过blast比对分析,具有高度的保守性和特异性;同时经过特异性实验验证能够很好的区分与检测目标种属相近、生存环境相同的细菌及病毒,包括假结核耶尔森氏菌、大肠埃希氏菌、阪崎肠杆菌、志贺氏菌、金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、单核细胞增生性李斯特氏菌、霍乱弧菌、蜡样芽孢杆菌、空肠弯曲菌、结肠弯曲菌、人肠道冠状病毒、人双埃可病毒、沙波病毒、柯萨奇病毒等,证明检测方法具有高度的特异性,能够将非检测目标准确区分开来。(三)灵敏度高本发明所建立的检测方法能够实现7个目标的同时检测,在每一个反应体系中每个检测目标的检测灵敏度可达到20拷贝/μL。(四)成本较低本发明所建立的多重PCR检测方法在操作性上降低了人力成本和时间成本,原来单重检测需要7次人工和7倍时间,现在使用此方法只需要1次人工和1个反应的时间;该多重检测方法同时节省了重复检测同一个样本的试剂消耗,最大可节省50%的试剂成本。(五)节省时间传统的两步法的反应,耗时较长。本发明采用一步法的RT-PCR体系,包括提取在内的整个实验过程仅需3小时,显著缩短了检测所需的时间。(六)覆盖全面本发明所建立的方法可全面覆盖我国主要的腹泻病毒流行株,可对轮状病毒A组的G1P[8]、G2P[4]、G3P[8]、G4、G9P[8]、G10、G12型,诺如病毒G1.4、G1.5、G1.2、G1.3型,诺如病毒GII.4、GII.3、GII.6、GII.12、GII.14、GII.2、GII.16、GII.d、GII.b型,札如病毒GI.1、GI.2、GI.3、GI.5、GI.8、GII.1、GIV型,星状病毒HAstV-1a、HAstV-1b、HAstV-1d、HAstV-2、HAstV-4型,肠道腺病毒Adv40、Adv41型,博卡病毒HBoV-1、HBoV-2、HBoV-4型等进行检测。(七)预防假阴性结果本发明反应体系中添加的阳性内对照,可以有效的提示因为操作失误、PCR抑制物等原因造成的假阴性检测结果。本发明为腹泻病毒快速筛查提供了整体的解决方案,能实现常见腹泻病毒的快速、自动化判定分析。以下,通过实施例进一步详细说明本发明。实施例11、引物合成:按照表3所示的序列,进行SEQIDNO.1和3-18的引物的合成。表3引物序列表以物质的量为单位,将SEQIDNO.3-18的引物各取1重量份,与4重量份的SEQIDNO.1的引物混合,构成本实施例的引物组。然后对上述引物组进行特异性验证和敏感性验证。2、特异性验证:选择以下16种无关病原体作为模拟干扰样本:假结核耶尔森氏菌(购自中国医学菌种保藏中心,编号为53501)、大肠埃希氏菌(购自中国医学菌种保藏中心,编号为44101)、阪崎肠杆菌(购自中国医学菌种保藏中心,编号为21665)、志贺氏菌(购自中国医学菌种保藏中心,编号为51054)、金黄色葡萄球菌(购自中国医学菌种保藏中心,编号为26003)、沙门氏菌(购自中国医学菌种保藏中心,编号为50001)、副溶血性弧菌(购自中国医学菌种保藏中心,编号为21617)、单核增生性李斯特氏菌(购自中国医学菌种保藏中心,编号为54002)、霍乱弧菌(购自中国医学菌种保藏中心,编号为1109)、蜡样芽孢杆菌(购自中国医学菌种保藏中心,编号为63303)、空肠弯曲菌(购自中国医学菌种保藏中心,编号为33291)、结肠弯曲菌(购自中国医学菌种保藏中心,编号为52204)等腹泻相关细菌,以及人肠道冠状病毒(源自国家CDC,编号为IVDC2.2334)、人双埃可病毒(源自国家CDC,编号为IVDC2.2335)、沙波病毒(源自国家CDC,编号为IVDC2.2336)、柯萨奇病毒(源自中国科学院武汉病毒所,编号为IVCAS6.0190)。上述模拟干扰样本用于特异性评估,分别进行总核酸的提取,每种样本提取得到的总核酸溶解于TE缓冲液中,浓度为1ng/μL。使用上述得到的每种样本的总核酸与等量的阳性内对照(pET28a质粒)混合,作为模板,用上述得到的引物组进行逆转录及多重PCR扩增。多重PCR反应体系的配制方案包括:以25μL体系为例,模板2μL,引物组中SEQIDNO.3-18的引物终浓度为0.2μM,SEQIDNO.1的引物终浓度为0.8μM,逆转录酶、DNA聚合酶、PCR缓冲液和dNTP以及MgCl2参照酶说明书使用。反应的条件包括如下a-i的步骤:a:50℃30min;b:95℃15min;c:95℃15-60s,d:50-65℃15-60s,e:72℃30-120s,c-e循环10个反应;f:95℃15-60s,g:45-55℃15-60s,h:72℃30-120s,f-h循环30个反应;i:72℃5-10min。多重PCR产物置于QIAxcel全自动毛细管电泳分析仪中进行分析,结果显示,16种无关病原体样本的总核酸与等量的阳性内对照混合作为模板所进行的多重PCR全部扩增到了532bp的阳性内对照条带,但除532bp的阳性内对照条带外,均没有扩增出其它条带,具体结果如图1所示。由此证明,本实施例的引物组难以被无关病原体所干扰,具有较高的特异性。3、敏感性验证:从中国疾病预防控制中心按照表4获取7种腹泻病毒共计37个亚型的标准品质粒。表4腹泻病毒的标准品质粒信息表将上述标准品质粒稀释为106拷贝/μL的浓度,然后进行梯度稀释并分别与等量的阳性内对照混合,作为敏感性评估的模板;其中,梯度包括106拷贝/μL、105拷贝/μL、104拷贝/μL、103拷贝/μL、102拷贝/μL、50拷贝/μL、20拷贝/μL和10拷贝/μL。用上述得到的引物组进行多重PCR扩增。多重PCR反应体系的配制方案包括:以25μL体系为例,模板2μL,引物组中SEQIDNO.3-18的引物终浓度各自为0.2μM,SEQIDNO.1的引物终浓度为0.8μM,逆转录酶、DNA聚合酶、PCR缓冲液和dNTP以及MgCl2参照酶说明书使用。反应的条件包括如下a-i的步骤:a:50℃30min;b:95℃15min;c:95℃30s,d:55℃30s,e:72℃60s,c-e循环10个反应;f:95℃30s,g:50℃30s,h:72℃60s,f-h循环30个反应;i:72℃8min。多重PCR产物置于QIAxcel全自动毛细管电泳分析仪中进行分析,结果显示,上述37个亚型的标准品在20拷贝/μL的浓度下均能扩增出各自对应的目的条带和阳性内对照条带,具体典型结果如图2所示;由此证明本实施例的引物组的检测灵敏度能够达到20拷贝/μL的水平,并且本实施例的引物组能够覆盖7种腹泻病毒共计37个亚型。图2中,具体地,第1泳道还出现1条139bp的PCR扩增产物,是轮状病毒A组的扩增条带;第2泳道还出现1条364bp的PCR扩增产物,是诺如病毒GI型的扩增条带;第3泳道还出现1条487bp的PCR扩增产物,是诺如病毒GII型的扩增条带;第4泳道还出现1条415bp的PCR扩增产物,是札如病毒的扩增条带;第5泳道还出现1条282bp的PCR扩增产物,是星状病毒的扩增条带;第6泳道还出现1条200bp的PCR扩增产物,是肠道腺病毒的扩增条带;第7泳道还出现1条166bp的PCR扩增产物,是博卡病毒的扩增条带;第8泳道为7种腹泻病毒共计37个亚型的标准品质粒与阳性内对照混合物的扩增条带。对比例1按照实施例1的方法制备对比引物组1-7,见表5。表5对比引物序列表SEQIDNO引物对序列(5’-3’)19CCCGTCGATAAATATCTGCTCTATATTTAATNCTTYTTTTAGRG20CCCGTCGATAAATATCTGCTCTATATTATTAACACTTCTTTTGAA21CCCGTCGATAAATATCTGCTCTATATAAAGGTCGCCGCGAACAG22CCCGTCGATAAATATCTGCTCTATATACCTCCGAGTCCTGCGGC23CCCGTCGATAAATATCTGCTCTATATCTACCATCTGGCGTGCCTTGCACC24CCCGTCGATAAATATCTGCTCTATATTCCAGCAGGTTGGTTTGGAAA25CCCGTCGATAAATATCTGCTCTATATAACTTATGCTAAACTTGC26CCCGTCGATAAATATCTGCTCTATATAGATCCGTGATGCTAATG27CCCGTCGATAAATATCTGCTCTATATGGTCAATGAGTTCGTAGTTAT28CCCGTCGATAAATATCTGCTCTATATGGCAGGACGCCTCGGAGTACC29CCCGTCGATAAATATCTGCTCTATATAACAAGTTCAGAAACCCC30CCCGTCGATAAATATCTGCTCTATATACAACCGGGTTTTGG31CCCGTCGATAAATATCTGCTCTATATAAATCTATTAGTTTATGA32CCCGTCGATAAATATCTGCTCTATATCCTGTAATTATATCCACT区别仅在于,将实施例1的引物组中SEQIDNO.3-4所示的引物替换为SEQIDNO.19-20所示的引物获得对比引物组1。将实施例1的引物组中SEQIDNO.5-6所示的引物替换为SEQIDNO.21-22所示的引物获得对比引物组2。将实施例1的引物组中SEQIDNO.7-8所示的引物替换为SEQIDNO.23-24所示的引物获得对比引物组3。将实施例1的引物组中SEQIDNO.9-10所示的引物替换为SEQIDNO.25-26所示的引物获得对比引物组4。将实施例1的引物组中SEQIDNO.11-12所示的引物替换为SEQIDNO.27-28所示的引物获得对比引物组5。将实施例1的引物组中SEQIDNO.13-14所示的引物替换为SEQIDNO.29-30所示的引物获得对比引物组6。将实施例1的引物组中SEQIDNO.15-16所示的引物替换为SEQIDNO.31-32所示的引物获得对比引物组7。将实施例1的引物组中SEQIDNO.3-16所示的引物替换为SEQIDNO.19-32所示的引物获得对比引物组8。其中,第1泳道样品为轮状病毒A组标准品质粒,引物为对比引物组1;第2泳道样品为诺如病毒GI型标准品质粒,引物为对比引物组2;第3泳道样品为诺如病毒GII型标准品质粒,引物为对比引物组3;第4泳道样品为札如病毒标准品质粒,引物为对比引物组4;第5泳道样品为星状病毒标准品质粒,引物为对比引物组5;第6泳道样品为肠道腺病毒标准品质粒,引物为对比引物组6;第7泳道样品为博卡病毒标准品质粒,引物为对比引物组7;第8泳道样品为7种腹泻病毒共计37个亚型的标准品质粒与阳性内对照混合物,引物为对比引物组8。泳道9为16种无关病原体样本的总核酸与等量的阳性内对照的混合样本,引物为对比引物组8。按照与实施例1相同的方法进行特异性和敏感性试验,典型的结果如图3所示,结果显示本对比例的引物19-32的特异性、敏感性和覆盖率均差于实施例1的引物。如图3所示:第1-7泳道中,第1、2、6泳道对应的检测目标未检测出;第9泳道的特异性展示中,除了阳性内对照外还有其余的杂带,说明其特异性较差。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 李坏死环斑病毒LAMP引物、试剂盒及检测方法与流程
- 一种检测脑炎病毒的引物组合及应用、试剂盒的制作方法与工艺
- 一种犬博卡病毒的通用型PCR检测引物、试剂盒和检测方法与流程
- 检测辣椒叶脉黄化病毒的引物组合物、试剂盒及其应用的制作方法与工艺
- 多重PCR检测七种腹泻病毒用引物组和试剂盒及其检测方法与流程
- 一种检测鲑鱼甲病毒的引物对、SYBR GreenⅠ荧光定量PCR试剂盒及其应用的制作方法与工艺
- 一种用于检测犬圆环病毒的引物和高效CL‑RCA‑PCR检测试剂盒及方法与流程
- 黄瓜花叶病毒LAMP引物、试剂盒及检测方法与流程
- 香蕉束顶病毒LAMP引物、试剂盒及检测方法与流程
- 一种锦鲤疱疹病毒CPA检测引物及应用的制作方法与工艺