一种化合物在制备抑制激肽释放酶KLK7的药物上的应用及合成方法与流程
本发明属于生物医学领域,尤其是涉及一种化合物在制备抑制激肽释放酶KLK7的药物上的应用及合成方法。
背景技术:
特应性皮炎(Atopic Dermatitis,AD)是一种广泛传播的慢性炎症性皮肤病,特点是干燥、鳞状皮肤、炎症、皮肤渗透性增加,AD病人的皮肤对环境中常见的而对正常人无害的因素也会很敏感从而易于受到表面感染。在过去的30年间工业化国家的特应性皮炎的发病率增长了2到3倍,据估计儿童的特应性皮炎患病率达到了15-30%,成人的特应性皮炎患病率达到了2-10%。由于发病机制的复杂性,对AD的发病机制了解得不多,但皮肤屏障功能紊乱已经被证实是AD发展过程中的关键因素之一。皮肤屏障的稳定依赖于颗粒层的角质形成细胞分化为角质细胞和皮肤表层角质细胞脱落(即脱屑)之间的平衡,皮肤的脱屑过程包括由KLKs参与的桥粒的降解,由于桥粒是角质细胞的粘连蛋白,桥粒的降解则会导致角质细胞脱落而致皮肤脱屑。证据显示,局部或暂时性的KLKs活性控制的失调,是AD病人皮肤屏障稳定缺失的主要原因之一。
KLKs(Kallikreins,激肽释放酶)是具有胰蛋白酶或胰凝乳蛋白酶特异性的丝氨酸蛋白酶,其编码基因定位于19q13.4,编码15个分泌型丝氨酸蛋白酶KLK 1-KLK15。已经证明,KLKs存在于正常人的角质层细胞中,目前发现,至少有8种KLK(KLK5,KLK 6,KLK 7,KLK 8,KLK|10,KLK 11,KLK|13和KLK|14)存在于人的角质层和汗液中,其中KLK7占总量的40%。KLK7可能是皮肤损伤的一个关键酶,而且在AD病人中它可能参与一个系统性炎症反应,在AD的角质层KLK7升高最为突出,这提示KLK7在AD的发病机制上可能是至关重要的,因此,抑制KLK7的活性对于AD的治疗显得最为重要。
LEKTI(Lympho-epithelial Kazal-type-related inhibitor,LEKTI)是由SPINK5基因编码的丝氨酸蛋白酶抑制剂家族的成员,LEKTI前体包含一个信号肽和彼此隔开的15个丝氨酸蛋白酶抑制域(D1-D15),表达后迅速被弗林蛋白酶水解为几个蛋白片段,其中包含D6-D9抑制域的LEKTI能抑制胰蛋白酶、胰凝乳蛋白酶、KLK5和KLK7等酶的活性。LEKTI的内源靶至少包括KLK5、KLK7和KLK14,它们共同参与皮肤的脱屑过程。在AD病人,LEKTI表达水平严重降低,导致了KLK7活性的异常升高。尽管LEKTI是表皮内KLK7的天然抑制剂,但作为治疗AD的外用药,其不能透过皮肤角质层,而且其大分子蛋白质的特性也会导致吸收扩散速度过慢、降解速度过快的问题,因而作用非常有限。到目前为止,还没有一种有效的KLK7抑制剂应用于临床。
技术实现要素:
基于此,本发明提供化合物在制备抑制激肽释放酶KLK7的药物上的应用及其合成方法。
本发明技术方案为:
一种化合物在制备抑制激肽释放酶KLK7的药物上的应用,该化合物的结构式为:
合成权利要求1所述的化合物的方法,所述合成路线如下:
其中:
物质二十三的合成:将物质二十一、物质二十二、冰醋酸加入到反应瓶,加热至回流反应4~8小时,冷却,过滤,水洗,二氯甲烷洗,得物质二十三;
物质二十四的合成:向反应瓶中加入物质二十三和吡啶的混合物,再滴加三氯氧磷,加毕,升温反应,反应结束后将反应液冷却至50℃,加入氯仿,搅拌反应,冷却至0~5℃,加入冷水,分出有机相,冷水洗氯仿层为中性,浓缩除去氯仿,干燥得物质二十四;
化合物Ⅳ的合成:向反应瓶中加入物质二十四、物质二十五、甲苯、碳酸钾,回流反应3-4小时,冷至25℃,过滤,用二氯甲烷洗固体,滤液减压浓缩得粗品,粗品以氯仿重结晶得化合物Ⅳ。
优选地,所述物质二十一、物质二十二、冰醋酸的摩尔比为1.0:1.0~2.0:1.5~2.5,回流反应4~8小时,冷却至25℃。
优选地,所述物质二十三、吡啶、三氯氧磷的摩尔比为1.0:1.0~1.5:1.5~2.5,升温至110~120℃反应2-6小时,将反应液冷却至50℃,加入氯仿。
优选地,所述氯仿的体积为吡啶的30~60倍,搅拌反应1~2小时,冷却至0~5℃,加入5~10℃的冷水,冷水的体积为氯仿的0.5~2.0倍。
优选地,所述物质二十四、物质二十五、碳酸钾、甲苯的摩尔比为1.0:1.0~2.0:1.0~2.0:10.0~30.0,回流反应3-4小时,冷却至25℃。
所述化合物或所述方法在制备抑制激肽释放酶KLK7的药物上的应用,其特征在于,所述制备抑制激肽释放酶KLK7的药物上的应用的药物包括:
中的一种或几种的混合物。
优选地,所述制备抑制激肽释放酶KLK7的药物上的应用的药物包括:化合物I、化合物II、化合物III、化合物IV和化合物V的摩尔比为1:1~4:1~5:1~3:1~2。
本发明优点:
1、本发明提供的抑制激肽释放酶KLK7的化合物能够有效的抑制KLK7的活性,其合成方法简单易行,加入适当的辅料和助剂可制备成抑制KLK7活性的药物制剂。
2、采用本发明合成方法副产物产生的少,杂质含量低至0.05%~0.08%。
3、本发明化合物和其他化合物联用,对于激肽释放酶KLK7的活性抑制效率更高。
4、在皮肤中主要表达的丝氨酸蛋白酶还包括KLK5,KLK14,Matriptase与Elastase2。本发明化合物合物对上述丝氨酸蛋白酶在100μM的浓度下均不变现出抑制活性,表明式其KLK7具有良好特异性。
5、本发明化合物在pH8,150mM NaCl,37℃的缓冲液中孵育72h,其对KLK7的抑制活性维持不变,表明本发明化合物的抑制效率高,活性强,并且其抑制效果稳定。
附图说明
图1:本发明实施化合物Ⅳ的浓度与抑制率的关系曲线。
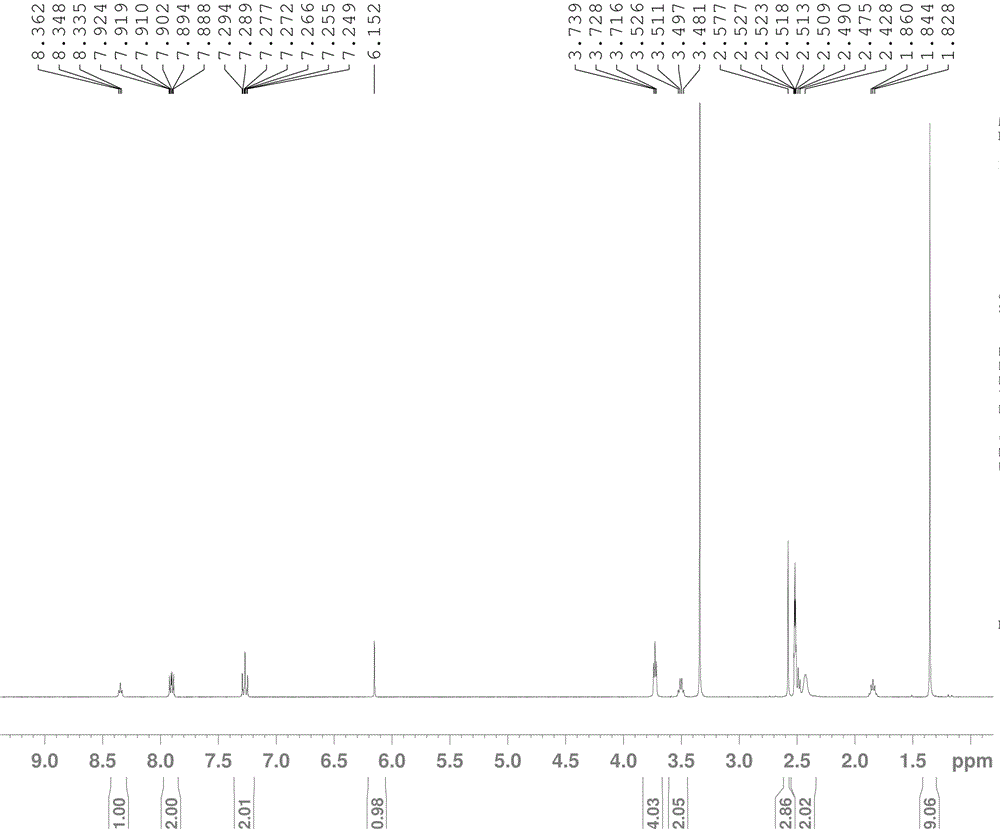
图2:本发明化合物Ⅳ的H1核磁图。
图3:本发明化合物Ⅳ的C13核磁图。
图4:实施例7合化合物浓度与抑制率关系曲线。
具体实施方式
下面结合实施例来进一步说明本发明,但本发明要求保护的范围并不局限于实施例表述的范围。
实施例1
化合物在制备抑制激肽释放酶KLK7的药物上的应用,该化合物的结构式为:
实施例2
合成实施例1所述的化合物的方法,所述合成路线如下:
其中:
物质二十三的合成:将物质二十一、物质二十二、冰醋酸加入到反应瓶,加热至回流反应4~8小时,冷却,过滤,水洗,二氯甲烷洗,得物质二十三;
物质二十四的合成:向反应瓶中加入物质二十三和吡啶的混合物,再滴加三氯氧磷,加毕,升温反应,反应结束后将反应液冷却至50℃,加入氯仿,搅拌反应,冷却至5℃,加入冷水,分出有机相,冷水洗氯仿层为中性,浓缩除去氯仿,干燥得物质二十四;
化合物Ⅳ的合成:向反应瓶中加入物质二十四、物质二十五、甲苯、碳酸钾,回流反应4小时,冷至25℃,过滤,用二氯甲烷洗固体,滤液减压浓缩得粗品,粗品以氯仿重结晶得化合物Ⅳ。
所述物质二十一、物质二十二、冰醋酸的摩尔比为1:1:1.5,回流反应4小时,冷却至25℃。
所述物质二十三、吡啶、三氯氧磷的摩尔比为1:1:1.5,升温至110℃反应2小时,将反应液冷却至50℃,加入氯仿,所述氯仿的体积为吡啶的30倍,搅拌反应1小时,冷却至0℃,加入5℃的冷水,冷水的体积为氯仿的0.5倍。
实施例3
合成实施例1所述的化合物的方法,所述合成路线为实施例2所述:
物质二十三的合成:将物质二十一、物质二十二、冰醋酸加入到反应瓶,加热至回流反应8小时,冷却,过滤,水洗,二氯甲烷洗,得物质二十三;
物质二十四的合成:向反应瓶中加入物质二十三和吡啶的混合物,再滴加三氯氧磷,加毕,升温反应,反应结束后将反应液冷却至50℃,加入氯仿,搅拌反应,冷却至5℃,加入冷水,分出有机相,冷水洗氯仿层为中性,浓缩除去氯仿,干燥得物质二十四;
化合物Ⅳ的合成:向反应瓶中加入物质二十四、物质二十五、甲苯、碳酸钾,回流反应4小时,冷至25℃,过滤,用二氯甲烷洗固体,滤液减压浓缩得粗品,粗品以氯仿重结晶得化合物Ⅳ。
所述物质二十一、物质二十二、冰醋酸的摩尔比为1:2:2.5,回流反应8小时,冷却至25℃。
所述物质二十三、吡啶、三氯氧磷的摩尔比为1:1.5:2.5,升温至120℃反应6小时,将反应液冷却至50℃,加入氯仿,所述氯仿的体积为吡啶的60倍,搅拌反应2小时,冷却至5℃,加入10℃的冷水,冷水的体积为氯仿的2倍。
实施例4
合成实施例1所述的化合物的方法,所述合成路线为实施例2所述:
物质二十三的合成:将物质二十一、物质二十二、冰醋酸加入到反应瓶,加热至回流反应6小时,冷却,过滤,水洗,二氯甲烷洗,得物质二十三;
物质二十四的合成:向反应瓶中加入物质二十三和吡啶的混合物,再滴加三氯氧磷,加毕,升温反应,反应结束后将反应液冷却至50℃,加入氯仿,搅拌反应,冷却至4℃,加入冷水,分出有机相,冷水洗氯仿层为中性,浓缩除去氯仿,干燥得物质二十四;
化合物Ⅳ的合成:向反应瓶中加入物质二十四、物质二十五、甲苯、碳酸钾,回流反应3.5小时,冷至25℃,过滤,用二氯甲烷洗固体,滤液减压浓缩得粗品,粗品以氯仿重结晶得化合物Ⅳ。
所述物质二十一、物质二十二、冰醋酸的摩尔比为1:1.5:1.8,回流反应6小时,冷却至25℃。
所述物质二十三、吡啶、三氯氧磷的摩尔比为1:1.3:1.8,升温至115℃反应5小时,将反应液冷却至50℃,加入氯仿,所述氯仿的体积为吡啶的40倍,搅拌反应1.5小时,冷却至3℃,加入8℃的冷水,冷水的体积为氯仿的0.8倍。
实施例5
1)将化合物Ⅳ溶解在DMSO中,配置成浓度10mM的母液;
2)在KLK7活性缓冲液中加入化合物Ⅳ,配制成6.25μM,12.5μM,25μM,50μM,100μM,200μM的溶液,并在37℃作用15分钟;
3)加入荧光底物MCa-R-P-K-P-V-E-Nval-W-R-K(Dnp)-NH2,在37℃下测KLK7的活性15分钟,采用荧光酶标仪检测荧光值,根据荧光值的大小计算KLK7的活性。
阴性对照组:在KLK7的活性缓冲液中加入DMSO,其它操作条件均与实验组相同。
根据上述实验组和阴性对照组获得的KLK7的活性计算化合物Ⅳ对KLK7的抑制率,计算抑制率的公式为%inhibition=(1-a/b)×100%,计算结果如表1所示;其中,a为待测样品的酶活,b为阴性对照的酶活。
表1为化合物Ⅳ在不同浓度下对KLK7活性的抑制率,根据表1所示的结果绘制化合物Ⅳ的浓度与抑制率的关系图,采用KaleidaGraph软件进行曲线拟合得到化合物Ⅳ的浓度与抑制率的关系曲线,如图1所示。
由表1和图1的结果可以看出,随着化合物Ⅳ浓度的增加,对KLK7活性的抑制率逐渐增高,化合物Ⅳ的浓度为200μM时,对KLK7活性的抑制率达到100%。
因此,化合物Ⅳ对KLK7具有优异的抑制效果,该化合物作为活性组分加入适当的辅料和助剂可制备成抑制KLK7活性的药物制剂。
化合物Ⅳ在不同浓度下对KLK7活性的抑制率
由上述描述可以看出,本发明提供的抑制激肽释放酶KLK7的化合物的制备方法简单易行,能够有效的抑制KLK7的活性,加入适当的辅料和助剂可制备成抑制KLK7活性的药物制剂。
实施例6
所述制备抑制激肽释放酶KLK7的药物上的应用的药物包括:
所述化合物I、化合物II、化合物III、化合物IV和化合物V的质量比为1:1~2:1~2.5:2~3:1~2。
实施例7
实施例6组合物的中按摩尔比为1:1:1:1:1混合后,按照实施例5的方法测试不同浓度下对KLK7活性的抑制率,结果见表2和图4
表2混合物在不同浓度下对KLK7活性的抑制率
由表2结果证明,式化合物I、化合物II、化合物III、化合物IV和化合物V联用效果要比单独使用效果更加显著,同样的添加量情况下,混合物的药效要比单独使用时对KLK7活性抑制率更高。
实施例8
合成化合物I的方法,所述合成路线如下:
其中:
物质三的合成:向反应瓶中加入乙醇、物质一、质量浓度37%的甲醛水溶液、氢氧化钠以及物质二,反应,反应完毕,乙酸乙酯萃取三次,每次乙酸乙酯的用量为前述乙醇体积的1~5倍,合并有机相,蒸馏,冷却,过滤,水洗,乙醇洗,干燥得物质三;
物质四的合成:向反应瓶中加入物质三、醋酐,控制温度为-12℃,滴加质量浓度为90%的发烟硝酸反应,反应完毕,升至25℃,倒入冰水中,冰水的体积为反应液5-10倍,过滤,先用1~5%碳酸氢钠溶液洗,再用冰水洗,干燥得物质四;
物质五的合成:向反应瓶中加入乙醇、水、醋酸、铁粉、氯化铵和物质四,回流反应,再加入乙醇,第二次加入乙醇的质量为物质四的5倍,趁热过滤,滤液冷却至25℃,倒入冰水中,冰水的体积为滤液的10倍,过滤,水洗,干燥得物质五;
物质七的合成:向反应瓶中加入物质五、物质六、二甲基甲酰胺、碳酸钾,反应,冷却至25℃,将反应液加入到冰水中,冰水的质量为反应液的10倍,过滤,水洗,干燥得物质七。
物质八的合成:向反应瓶中加入物质七和吡啶的混合物,再滴加三氯氧磷,升温反应,将反应液冷却,加入氯仿,搅拌,冷却,加入冷水,分出有机相,冷水洗氯仿层为中性,浓缩除去氯仿,干燥得物质八。
化合物I的合成:将二甲基甲酰胺、物质八、碳酸钾和物质九依次加到反应瓶中,加热反应,冷却,将反应液倒入水中,抽滤,滤饼用水淋洗,干燥得化合物I。
所述物质二、质量浓度37%的甲醛水溶液、物质一、氢氧化钠和乙醇的质量比为1:1:1:1:5,25℃下反应2时。
所述物质三、醋酐、硝酸的质量比为1:0.5:0.5,在-5℃下反应4小时。
所述物质四、乙醇、水、醋酸、铁粉、氯化铵质量比为1:2.5:2:0.05:1:0.02,回流反应2小时。
所述物质五、物质六、碳酸钾、二甲基甲酰胺的摩尔比为1:1:1:10,升温至80℃反应4小时。
所述物质七、吡啶、三氯氧磷的摩尔比为1:1:1.5,加毕,升温至100℃反应3小时,将反应液冷却至50℃,加入氯仿,氯仿的体积为吡啶的40倍,搅拌1小时,冷却至0℃,加入5℃的冷水,冷水的体积为氯仿的0.6倍,分出有机相,冷水洗氯仿层为中性,浓缩除去氯仿,干燥得物质八。
所述物质八、物质九、碳酸钾、二甲基甲酰胺的摩尔比为1:2:2:20,加热至50℃,反应1h,冷却,将反应液倒入水中,水的体积为反应液的10倍,抽滤,滤饼用水淋洗,干燥得化合物I。
实施例9
合成化合物II的方法,所述合成路线如下:
其中:
物质十二的合成:将物质十、物质十一、POCl3加入装有回流冷凝管的圆底烧瓶中,将圆底烧瓶放置于超声清洗仪中反应,减压蒸出剩余的POCl3,残余物倾倒于碎冰中,碎冰质量为残余物的20倍,析出沉淀,抽滤,固体用1~5%的NaOH溶液洗涤,水洗至中性,得物质十二;
物质十三的合成:反应瓶中加入二氯甲烷和物质十二,盐冰浴冷却至-15℃,避光,氮气保护下,逐滴加入20wt%三溴化硼的无水二氯甲烷溶液,滴加完后,升温反应,反应结束后将反应液倒入冰水中,冰水的质量为反应液的5倍,分出有机相,水相用乙酸乙酯萃取三次,每次乙酸乙酯的体积为水相的0.5倍,合并有机相,有机相用硫酸钠干燥,蒸出溶剂,得物质十三;
物质十四的合成:将氯乙酸与5wt%氢氧化钠水溶液混合得溶液A,将物质十三与5wt%氢氧化钠水溶液混合得溶液B,将溶液A加入到反应瓶中,再滴加溶液B,滴加完毕,升温反应,冷却,加5wt%盐酸酸化至pH=1,过滤、洗涤、干燥得物质十四;
物质十五的合成:在反应瓶中装有搅拌棒、温度计,回流冷凝管,其回流冷凝管连接氯化氢吸收装置,依次加入氯化亚砜和物质十四,搅拌升温反应,减压蒸出低沸物,瓶内残余物即为物质十五,不经分离直接用于下步反应;
化合物II的合成:在反应瓶中加入上步制得的物质十五,再加入三乙胺、二氯甲烷和物质十六,搅拌反应,减压蒸出溶剂,冷却,过滤,水洗,丙酮洗得化合物II。
所述物质十、物质十一、POCl3的质量比为1:1:3,超声清洗仪中反应温度为50℃,功率为350W,超声作用60分钟。
所述二氯甲烷、物质十二、20wt%三溴化硼的二氯甲烷溶液的质量比为20:1:6,升温至25℃,25℃下反应2小时。
所述溶液A中氯乙酸与氢氧化钠的摩尔比为1:1,所述溶液B中物质十三与氢氧化钠的摩尔比为1:1,将溶液A加入到反应瓶中,再滴加溶液B,加入到反应瓶中的物质十三与氯乙酸的摩尔比为1:1,升温至60℃反应1小时,冷却至25℃。
所述物质十四与氯化亚砜的摩尔比为1:1,搅拌升温至60℃,在60℃下反应5小时。
所述物质十五、物质十六、三乙胺和二氯甲烷的摩尔比1:1:1:5,在0~25℃搅拌2小时。
实施例10
合成化合物III的方法,所述合成路线如下:
其中:
物质十八的合成:将物质十七、KOH、水、二硫化碳加入到反应瓶,,加热至回流,反应2小时,冷至25℃,过滤,滤液用1wt%盐酸调节pH值析出物质十八,过滤、洗涤、干燥得物质十八;
物质二十的合成:向反应瓶中加入物质十八、物质十九、甲苯和碳酸钾,回流反应,冷却过滤,用二氯甲烷洗固体,滤液减压浓缩,残留物用硅胶层析,己烷-乙酸乙酯洗脱,得物质二十。
化合物III的合成:向反应瓶中加入物质二十、4-氟苄氯、NaOH、乙腈,回流反应,冷却,减压蒸出溶剂得残留物,残留物用乙酸乙酯萃取三次,每次乙酸乙酯的体积为残留物的2倍,有机相水洗,再用无水硫酸钠干燥,过滤,滤液减压蒸出溶剂得粗品,粗品以乙腈重结晶得化合物III。
所述物质十七、二硫化碳、KOH、水的摩尔比为1:1:1:5。
所述物质十八、物质十九、碳酸钾、甲苯的摩尔比为1:1:1:5,回流反应,冷却,所述己烷-乙酸乙酯体积比为2:1。
所述物质二十合成中回流反应时间为4小时,冷却至25℃。
所述物质二十、4-氟苄氯、NaOH、乙腈的摩尔比为1:1:1:10,回流反应4小时。
实施例11
合成化合物V的工艺,所述合成路线如下:
其中:
物质二十八的合成:将物质二十六和物质二十七加入干燥圆底烧瓶中,升温进行搅拌反应,薄层色谱跟踪反应至原料消失,将混合物冷却至25℃,倒入冰水混合物中,过滤,水洗,氯仿洗,得物质二十八;
物质二十九的合成:反应瓶中加入依次乙醚、氢化锂铝,搅拌溶解,冰水浴冷却至0℃,再缓慢加入物质二十八,加料完毕,冰水浴下反应,将反应液倒入冰水中,静置让沉淀物停在底部,过滤,氯仿洗滤渣,滤液分出有机相,水相以氯仿萃取三次,有机相合并,减压浓缩得物质二十九。
化合物V的合成:在反应中加入物质二十九、三乙胺、二氯甲烷和物质三十,搅拌反应,浓缩除去二氯甲烷,然后加水,加水质量为浓缩物的10倍,用氯仿萃取三次,萃取剂氯仿每次用量为前述所加水的体积的1倍,有机相合并,减压浓缩得粗品,粗品用氯仿重结晶得化合物V。
所述物质二十六、物质二十七的摩尔比为1:1.,升至80℃进行搅拌反应,所述冰水混合物的质量为物质二十六的5倍。
所述物质二十八、氢化锂铝、乙醚的质量比为1:0.5:15,加料速度以微回流为宜,所述冰水浴下反应1.5小时,将反应液倒入冰水中,冰水的体积为反应液的1倍,萃取剂氯仿每次用量为水相体积的1倍。
所述物质二十九、物质三十、三乙胺和二氯甲烷的摩尔比为1:1:1:10,25℃搅拌1.5小时。
上述的实施例仅为本发明的优选技术方案,而不应视为对于本发明的限制,本申请中的实施例及实施例中的特征在不冲突的情况下,可以相互任意组合。本发明的保护范围应以权利要求记载的技术方案,包括权利要求记载的技术方案中技术特征的等同替换方案为保护范围。即在此范围内的等同替换改进,也在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!