重组蛋白A及其编码基因和应用的制作方法
本发明涉及一种重组蛋白A及其编码基因和应用,属于生物技术领域。
背景技术:
抗体类药物包括含有抗体基因片段的蛋白类药物,与靶抗原可以特异性的结合,同时具有很高的疾病治疗效果和很高的安全性等优点,在肿瘤类疾病,心血管类疾病,尤其是自身免疫性疾病的治疗过程中逐步凸显重要作用,是现在生物类药物中增长率最高的一类药物,在生物制药领域起重要作用。
根据化生物数据库数据统计,2006年全球单克隆抗体规模仅为200亿美元,而2015年已达980亿美元,单克隆抗体药物的制备过程中,对抗体的捕获阶段在抗体的纯化工艺中起着关键作用。现在抗体药物的纯化工艺中,70%以上都在应用以蛋白A为基础衍生的一系列的用于抗体纯化的短链多肽类填料。蛋白A是从A型金黄色葡萄球菌(Staphylococcus aureus)分离而得的一种细胞壁蛋白,具有能够与免疫球蛋白结合的性质,可用于免疫分析和抗体及抗体类药物的提纯。
以蛋白A为基础的抗体药物纯化填料种类繁多,但是它们在抗体药物纯化过程中,大多数容易出现一系列问题:如1.抗体捕获过程中载量较低,增加纯化的成本;2.抗体回收率较低,洗脱过程中,洗脱液的pH值较低,导致部分抗体发生变性,降低了抗体的回收率;3.杂质较多,很多在CIP清洗过程中,NaOH在位清洗的时间较短,导致核酸,内毒素等一些杂质残留较多,无形中增加了抗体中的杂质,同时也一定程度降低了填料的使用寿命;4.配基脱落率高,配基的脱落率很大程度上取决于配基的偶联方式,配基的氨基酸分布,偶联方式的筛选决定了配基的脱落程度,同时配基自身不稳定氨基酸的破坏也导致脱落增加。5.填料价格较高。这些缺陷在一定程度上制约了抗体药物的发展。
技术实现要素:
本发明的目的是为了克服现有蛋白A应用于抗体药物纯化填料中时,抗体捕获量不高、抗体易变性、杂质残留多、配基脱落率高的缺陷,提供一种重组蛋白A及其编码基因和应用。
为实现上述目的,本发明提供的重组蛋白A,其氨基酸序列如SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4所示。
本发明还提供了上述重组蛋白A的编码基因,其核苷酸序列对应地如SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8所示。
本发明还提供了上述重组蛋白A及其编码基因在制备抗体纯化填料中的应用。
本发明的有益效果:
1)经过修饰改造后的氨基酸序列,再经密码子进行优化处理后,表达量有显著提高。
2)修饰后的蛋白A对蛋白酶有一定的耐受性,减少配基脱落。
3)提高了吸附剂对碱性条件的耐受性,在0.1~0.5mol/L条件下,耐受时间延长,
4)提高了对抗体的吸附性能,人IgG的静态吸附性能达到50~60mg/g。
附图说明
图1为本发明的重组蛋白A的序列设计图。
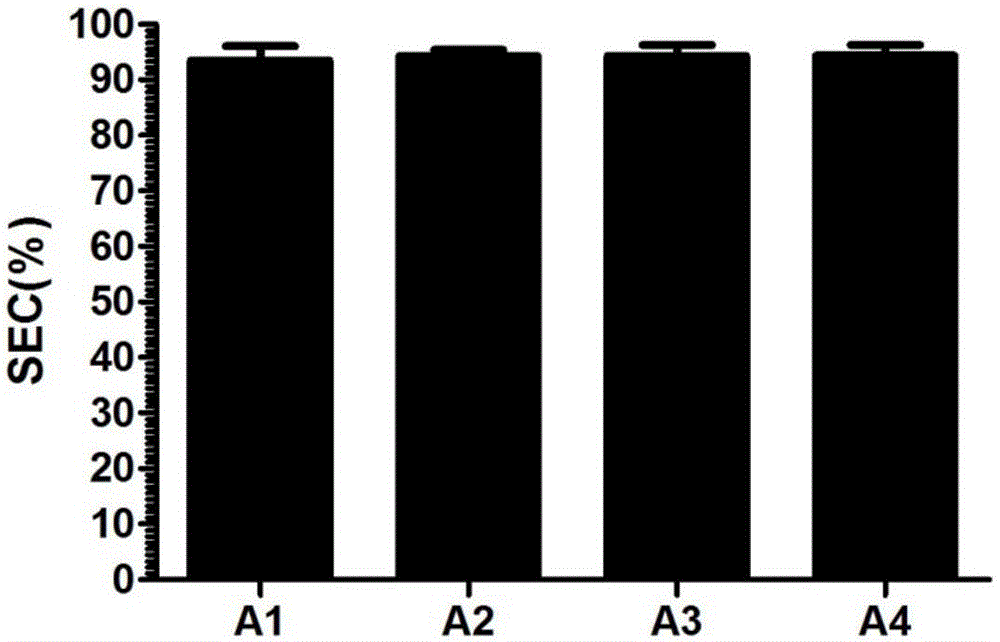
图2为由本发明重组蛋白A吸附微球所制备的抗体纯度对比柱状图。
具体实施方式
以下结合具体实施例和附图对本发明作进一步详细描述。下述实施例中所用方法如无特别说明均为常规方法。
实施例1蛋白A基因的优化
如图1所示,基于天然蛋白A的氨基酸结构进行分析,天然蛋白A氨基酸结构可以分为5个高度同源的氨基酸区域,分别为E,D,A,B,C,每个区域有50个左右氨基酸,尤其是B结构域,同源性最高,很多报道认为B结构域是抗体结合的关键区域,很多修饰改造是基于B结构域,但是我们的修饰改造,第一,二氨基酸螺旋结构基于B结构域,同时在后面添加8个甘氨酸序列,作为连接段连接到第三个螺旋结构域,降低三个螺旋直接的空间位阻,提高吸附性能。第三个螺旋结构采用C结构域并对其进行修饰。
蛋白A的氨基酸序列中,每个结构域都是三个α螺旋组成,每个结构域中都含有对碱性条件敏感的氨基酸,对这些氨基酸进行修饰改造能够提高耐碱性能。每个结构域都含有约8个天冬酰胺,天冬酰胺是对碱性条件最明的氨基酸,为了增强其耐碱性能,将29号位点的甘氨酸G29氨基酸突变为色氨酸(Thr),保持了28号位点天冬酰胺的结构的稳定性,同时增强了耐碱性能。其他天冬酰胺,选择部分进行突变N3A,N7D,N23T,一定程度能够提高耐碱性能。
将以上修饰后的氨基酸进行3,4,5,6个重复序列串联,以串联的形式连接并在末端添加半胱氨酸,做点对点定向偶联,提高偶联量。
设计好的氨基酸序列,翻译成核苷酸序列并委托基因合成公司进行基因合成,分别针对3,4,5,6个重复序列得到SEQ ID NO:5~8。
实施例2重组蛋白A的表达
将上述合成的基因分别构建载体,培养并表达纯化的得到序列对应SEQ ID NO:1~4的重组蛋白A1溶液、重组蛋白A2溶液、重组蛋白A3溶液、重组蛋白A4溶液。
采用表达载体为PET23a,单个重组质粒转化到大肠杆菌RosettaBlue(DE3)pLysS中通过LB液体培养基进行发酵培养并进行诱导表达,发酵后,收集菌体并采用热裂解的方式破坏细胞壁将表达产物释放出来并离心分离。
将分离液体经过IgG亲和介质进行纯化,分离液上样经过亲和介质,用10mM的磷酸盐缓冲液清洗介质,并用pH3.8的缓冲溶液收集目的蛋白,并进行调节到中性环境,保存待用。上述构建载体、培养及蛋白A的表达和纯化均采用常规技术,为本领域技术人员所熟知,此处仅简述过程。
实施例3重组蛋白A制备抗体药物纯化填料
利用实施例2表达得到的重组蛋白A1~A4分别制备重组蛋白A吸附微球1~4,制备过程如下:
1)微球活化
Bio-sep-6FF经过纯化水清洗保存液,砂芯漏斗中抽干,称取10g微球,纯化水20ml,氢氧化钠0.2g,环氧氯丙烷10ml,在100ml三角烧瓶中反应,30℃,120rpm,恒温振荡器中反应5h,完成环氧氯丙烷修饰活化。
2)偶联
在100ml三角烧瓶中,加入80ml重组蛋白A溶液(10mg/ml),加入活化后的微球6FF 10g,再分别加入Na2CO3 10mg,KCL 200mg,(NH4)2SO4 500mg,NaOH 400mg,在恒温振荡器中,37℃,180rpm,8h,然后经过层析柱收集微球,检测洗脱液中的蛋白含量,用PBS缓冲溶液充分清洗凝胶,计算偶联量。
3)封闭
偶联之后再将微球10g与20ml,1mol/L乙醇胺溶液在37℃,180rpm,反应2h,完成对残留的环氧基团的封闭,减小影响。完成吸附微球制备流程,吸附微球偶联量约为10mg/g。
试验例1重组蛋白A吸附微球1~4的IgG吸附性能检测试验
本试验检测步骤如下:
1)取2g重组蛋白A吸附微球装入到10/20cm层析柱中。
平衡缓冲液:10mmol/L磷酸盐缓冲液+0.15M NaCL,pH7.0
洗脱缓冲液:0.1mol/L甘氨酸缓冲液+0.15M NaCL,PH3.8
2)先将Ph 7.0的平衡缓冲液以2ml/min的流速冲系至基线平稳,再以10ml/min的流速注入20ml标准小鼠腹水,上样后再以PH 7.0的平衡缓冲液清洗至基线稳定。
3)用PH 3.8的洗脱缓冲液以5ml/min的流速进行洗脱,收集洗脱液,在洗脱液中滴加pH8.5 1mo/L的Tris溶液,调节PH值至中性。
4)然后用0.5mol/L NaOH以2ml/min的流速清洗填料,清洗时间可以延长至30分钟,再用平衡液清洗,直至基线平稳。
5)最后用20%乙醇清洗,保存等待下一次使用。
为了检验填料的耐碱性能,根据以上步骤,再次使用,通过检验洗脱液中IgG含量,计算吸附性能,推断填料的耐碱性能,重组蛋白A吸附微球1~4的检测结果见下表。
表1.重组蛋白A吸附微球1~4吸附性能比较表
试验例2.重组蛋白A吸附微球吸附的抗体纯度检测
通过对试验例1中各个洗脱液中抗体进行纯化,再利用高压液相色谱SEC-HPLC对其进行纯度检测。结果显示重组蛋白A吸附微球(对应各个吸附微球编号将抗体溶液标记为抗体A1~A4)制备的抗体纯度均在95%以上,见附图2所示,横坐标为抗体编号,纵坐标为纯度数值。
试验例3重组蛋白A吸附微球1~4的配基脱落检测
通过对试验例1中各个洗脱液中抗体进行纯化,并参照市售Protein A ELISA检测试剂盒对重组Protein A检测方法,分别对各纯化后的抗体溶液中重组蛋白A进行检测,计算配基脱落量,结果见表2。
表2.重组蛋白A吸附微球1~4溶液中配基脱落量比较表
上述试验表明,本发明所制备的重组蛋白A配基脱落率低,吸附性能好。
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺