改变细胞命运的手段的制作方法
本发明涉及生物技术领域,更具体的,本发明涉及一种改变细胞命运的方法、一种用于调节细胞组蛋白乙酰化程度的方法、一种用于改变细胞多能性基因Oct4、Nanog、Sox2和Rex1表达水平的方法和一种用于改变细胞异染色质蛋白HP1a在细胞中表达量或定位的方法,以及一种构建体和一种重组细胞。
背景技术:
随着干细胞研究的深入,科学家们发现终末分化的哺乳动物细胞也是具有全能性的,成体细胞可以被重编程,改变基因表达谱从而改变它的命运,重新拥有多能性或者直接转分化变成另一种细胞。早期体细胞重编程的方法主要有两种:核移植和细胞融合,但是这两种方法仍然需要涉及到胚胎,在伦理方面受到极大的限制。2006年,日本Yamanaka实验室在重编程领域获得了突破性的研究成果,发现通过外源表达四个转录因子Sox2,Oct4,Klf4和c-Myc可以使小鼠成纤维细胞重编程为多能干细胞(iPSC),为干细胞研究开拓了一个新的方向,并因此获得诺贝尔奖。随后的短短几年间,体细胞重编程领域的进展异常迅猛。虽然诱导多能干细胞研究初期遇到许多问题,包括外源癌基因插入,效率低下,甚至还有自体免疫反应等问题,但是各种改进方法的提出大大促进了重编程技术的机制及应用研究。通过方法改进,重编程技术被应用到各种物种及细胞中,而不仅仅是小鼠成纤维细胞。科学家们还筛选出各种重编程因子组合,不仅提高了重编程效率与质量,而且还避免了癌基因的插入。科学家们还发展了蛋白诱导,小分子化合物诱导等方法。
重编程技术的目标就是在临床上解决病人特异的多能细胞的大量获得难题。科学家已经在实验室成功用重编程技术和基因修复技术治疗了镰刀型贫血的小鼠。虽然这个技术离临床还很遥远,但是科学家们已经成功诱导出许多单基因突变疾病的病人iPS细胞,用作药物筛选和基因修复。重编程和发育分化是细胞命运的改变。细胞向其他细胞转变的过程中发生了什么,是科学家们迫切想知道的。
然而,如何改变细胞命运尤其是促进体细胞的重编程,仍有待进一步研究。
技术实现要素:
本发明旨在至少在一定程度上解决上述技术问题之一。为此,本发明的一个目的在于提出一种能够有效改变细胞命运尤其是促进体细胞的重编程的方法。
需要说明的是,在本文中所使用的术语“细胞命运”是指从一种细胞类型向另一种细胞类型的转变,包括体细胞的重编程、转分化以及干细胞的分化。
根据本发明的第一个方面,本发明提供了一种改变细胞命运的方法,其包括改变所述细胞中预定蛋白质的表达水平,所述预定蛋白质具有下列氨基酸序列的至少之一:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)与(a)和(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列。其中,SEQ ID NO:1所示的氨基酸序列为Mkk3蛋白的氨基酸序列,具体为:MESPAASPPASLPQTKGKSKRKKDLRISCVSKPPVSNPTPPRNLDSRTFITIGDRNFEVEADDLVTISELGRGAYGVVEKVRHAQSGTIMAVKRIRATVNTQEQKRLLMDLDINMRTVDCFYTVTFYGALFREGDVWICMELMDTSLDKFYRKVLEKNMKIPEDILGEIAVSIVRALEHLHSKLSVIHRDVKPSNVLINKEGHVKMCDFGISGYLVDSVAKTMDAGCKPYMAPERINPELNQKGYNVKSDVWSLGITMIEMAILRFPYESWGTPFQQLKQVVEEPSPQLPADQFSPEFVDFTSQCLRKNPAERMSYLELMEHPFFTLHKTKKTDIAAFVKEILGEDS(SEQ ID NO:1)。其中,SEQ ID NO:2所示的氨基酸序列为Mkk6蛋白的氨基酸序列,具体为:MSQSKGKKRNPGLKIPKEAFEQPQTSSTPPRDLDSKACISIGNQNFEVKADDLEPIVELGRGAYGVVEKMRHVPSGQIMAVKRIRATVNSQEQKRLLMDLDVSMRTVDCPFTVTFYGALFREGDVWICMELMDTSLDKFYKQVIDKGQTIPEDILGKIAVSIVKALEHLHSKLSVIHRDVKPSNVLINTLGQVKMCDFGISGYLVDSVAKTIDAGCKPYMAPERINPELNQKGYSVKSDIWSLGITMIELAILRFPYDSWGTPFQQLKQVVEEPSPQLPADKFSADFVDFTSQCLKKNSKERPTYPELMQHPFFTVHESKAADVASFVKLILGD(SEQ ID NO:2)Mkk3或Mkk6属于MAPK级联系统的中心激酶,它们有双重特性,既能被特异的上游激酶激活,又能激活特异的下游激酶,这样就能保证信号传导的精确性。发明人惊奇地发现,改变细胞Mkk3或Mkk6蛋白表达量,能够有效改变多能性基因启动子区的组蛋白乙酰化,从而影响染色质开放水平,改变多能性基因的表达,从而能够方便有效地改变细胞命运尤其是影响体细胞的重编程。此外,该方法简单易行,效率高,可重复性好。
根据本发明的实施例,上述改变细胞命运的方法还可以进一步包括下列附加技术特征至少之一:
根据本发明的实施例,所述细胞为体细胞或干细胞。由此,能够显著有效地改变体细胞或干细胞的细胞命运。
根据本发明的实施例,改变所述细胞中预定蛋白质的表达水平是通过过表达所述细胞中的预定蛋白质实现的,发明人惊奇地发现,使细胞过表达Mkk3或Mkk6蛋白,能够有效促进多能性基因启动子区的组蛋白乙酰化,从而促进染色质开放,促进多能性基因的表达,从而能够方便有效地改变细胞命运尤其是影响体细胞的重编程。
根据本发明的实施例,所述细胞预先过表达Sox、Klf4、Oct4和c-Myc的至少一种,任选的,所述细胞预先同时过表达Sox、Klf4和Oct4。发明人发现,与现有技术相比,预先过表达Sox、Klf4、Oct4和c-Myc的至少一种,在此基础上过表达Mkk3或Mkk6,可以显著促进多能性基因启动子区的组蛋白乙酰化,从而大大促进染色质开放,显著提高了多能性基因的表达,从而能够更加有效地改变细胞命运尤其是促进体细胞的重编程。
根据本发明的实施例,改变所述细胞中预定蛋白质的表达水平是通过向所述细胞中引入具有选自下列核苷酸序列之一的核苷酸分子而进行的:(a)SEQ ID NO:3或4的至少之一所示的核苷酸序列;(b)SEQ ID NO:3或4的至少之一所示的核苷酸序列的一部分;(c)与(a)和(b)中所示核苷酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的核苷酸序列;(d)在严谨条件下,能够与(a)或(b)中所示核苷酸序列的至少之一或其互补序列杂交的核苷酸序列。其中,SEQ ID NO:3所示核苷酸序列为Mkk3蛋白的编码基因的序列,具体为:atggagtcgcccgccgcgagcccgccggccagcttgcctcagaccaaaggaaaatccaaaaggaaaaaggacttacggatatcctgcgtgtccaagccacctgtgtccaaccccacacccccccggaacctggactcccggaccttcatcactatcggagacagaaacttcgaagtggaggctgatgacttggtgaccatctcagagctgggtcgtggagcctatggggtggtagagaaagtgcggcatgctcagagtggtaccatcatggctgtcaagcgcatccgggccacagtgaacacacaggagcagaaacgtctgcttatggacctagacatcaacatgcgcacggtcgactgcttctacactgtcaccttctatggtgccctcttcagagagggggatgtatggatctgcatggagctcatggacacttccctggataagttctaccggaaggtgctggagaagaacatgaaaattccggaagacatcctgggggagatcgctgtgtctatcgtgcgggccctggagcacctgcatagcaagctgtctgtgatccacagagatgtgaagccatccaatgtcctcatcaacaaggaagggcatgtgaagatgtgcgactttggcatcagtggctacctggtggactctgtggcaaagacaatggatgctggctgcaagccttacatggcccctgagaggatcaaccctgaactgaatcagaagggctacaatgtcaagtctgatgtctggagcctcggcatcaccatgatcgagatggccattctgcgattcccttatgagtcttggggcacaccgttccagcagctgaagcaggtggtggaggagccatccccacagctcccagcggaccagttctcccctgagtttgtggacttcactagccagtgcctaaggaagaaccctgcagagcgcatgagctacctggagctgatggaacacccattcttcaccttgcacaaaactaagaagacagacattgctgcctttgtgaaggagatcctgggagaggattcatag(SEQ ID NO:3)其中,SEQ ID NO:4所示核苷酸序列为Mkk6蛋白的编码基因的序列,具体为:atgtctcagtcgaaaggcaagaagcgaaacccgggccttaagattccaaaagaagcgtttgaacagcctcagaccagttccacgccgcctcgggatttagactccaaggcttgcatatctattggaaaccagaactttgaggtgaaggcagatgacctggagccgatagtggagctgggacgaggtgcgtacggggtggtggagaagatgcgtcacgtgcccagcgggcagatcatggcagtgaagcggatacgggccacagttaatagccaggaacagaaacggctgctgatggatttggatgtctccatgaggacggtggactgtccattcaccgtgaccttctacggtgcactcttccgggagggcgacgtgtggatctgcatggagctcatggatacgtcactagataaattctacaaacaagttattgataaaggccaaacaattccagaggatatcttaggaaagatagcagtttctattgtaaaagcgttagaacatttacacagtaagctgtctgttatccatcgagacgtcaagccttctaatgtgctcattaacacactgggccaggtgaagatgtgtgactttggaatcagtggctacctggtcgactctgttgctaaaacgatcgatgccggttgcaaaccatacatggctcctgaacgaataaatccagagctcaaccagaaggggtacagtgtgaagtctgacatttggagcctgggcatcaccatgatcgagctggccatccttcggtttccttatgattcttggggaacgcccttccagcagctaaagcaggtggtcgaagagccctctcctcagctcccagcagacaagttctccgcggactttgttgactttacctcacagtgcttgaagaaaaattccaaagaacggcccacatatccagagcttatgcaacatccatttttcaccgtacatgaatccaaagcagcagacgtggcatcttttgtaaaactgatacttggggactaa(SEQ ID NO:4)发明人发现,向细胞中引入上述核苷酸分子能够使细胞高效地过表达Mkk3或Mkk6蛋白,进而能够有效促进组蛋白乙酰化水平的提高,从而提高多能性基因的表达,进而能够有效地改变细胞命运尤其是促进体细胞的重编程。
根据本发明的第二方面,本发明提供了一种构建体,包括第一核酸分子,所述第一核酸分子编码具有选自下列氨基酸序列之一的蛋白质:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)(a)与(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列。发明人惊奇地发现,利用本发明的构建体能够有效地将上述编码Mkk3或Mkk6蛋白的相关基因引入受体细胞,并使受体细胞成功过表达Mkk3或Mkk6蛋白,进而能够有效促进多能性基因启动子区的组蛋白乙酰化,提高多能性基因的表达,从而能够有效地改变细胞命运尤其是促进体细胞的重编程。
根据本发明的实施例,上述构建体还可以进一步包括下列附加技术特征至少之一:
根据本发明的实施例,所述第一核酸分子是具有选自下列核苷酸序列之一的核苷酸分子:(a)SEQ ID NO:3或4的至少之一所示的核苷酸序列;(b)SEQ ID NO:3或4的至少之一所示的核苷酸序列的一部分;(c)与(a)和(b)中所示核苷酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的核苷酸序列;(d)在严谨条件下,能够与(a)或(b)中所示核苷酸序列的至少之一或其互补序列杂交的核苷酸序列。发明人发现,利用该构建体能够有效地将上述编码Mkk3或Mkk6蛋白的相关基因引入受体细胞,并使受体细胞高效地过表达Mkk3或Mkk6蛋白,能够有效促进多能性基因启动子区的组蛋白乙酰化,提高多能性基因的表达,进而能够有效改变细胞命运尤其是促进体细胞的重编程。
根据本发明的实施例,所述构建体选自质粒、噬菌体、人工染色体、粘粒以及病毒的至少一种的形式。构建体的形式不受特别限制。任选地,构建体呈质粒的形式。质粒作为遗传载体,具有操作简单,可以携带较大片段的性质,便于操作和处理。质粒的形式也不受特别限制,既可以是环形质粒,也可以是线性质粒,即可以是单链的,也可以是双链的。本领域技术人员可以根据需要进行选择。
根据本发明的实施例,所述构建体用于转化预先过表达Sox、Klf4、Oct4和c-Myc的至少一种的细胞,任选地,所述细胞预先同时过表达Sox、Klf4和Oct4。发明人发现,与现有技术相比,预先过表达Sox、Klf4、Oct4和c-Myc的至少一种,在此基础上过表达Mkk3或Mkk6,可以显著促进多能性基因启动子区的组蛋白乙酰化,从而大大促进染色质开放,显著提高了多能性基因的表达,从而能够更加有效地改变细胞命运尤其是促进体细胞的重编程。
根据本发明的第三方面,本发明提供了一种用于调节细胞组蛋白乙酰化程度的方法,其特征在于,该方法包括改变所述细胞中预定蛋白质的表达水平,所述预定蛋白质具有下列氨基酸序列的至少之一:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)(a)与(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列,任选地,所述调节细胞组蛋白乙酰化程度为提高细胞组蛋白乙酰化程度。根据本发明的实施例,提高细胞组蛋白乙酰化程度是指提高多能性基因启动子区的组蛋白乙酰化程度,从而提高了多能性基因的表达,进而能够有效改变细胞命运尤其是促进体细胞的重编程。
根据本发明的第四方面,本发明提供了一种用于改变细胞多能性基因Oct4、Nanog、Sox2和Rex1等表达水平的方法。该方法包括改变所述细胞中预定蛋白质的表达水平,所述预定蛋白质具有下列氨基酸序列的至少之一:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)与(a)和(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列,任选地,所述改变细胞多能性基因Oct4、Nanog、Sox2和Rex1表达水平为提高细胞多能性基因Oct4、Nanog、Sox2和Rex1的表达水平。其中,需要说明的是,多能性基因的种类不受限制,只要能通过本发明的方法改变多能性基因的表达水平即可,例如Oct4、Nanog和Rex1基因。
根据本发明的第五方面,本发明提供了一种用于改变细胞异染色质蛋白HP1a在细胞中表达量或定位的方法。根据本发明的实施例,该方法包括改变所述细胞中预定蛋白质的表达水平,所述预定蛋白质具有下列氨基酸序列的至少之一:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)与(a)或(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列。异染色质蛋白HP1a对于基因的转录调控、端粒的沉默与加帽等紧密相关。根据本发明的实施例,细胞过表达Mkk3或Mkk6蛋白,能够有效改变细胞异染色质蛋白HP1a在细胞中的表达量和定位,从而影响多能基因的转录调控,提高多能性基因的表达,进而能够有效改变细胞命运尤其是促进体细胞的重编程。
根据本发明的第六方面,本发明提供了一种用于改变细胞组蛋白H1迁移率的方法,该方法包括改变所述细胞中预定蛋白质的表达水平,所述预定蛋白质具有下列氨基酸序列的至少之一:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)与(a)或(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列,任选地,所述改变细胞组蛋白H1迁移率为提高细胞组蛋白H1的迁移率。H1则与核小体间的DNA结合。发明人惊奇地发现,提高细胞组蛋白H1的迁移率,有利于打开染色质的结构,促进多能基因的表达,进而能够有效改变细胞命运尤其是促进体细胞的重编程。
根据本发明的实施例,上述方法还可以进一步包括下列附加技术特征至少之一:
根据本发明的实施例,上述细胞预先过表达Sox、Klf4、Oct4和c-Myc的至少一种,任选地,所述细胞预先同时过表达Sox、Klf4和Oct4。与现有技术相比,预先过表达Sox、Klf4、Oct4和c-Myc的至少一种,在此基础上过表达Mkk3或Mkk6,可以显著促进多能性基因启动子区的组蛋白乙酰化,显著改变细胞异染色质蛋白HP1a在细胞中表达量或定位,显著改变细胞组蛋白H1迁移率,从而大大促进染色质开放,从而能够更加有效地改变细胞命运尤其是促进体细胞的重编程。
根据本发明的实施例,改变所述细胞中预定蛋白质的表达水平是通过过表达所述细胞中的预定蛋白质实现的,过表达Mkk3或Mkk6,能够有效地改变细胞命运尤其是促进体细胞的重编程。
根据本发明的实施例,过表达是通过向所述细胞中引入构建体实现的。构建体作为遗传载体,将编码Mkk3或Mkk6的核酸分子导入宿主细胞,从而实现在宿主细胞中过表达Mkk3或Mkk6,从而改变细胞命运,促进体细胞的重编程。
根据本发明的第七方面,本发明还提供了一种重组细胞,与野生型细胞相比,所述重组细胞中预定蛋白质的表达水平被改变,所述预定蛋白质具有下列氨基酸序列的至少之一:(a)SEQ ID NO:1或2的至少之一所示的氨基酸序列;(b)SEQ ID NO:1或2的至少之一所示的氨基酸序列的一部分;(c)(a)与(b)中所示氨基酸序列具有至少80%,优选至少90%,更优选至少95%,进一步优选至少99%序列同一性的氨基酸序列。本发明的细胞能够过表达Mkk3或Mkk6蛋白,重编程效率高,从而能够有效用作研究细胞命运变化的模型。
根据本发明的实施例,上述重组细胞还可以进一步包括下列附加技术特征至少之一:
根据本发明的实施例,上述重组细胞进一步预先过表达Sox、Klf4、Oct4和c-Myc的
至少一种,任选地,所述细胞预先同时过表达Sox、Klf4和Oct4。与现有技术相比,预先过表达Sox、Klf4、Oct4和c-Myc的至少一种,在此基础上过表达Mkk3或Mkk6,重组细胞的重编程效率显著提高,能够有效用作研究细胞命运变化的模型。
根据本发明的实施例,重组细胞中预定蛋白质的表达水平被改变是通过过表达所述预定蛋白实现的。过表达Mkk3或Mkk6,重组细胞的重编程效率显著提高,能够有效用作研究细胞命运变化的模型
根据本发明的实施例,上述过表达是通过向所述细胞中引入构建体实现的。构建体作为遗传载体,将编码Mkk3或Mkk6的核酸分子导入宿主细胞,从而实现在宿主细胞过表达Mkk3或Mkk6,形成上述重组细胞。重组细胞多能性基因启动子区的组蛋白乙酰化程度高,细胞异染色质蛋白HP1a在细胞中表达量或定位被改变,细胞组蛋白H1迁移率高,从而使得重组细胞的多能基因的表达水平高,重组细胞重编程效率显著提高。
需要说明的是,发明人发现,单独过表达Mkk3或者Mkk6使细胞重编程的效率极低,只有在预先过表达了Sox、Klf4、Oct4和c-Myc的至少一种的基础上过表达Mkk3或者Mkk6,才能使细胞发生上述变化。在本文中所使用的术语“严谨条件”是指形成特异性杂交体而不形成非特异性杂交体的条件。典型的严谨条件例如可以举出在钾浓度约25mmol/L~约50mmol/L以及镁浓度约1.0mmol/L~约5.0mmol/L中,进行杂交的条件。作为本发明的条件的示例,可以举出在Tris-HCl(pH8.6)、25mmol/L的KCl以及1.5mmol/L的MgCl2下进行杂交的条件,但是不限于此。此外,严谨条件被记载在Molecular Cloning 3rd(J.Sambrook et al.,Cold Spring Harbor Lab.Press,2001)中。该文献通过参照并入本说明书。本领域技术人员可以通过改变杂交反应、杂交反应液的盐浓度等,来容易地选择上述条件。
另外,说明书中描述:“同一性”是本领域所熟知的,是指两个或多个核酸序列之间经序列比较后决定的关系;在本领域中,“同一性”也指核酸分子序列之间的序列相关程度,由这些序列的碱基匹配程度决定;“同一性”可以根据已知的方法容易地计算出,这些方法包括,但不限于,描述于Computer Molecular Biology,Lesk编辑,牛津大学出版,纽约1993;Biocomputing:Infornatics and Genome Projects,Smith编辑,Academic出版,纽约1988;Computer Analysis of Sequence Data,第一部分,Griffin和Griffin编辑,Humana出版,新泽西,1994;Sequence Analysis in Molecular Biology,von Heinje,Academic出版1987;Sequence Analysis Primer,Gribskov和Devereux编辑,Stockton出版,纽约1991;和Carillo和Lipman,SIAM J,应用数学,48:1073,1988。)。
最后,需要说明的是,本发明的改变细胞命运尤其是促进体细胞的重编程的方法是本申请的发明人经过艰苦的创造性劳动和不断的优化工作才完成的。
附图说明
图1是根据本发明实施例的Mkk3或Mkk6蛋白促进重编程实验的结果示意图;
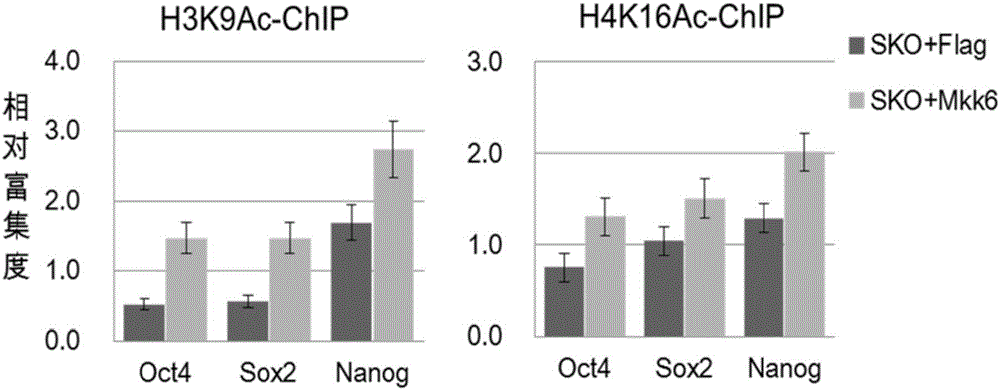
图2是根据本发明实施例的Mkk6蛋白提高重编程过程中的细胞多能性基因启动子区组蛋白乙酰化水平的实验结果示意图;
图3是根据本发明实施例的Mkk6蛋白提高Oct4、Nanog、Sox2和Rex1多能性基因的表达水平的实验结果图;
图4是根据本发明实施例的Mkk6蛋白改变异染色质蛋白HP1a表达量和定位的实验结果图;以及
图5是根据本发明实施例的Mkk6蛋白提高组蛋白H1迁移率的实验结果图。
具体实施方式
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件(例如参考J.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版社)或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品,例如可以采购自Illumina公司。
在以下的实施例中,选择逆转录病毒包装载体pMXs。
本文中所述的“细胞”为任何可以获得的细胞,在以下的实施例中,选择小鼠胚胎成纤维细胞(mouse embryo fibroblast cell,MEF细胞)。
可以通过本领域已知的任何手段转染或感染细胞,在以下的实施例中,选择逆转录病毒感染细胞。
可以使用本领域已知的各种方法检测蛋白质对细胞命运转换的影响。在以下的实施例中,染色质免疫沉淀技术可用来研究Mkk3或Mkk6对c-Myc结合到Oct4启动子水平的影响;荧光定量PCR技术可用来研究Mkk3或Mkk6对Oct4等多能性基因表达水平的影响。
实施例1:Mkk3或Mkk6基因的克隆
以小鼠胚胎成纤维(MEF)细胞的cDNA为模板,利用表1所示的引物扩增Mkk3或Mkk6片断,然后用琼脂糖凝胶电泳回收。通过在pMXs载体的多克隆位点PmeI酶切后插入PCR片段,连接,转化,挑菌,测序,最后得到Mkk3或Mkk6的逆转录病毒包装质粒。
表1克隆Mkk3或Mkk6蛋白片段的引物
实施例2:过表达Mkk3或Mkk6蛋白促进重编程实验
用单嗜性(Plat-E)逆转录病毒包装细胞系包装出重编程因子Sox2,Klf4,Oct4和c-Myc以及Mkk3或Mkk6的逆转录病毒。
具体过程如下:将Plat-E细胞接种到培养皿中12小时或过夜即可转染,转染前观察细胞密度,细胞密度在70%-90%即可转染。转染时,先将DNA和OPTI-MEM加好,混匀,相混合液中加入PEI,剧烈颠倒混匀,混合液静置13-15分钟,最后将混合液加入到已换液的Plat-E细胞中,混匀,之后将细胞放入培养箱培养。8-10小时后,给Plat-E细胞换MEF培养基。用注射器收集病毒,用0.45微米的滤器将病毒过滤到离心管中,并向离心管中补加适量的新鲜MEF培养基(直径10厘米的细胞培养盘大概12毫升),加入polybrene(聚凝胺)混匀,首次感染MEF(也可以将收集到病毒保存在4℃,备用)。再24小时后,按同样方法收集病毒,二次感染MEF。每次感染24小时。
二次感染后的小鼠胚胎成纤维(MEF)细胞换用mESC诱导培养基进行培养,其中,mESC诱导培养基的基础培养基为高糖DMEM(其中葡糖糖的含量为4500mg/L),并且mESC诱导培养基中含有15体积%FBS,1mM丙酮酸钠,100倍稀释的非必须氨基酸(NEAA)、100倍稀释的稳定态的左旋谷酰胺(200mM,购自GlutaMax)、100倍稀释的双抗(其中含有10000units/ml青霉素和10000ug/ml链霉素)和1000units/ml重组的小鼠白细胞抑制因子(Lif)。之后,每天更换新鲜mESC诱导培养基,直到12-15天后出现克隆形态的细胞实验结束。
采用OG2-MEF细胞(来自中国科学院广州生物医药与健康研究院)(内源Oct4启动子上偶联有GFP蛋白),计量上述实验中获得的诱导细胞的多能分化的效率。当iPS克隆有GFP荧光时,表明内源Oct4启动子得到表达,是成功重编程的标志。利用显微镜下数出GFP荧光阳性的克隆,即为iPS的诱导效率。在四因子SKOM(重编程因子Sox2,Klf4,Oct4和c-Myc)基础上单独过表达Mkk3或Mkk6蛋白,Mkk3或Mkk6蛋白促进重编程实验的结果如图1所示。其中,Flag组为感染了空载体的对照MEF细胞,Mkk3或Mkk6组为感染了Mkk3或Mkk6病毒的MEF细胞,然后统计GFP阳性克隆数量。
图1结果显示:Mkk3或Mkk6组的GFP阳性克隆数约为Flag组的2.5倍,表明当在四因子SKOM的基础上,感染Mkk3或Mkk6可以大大增加GFP阳性克隆数量,表明在四因子SKOM的基础上,过表达Mkk3或Mkk6可以显著提高重组细胞的重编程效率。
实施例3:Mkk3或Mkk6对多能性基因启动子区组蛋白乙酰化水平的影响
在分析Mkk3或Mkk6对多能性基因启动子区乙酰化水平的影响时,首先包装Mkk3或Mkk6的逆转录病毒,感染小鼠胚胎成纤维(MEF)细胞,其中,需要说明的是,任何MEF均是可病毒感染的受体细胞,并且均预先过表达SKO(重编程因子Sox2,Klf4,Oct4)。收集作为对照的感染了空载体的MEF细胞和表达Mkk3或Mkk6病毒的MEF细胞,用终浓度1%的甲醛固定,再用终浓度0.125M的甘氨酸终止。PBS洗两遍后,用适量PBS重悬细胞,按每管1000万细胞分装。离心去上清。将细胞沉淀置于冰上,加入1毫升裂解缓冲液A,其中,裂解缓冲液A的成份如下:50mM HEPES-KOH pH7.3;140mM NaCl;1mM EDTA pH8.0;10%glycerol;0.5%NP-40;0.25%Triton-100;protease inhibitor cocktail,冰上裂解10分钟后,1400g 4℃离心5分钟。去上清后加入200微升裂解缓冲液B,其中,裂解缓冲液B的成份如下:1%SDS;50mM Tris-HCl pH8.0;10mM EDTA;protease inhibitor cocktail,冰上裂解10分钟。超声,将基因组破碎成片断400-500bp左右的样品。
取适当体积的protein A和protein G磁珠(Life technologies,26162)混合,取出保存液后,用200微升PBST重悬,加入H3K9Ac或H4K16Ac等组蛋白乙酰化抗体和IgG各1μg,4℃旋转结合3小时。用PBST洗磁珠。将上述超声样品用IP(免疫沉淀)缓冲液稀释10倍,取10微升稀释液做Input对照,取400微升稀释液加入到磁珠,4℃旋转结合过夜。第二天用低盐清洗液、高盐清洗液、LiCl清洗液和TE溶液洗磁珠。最后加入200微升的Chelex-100溶液和1微升蛋白酶,56℃1100g反应半小时,沸水浴10分钟,离心取上清,上清即可作荧光定量PCR(QPCR)模板。最后用荧光定量PCR(QPCR)方法检测乙酰化修饰的组蛋白结合启动子区DNA情况。
结果显示,Mkk3或Mkk6蛋白能够显著提高多能性基因启动子区组蛋白乙酰化程度。
其中,Mkk6蛋白提高多能性基因启动子区组蛋白乙酰化程度的实验的结果如图2所示。图2结果显示,Flag组中,即在感染了空载体对照的MEF细胞中,乙酰化的组蛋白结合到的启动子区序列较少,而在Mkk6实验组中,乙酰化的组蛋白结合到的启动子区序列较多。从而可以看出,Mkk6蛋白提高了多能性基因启动子区组蛋白乙酰化程度。
实施例4:Mkk3或Mkk6对Oct4等多能性基因表达水平的影响实验
收集感染了空载体对照和Mkk3或Mkk6病毒的MEF细胞,分别做SKOM+Flag组和SKOM+Mkk3或Mkk6组,加入Trizol试剂裂解细胞,六孔板每孔1毫升。小心吹打,直至所用细胞被裂解,吸出到EP管中,置于-80℃保存。RNA提取时,将其从-80℃取出置冰上融化。加入200微升氯仿抽提,颠倒混匀,13000g 4℃离心15分钟。取上清,将上清转移到新的EP管中,加入400微升异丙醇,颠倒混匀。室温静置10分钟,13000g4℃离心15分钟,去上清,留沉淀。沉淀用70%乙醇洗一次。空气干燥10-20分钟,加入适量的RNAse-Free水,55℃溶解20分钟,测定浓度。反转录体系取适量质量的RNA为模板,以Oligo-dT为引物进行反转录。将反转录得到的cDNA样品用双蒸水稀释50-200倍。将QPCR的上下游引物稀释到一起,终浓度为2.5μM,其中,引物序列如下:
上游引物:CTGTAAGGACAGGCCGAGAG(SEQ ID NO:9)
下游引物:CAGGAGGCCTTCATTTTCAA(SEQ ID NO:10)
按照QPCR试剂盒(Bio-rad,SsoAdvancedTM Universal Green Supermix-172-5272)的说明操作。
实验结果表明,Mkk3或Mkk6能显著提高Oct4、Nanog、Sox2和Rex1多能性基因的表达水平。
其中,Mkk6提高Oct4、Nanog、Sox2和Rex1多能性基因的表达水平的结果如图3所示。图3结果显示,多能性基因相对表达量曲线从上到下依次是SKOM+Mkk6、SKOM+flag、SKO+Mkk6、SKO+flag细胞中多能基因的表达,由此可以得出,Mkk6能显著提高Oct4、Nanog、Sox2和Rex1多能性基因的表达水平。
实施例5:Mkk6对异染色质蛋白HP1a的影响实验
在分析Mkk3或Mkk6对异染色质蛋白HP1a的影响时,首先包装Mkk3或Mkk6的逆转录病毒,感染MEF(在本实施例中,MEF细胞没有过表达任何基因,是野生型原代MEF)。培养3天后,用PBS洗一遍,用4%多聚甲醛室温固定半小时。固定后吸取多聚甲醛,换上PBS。用甘氨酸溶液洗一遍,再用PBS洗3次,然后用Triton X 100和BSA的混合溶液通透封闭1小时。PBS洗3次后孵育一抗(HP1a抗体)至少1小时;用洗液洗5次后孵育荧光二抗。最后用DAPI染细胞核,PBS洗一遍,用封片剂将玻片封闭在载玻片上,然后用激光共聚焦显微镜(Zeiss 710)观察拍照。
结果显示,Mkk3或Mkk6蛋白增加MEF细胞HP1α蛋白在细胞核中的表达和聚集。
其中,Mkk6蛋白增加MEF细胞HP1α蛋白在细胞核中的表达和聚集的结果如图4所示。图4结果显示,在感染了空载体对照的MEF细胞中,HP1a在细胞核中表达量强,形成一个个聚集;而Mkk6感染的MEF中,虽然在细胞核中也能形成一些HP1a的聚集,但整体水平比对照组显著下降。这些结果表明Mkk6能影响HP1a蛋白的表达量和在细胞中的定位。
实施例6:Mkk3或Mkk6对组蛋白H1迁移率的影响实验
MEF细胞被接种在用多聚赖氨酸包被的35毫米的玻璃底小皿中。接着用荧光融合蛋白GFP-Histone1感染,然后用Mkk3或Mkk6包装的病毒感染MEF(在本实施例中,MEF细胞没有过表达任何基因,是野生型原代MEF),3天后进行FRAP检测。
挑选荧光强度(指H1-GFP)适中的细胞,先拍照作为对照,再选定所要漂白的区域:一个直径为25像素的圆形,用正常激光照射值的一倍或几倍的激光强度透射该圆形区域,漂白绿色荧光。然后拍下一系列光漂白后的图像(平均每0.5秒一张),大概2分钟后,荧光强度趋于稳定,停止拍照,保存图像。
结果显示,Mkk3或Mkk6蛋白能显著增加异染色质的H1的迁移率。
其中,Mkk6蛋白对MEF细胞中组蛋白H1的迁移率的影响实验结果如图5所示。图5结果显示,Mkk6能显著增加异染色质的H1的迁移率,表明Mkk6蛋白能打开染色质的结构。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!