本发明属于疏水蛋白领域,特别涉及一种香菇疏水蛋白Hyd2及其应用。
背景技术:
香菇(Lentinula edodes)属于中低温型变温结实性菇类,具有极高的食药用价值,随着生活水平的日益提高,人们对香菇的需求量也大大增加。在正常生长条件下,香菇子实体发生的最适温度为8-20℃,菌丝生长发育最适温度为24-27℃,原基分化的最适温度为10-12℃。我国作为香菇生产大国,由于主产区的夏季温度远高于25℃,经常会出现烧菌、菇小盖薄、开伞难等问题,因此夏季温度过高严重影响了香菇的产量,造成夏季香菇供不应求。对香菇耐热机理的研究及其育种应用,成为亟待解决的科学与技术问题。
真菌疏水蛋白(Hydrophobins)是指一类由高等丝状真菌在某一特定时期分泌产生的具有特殊理化性质的小分子量两性蛋白质(Aimanianda et al,1991),其肽链由8个半胱氨酸组成,且能够形成四个链内二硫键,这是真菌疏水蛋白主要的结构特点。这类蛋白质约含有100多个氨基酸,分子量在10-15kDa之间。疏水蛋白既具有疏水结构又具有亲水结构,当遇到两相界面时能够通过自组装形成纳米级两亲性蛋白薄膜,从而改变界面的疏水性和亲水性(Bailey et al,2002)。因而疏水蛋白能够帮助真菌克服气液屏障并形成气生结构:水下菌丝分泌的疏水蛋白能够扩散到水-空气的界面,自组装形成两亲性蛋白薄膜;随着水表面张力的急剧下降,能促使菌丝向空中生长,继而形成气生菌丝等诸多疏水结构。
根据氨基酸亲水-疏水性图谱和自我组装形成的两性蛋白膜的溶解性,Kershaw等人将真菌疏水蛋白分为Ⅰ型和Ⅱ型(Kershaw et al,2005)。疏水蛋白的各氨基酸的排列方式和排列顺序都存在显著的差异性,所以具有相似功能但不同来源的疏水蛋白,其同源性很低。研究还发现,同一种真菌中可能分布着多种疏水蛋白,大部分疏水蛋白主要分布在高等真菌的担子菌、子囊菌的子实体表面或侵染结构中,以及接合菌的气生菌丝中。
由于疏水蛋白能够改变原介质表面的亲/疏水性(Aimanianda et al,2009),因此它能够增强植物的耐脱水能力,参与到渗透调节和水分运输中,从而可以保护细胞的结构。已有研究表明,植物的疏水蛋白在其应对高温胁迫中起到重要作用,但是目前关于该蛋白在食用菌抵御高温胁迫中的研究甚少。
技术实现要素:
本发明所要解决的技术问题是提供一种香菇疏水蛋白Hyd2及其应用,将含有该蛋白读码框的核苷酸序列转入适合的宿主体内,可使宿主表达疏水蛋白并提高宿主细胞的耐热性,具有良好的应用前景。
本发明提供了一种香菇疏水蛋白Hyd2,所述疏水蛋白的氨基酸序列如SEQ ID NO.1所示。
本发明提供了一种编码香菇疏水蛋白Hyd2的基因,所述基因的序列如SEQ ID NO.2所示。
本发明提供了一种香菇疏水蛋白Hyd2的基因设计的引物,所述引物序列如下:
5’-CGGATCCGATGCAGTTCAAACTTGCCTT-3’;
5’-GGAATTCCGAGAGTGACGGGAAGACATC-3’。
本发明提供了一种含香菇疏水蛋白Hyd2基因的载体。
所述载体为pET32a(+)/Hyd2。
本发明提供了一种细胞、组织或微生物,转入上述载体。
本发明提供了一种香菇疏水蛋白Hyd2的应用,应用于转入大肠杆菌中使宿主获得耐热性。
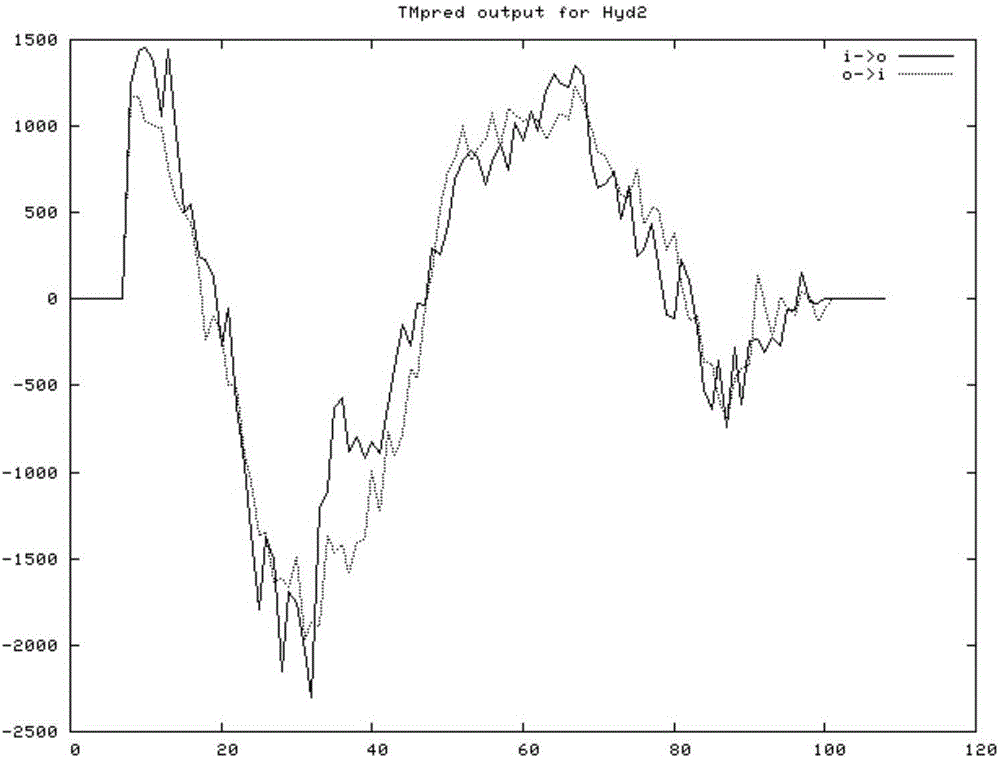
本发明以香菇菌株18N44为材料,根据GeneBank中香菇(AF217808.1)Hyd2蛋白基因保守序列,使用Primer Premier 5.0结合DNAMAN 6.0程序设计一对引物,从香菇菌株18N44基因组DNA中扩增出Hyd2全基因片段,经PCR鉴定后,将目的片段与T载体连接,转化到大肠杆菌TOP10感受态中,送交生工生物工程(上海)有限公司测序,片段长度如SEQ ID NO.2所示,编码109个氨基酸,如SEQ ID NO.1所示。运用生物信息学方法进一步分析香菇疏水蛋白Hyd2的核苷酸序列和氨基酸序列,序列分析表明该基因属于疏水蛋白基因家族。多序列比对的进化树结果如图1所示,香菇的Hyd2蛋白与云芝(Trametes versicolor)、污叉丝孔菌(Dichomitus squalens)等的亲缘关系较近,与双孢蘑菇(Agaricus bisporus)、双色蜡蘑(Laccaria bicolor)的亲缘关系较远。由生物信息学分析得知,香菇Hyd2蛋白分子量约为13.4kDa,等电点(pI,isoelectric point)为4.02;不稳定系数为40.12,属于不稳定蛋白;疏水性系数为0.808,表明该蛋白具有疏水性。经NetPhos 2.0软件预测得知,香菇Hyd2蛋白的Ser磷酸化位点为6个,Thr磷酸化位点为1个,Tyr磷酸化位点为0个。利用SignalP 4.1server对香菇Hyd2蛋白进行了信号肽的预测,结果表明该蛋白的综合分值Y值为0.437,剪切位置分值C值为0.231,信号肽分值S值为0.934,C值和Y值都不低(图3),剪切位置在第23和24个氨基酸之间,因此可判断香菇Hyd2蛋白存在信号肽,属于分泌蛋白。经EMBnet Tmpred跨膜结构预测可知,该蛋白从N端开始由内向外然后再由外向内,依次经过2次跨膜,是一个双向跨膜蛋白,可能与膜定位和跨膜转运有关。
将获得的香菇Hyd2基因序列,如SEQ ID NO.2所示的核苷酸序列与骨架载体pET32a(+)连接构建得到原核表达载体pET32a(+)/Hyd2,转入大肠杆菌BL21(DE3)中,经IPTG诱导进行异源表达,提取表达蛋白经SDS-PAGE电泳分析,结果显示得到蛋白分子量约为13kDa的融合蛋白,与预期结果吻合。
转基因大肠杆菌经高温(50℃)热激处理后,通过对大肠杆菌活力的测定和大肠杆菌可溶性蛋白SDS-PAGE电泳检测,结果均表明,香菇Hyd2蛋白的异源表达可显著提高大肠杆菌耐高温的能力,如图9所示,且对大肠杆菌中其它蛋白有较好的保护作用。
有益效果
本发明获得了香菇疏水蛋白Hyd2基因的完整开放读码框及疏水蛋白的氨基酸序列,将含有该读码框的核苷酸序列转入适合的宿主体内,可使宿主表达疏水蛋白并提高宿主细胞的耐热性,实验证明转基因大肠杆菌过量表达该疏水蛋白后获得了耐热性,推测该基因转入其它生物中也可提高宿主的耐热性。
附图说明
图1为香菇疏水蛋白Hyd2的系统发育树;
图2为香菇疏水蛋白Hyd2的跨膜结构预测;
图3为香菇疏水蛋白Hyd2的信号肽预测;
图4为香菇疏水蛋白Hyd2的磷酸化位点预测;
图5为香菇疏水蛋白Hyd2的三维结构预测;
图6为pET-32a(+)/Hyd2重组质粒PCR鉴定电泳图谱;
图7为未进行高温处理条件下,pET-32a/Hyd2重组表达蛋白产物的SDS-PAGE电泳图;
其中,泳道1是经IPTG诱导后,含有pET-32a空载体的大肠杆菌蛋白表达情况;泳道2是经IPTG诱导,含有pET-32a/Hyd2重组质粒的大肠杆菌的蛋白表达情况;泳道3是未用IPTG诱导,含有pET-32a/Hyd2重组质粒的大肠杆菌蛋白表达情况;泳道4是蛋白Marker。
图8为高温(50℃)条件下,pET-32a/Hyd2重组表达蛋白产物的SDS-PAGE电泳图;
其中,泳道1是IPTG诱导后,在50℃条件下热激60min,含有pET-32a空载体的对照组大肠杆菌蛋白表达电泳图谱;泳道2是经1mM的IPTG诱导后,未进行热激处理,含有pET-32a空载体的大肠杆菌蛋白表达电泳图谱;泳道3是蛋白Marker;泳道4是经IPTG诱导后,在50℃的高温胁迫条件下热激60min,含有pET-32a/Hyd2重组质粒的大肠杆菌蛋白表达电泳图谱;泳道5是经IPTG诱导后,未进行热激处理,含有pET-32a/Hyd2重组质粒的大肠杆菌蛋白表达电泳图谱。
图9为高温(50℃)条件下转入香菇Hyd2基因的大肠杆菌存活率比较。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附专利要求书所限定的范围。所用试验材料及试剂
1.1.1试验材料
香菇18N44菌株是由菌株18诱变而来,相较于18菌株对高温的抵抗力更强。
1.1.1.1大肠杆菌菌株
大肠杆菌(E.coli)菌株TOP10,大肠杆菌(BL21)为常用菌株,可在市场购买获得。
1.1.1.2克隆载体
本试验采用T载体:pGM-T Easy vector System I,Promega Corporation,全长2692bp,携带有氨苄青霉素抗性基因(Amp)和LacZ基因,重组体可通过蓝白斑和氨苄抗性双重筛选鉴定。
表达载体pET-32a(+)为常用载体,可在生物公司购买到,全长5900bp,携带有氨苄青霉素(Amp)抗性基因。
1.1.2试验培养基
1.1.2.1PDA固体培养基
马铃薯200g(取汁),蔗糖20g,琼脂20g,加蒸馏水定容至1000mL。
1.1.2.2LB固体培养基
蛋白胨20g,酵母提取物5g,NaCl 10g,琼脂20g,加蒸馏水定容至1000mL。
1.1.2.3LB液体培养基
蛋白胨20g,酵母提取物5g,NaCl 10g,加蒸馏水定容至1000mL。
1.1.3试剂
总RNA提取试剂盒:Redzol,购自赛百盛(北京)基因技术有限公司;
琼脂糖凝胶DNA回收试剂盒:购自爱思进生物技术(杭州)有限公司;
Marker:GeneRulerTM DNA Ladder Mix,购自生工生物工程(上海)有限公司;
反转录试剂盒:PrimeScript RT reagent Kit with gDNAEraser,购自TAKARA公司;
限制性内切酶EcoR I和BamH I购自TAKARA BIOTECHNOLOGY;
质粒DNA提取试剂盒,TIANprep Mini Plasmid Kit,购自TIANGEN公司;
SDS-PAGE凝胶试剂盒购自PROMOTON;
SDS-PAGE染色脱色试剂盒购自生工生物工程(上海)有限公司。
1.1.4仪器
PCR扩增仪,核酸蛋白检测仪,凝胶成像系统,BCD-281E冰箱,VS-15000CFNⅡ高速冷冻离心机,电泳仪,制冰机,HWS12型电热恒温水浴锅,DPH-9272恒温培养箱,超净工作台,SX-500TOMY自动灭菌锅,DKY-Ⅱ恒温调速回转式摇床,微量移液器。
1.1.5常用溶液的配制
1.1.5.1氨苄青霉素储存液:
将1g氨苄青霉素溶解于10mL去离子水中,使终浓度达到100mg/mL,用0.22μm微孔滤膜过滤除菌,分装,-20℃储存备用。
1.1.5.2IPTG:
将IPTG配制成24mg/mL(100mM)的水溶液,用0.22μm微孔滤膜过滤除菌,分装,-20℃储存备用。
1.1.5.3PBS缓冲液:
NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 10mmol/L,KH2PO4 1.76mmol/L,加蒸馏水定容至1000mL,调PH值至7.2-7.4。
1.1.5.4电极缓冲液(Running Buffer):
Tris 3.1g,甘氨酸18.8g,SDS 1g,加蒸馏水定容至1L。
实施例1
香菇18N44中疏水蛋白Hyd2表达载体的构建
将香菇菌株18N44接种到PDA平板上,置于25℃恒温箱中培养2周,直至长满平板,然后将菌种与培养基一同转移到匀浆机中,加入100mL的马铃薯肉汤培养基,低速15s高速15s再低速15s,打碎后吸取10mL至装有培养液的三角瓶中。25℃、150r/min培养1周,收集菌丝。
(1)香菇菌丝RNA的提取
采用Redzol试剂盒提取香菇菌丝的总RNA,具体操作如下:
①向经无RNA酶处理过的2mL离心管中加入1mL的Redzol裂解液,然后置于冰上。
②液氮预冷研钵、研棒、药匙,将菌丝在液氮中研磨成粉末,然后加入到含有Redzol裂解液的离心管中,上下颠倒,充分混匀,常温下静置5min,使样品充分裂解。
③加200μL的氯仿,剧烈震荡,常温静置3min,在4℃、12000rpm条件下离心15min。离心后EP管中的液体分成三相,RNA在上层水相中。
④将上清液转移到1.5mL的离心管中,加500μL的异丙醇,充分混匀后冰上静置10min沉淀RNA。
⑤在4℃、12000rpm条件下离心10min,弃上清。
⑥加入现配的75%乙醇1mL,漂洗2-3次RNA沉淀。
⑦在4℃、7500rpm条件下离心5min,弃掉上清,并用移液枪吸去残液。
⑧在超净台内,打开管的盖子,干燥RNA沉淀,6-10min,然后加入60μL DEPC水,溶解RNA,溶解6-10min。
⑨用1.0%的琼脂糖电泳检验RNA质量,并用NADO测定RNA样品浓度,暂时不用的RNA于-80℃冰箱中保存。
(2)香菇菌丝RNA的反转录
①去除总RNA中的基因组DNA
按照反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser,对香菇菌丝RNA进行反转录,操作在冰上进行。去除基因组DNA的反应体系如下:Total RNA 1μg,gDNA Eraser 1μL,5×g DNA Erase Buffer 2μL,RNase Free dH2O,up to 10μL。反应条件:42℃2min,4℃保存。②反转录为cDNA
为了确保试验的准确性和一致性,先配制好母液然后分装到各反应管中,操作在冰上进行。反转录反应体系如下:RT Primer Mix 1μL,PrimeScript RT Enzyme MixⅠ1μL,5×PrimeScript Buffer 2(for Real Time)4μL,Reaction solution from Step 1 10μL,RNase Free dH2O,up to 20μL。反应条件:42℃2min,37℃15min,85℃5s,4℃保持。
(3)常规PCR扩增目的片段
利用Primer Premier 5.0设计香菇疏水蛋白Hyd2基因的引物,并且用DNAMAN分析找到相应的酶切位点。引物交由上海捷瑞生物公司合成,使用前用无菌双蒸水稀释到10mol/L。引物序列如下:
5’-CGGATCCGATGCAGTTCAAACTTGCCTT-3’;
5’-GGAATTCCGAGAGTGACGGGAAGACATC-3’。
PCR反应体系:正向引物1μL,反向引物1μL,模板DNA 1μL,dNTP(10mmol/L)1μL,Loading Buffer(10×)2.5μL,Tap酶(5U/μL)0.25μL,ddH2O 18.25μL,Total 25μL。反应条件:94℃3min;94℃30s,50℃30s,72℃30s,30个循环;72℃延伸10min;4℃保存。
(4)PCR目的产物的纯化与回收
按照AxyPrep DNA试剂盒的说明书对PCR目的产物进行回收。取3μL的纯化产物,用1.5%琼脂糖电泳检测回收的纯度。
(5)连接反应
将纯化后的PCR产物连接到T载体上,根据试剂盒说明书,连接的反应体系如下:PCR产物2μL,Vector 0.5μL,T4DNA Ligase 0.5μL,2×Rapid Ligation Buffer5μL,ddH2O 2μL,Total 10μL。反应条件:吹打混匀,在4℃条件下,过夜连接。
(6)克隆转化
①向每个含有Amp抗性的LB平板上,加入40μL X-GAL(20mg/mL)和16μL IPTG(200mg/mL)),并涂布均匀;
②准备好冰盒,在冰上操作,简短离心连接反应液,将10μL连接反应液全部加入到1.5mL无菌离心管中;
③取出感受态细胞TOP10,置于冰上融化,然后吸取50μL加入到步骤②的离心管中,用枪头轻轻吸打混匀,置于4℃,30min;
④将步骤③中的反应液,置于42℃,热激50s,冰上冷却2min;
⑤加入800μL的液体LB,37℃,220rpm,40-60min,摇床振荡培养;
⑥将步骤⑤中的菌液,5000rpm,2min,吸掉750μL上清,然后将菌液吸打混匀;
⑦取80μL菌液涂布到步骤①准备的平板培养基,37℃,静置5-10min,然后倒置,过夜培养;⑧准备好无菌的2.0mL的离心管,加入1mL含有Amp抗性的LB培养基,然后挑取白色菌落,置于相应的离心管中,37℃,220rpm,5-6h;
⑨将摇好的菌液进行PCR验证,1.5%凝胶电泳检验PCR产物,选取3个阳性克隆送公司测序。
(7)质粒的提取
提取测序验证正确的菌液质粒,在超净工作台上,挑取经验证的单菌落,接到含有Amp的LB液体培养基中,37℃,150rpm恒温震荡过夜培养。按照质粒快速提取试剂盒的说明书提取质粒。提取的质粒用1.0%凝胶电泳验证,然后以每管10μL进行分装,于-20℃冰箱保存。(8)目的片段酶切
将目的片段进行酶切:其反应体系为:T载体重组质粒40μL,EcoRⅠ3μL,BamHⅠ3μL,10×M Buffer 10μL,ddH2O 44μL,Total 100μL。酶切条件:4℃3h。将酶切反应液进行片段回收,按照AxyPrep DNA试剂盒的说明书对PCR目的产物进行回收,然后用1.5%的琼脂糖凝胶电泳检测目的片段。
(9)酶连反应
酶连反应的体系为:目的片段2μL,pET-32a Vector 1μL,EcoRⅠ0.5μL,BamHⅠ0.5μL,10×H Buffer 5μL,ddH2O 1μL,Total 10μL。反应条件:4℃过夜。将连接产物转化大肠杆菌TOP10,经过菌落PCR验证后送菌样至生工测序,测序的结果与克隆全长比对匹配。
实施例2
香菇疏水蛋白Hyd2基因的原核表达及蛋白功能验证
(1)提取测序成功的pET-32a/Hyd2重组质粒,然后将pET-32a/Hyd2载体重组质粒以及pET-32a空载体质粒分别导入到大肠杆菌表达宿主细胞BL21中。
(2)大肠杆菌的热激处理
①吸取60μL验证正确的菌液,然后涂布到含有Amp的LB平板上,37℃过夜培养;
②挑取单菌落,接种到含有5mL LB+Amp培养基中,37℃,150r/min过夜培养;
③取1mL活化后的培养液加到100mL含有Amp的LB液体培养基中,37℃,220r/min培养2.5-3h,用紫外分光光度计检测待OD600达到0.4-0.6时,加入1mM的IPTG进行诱导;
④继续培养2h,然后用含有Amp的LB培养基将菌液稀释104倍,转入到50℃的水浴锅中,分别热激0min、30min、60min、90min、120min;
⑤取热激处理后的菌液80μL,涂布在含有Amp的LB固体培养基上,37℃,过夜培养,每个实验梯度设置3个重复。
(3)大肠杆菌原核表达蛋白Hyd2的提取
①取1mL活化后的培养液加到100mL含有Amp的LB液体培养基中,37℃,220r/min培养2.5-3h,用紫外分光光度计检测待OD600达到0.4-0.6时,加入1mM的IPTG进行诱导;
②加入IPTG后,继续培养2h,将菌液转移到50mL无菌的离心管中,在4℃、5000r/min的条件下离心2min;
③向无菌离心管中加入25mL的PBS,然后用枪头将菌体吸打混匀,加入20μL Protease Inhibitor Cocktail,保护蛋白免受损伤;
④将处理好的菌体用超声破碎,工作3s,间歇5s,工作电压300W,破碎时间20-30min;
⑤将破碎后的菌体转入到无菌的50mL的离心管中,在4℃、8000r/min下离心20min;
⑥取离心后的上清50μL于无菌小离心管中,加入12.5μL的5×蛋白Loading Buffer,沸水中煮10min,再取200μL,放于-80℃中保存。
(4)大肠杆菌原核表达蛋白Hyd2的SDS-PAGE分析
①将玻璃板、电泳架、电泳槽等用清水冲洗干净,用滤纸将玻璃板擦拭干净,然后安装好电泳装置;
②用移液枪在玻璃板的左上角注入浓度为15%的分离胶,给浓缩胶留足够的空间,然后注入双蒸水,置于37℃恒温培养箱,30min,水封能够将分离胶压平并且能防止空气中的氧使凝胶聚集;
③分离胶固定好后,将水封的双蒸水倒掉,用吸水纸洗干净;
④配制浓度为5%的浓缩胶,用移液枪在玻璃板的左上角注入浓缩胶,插入梳子,然后置于37℃的恒温培养箱,30min,插入时应小心避免产生气泡;
⑤待浓缩胶固定后,将梳子拔出,然后用双蒸水清洗胶板,将胶板固定在电泳槽中,向上下电泳槽中注入现配制的电泳缓冲液,检验电泳槽是否有泄漏;
⑥按照次序,依次在上样孔中注入16μL的蛋白样品;
⑦在浓缩胶时,电压设置为100V,当显示溴酚蓝指示剂跑出浓缩胶的底部时,将电压改为140V,继续进行分离胶的电泳,当显示溴酚蓝指示剂跑到分离胶的底部时,停止电泳;
⑧电泳结束后,将胶置于干净的盒子中,用双蒸水冲洗15min,重复3次,然后加入考马斯亮蓝染液,染色30min;
⑨染色完毕后,将考马斯亮蓝染液置于回收瓶中,然后加入双蒸水,置于微波炉中,中火微波15-20s,清洗数次,然后加入脱色液,覆盖凝胶表面,20-25min换一次脱色液,直至退去凝胶的考马斯亮蓝蓝色背景,观察到清晰的蛋白质条带;
⑩对蛋白质凝胶拍照,然后进行结果分析。
由SDS-PAGE电泳图(图7、图8)可知:经IPTG诱导后,在10kDa-15kDa之间,重组组中出现一条表达量显著高于对照组的特异性蛋白条带,其分子量与疏水蛋白Hyd2的分子量相吻合,表明香菇疏水蛋白Hyd2在大肠杆菌中异源表达成功。
(5)热激处理下大肠杆菌存活率的测定
将过夜培养的大肠杆菌平板进行菌落计数,数出不同处理条件下各平板上长出来的菌落数(Soto et al,1999;李翠翠,2009;孙翔英,2014),分别以处理0min平板上长出来的菌落数为对照组,由热激后的存活率柱形图(图9)可以看出,在热激处理30min、60min及90min时,重组组的存活率要显著高于对照组,证明了香菇疏水蛋白Hyd2基因的导入及表达确实提高了大肠杆菌BL21在高温胁迫条件下的存活率。