一种高纯度盐酸阿罗洛尔的制备工艺的制作方法
本发明涉及有机合成
技术领域:
,特别涉及一种高纯度盐酸阿罗洛尔的制备工艺。
背景技术:
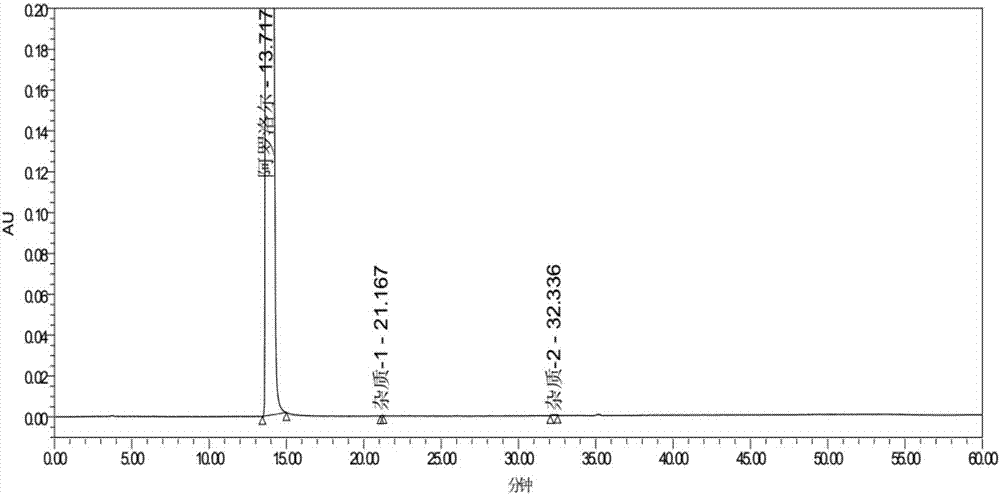
:盐酸阿罗洛尔由日本住友制药株式会社研发,1985年首次在日本上市,1996年向国内进口注册。盐酸阿罗洛尔是第4代β受体阻滞药,无内在拟交感神经活性,本品具有β受体阻滞作用和适度的α受体阻滞作用,二者作用强度之比为8:1,可增加疗效,减少不良反应,不影响血脂和糖代谢,对肾功能无不利影响。临床主要用于治疗轻至中度原发性高血压,心绞痛,心动过速性心律失常和原发性震动。j.phmarmaceuticalsciences,67(9),1978、epo245835、jp0413918、progressinpharmaceuticalscience,1382013,vol.37,no.3、chinesejournalofpharmaceticals2011,42(9)均涉及了盐酸阿罗洛尔的合成方法及制备工艺,专利us3932400、us4316907中描述了盐酸阿罗洛尔及其制备方法;专利cn103626750a、cn104356126a、cn104370900a、cn104530033a及河北科技大学学士论文等文献均对盐酸阿罗洛尔的合成工艺及后处理方式进行了较为详细的描述。专利及文献报道的其合成路线基本一致,均采用5-(2-巯基-4-噻唑)-2-噻吩甲酰胺为起始原料,通过与环氧氯丙烷缩合反应,制得5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺,然后碱性条件下与叔丁胺开环,得到阿罗洛尔粗品,最后与盐酸成盐并精制得到式(ⅰ)化合物盐酸阿罗洛尔。合成路线:专利及文献报道的本品合成路线一致,制得的盐酸阿罗洛尔粗品纯度不高,杂质谱一致,多个杂质大于0.1%,总杂质大于1.0%。由于盐酸阿罗洛尔在多种溶剂中溶解度均较低,在甲醇和水中略溶,在无水乙醇中极微溶解,在氯仿、乙醚中几乎不溶,仅在高沸点溶剂二甲亚砜中易溶,从而使本品去杂质比较困难,采用水和醇复合溶剂重结晶亦不能有效去除本品的杂质。为提高本品纯度,现有专利及文献采用多种不同且复杂的后处理和精制方法,cn104356126a、cn104370900a、cn104530033a及河北科技大学学士论文等文献对中间体(ⅲ)采用甲基叔丁基醚打浆,对中间体(ⅳ)阿罗洛尔粗品先采用甲苯打浆,最后采用高沸点溶剂二甲亚砜溶解成盐,加丙酮分散降温析晶,该工艺操作繁琐,不仅引入了二类毒性溶剂甲苯,且高沸点溶剂二甲亚砜易形成残留;cn104530033a对中间体(ⅲ)制备采用甲醇做溶剂,路易斯酸做催化剂制得较纯的中间体(ⅲ),然后乙腈作溶剂与叔丁胺开环,盐酸调ph值成盐,最后用醇和水复合溶剂重结晶,该工艺操作相对简单,但经验证简单的醇和水复合溶剂重结晶并不能有效去除杂质,达到专利公开的纯度,且中间体(ⅲ)制备引入了二类毒性较大的溶剂甲醇及路易斯酸,易引起金属离子残留,且收率偏低(约78%)。基于盐酸阿罗洛尔的药学价值及良好的市场前景,及现有技术去除杂质的过程较为繁琐,收率偏低,用到多种毒性较大的二类溶剂或高沸点溶剂。探索一条除杂效果好,不用或少用毒性溶剂,操作简便,收率较高,且适合工业化生产的盐酸阿罗洛尔制备工艺非常重要。技术实现要素:本发明提供一种高纯度盐酸阿罗洛尔的制备工艺,该工艺除杂效果好,不用毒性溶剂,操作简便,收率高,更适合于工业化生产。为解决上述技术问题,本发明的技术方案为:一种高纯度盐酸阿罗洛尔的制备工艺,包括以下步骤:步骤①:在醇水复合溶剂中,投入缚酸剂无机碱,搅拌溶解透明,加入起始原料ⅱ:化合物5-(2-巯基-4-噻唑)-2-噻吩甲酰胺,室温搅拌均匀;然后加入环氧氯丙烷,室温继续反2~3小时,过滤、干燥得中间体ⅲ:5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺,类白色固体;步骤②:在无水乙醇中,投入叔丁胺,搅拌溶解均匀,加入步骤①所得中间体ⅲ,搅拌加热并保温微回流反应10~14小时,浓缩除去溶剂无水乙醇及过量的叔丁胺至尽,得中间体ⅳ,加入纯化水,搅拌加热至溶解透明,冷却到室温,用盐酸调节ph酸性,用有机溶剂洗涤,弃去有机层,水层加入乙醇,继续搅拌加热至溶解透明,冷却析晶,过滤得盐酸阿罗洛尔粗品;步骤③:在醇水复合溶剂中,投入步骤②所得盐酸阿罗洛尔粗品,搅拌加热至溶解透明,冷却析晶,过滤、干燥得高纯度盐酸阿罗洛尔,白色固体。其中,优选地,所述步骤①中醇水复合溶剂中的醇为乙醇、甲醇或异丙醇,醇的质量浓度为5%~50%,所述醇水复合溶剂的用量为起始原料ⅱ重量的5~20倍。其中,优选地,所述缚酸剂无机碱为碳酸氢钠、碳酸钠、碳酸氢钾或碳酸钾,所述缚酸剂无机碱的用量为起始原料ⅱ重量的0.5~3倍。其中,优选地,所述步骤②中加入纯化水后,搅拌加热至70~100℃,所述纯化水的加入量为中间体ⅲ重量的8~30倍。其中,优选地,所述步骤②中盐酸的质量浓度1%~36%,酸化的ph值为0.5~3.0。其中,优选地,所述步骤②中用于洗涤的有机溶剂为乙酸乙酯、异丙醚、甲苯、醋酸丁酯、正己烷、环己烷、乙醚、二氯甲烷或三氯甲烷。其中,优选地,所述步骤③中的醇水复合溶剂中的醇为乙醇、甲醇或异丙醇,醇的质量浓度为15%~85%,所述醇水复合溶剂的加入量为中间体ⅳ重量的10~30倍(g/g)。本发明的有益效果:本发明方法根据步骤①中间体(ⅲ)的制备为非均相反应,采用醇水复合溶剂做反应溶剂,改变了现有技术单纯采用有机溶剂或单纯采用水作溶剂,环氧氯丙烷与缚酸剂不能充分接触的缺点,缩短了反应时间,提高了反应转化率(转化率近100%),制得的中间体(ⅲ)纯度达到99.5%以上,收率大于97%。避免了现有技术再次对中间体(ⅲ)采用甲基叔丁基醚打浆提纯;本发明方法根据步骤②实验中发现,盐酸阿罗洛尔在多种溶剂中溶解度均较低,但阿罗洛尔在水中加热回流溶解后,冷却到室温后,短时间不易析出,依然为透明溶液状态,用盐酸调节ph值后,直接用乙酸乙酯等有机溶剂洗涤,能很好除去阿罗洛尔含有的杂质,且有机相中溶解的盐酸阿罗洛尔很低,明显提高了盐酸阿罗洛尔的纯度,避免了现有技术再次阿罗洛尔粗品采用二类有毒溶剂甲苯打浆提纯;本发明方法根据步骤①②对盐酸阿罗洛尔粗品提纯后,可直接采用乙醇水溶液对盐酸阿罗洛尔粗品重结晶,重结晶精制后盐酸阿罗洛尔纯度可达到99.95%以上,单个杂质不大于0.02%,总杂质不大于0.05%,达到并高于原研日本住友制药株式会社的产品。避免了现有技术中精制采用高沸点溶剂二甲亚砜溶解,加丙酮分散降温析晶,避免了产品中高沸点溶剂二甲亚砜的残留;本发明方法盐酸阿罗洛尔制备工艺整个过程中仅使用了乙醇和乙酸乙酯两种溶剂,未使用到现有技术中毒性较大的甲苯、甲醇二类溶剂及其他甲基叔丁基醚、丙酮、二甲亚砜等多种溶剂,三步总摩尔收率约75%,远高于现有技术约50%。另外,操作简单,更适合于工业化生产。本发明所述的方法能够有效去除盐酸阿罗洛尔的杂质,使本品完全达到并高于原研日本住友制药株式会社的产品,纯度可达到99.95%以上,单个杂质不大于0.02%,总杂质不大于0.05%,且操作简便,收率高。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。图1为用本发明路线步骤②对酸化后阿罗洛尔水层用乙酸乙酯洗涤,乙酸乙酯层洗涤去杂质效果检查的高效液相色谱图;图2为用本发明路线制得的式ⅰ化合物盐酸阿罗洛尔,纯度检查的高效液相色谱图。具体实施方式下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1按以下操作制备盐酸阿罗洛尔:(1)中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺的制备在三口瓶中,投入20%(g/g)乙醇水溶液100g,加入碳酸氢钠(10.0g,0.12mol),搅拌溶解透明,加入起始原料式(ⅱ)化合物5-(2-巯基-4-噻唑)-2-噻吩甲酰胺(10.00g,0.041mol),室温搅拌均匀;然后加入环氧氯丙烷(7.64g,0.082mol),室温继续反应,tlc监控反应完全,约2~3小时,过滤,70~80℃干燥得中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺(11.94g,摩尔收率97.0%,hplc纯度99.6%),类白色固体;(2)盐酸阿罗洛尔粗品的制备在三口瓶中,投入无水乙醇85g,叔丁胺(26.57g,0.368mol),搅拌溶解均匀,加入中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺(11.00g,0.037mol),搅拌加热并保温微回流反应,hplc监控反应完全,约12小时,浓缩除去溶剂无水乙醇及过量的叔丁胺至尽,得中间体(ⅳ),稍冷,加入纯化水165g,搅拌加热80℃至回流,溶解透明后冷却到室温,用10%盐酸调节ph1~2,用乙酸乙酯50g洗涤3次,弃去有机层,水层加入乙醇165g,继续搅拌加热至溶解透明,冷却降温至0~5℃搅拌析晶4小时以上,过滤得盐酸阿罗洛尔粗品(折干:12.62g,摩尔收率84.0%,hplc纯度99.7%);(3)盐酸阿罗洛尔成品的制备在三口瓶中,投入70%(g/g)乙醇水溶液240g,加入盐酸阿罗洛尔粗品(折干:12.00g),搅拌加热至微回流,溶解透明后保温搅拌15分钟,冷却降温至-5~0℃搅拌析晶4小时以上,过滤,70~80℃干燥得盐酸阿罗洛尔成品(10.82g,收率90.1%,hplc纯度99.97%)。实施例2按以下操作制备盐酸阿罗洛尔:(1)中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺的制备在三口瓶中,投入5%(g/g)甲醇水溶液2000g,加入碳酸氢钠(5.0g,0.060mol),搅拌溶解透明,加入起始原料式(ⅱ)化合物5-(2-巯基-4-噻唑)-2-噻吩甲酰胺(10.00g,0.041mol),室温搅拌均匀;然后加入环氧氯丙烷(7.64g,0.082mol),室温继续反应,tlc监控反应完全,约2~3小时,过滤,70~80℃干燥得中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺(11.85g,摩尔收率96.3%,hplc纯度99.7%),类白色固体;(2)盐酸阿罗洛尔粗品的制备在三口瓶中,投入无水乙醇85g,叔丁胺(26.57g,0.368mol),搅拌溶解均匀,加入中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺(11.00g,0.037mol),搅拌加热并保温微回流反应,hplc监控反应完全,约12小时,浓缩除去溶剂无水乙醇及过量的叔丁胺至尽,得中间体(ⅳ),稍冷,加入纯化水88g,搅拌加热80℃至回流,溶解透明后冷却到室温,用1%盐酸调节ph2~3,用异丙醚50g洗涤3次,弃去有机层,水层加入乙醇180g,继续搅拌加热至溶解透明,冷却降温至0~5℃搅拌析晶4小时以上,过滤得盐酸阿罗洛尔粗品(折干:12.04g,摩尔收率80.1%,hplc纯度99.8%);(3)盐酸阿罗洛尔成品的制备在三口瓶中,投入15%(g/g)甲醇水溶液800g,加入盐酸阿罗洛尔粗品(折干:12.00g),搅拌加热至微回流,溶解透明后保温搅拌15分钟,冷却降温至-5~0℃搅拌析晶4小时以上,过滤,70~80℃干燥得盐酸阿罗洛尔成品(10.75g,收率89.6%,hplc纯度99.98%)。实施例3按以下操作制备盐酸阿罗洛尔:(1)中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺的制备在三口瓶中,投入50%(g/g)异丙醇水溶液500g,加入碳酸氢钠(300g,3.59mol),搅拌溶解透明,加入起始原料式(ⅱ)化合物5-(2-巯基-4-噻唑)-2-噻吩甲酰胺(100.0g,0.413mol),室温搅拌均匀;然后加入环氧氯丙烷(76.4g,0.83mol),室温继续反应,tlc监控反应完全,约2~3小时,过滤,70~80℃干燥得中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺(120.8g,摩尔收率98.1%,hplc纯度99.7%),类白色固体;(2)盐酸阿罗洛尔粗品的制备在三口瓶中,投入无水乙醇850g,叔丁胺(265.7g,3.68mol),搅拌溶解均匀,加入中间体(ⅲ)5-(2,3-环氧丙基-2-巯基-4-噻唑)-2-噻吩甲酰胺(110.0g,0.37mol),搅拌加热并保温微回流反应,hplc监控反应完全,约12小时,浓缩除去溶剂无水乙醇及过量的叔丁胺至尽,得中间体(ⅳ),稍冷加入纯化水3300g,搅拌加热至110℃回流,溶解透明后冷却到室温,用36%盐酸调节ph0.5~1,用甲苯50g洗涤3次,弃去有机层,水层加入乙醇1700g,继续搅拌加热至溶解透明,冷却降温至0~5℃搅拌析晶4小时以上,过滤得盐酸阿罗洛尔粗品(折干:128.5g,摩尔收率84.0%,hplc纯度99.7%);(3)盐酸阿罗洛尔成品的制备在三口瓶中,投入80%(g/g)异丙醇水溶液2000g,加入盐酸阿罗洛尔粗品(折干:120.0g),搅拌加热至微回流,溶解透明后保温搅拌15分钟,冷却降温至-5~0℃搅拌析晶4小时以上,过滤,70~80℃干燥得盐酸阿罗洛尔成品(102.2g,收率85.2%,hplc纯度99.97%)。盐酸阿罗洛尔纯度检查方法:参照本品进口注册标准jx20030209及文献自拟,照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。用十八烷基硅烷键合硅胶为填充剂(5μm,4.6mm×250mm),用流动相a硫酸铵缓冲液(取约1.82g磷酸铵溶于1000ml水中,用磷酸调ph值至6.5)-乙腈(80:20),与流动相b硫酸铵缓冲液(取约1.82g磷酸铵溶于1000ml水中,用磷酸调ph值至6.5)-乙腈(20:80),按下表实施梯度洗脱,流速为每分钟1.0ml;检测波长为315nm,柱温为30℃。取本品适量,用50%乙腈溶解并稀释至每1ml约含1.5mg的溶液,作为供试品溶液,精密量取20μl注入液相色谱仪,记录色谱图。按峰面积归一化法计算。运行时间(分钟)流动相a(%)流动相b(%)0010050100202575505050550100600100本发明路线步骤②对酸化后阿罗洛尔水层用乙酸乙酯洗涤,乙酸乙酯层洗涤去杂质效果检查的高效液相色谱图如图1所示;对色谱图的分析结果如下表所示:色谱峰结果名称保留时间峰高面积%面积1杂质-12821352281729175.28162杂质-23.546296721615144.93333杂质-35.55481121921645.86944阿罗洛尔14.388119261957025.97755杂质-420.86392461782125.44336杂质-521.7073124244845213.69757杂质-625.926139335192501558.7975本发明路线制得的式i化合物盐酸阿罗洛尔,纯度检查的高效液相色谱图如图2所示;对色谱图的分析结果如下表所示:色谱峰结果名称保留时间峰高面积%面积1阿罗洛尔13.71726277095393987699.97392杂质-121.16715140370.00753杂质-232336281100390.0186以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1