检测癌症的存在风险的方法与流程
本发明是关于一种检测癌症的存在风险的方法;特别是一种利用18个癌症基因标记检测癌症的存在风险的方法。
背景技术:
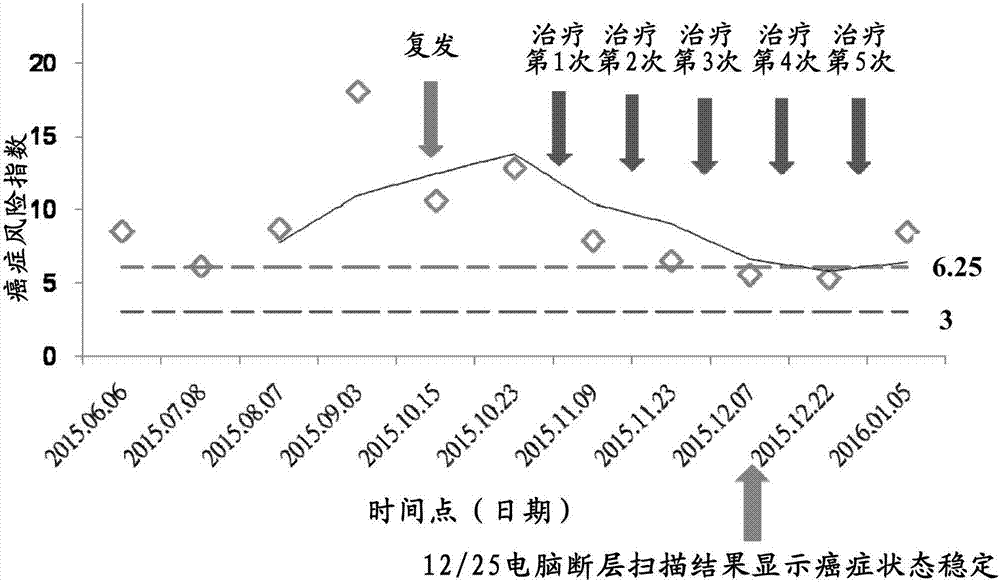
:近年来,分子医学科技逐渐发展出用于血液样本的癌症风险诊断及预测的癌症基因标记,该些标记可用于早期检测可改善患者的存活率,包括在症状为临床上可检测之前、接受治疗时以及在复原时。该些技术大多选择与癌症相关基因组,观察癌症患者与一般人在此基因组上的差异,通常利用皮尔森相关性系数(pearson'scorrelationcoefficient)建立机率转换机制或判断机制,再将受试者的基因表现导入前述机率转换机制或判断机制进行检验。然而,上述方法仅透过皮尔森相关性系数,其是一种线性相关系数,用来反映两个变量线性相关程度的统计量。该方法具有以下几个缺点:(1)该方法需考虑该些基因表现图形(pattern)是否相似,容易出现误判于基因表现皆在正常波动范围但基因表现图形相近,而并未考虑基因表现量高低是否合理;(2)该方法为考虑单一基因于群体中表线分布情况而忽略个体间差异;以及(3)单一基因效力不足。因此,目前用于血液样本的癌症风险诊断及预测的癌症基因标记,缺乏一种使用群体的基因表现量做为基础值以减少个体影响,以及对基因进行加权的方法。技术实现要素:有鉴于此,本发明提供一种检测癌症的存在风险的方法,其步骤包含:(a)从一受试者取得一包含核酸的体液的检体样本;(b)测量一癌症基因标记组的mrna表达量,该癌症基因标记组是由β-球蛋白(hemoglobinbetagene,hbb)、糖化血红蛋白(hemoglobina1,hba1)、细胞激素讯息抑制物-3(suppressorofcytokinesignalling3,socs3)、肾上腺髓质素(adrenomedullin,adm)、分泌型白细胞蛋白酶抑制蛋白(secretoryleukocyteproteaseinhibitor-1,slp1)、表面抗原分化簇68(clusterofdifferentiation68,cd68)、s100钙结合蛋白p(s100calciumbindingproteinp,s100p)、dna损伤诱导转移因子3(dnadamageinducibletranscript3,ddit3)、组织蛋白酶z(cathepsinz,ctsz)、bcl-2相关x蛋白(bcl-2-associatedproteinx,bax)、淀粉样蛋白前驱蛋白(amyloidprecursorprotein,app)、转酮醇酵酶(transketolase,tkt)、g蛋白偶联雌激素受体(gprotein-coupledestrogenreceptor,gper)、血红素结合蛋白以及血红素结合蛋白相关蛋白(haptoglobinandhaptoglobin-related,hpr|hp)、fk506结合蛋白3(fk506bindingprotein3,fkbp3)、酸性磷酸酶5(acidphosphatase5,acp5)、溶酶体关联蛋白跨膜4alpha(lysosomalproteintransmembrane4alpha,laptm4a)以及趋化因子受体4(chemokinereceptor,cxcr4)所组成;(c)计算该受试者的癌症风险指数,其公式为sum[ln(个别基因表现量/个别基因的基础表达量)],包含:(i)取个别基因表现量除以一个别基因的基础表达量以计算出每个基因的表达倍率;(ii)再将倍率取自然对数使上升倍数或下降倍数有相同的权重;(iii)基因表达量上升者确认有癌症的存在风险,基因表达量下降者不予考虑;以及(iv)加总个体基因表达上升者所属权重即为受试者的癌症风险指数;(d)该个别基因的基础表达量是取自一非癌症控制组的含核酸的体液的检体样本的相对应癌症基因的表达量的几何平均数;以及(e)以步骤(c)计算非癌症控制组的癌症风险指数;其中基于该受试者的癌症风险指数低于该非癌症控制组的癌症风险指数的中位数者,是代表该受试者具有形成癌症的低风险;基于该受试者的癌症风险指数高于该非癌症控制组的癌症风险指数99%可信区间(c.i.)者,代表该受试者具有形成癌症的高风险。本发明另提供一种评估一患者对癌症治疗的预后复发风险的方法,其步骤包含:(a)从一受试者取得一包含核酸的体液的检体样本;(b)测量一癌症基因标记组的mrna表达量,该癌症基因标记组是由hbb、hba1、socs3、adm、slpl、cd68、s100p、ddit4、ctsz、bax、app、tkt、gper、hpr|hp、fkbp3、acp5、laptm4a以及cxcr4所组成;(c)计算该受试者的癌症风险指数,其公式为sum[ln(个别基因表现量/个别基因的基础达量)],包含:(i)取个别基因表达量除以一个别基因的基础表达量以计算出每个基因的表达倍率;(ii)再将倍率取自然对数使上升倍数或下降倍数有相同的权重;(iii)基因表达量上升者确认有癌症的存在风险,基因表达量下降者不予考虑;以及(iv)加总个体所属权重即为受试者的癌症风险指数;(d)该个别基因的基础表达量是为取自一非癌症控制组的含核酸的体液的检体样本的相对应癌症基因的表达量的几何平均数;以及(e)以步骤(c)计算非癌症控制组的癌症风险指数;其中基于该患者的癌症风险指数低于该非癌症控制组的癌症风险指数的中位数者,是代表该患者具有癌症复发的低风险;基于该患者的癌症风险指数高于该非癌症控制组的癌症风险指数99%可信区间(c.i.)者,代表该患者具有癌症复发的高风险;且该非癌症控制组的人数需在20人以上。在本发明的一实施例中,其中步骤(b)是经由微数组芯片、实时聚合酶链锁反应(real-timepcr)、northern印迹杂交或原位杂交量测。在本发明的一实施例中,其中该癌症为乳癌、胃癌、膀胱癌或肝癌。在本发明的一实施例中,其中该检体样本是一外周血单核细胞(peripheralbloodmononuclearcell,pbmc)样本。因此,本发明提供一种检测癌症的存在风险的方法,该方法包括提供一个体以及非癌症控制组的血液样本,并量测18个癌症基因标记的表达量,其中该18个癌症基因标记包含由hbb、hba1、socs3、adm、slpl、cd68、s100p、ddit4、ctsz、bax、app、tkt、gper、hpr|hp、fkbp3、acp5、laptm4a以及cxcr4所组成的群组,先利用计算非癌症控制组个别基因的基础表达量,再分别将该个体以及非癌症控制组的个别基因表达量除以该个别基因的基础表达量以计算出每个基因的表达倍率;将倍率取自然对数使上升倍数或下降倍数有相同的权重;最后加总自然对数的倍率即为癌症风险指数,该癌症风险指数用以评估一个体癌症的存在风险及一患者在接受癌症治疗后的反应及预后情形。以下将进一步说明本发明的实施方式,以下所列举的实施例是用以阐明本发明,并非用以限定本发明的范围,任何熟习此技艺者,在不脱离本发明的精神和范围内,当可做些许更动与润饰,因此本发明的保护范围当视后附的申请专利范围所界定者为准。附图说明图1是本发明的检测癌症的存在风险的方法单一个体单次检测的癌症风险指数数据图;2图是本发明的检测癌症的存在风险的方法胃癌患者连续检测的癌症风险指数曲线图;图3是利用其他芯片进行本发明的检测癌症的存在风险的方法验证肝癌的癌症风险指数数据图。具体实施方式本发明提供一种检测癌症的存在风险的方法,该方法包括提供一个体以及非癌症控制组的血液样本,并量测18个癌症基因标记的表达,利用群体的基因表达量做为基础值以减少个体影响以及对基因进行加权的方法计算癌症分险指数,该癌症风险指数用以评估一个体癌症的存在风险及一患者在接受癌症治疗后的反应及预后情形。定义本文使用的用语「基因标记」,是指一种在mrna表现量发生改变,而可指引出特定疾病或异常的风险的增加。本文使用的用语「基因表达量」,是指由基因所产生的蛋白质或功能性rna产物。本文使用的用语「非癌症控制组」,是指该个体经确认未罹患癌症。本文使用的用语「微数组芯片」,是指可侦测基因表达量的微数组芯片,其可为affymetrix、illumina、agilent以及华联生物科技股份有限公司的微数组芯片,但不限于此。实施例1本发明的检测癌症的存在风险的方法本发明通过不同基因于外周血单核细胞(pbmc)的表达量不同给予加权,达成非癌症控制组以及癌症组分群的目的。收集基因组首先,本发明研究癌症发生的际在外周血单核细胞有特殊表达(过度表达或过低表达)基因;且观察该些基因于检测工具(mrna微数组芯片或实时聚合酶链锁反应(real-timepcr)系统或其他mrna分析方法)的表达区间,若基因表达量落于非线性侦测范围则降低权重(30%、40%、50%、60%、70%或其他可以获得较佳分析结果的比例),较佳为降低权重50%。本发明的18个与癌症最具相关性的基因标记,其中包含由β-球蛋白(hemoglobinbetagene,hbb)、糖化血红蛋白(hemoglobina1,hba1)、细胞激素讯息抑制物-3(suppressorofcytokinesignalling3,socs3)、肾上腺髓质素(adrenomedullin,adm)、分泌型白细胞蛋白酶抑制蛋白(secretoryleukocyteproteaseinhibitor-1,slp1)、表面抗原分化簇68(clusterofdifferentiation68,cd68)、s100钙结合蛋白p(s100calciumbindingproteinp,s100p)、dna损伤诱导转移因子3(dnadamageinducibletranscript3,ddit3)、组织蛋白酶z(cathepsinz,ctsz)、bcl-2相关x蛋白(bcl-2-associatedproteinx,bax)、淀粉样蛋白前驱蛋白(amyloidprecursorprotein,app)、转酮醇酵酶(transketolase,tkt)、g蛋白偶联雌激素受体(gprotein-coupledestrogenreceptor,gper)、血红素结合蛋白以及血红素结合蛋白相关蛋白(haptoglobinandhaptoglobin-related,hpr|hp)、fk506结合蛋白3(fk506bindingprotein3,fkbp3)、酸性磷酸酶5(acidphosphatase5,acp5)、溶酶体关联蛋白跨膜4alpha(lysosomalproteintransmembrane4alpha,laptm4a)以及趋化因子受体4(chemokinereceptor,cxcr4)所组成的群组。1.2计算个别基因的基础表现量本发明取非癌症控制组中单一基因于不同个体的表达量做几何平均数(或针对表达量分布进行加权平均)以此做为基因的基础表达量。1.3计算个体的癌症风险指数本发明将所有样本中单一个体所有基因分别除以个别基因基础表达量,可得基因表达的倍率,将倍率取自然对数使上升倍率或下降倍率有相同的权重;检视上升倍率的基因,最后加总个体所属基因表达上升的基因权重即为该个体的癌症风险指数。1.4进行分群本发明将非癌症控制组的癌症风险指数分布与癌症组的癌症风险指数分布分别计算。单一个体单次检测:该个体的癌症风险指数于非癌症控制组常态分布区域中位数(或平均数)以下为癌症低风险者,于非癌症控制组常态分布区域99%信心区间(c.i.)以上者为癌症高风险者,两者间为中度癌症风险者。单一个体连续检测:该个体的癌症风险指数连续(2、3、4或更多次数)出现于非癌症控制组常态分布区域或癌症患者分布区域,则为相应表现(correspondingperformance)。实施例2本发明的检测癌症的存在风险的方法的验证本发明为确认18个基因标记可准确应用于检测、诊断癌症、以及评估癌症治疗效果以及预后的预测,利用癌症患者及非癌症患者的控制组的血液样本量测18个基因标记的表达量再计算个别样本的癌症风险指数。2.1研究样本控制组样本:本发明收集26位经诊断未罹患癌症的正常个体的外周血单核细胞(peripheralbloodmononuclearcell,pbmc)样本,其皆取得捐赠样本的本人同意。每个样本至少检测至少两次,本发明共进行55人次的检测结果。癌症样本:本发明收集一位胃癌患者、两位膀胱癌患者、一位乳癌患者的外周血单核细胞(pbmc)样本,该些患者分别于癌症复发确诊前、癌症复发确诊、治疗期间或治疗后进行检测,其皆取得捐赠样本的本人同意。2.2rna萃取本发明依据商品操作手册利用试剂(invitrogen公司,美国)萃取rna,萃取后以超威量分光亮度计(nanodropspectrophotometer)(thermofisherscientific公司,美国)测量rna的浓度及纯度,借助od260/od280的比值以及od260/od230的比值估计rna的纯度,其中od260/od280的比值介于1.8至2.0之间;od260/od230的比值不小于2.0代表rna的纯度佳;以及借助微流体电泳分析仪(型号2100,agilent公司,美国)评估rna的片段大小、定性与定量分析。人类表达谱芯片(humanoligonucleotidednamicroarray,hoa)分析本发明使用人类表达谱芯片v6(华联生物科技股份有限公司,中国台湾)包含32,679个探针,每个探针设计为长链60个碱基寡核酸(sense-strand)的人类表达谱基因探针;其中32,741个探针是参考国际公认的refseq及ensembl序列数据库的注释基因,另外还包含938个控制组探针。芯片分析本发明使用经由1μgrna使用氨基化标记arna扩增试剂(华联生物科技股份有限公司,中国台湾)以及cy5染剂(奇异医疗设备公司,美国)制备荧光标记的反股rna(arna)标的物。利用杂交系统(华联生物科技股份有限公司,中国台湾)以杂交缓冲液(华联生物科技股份有限公司,中国台湾)将该荧光标记的反股rna(arna)标的物杂交至该人类表达谱芯片上。杂交16小时之后,将非专一性结合的标的物冲洗后,利用dna芯片扫描仪(型号g2565ca,agilent公司,美国)进行芯片扫描,并利用genepix4.1软件分析(moleculardevice公司)分析cy5荧光讯号强度。每个单一样本至少进行两次检测使重复性(reproducibility)超过0.975,将所得的讯号强度输入至rosetta解析器系统(rosetta生物软件公司,美国)以进行数据处理以及将数据标准化以适用于中位数的75百分位。在相同时间利用错误加权方法(error-weightedapproach)评估样本的错误。成对样本的表达量改变及p值两者的比较经由评估基因差异表达(differentiallyexpressedgene)分析计算,确定基因差异表达的标准是表达量改变≧2或≦-2以及p值<0.05以进行之后进一步分析。2.5癌症风险指数分析本发明撷取非癌症控制组中18个基因表达值,取个别基因于实验族群的几何平均数做为基础表达量;如表一及表二所示,将所有样本中(包含非癌症控制组及癌症组)单一个体所有基因分别除以个别基因基础表达量,可得基因表达的倍率,将倍率取自然对数使上升倍率或下降倍率有相同的权重,最后加总个体所属权重即为该个体的癌症风险指数。在非癌症控制组常态分布区域信心区间99%(即癌症风险指数6.25)以上者为癌症高风险者或癌症患者;癌症风险指数的为3(中位数)以下者为癌症低风险者;介于两者(3及6.25)之间为中度风险者。在癌症组织癌症风险指数:a.一位胃癌患者复发确诊前癌症风险指数为8.52,6.08、8.75、18.09以及10.58,其化疗前癌症风险指数为12.77,化疗期间癌症风险指数为7.90,6.48,6.31,5.27以及8.45;b.两位膀胱癌患者连续检测癌症风险指数分别为11.63以及13.31,10.24以及12.30;c.一位乳癌患者治疗期间癌症风险指数为11.88,治疗结束一个月后癌症风险指数为2.40。以上样本检验时间间隔2周至8周。表一控制组样本的癌症风险指数表二癌症样本的癌症风险指数本发明的检测癌症的存在风险的方法单一个体单次检测结果,如图1所示,乳癌、胃癌、膀胱癌患者利用本发明的18个基因标记得到最佳检测表现,其有效指标为:88.2%的敏感性(sensitivity)、91%的专一性(specificity)、90.4%的准确性(accuracy)。本发明的检测癌症的存在风险的方法胃癌患者连续检测的癌症风险指数结果,如图2所示,胃癌患者于复发确诊前至化疗前的癌症风险指数随时间逐渐增加,化疗期间至计算机断层扫描显示癌症状态稳定的癌症风险指数随时间逐渐减少,证实癌症患者利用本发明的18个基因标记可用于检测癌症存在及评估患者对癌症治疗的预后反应。实施例3使用其他芯片进行本发明的检测癌症的存在风险的方法的验证本发明为验证不同实验方式进行测量该18个癌症基因标记组的mrna表达量皆可应用本发明的方法。首先,本发明经由shim,chenms,sekark,tancketal.ablood-basedthree-genesignatureforthenon-invasivedetectionofearlyhumanhepatocellularcarcinoma.eurjcancer2014mar;50(5):928-36论文中公开的affymetrixhumangenomeu133plus2.0array基因芯片的所有基因表达量,取得本发明所述的18个癌症基因的mrna表现量,利用实施例2所述的方法进行本发明的癌症风险指数分析。癌症风险指数分布如图3所示,其中包含10个控制组样本(如表三所示),10个肝癌样本(如表四所示),在非癌症控制组常态分布区域信心区间99%(即癌症风险指数2.9)以上者为癌症高风险者或癌症患者;癌症风险指数的为1.0(中位数)以下者为癌症低风险者;介于两者(1及2.9)之间为中度风险者。其有效指标为:100%的敏感性(sensitivity)、60%的专一性(specificity)、80%的准确性(accuracy)。证实本发明的方法可应利用不同实验方式所获得的mrna表现量进行各种癌症存在风险的检测。表三控制组样本的癌症风险指数控制组样本癌症风险指数gsm12003040.805993gsm12003055.811704gsm12003065.468377gsm12003075.348942gsm12003081.9e-05gsm12003091.017762gsm12003102.184581gsm12003111.959261gsm12003127.340933gsm12003130.413556表四肝癌样本的癌症风险指数肝癌样本癌症风险指数gsm120029419.44gsm120029514.80gsm120029611.80gsm120029714.44gsm120029816.03gsm120029916.19gsm12003004.19gsm120030122.02gsm12003027.03gsm120030313.59基于上述,本发明的检测癌症的存在风险的方法,其是利用量测一个体以及非癌症控制组的血液样本中18个癌症基因标记的表达量,再利用群体的基因表达量做为基础值以减少个体影响以及对基因进行加权的方法计算癌症分险指数,该癌症风险指数用以评估一个体癌症的存在风险及一患者在接受癌症治疗后的反应及预后情形。因此,本发明的方法可应用于预防保健医学以评估癌症潜在风险;癌症治疗效果评估以辅助评估目前治疗是否有效;应用于癌症追踪预后以评估癌症复发风险。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1