具有增加的脂肪酶活性的两亲性肽‑脂肪酶缀合物及其用途的制作方法
技术领域
本发明涉及具有增加的脂肪酶活性的两亲性肽-脂肪酶缀合物,编码所述缀合物的多核苷酸,包含所述多核苷酸的表达载体,其中锚定了所述表达载体的转化体,构建所述缀合物的方法,使用所述缀合物的脂解方法,和使用所述脂肪酶制备生物柴油的方法。
背景技术:
脂肪酶(三酰基甘油酰基水解酶,EC3.1.1.3)是催化甘油三酯水解为脂肪酸和甘油酯或甘油并且作为消化食物的三种消化酶之一与淀粉酶和蛋白酶一起具有重要作用的酶。脂肪酶天然地来源于广泛范围的生物体,包括动物、植物和微生物。
除了在体内脂类(lipid)代谢中具有重要作用,脂肪酶还可用于提高奶酪的风味,在蔬菜发酵时增加游离脂肪酸,在肉发酵时使风味变浓,以及脂解鱼肉。此外,脂肪酶的利用目前已经扩展到合成昂贵的、光学纯的异构体。而且,脂肪酶还应用于多种工业中。作为其一些实例,脂肪酶在乳品工业中的应用包括经由乳脂(milk fats)的水解和牛脂(butterfat)或奶油(crease)的裂解制备奶酪。在洗涤剂工业中,脂肪酶可以用来制备洗衣剂或洗衣机洗涤剂。该酶可以减小洗涤剂产品的环境载荷,因为它们通过使得待使用的洗涤温度更低而节约能量。脂肪酶在油脂化工中的应用范围是巨大的,包括制造不饱和脂肪酸和肥皂以及从廉价的棕榈油生产可可脂。在造纸工业中,脂肪酶被用来从木材中移除树脂或松香和从废纸中移除墨。转到制药工业,脂肪酶的利用包括合成单独的R-和S-光学异构体,分离外消旋体和制造药物。化妆品工业应用脂肪酶来生产皮肤化妆品,包括蜡、防晒霜和沐浴产品。此外,脂肪酶可在能源工业中用作从植物油中生产生物柴油的手段。
目前,生物柴油,作为新的可再生能源出现,在全世界已经使用基于化学催化剂的方法而进行生产。然而,因为大量有机溶剂的使用,环境处置的高昂费用,以及归因于高反应温度引起的高能耗,它们的商业化还没有成功。出于这些原因,采用脂肪酶作为催化剂的工艺得到了广泛的关注。这些工艺所享有的优点是由于低反应温度而节省了能量,通过从副产物甘油形成收益而减小了生产成本,并且几乎没有环境污染。然而,就稳定性和效率相对于成本而言,该酶是不佳的。已经提议将该酶固定化作为克服所述缺点的方式,但作为解决如何提高酶性质的问题的方案还很遥远。因此,正在进行积极的研究以通过增加该酶的酶活性来提高该酶的工业实用性。
例如,不是开发廉价的和强力的脂肪酶,而是已经使用间接的替代方式,诸如改良的用于脂肪酶和酶固定化的反应条件,来解决与脂肪酶相关的问题。可选地,已经使用宏基因组学来搜索新的脂肪酶,但还没有得到值得注意的成就。为了提高脂肪酶的活性以及它们的底物特异性、耐热性和热稳定性,已经进行了广泛的研究,其中已经收集了各种脂肪酶的X-线结晶学数据,并且已经通过下面的方式对脂肪酶进行修饰:使用蛋白质工程技术诸如定向诱变,置换活性位点和周围区域的氨基酸残基。尽管这带来了脂肪酶活性的提高,但提高仅是部分的。
技术实现要素:
技术问题
鉴于此技术背景,本发明人想到造成脂肪酶与其底物的低可接近性的原因是底物的溶解度差,并且发现当与两亲性肽——即,具有亲水和疏水部分两者的肽——缔合时,脂肪酶与其底物的可接近性、结合性和反应性均提高,由此得到本发明。
解决问题的技术方案
因此本发明的目的是提供两亲性肽-脂肪酶缀合物,其表现出与单独脂肪酶相比更高的脂肪酶活性。
本发明的另一目的是提供编码所述缀合物的多核苷酸,包含所述多核苷酸的表达载体,以及其中包含所述表达载体的转化体。
本发明的又一目的是提供制备所述两亲性肽-脂肪酶缀合物的方法。
本发明的再又一目的是提供使用所述两亲性肽-脂肪酶缀合物的脂解方法。
本发明的再另一目的是提供使用所述两亲性肽-脂肪酶缀合物生产生物柴油的方法。
发明的有益效果
由于显著地提高了对脂类底物的反应性并且因此提高了酶活性,根据本发明的与两亲性肽缀合的脂肪酶,即使以小量使用,也能在需要脂肪酶的领域,诸如生物柴油生产中保证足够的脂类转化率。另外,本发明的脂肪酶缀合物不需要使用额外的表面活性剂,因此提供了经济效益。
附图说明
从下面结合附图的详述中,将更清晰地理解本发明的上述和其他目的、特征和其他优势,在附图中:
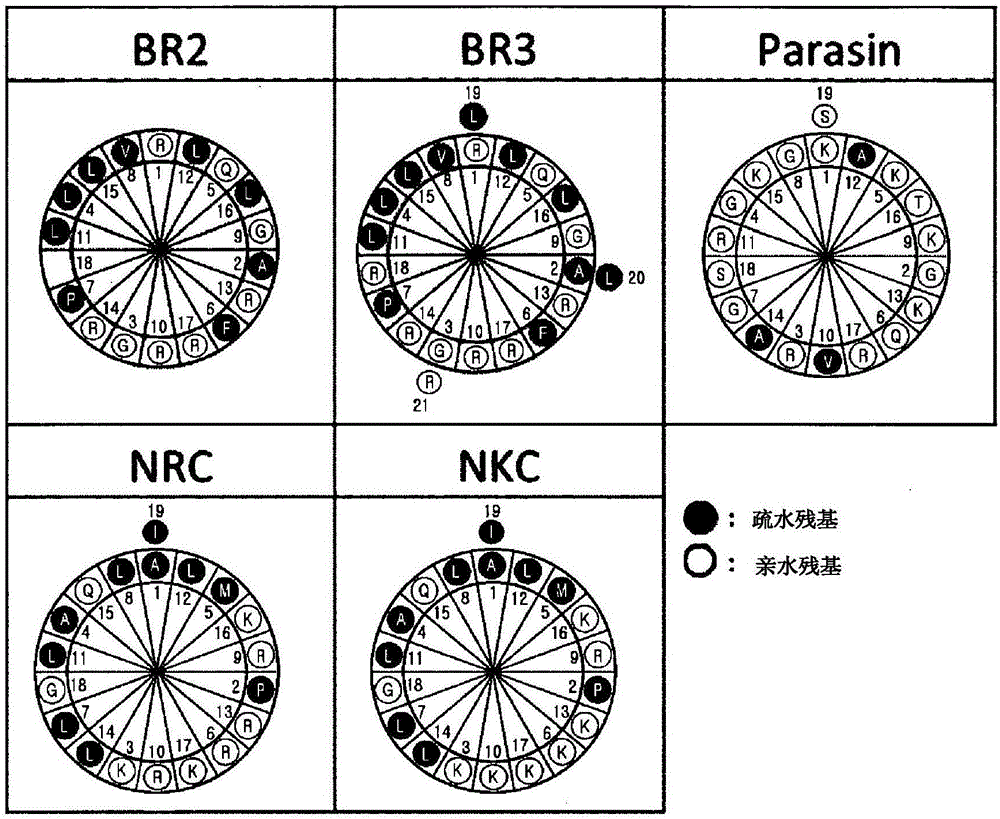
图1示出两亲性肽的Schiffer-Edmundson轮投影(wheel projection)的图,其中号码1表示肽的残基1,并且实心圆和空心圆分别指示疏水和亲水氨基酸;
图2是示出用于表达活性增强的脂肪酶的载体的基因结构的示意图;
图3是示出肽-脂肪酶TliA缀合物的表达的SDS-PAGE照片;
图4是示出根据本发明的与两亲性肽融合的TliA脂肪酶使用棕榈酸对硝基苯酯通过比色测定法所测量的脂解活性的图,棕榈酸对硝基苯酯在与脂肪酶反应时显色;
图5是示出根据本发明制备的TliA脂肪酶通过pH-STAT法测量的脂解活性的图;
图6是示出根据本发明的与两亲性肽融合的M37脂肪酶使用棕榈酸对硝基苯酯通过比色测定法测量的脂解活性的图;
图7是示出根据本发明制备的M37脂肪酶通过pH-STAT法测量的脂解活性的图;
图8示出使用荧光显微镜的NKC-融合的M37脂肪酶对脂类颗粒的定位;
图9示出南极假丝酵母(Candida antarctica)脂肪酶B(A),野生型M37脂肪酶(B)和NKC-融合的M37脂肪酶(C)在40℃温育12h的预定时间测量的酶活性。南极假丝酵母脂肪酶B、野生型M37和NKC-融合的M37脂肪酶的水解活性在0%、3.3%、5%和10%甲醇水溶液中测量;和
图10示出使用野生型M37脂肪酶和NKC-M37脂肪酶采用橄榄油进行生物柴油生产。生物柴油通过气相色谱定量分析和通过薄层色谱定性分析。(A)使用野生型M37脂肪酶(空心圆)和NKC-融合的M37脂肪酶(实心圆)的橄榄油三步酯交换的时程。此外,对使用野生型M37脂肪酶(左)和NKC-融合的M37脂肪酶(右)的酯交换反应期间的反应混合物进行TLC分析。箭头指示向反应混合物中添加甲醇。(B)使用野生型M37脂肪酶和NKC-融合的M37脂肪酶的橄榄油两步酯交换的时程。(C)使用野生型M37脂肪酶和NKC-融合的M37脂肪酶的橄榄油一步酯交换的时程。
具体实施方式
根据其一个方面,本发明提供了两亲性肽-脂肪酶缀合物,其中脂肪酶与两亲性肽缀合。
术语“两亲性肽”,当在本文中使用时,是指在极性面上包含极性氨基酸且在非极性面上包含非极性氨基酸的肽。极性氨基酸残基包括半胱氨酸、谷氨酰胺、苏氨酸、酪氨酸、丝氨酸和天冬酰胺,而非极性氨基酸残基的实例包括苯丙氨酸、色氨酸、甲硫氨酸、脯氨酸、缬氨酸、异亮氨酸、亮氨酸、甘氨酸和丙氨酸。在本发明中,两亲性肽充当用于增强脂肪酶与其底物脂类的结合和反应性的介质。在两亲性肽中,极性氨基酸残基或非极性氨基酸残基可以在氨基酸序列中紧靠着存在。可选地,氨基酸残基可以随机地分布,而无论其在氨基酸序列上的极性如何,但由于极性对三维结构的影响而在空间上彼此接近地定位,形成极性面和非极性面。
只要其可以缀合脂肪酶并且提高该酶与底物的可接近性或反应性,可以将任何两亲性肽用于本发明的目的。两亲性肽的实例包括Buforin IIb(SEQ ID NO:1)、B0(SEQ ID NO:2)、Paracin I(SEQ ID NO:3)、NKC(SEQ ID NO:4)、和NRC(SEQ ID NO:5),但不限于这些。另外,如果两亲性肽可以发挥作用以增强与其缀合的脂肪酶对底物的可接近性和反应性,则对其长度没有特殊的限制。在优选的实施方式中,采用buforin IIb、B0、paracin I、NKC和NRC。
如上所提到的,可用于本发明中的两亲性肽可以是包含选自SEQ ID NO:1至5的氨基酸序列的肽。另外,可以采用包含与具有SEQ ID NO:1至5的氨基酸序列至少70%,优选至少80%,更优选至少90%,更优选至少95%,和最优选至少98%同源性的肽作为本发明中的两亲性肽,条件是它们保留了实质上增强脂肪酶活性的生物学功能。要认识到肽变体,即使部分通过缺失、修饰、置换或添加而被突变,均落入本发明的范围内,只要它们表现出与两亲性肽相同或对应的生物活性即可。
当在本文中使用时,术语“脂肪酶”是指催化脂肪水解的酶。详细地,当作用于中性脂肪时,脂肪酶负责将三酰基甘油酯降解成二酰基甘油酯以及将一酰基甘油酯降解成脂肪酸和甘油。总体来说,脂肪酶在动物的胰瘘中丰富地存在,而植物在种子诸如小麦、蓖麻子、豆等中含有脂肪酶。如果其具有水解脂类的生物活性,则在本发明中可以使用任何类型的脂肪酶而没有限制。例如,可以使用来源于荧光假单胞菌(Pseudomonas fluorescens)的脂肪酶TliA(热稳定脂肪酶),或来源于溶脂发光杆菌(Photobacterium lipolyticum)的脂肪酶M37。关于脂肪酶的信息可以获自已知的数据库,诸如GenBank,NIH。例如,TliA和M37可以分别以AAD09856和AAS78630的登录号被搜索到。TliA和M37可以是分别包含,但不限于SEQ ID NO:6和7的氨基酸序列的脂肪酶。还可用于本发明中的有,如上所述,与具有SEQ ID NO:6或7的氨基酸序列至少70%,优选至少80%,更优选至少90%,还更优选至少95%,和最优选至少98%同源性的蛋白,条件是它们具有降解脂类的实质生物活性。此外,要理解的是肽变体,即使部分通过缺失、修饰、置换或添加而被突变,均落入本发明的范围内,只要它们表现出与两亲性肽相同或对应的生物活性即可。
当在本文中使用时,术语“两亲性肽-脂肪酶缀合物”是指以不损害脂肪酶的生物活性的方式与脂肪酶连接的两亲性肽。在两亲性肽-脂肪酶缀合物中,两亲性肽以化学方式、酶学方式或通过基因操作而与脂肪酶连接,以形成融合蛋白。
两亲性肽可以与脂肪酶直接连接或经由接头与脂肪酶连接。
当在本文中使用时,术语“接头”是指利用氢键、静电相互作用、范德华力、二硫键、盐桥、疏水相互作用、共价键等连接两个不同的融合伴侣(例如,生物聚合物)的任何部分。在优选的实施方式中,接头具有至少一个半胱氨酸残基,该半胱氨酸残基可以在生理条件下或其他标准肽条件(例如,用于纯化或保存肽的条件)下参与至少一个二硫键。除了连接融合伴侣,接头还可以充当间隔物并在融合伴侣之间提供空间或充当铰链以为缀合物提供柔性或刚度。接头可以是肽基接头或非肽基接头。经由肽键或二硫键在融合伴侣之间的直接连接包括在接头的作用范围内。
术语“非肽基接头”,当在本文中使用时,是指由至少两个重复单位组成的生物相容性接头,其中在重复单位之间具有非肽基共价键。
可用于本发明中的非肽基接头的实例包括聚乙二醇(PEG)均聚物、聚丙二醇均聚物、乙二醇-丙二醇共聚物、聚氧乙烯多元醇、聚乙烯醇、多糖、右旋糖酐、聚乙烯基乙醚、生物可降解聚合物、脂类聚合物、壳多糖、透明质酸和它们的组合,优选聚乙二醇均聚物。在本领域中已知晓或可以在现有技术水平上容易制备的它们的衍生物包括在本发明的范围内。更优选地,聚乙二醇均聚物为双官能醛形式,分子量为1-5kDa且最优选具有3.4kDa的分子量,使得在相对的端部处的醛基可以与两个多肽的末端氨基形成共价键,由此连接两亲性肽与脂肪酶。特别地,在相对的端部处的醛官能团有效地允许将非特异性反应保持到最小。
另外,对两亲性肽和脂肪酶之间的缀合状态没有特别的限制。在此上下文中,两亲性肽可以连接到脂肪酶的N-或C-末端,或两个两亲性肽分别连接到脂肪酶的N-和C-末端两端。例如,buforin IIb、B0、paracin I、NKC或NRC可以融合到脂肪酶TliA的N-末端(SEQ ID NO:8-12),脂肪酶M37的N-末端(SEQ ID NO:13-17),脂肪酶TliA的C-末端(SEQ ID NO:18-22),脂肪酶M37的C-末端(SEQ ID NO:23-27),脂肪酶TliA端的N-和C-末端两端(SEQ ID NO:28-32),或脂肪酶M37的N-和C-末端两端(SEQ ID NO:33-37)。
在本发明的一个实施方式中,buforin IIb、B0、paracin I、NKC或NRC用作两亲性肽,而TliA或M37充当脂肪酶。两亲性肽连接到脂肪酶的N-末端以构建两亲性肽-脂肪酶,发现该两亲性肽-脂肪酶具有比野生型脂肪酶本身高多达10倍的脂解活性(图4-7)。因此,当与两亲性肽缀合时,脂肪酶的脂解活性增加使得其可以在需要脂解的多种领域中使用,具有极大的经济效益。还观察到该两亲性肽-脂肪酶具有提高的对脂类颗粒的可接近性(图8)。另外,该两亲性肽-脂肪酶缀合物,NKC-M37脂肪酶,与野生型脂肪酶M37相比,甚至在甲醇——在制备生物柴油中使用的成分之一——的存在下,表现出更高的稳定性和脂解活性(图9和10),这提示本发明的两亲性肽-脂肪酶缀合物可用于生产生物柴油。
根据其另一个方面,本发明提供了编码缀合物的多核苷酸,包含该多核苷酸的表达载体,和其中包含该表达载体的转化体。
当在本文中使用时,术语“多核苷酸”是指由在链中共价键合的许多核苷酸单体构成的聚合物分子。DNA(脱氧核糖核酸)和RNA(核糖核酸)是具有不同的生物学功能的多核苷酸的实例。因此,本发明的多核苷酸可以是编码缀合物的DNA或RNA形式。
根据本发明的多核苷酸可以编码,但不限于,其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶TliA的N-末端的缀合物(SEQ ID NO:45-49),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶M37的N-末端的缀合物(SEQ ID NO:50-54),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶TliA的C-末端的缀合物(SEQ ID NO:55-59),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶M37的C-末端的缀合物(SEQ ID NO:60-64),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶TliA的N-和C-末端两端的缀合物(SEQ ID NO:65-69),或其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶M37的N-和C-末端两端的缀合物(SEQ ID NO:70-74)。
在本发明的编码缀合物的多核苷酸中,由于密码子简并性或考虑到要表达它们的生物体优先使用的密码子,可以在编码区中做出许多修饰,条件是它们不改变在编码区中表达的多肽的氨基酸序列,并且甚至可以在编码区以外的区域中引入各种修饰或改变,只要它们对基因的表达没有影响即可。本领域技术人员充分理解的是,这些修饰和改变包括在本发明的范围内。也就是说,本发明的多核苷酸可以在一个或多个核酸碱基处通过置换、缺失、插入或其组合被修饰,只要得到的多核苷酸编码功能上等同的多肽即可,并且它们也包括在本发明的范围内。
根据本发明包含编码缀合物的多核苷酸的表达载体可以是允许多核苷酸在真核细胞或原核细胞中复制和/或表达的载体,所述真核细胞或原核细胞包括,但不限于,哺乳动物细胞(例如,人细胞,猴细胞,兔细胞,大鼠细胞,仓鼠细胞,鼠科动物细胞,等),植物细胞,酵母,昆虫细胞或细菌细胞(例如,大肠杆菌,等)。在表达载体中,优选地,核苷酸可操作地连接至适宜的启动子,使得其在宿主细胞中表达。此外,该表达载体可以含有至少一个选择标志。例如,多核苷酸可以被引入至噬菌体、粘粒、微型染色体,或病毒或逆转录病毒载体。
转化体可以通过将表达载体引入至宿主细胞中来进行制备。可用于本发明中的宿主细胞的实例包括,但不限于,细菌细胞,诸如大肠杆菌,链霉菌属(Streptomyces),鼠伤寒沙门氏菌(Salmonella typhimurium),等;酵母;真菌,诸如毕赤酵母(Pichia pastoris);昆虫细胞,诸如果蝇(Drosophila),甜菜夜蛾(Spodoptera),和Sf9细胞;动物细胞,诸如CHO(中国仓鼠卵巢细胞),SP2/0(小鼠骨髓瘤),人淋巴母细胞,COS,NSO(小鼠骨髓瘤),293T,Bowes黑色素瘤细胞,HT-1080,BHK(幼仓鼠肾细胞),HEK(人胚肾细胞),和PERC.6(人视网膜细胞);和植物细胞。在本发明的一个实施方式中,大肠杆菌用作宿主细胞(实施例2)。
术语“引入”,当在本文中使用时,是指将包含编码缀合物的多核苷酸的载体递送至宿主细胞中。引入可以通过本领域中已知的多种方式实现,包括磷酸钙-DNA共沉淀,DEAE-右旋糖酐-介导的转染,聚凝胺介导的转染,电击,微注射,脂类体融合,脂类体转染和原生质体融合。转染是指将感兴趣的核酸材料通过使用病毒颗粒感染的方式转移到细胞中。另外,可以使用基因轰击来实现对表达载体的细胞摄取。在本文中,术语“引入”可以与术语“转化”互换使用。
根据其进一步的方面,本发明提供了制备两亲性肽-脂肪酶缀合物的方法。
优选地,该方法包括(a)培养包含携带编码两亲性肽-脂肪酶缀合物的多核苷酸的表达载体的转化体;和(b)从细胞培养物或培养基中回收两亲性肽-脂肪酶缀合物。
回收步骤可以在破坏来自细胞培养物或上清液的细胞团后使用纯化方法来进行,所述纯化方法诸如萃取,亲和色谱,离子交换色谱,凝胶过滤色谱,疏水色谱,蛋白沉淀,透析或其组合。回收的感兴趣蛋白可以使用本领域中熟知的方法确认,诸如SDS-PAGE,Western印迹,等。
在本发明的一个实施方式中,制备编码两亲性肽-脂肪酶缀合物,paracin I-TliA脂肪酶,buforin IIb-TliA脂肪酶,B0-TliA脂肪酶,paracin I-M37脂肪酶,buforin IIb-M37脂肪酶,B0-M37脂肪酶,NKC-M37脂肪酶和NRC-M37脂肪酶的基因并使用它们来构建携带它们的各个表达载体(pET-Par-TliA,pET-Buf-TliA,pET-B0-TliA,pET-Par-M37,pET-Buf-M37,pET-B0-M37,pET-NKC-M37和pET-NRC-M37)。将这些表达载体引入至大肠杆菌中以获得各个转化体,然后进行培养。从培养物中回收为两亲性肽-脂肪酶缀合物形式的融合多肽(实施例1和2,图2和3)。
根据其又一方面,本发明提供了使用两亲性肽-脂肪酶缀合物的脂解方法。该方法包括使两亲性肽-脂肪酶缀合物与脂类反应。
两亲性肽、脂肪酶和两亲性肽-脂肪酶缀合物如上所述。表现出提高的对脂类底物的可接近性和反应性归因于两亲性肽(图4-8),两亲性肽-脂肪酶缀合物在脂解中可以是有效的。两亲性肽的存在消除了使用额外的表面活性剂的必要性,并且减少了脂肪酶的量,使得两亲性肽-脂肪酶缀合物可以以经济上有效益的方式水解脂类。
只要其充当脂肪酶的底物,可以采用任何脂类而没有特殊限制。
在本发明的一个实施方式中,缀合物的脂解活性与野生型脂肪酶进行比较,野生型脂肪酶不含两亲性肽。为了进行比较,使用棕榈酸对硝基苯酯和橄榄油作为底物。关于作为底物的棕榈酸对硝基苯酯,发现当脂肪酶TliA以缀合物的形式时与野生型脂肪酶相比其活性增加大约10%(图4)。与野生型相比,包含脂肪酶M37的缀合物的活性增加1.2-至4.2-倍(图6)。当在橄榄油上使用时,发现与脂肪酶TliA本身相比,当与两亲性肽融合时脂肪酶TliA的活性增加大约35.5-至78-倍(图5)。在脂肪酶M37的情况下,与野生型相比,当其为缀合物的形式时其对橄榄油的脂解活性增加大约2.2至10.2倍(图7)。这些数据支持了下面的结论:本发明的缀合物可以有效地水解脂类。
根据其又另一方面,本发明提供了使用两亲性肽-脂肪酶缀合物生产生物柴油的方法。
优选地,此方法包括,但不限于,使两亲性肽-脂肪酶缀合物与油和/或脂肪和醇反应。
可选地,用于生产生物柴油的方法可以包括,但不限于,(a)将表达载体引入至宿主细胞中以形成转化体;(b)培养转化体并从细胞培养物或培养基中回收脂肪酶;和(c)在脂肪酶的存在下使油和/或脂肪与醇反应以生产生物柴油。
根据本发明可用于生产生物柴油的脂肪酶可以是游离形式或是固定化形式。脂肪酶的固定化可以使用本领域中熟知的多种方法来实现,包括,但不限于,物理方法诸如吸附和包封以及化学方法诸如共价键合和交联。
可用于本发明中的油和脂肪有天然的油和脂肪,经加工的油和脂肪以及废弃的油和脂肪。更优选的是大豆油,菜籽油和棕榈油。在本发明中可用于制备生物柴油的醇优选含有2-8个碳原子,且更优选2-4个碳原子。醇的实例包括乙醇、甲醇、1-丙醇、异丙醇、1-丁醇、2-丁醇、异丁醇和叔丁醇。醇的进料可以使用本领域中已知的多种进料方法来实现。例如,醇可以以多步进料的方式或以连续的方式进料。
在本发明的一个实施方式中,橄榄油或废油以及甲醇被用作用于生产生物柴油的起始物料(实施例5)。典型的脂肪酶,诸如CalB脂肪酶,在具有高甲醇含量的介质中是不稳定的,而本发明的脂肪酶在3.3%,5%和甚至10%甲醇溶液中维持高活性(图9)。另外,在3步甲醇进料法(1摩尔当量)中,本发明的NKC-M37脂肪酶确保从橄榄油获得生物柴油的高生产产率。事实上,其允许达到该生产产率比野生型M37脂肪酶快95%(节省21小时)(图10a)。在2步甲醇进料法中(其比3步甲醇进料法更有经济效益),本发明的缀合物达到最大转化产率比野生型M37脂肪酶快27小时(图10b)。在1步甲醇进料法中,本发明的脂肪酶缀合物与野生型脂肪酶相比在更短的时间内也达到了最大转化率(图10c)。
另外,由于其中的杂质、游离脂肪酸和含水量,废油已知难以应用于生物柴油生产。此外,其杂质对脂肪酶有负面影响,尽管它们非常廉价。然而,发现本发明的NKC-M37脂肪酶从废油生产生物柴油所达到的程度与从橄榄油或棕榈油相似,这证明了本发明的缀合物在生物柴油生产中是经济上有效益的(实施例5)。
实施本发明的方式
下面的非限制性实施例用于举例说明本发明的选择的实施方式。要理解的是所示的各组分的比例变化和要素备选方式对于本领域技术人员将是明显的并且包括在本发明的实施方式的范围内。
实施例1:开发其中脂肪酶与各种两亲性肽融合的融合脂肪酶
实施例1-1:肽衍生物的制备
许多不同的具有强力抗菌活性的肽形成由疏水和亲水氨基酸残基组成的两亲性α-螺旋结构。具有优异的两亲性的抗菌肽,包含SEQ ID NO:1的氨基酸序列的buforin IIb(韩国专利第10-314721号),由buforin IIb修饰的包含SEQ ID NO:2的氨基酸序列的B0,包含SEQ ID NO:3的氨基酸序列的Paracin I(韩国专利第10-330136号),包含SEQ ID NO:4的氨基酸序列的NKC,和包含SEQ ID NO:5的氨基酸序列的NRC(韩国专利第10-836596号)(表1)由本发明人制备并且用来构建具有增强的脂解活性的融合多肽。
【表1】
5种两亲性肽的α-螺旋结构可以通过使用Schiffer和Edmundson轮投影来示意性地可视化,如图1中所示。在此轮中,连续氨基酸中的每一个对应于100°的圈(turn),使得螺旋每圈具有3.6个残基。
实施例1-2:编码肽-脂肪酶缀合物的基因的构建
对质粒pHOPE(Eom,GT,等人,Applied Environ.Microbiol.,71:3468-3474,2005)和pEML37(Yang KS,等人,J.Biosci.Bioeng.,107:599-604,2009)进行PCR(聚合酶链式反应)以扩增脂肪酶基因,然后将其与编码所选的两亲性肽的基因融合,上述两个质粒分别携带荧光假单胞菌来源的编码脂肪酶TliA的基因,已知具有强力的酶活性并且确保生物柴油生产的高转化率,以及溶脂发光杆菌来源的编码脂肪酶M37的基因,已知对甲醇高度耐受。在PCR中使用的引物的信息显示在表2中。
【表2】
实施例1-2-1:编码paracin I/脂肪酶TliA缀合物的基因的构建
为了构建编码paracin I/TliA脂肪酶融合蛋白的基因,首先,使用一对引物pET16-L和pET-R(Par)通过PCR扩增在pET16b(Merck biosciences)中与T7启动子-核糖体结合位点-His标签连接的基因片段。
单独地,使用引物TliA-rev(Par)和Nde-TliA-for对pHOPE进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分paracin融合。
在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-TliA-for通过PCR扩增T7启动子-核糖体结合位点-His标签-paracin I肽-脂肪酶基因。
实施例1-2-2:编码buforin IIb/脂肪酶TliA缀合物的基因的构建
为了构建编码buforin IIb/TliA脂肪酶融合蛋白的基因,首先,使用一对引物pET16-L和pET-R(Buf)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。
单独地,使用引物TliA-rev(Buf)和Nde-TliA-for对pHOPE进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分buforin基因融合。
在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-TliA-for通过PCR扩增T7启动子-核糖体结合位点-His标签-buforin IIb肽-脂肪酶基因。
实施例1-2-3:编码B0/脂肪酶TliA缀合物的基因的构建
为了构建编码B0/TliA脂肪酶融合蛋白的基因,首先,使用一对引物pET16-L和pET-R(B0)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。
单独地,使用引物TliA-rev(B0)和Nde-TliA-for对pHOPE进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分buforin基因融合。
在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-TliA-for通过PCR扩增T7启动子-核糖体结合位点-His标签-B0肽-脂肪酶基因。
实施例1-2-4:包含脂肪酶TliA的对照基因的构建
扩增不含任何两亲性肽的对照DNA(T7启动子-核糖体结合位点-His标签-脂肪酶TliA)。为此,首先,使用DNA引物pET16-L和pET-R(con)对pET16b进行PCR以合成T7启动子-核糖体结合位点-His标签基因片段。
单独地,在引物TliA-rev(con)和Nde-TliA-for的存在下进行PCR,以pHOPE充当底物,扩增包含脂肪酶基因的DNA片段。
在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-TliA-for通过PCR扩增T7启动子-核糖体结合位点-His标签-脂肪酶基因。
实施例1-2-5:编码buforin IIb/脂肪酶M37缀合物的基因的构建
构建编码buforin IIb/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一对引物pET16-L和pET-R(Buf)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。单独地,使用引物M37-rev(Buf)和Nde-M37-for对pEML37进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分两亲性肽基因融合。在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-M37-for通过PCR扩增T7启动子-核糖体结合位点-His标签-buforin IIb-脂肪酶基因。
实施例1-2-6:编码paracin I/脂肪酶M37缀合物的基因的构建
构建编码paracin I/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一对引物pET16-L和pET-R(Par)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。单独地,使用引物M37-rev(Par)和Nde-M37-for对pEML37进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分两亲性肽基因融合。在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-M37-for通过PCR扩增T7启动子-核糖体结合位点-His标签-paracin I-脂肪酶基因。
实施例1-2-7:编码B0/脂肪酶M37缀合物的基因的构建
构建编码B0/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一对DNA引物pET16-L和pET-R(B0)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。单独地,使用引物M37-rev(B0)和Nde-M37-for对pEML37进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分两亲性肽基因融合。在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-M37-for通过PCR扩增T7启动子-核糖体结合位点-His标签-B0脂肪酶基因。
实施例1-2-8:编码NKC/脂肪酶M37缀合物的基因的构建
构建编码NKC/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一对引物pET16-L和pET-R(NKC)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。单独地,使用引物M37-rev(NKC)和Nde-M37-for对pEML37进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分两亲性肽基因融合。在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-M37-for通过PCR扩增T7启动子-核糖体结合位点-His标签-NKC-脂肪酶基因。
实施例1-2-9:编码NRC/脂肪酶M37缀合物的基因的构建
构建编码NRC/M37脂肪酶融合蛋白的基因。为此,使用一对引物pET16-L和pET-R(NRC)通过PCR扩增在pET16b中与T7启动子-核糖体结合位点-His标签连接的基因片段。单独地,使用引物M37-rev(NKC)和Nde-M37-for对pEML37进行PCR以合成DNA片段,在该DNA片段中脂肪酶基因与一部分两亲性肽基因融合。在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-M37-for通过PCR扩增T7启动子-核糖体结合位点-His标签-NRC-脂肪酶基因。
实施例1-2-10:包含脂肪酶M37的对照基因的构建
扩增不含任何两亲性肽的对照DNA(T7启动子-核糖体结合位点-His标签-脂肪酶M37)。为此,使用DNA引物pET16-L和pET-R(NRC)对pET16b进行PCR以合成T7启动子-核糖体结合位点-His标签基因片段。单独地,在引物M37-rev(con)和Nde-M37-for的存在下进行PCR,以pEML37充当底物,扩增包含脂肪酶基因的DNA片段。然后,在两个扩增的DNA片段用作底物的同时,使用引物pET16-L和Nde-M37-for通过PCR扩增T7启动子-核糖体结合位点-His标签-M37脂肪酶基因。
实施例1-3:包含两亲性肽/脂肪酶融合蛋白基因的表达载体的构建
在实施例1-2中构建的T7启动子-核糖体结合位点-His标签-肽-脂肪酶缀合物DNA用限制性酶BglII和NdeI消化并克隆进各自的pET16b载体中,所述pET16b载体先前用相同的限制性酶消化(图2)。图2是示出用于表达活性增强的脂肪酶的载体的基因结构的示意图。在该载体中,两亲性肽基因位于条件性启动子的下游,其与脂肪酶基因的N-末端融合。另外,提供了组氨酸-标签,在两亲性肽之前,用于蛋白纯化,而蛋白酶Xa因子的识别位点插入在组氨酸标签和肽基因之间,目的是在表达和纯化后去除组氨酸标签。表达后,组氨酸标签-肽-脂肪酶缀合物使用Ni-柱分离并用酶Xa因子处理以分离期望的两亲性肽-脂肪酶结构。如上所述,所述基因位于条件性启动子的下游使得因为与两亲性肽融合而具有增强的活性的脂肪酶可以在期望的条件下表达。
将克隆的质粒转化进大肠杆菌XL1-Blue(Invitrogen)中,然后在含有氨苄青霉素的LB平板上选择。为了评价质粒是否被正确构建,它们从平板上生长的集落制备并用限制性酶BglII和NdeI消化。将DNA消化产物在琼脂糖凝胶上泳动以测量其尺寸并进行DNA碱基测序。
结果,将携带TliA脂肪酶(对照),paracin I-TliA脂肪酶,buforin IIb-TliA脂肪酶,B0-TliA脂肪酶,M37脂肪酶(对照),paracin I-M37脂肪酶,buforin IIb-M37脂肪酶,B0-M37脂肪酶,NKC-M37脂肪酶,和NRC-M37脂肪酶的重组表达质粒分别命名为pET-TliA,pET-Par-TliA,pET-Buf-TliA,pET-B0-TliA,pET-M37,pET-Par-M37,pET-Buf-M37,pET-B0-M37,pET-NKC-M37和pET-NRC-M37。
实施例2:肽-脂肪酶缀合物的分离和酶活性的测定
实施例2-1:肽-脂肪酶融合蛋白的表达
表达肽-脂肪酶融合蛋白。为此,将之前构建的质粒电穿孔至大肠杆菌BL21(DE3)(Merck biosciences)中,然后将其铺至平板上。选择由此生长的单一集落并将其接种至LB肉汤中。在37℃,将细胞培养至在600nm为0.4的光密度。在1mM IPTG(异丙基-1-硫代-β-D-半乳糖吡喃糖苷)的存在下诱导肽-脂肪酶缀合物的表达。诱导后4小时收获大肠杆菌细胞。通过10%SDS-PAGE检查感兴趣的肽-脂肪酶缀合物的表达。使用Bradford测定法测定蛋白水平。
结果,观察到肽-脂肪酶融合蛋白在大肠杆菌中作为包涵体表达(图3)。参照图3,提供了显示肽-脂肪酶TliA融合蛋白表达的SDS-PAGE照片,其中尺寸标记在M道泳动,未用IPTG诱导的细胞溶胞产物在1道上,用IPTG诱导的细胞溶胞产物在2道上,用IPTG诱导的细胞溶胞产物的可溶性上清液在3道上,且用IPTG诱导的包涵体在4道上,并且Par代表paracin I,Buf代表buforin IIb。
实施例2-2:肽-脂肪酶融合蛋白的分离
为了分离重组蛋白,将大肠杆菌细胞悬浮在裂解缓冲液(50mM NaH2PO4,300mM NaCl,pH 8.0)中,并通过超声处理(520秒,0.5周期,50%振幅)破坏。超声处理后,由此获得的细胞溶胞产物在4℃以12,000rpm离心20min,将可溶性上清液与包括包涵体的不溶部分分开。将在不溶部分中的肽-脂肪酶融合蛋白溶解于洗涤缓冲液(100mM NaH2PO4,10mM Tris-Cl,8M尿素,pH 6.3)中,然后通过离心去除细胞碎片。此后,将上清液上样至NTA(Ni2+次氮基三乙酸)琼脂糖柱(Qiagen,Hilden,Germany)以捕获肽-脂肪酶融合蛋白并将其与柱分离,然后通过膜透析以去除剩余的杂质。为了去除用于分离融合蛋白的His标签,将它们用Xa因子(New England Biolab,USA)处理。纯化蛋白的确认通过10%SDS-PAGE和N-端氨基酸测序来实现。
实施例2-3:对肽-脂肪酶融合蛋白的脂肪酶活性的测定
实施例2-3-1:使用棕榈酸对硝基苯酯测量脂肪酶活性
使用棕榈酸对硝基苯酯通过比色测定法测量脂肪酶活性。10mM棕榈酸对硝基苯酯在乙腈中的溶液、乙醇和50mM Tris-HCl溶液(pH 8.5)以1:4:95的比率混合。向0.8mL棕榈酸对硝基苯酯混合物加入0.2mL融合蛋白溶液,接着在45℃温育10min,然后测量在405nm的吸光度。结果显示在图4和6中。图4是示出根据本发明的与两亲性肽融合的TliA脂肪酶使用棕榈酸对硝基苯酯通过比色测定法测量的脂解活性的图,棕榈酸对硝基苯酯在与脂肪酶反应时显色。图6是示出根据本发明的与两亲性肽融合的M37脂肪酶使用棕榈酸对硝基苯酯通过比色测定法测量的脂解活性的图。
即使在室温下,如可从图4的数据看到的,paracin-TliA融合脂肪酶(Par-lip)表现出与在45℃的最适反应温度下野生型脂肪酶(对照)相似的酶活性。TliA,当与paracin I或B0融合时,发现与对照相比在45℃的活性增加大约10%。在图6中理解,B0/M37脂肪酶融合蛋白(B0-M37)、buforin IIb/M37脂肪酶融合蛋白(Buf-M37)、NKC/M37脂肪酶融合蛋白(NKC-M37)、NRC/M37脂肪酶融合蛋白(NRC-M37)和paracin I/M37脂肪酶融合蛋白(Par-M37)与对照相比活性分别增加4.2-,2.7-,6.3-,1.3-和1.2-倍。这些数据表明两亲性肽当与脂肪酶融合时,显著地增强了脂肪酶的活性。.
实施例2-3-2:使用橄榄油水解测量脂肪酶活性
为了更精确地定量分析,通过滴定由橄榄油的水解释放的游离脂肪酸来测量脂肪酶活性。通过在Waring捣碎机(Waring blender)中以最大速度在450mL 20mM NaCl,1mM CaCl2,0.5%(w/v)阿拉伯树胶溶液中乳化5mL橄榄油2min来制备橄榄油乳液。在通过添加10mM NaOH溶液将底物乳液的pH调整至8.0后,向其中加入酶溶液。脂肪酸释放的速率用pH滴定仪(718Stat Titrino,Metrohm)在50℃测量5min。结果显示在图5和7中。图5是示出根据本发明制备的TliA脂肪酶通过pH-STAT法测量的脂解活性的图。图7是示出根据本发明制备的M37脂肪酶通过pH-STAT法测量的脂解活性的图。
从图5的数据中很显然,发现B0-TliA,Par-TliA,Buf-TliA融合蛋白的活性分别是TliA本身的78±11.3,68.5±2.1和35.5±19.1倍大。另外,如图7中所示,与M37本身相比,B0-M37,Buf-M37,NKC-M37,NRC-M37和Par-M37的活性分别增加2.8-,4.2-,10.2-,4.1-和2.2-倍。
这些数据表明与两亲性肽缔合的脂肪酶与单独脂肪酶相比具有优异的脂解活性。
实施例3:NKC-融合的M37脂肪酶(NKC-M37)对脂类底物的增加的可接近性的测定
M37脂肪酶的活性位点被盖子螺旋(lid helix)(α3)覆盖。大多数在M37脂肪酶的盖子附近存在的疏水残基(Ile97,Trp100,Leu101和Phe102)被包埋并且分布在活性位点上,提示底物结合可能导致这些残基暴露并且形成宽的疏水表面。因此,需要一些构象改变以便疏水底物接近M37脂肪酶的活性位点。
将两亲性肽NKC与M37脂肪酶缀合,建立了疏水底物接近脂肪酶活性位点的较好状态并增加酶和底物之间的亲和性。为了在此背景下的进一步评价,构建了与野生型M37或与NKC-融合的M37脂肪酶的GFP杂合体,并且测定了这些脂肪酶在脂类颗粒内的定位(图8)。荧光显微镜检查证明,与野生型M37脂肪酶相比,NKC-融合的M37脂肪酶更多地定位于脂类颗粒,表明这些两亲性肽必定形成功能复合体。
实施例4:两亲性肽对M37脂肪酶针对甲醇的稳定性的作用的测定
在生物柴油生产的过程中甲醇的作用是溶剂以及酶底物。然而,因为通常的脂肪酶在具有高甲醇浓度的介质中是不稳定的,因此生物柴油生产的产率相当受限制。为了将1摩尔当量的三酰基甘油完全转变成其相应的甲酯,需要至少3摩尔当量的甲醇。然而,与油相比,通常的脂肪酶在含有超过1摩尔当量(3.3%v/v)甲醇的介质中是失活的。因此,生物柴油生产反应通过多步地添加甲醇以避免脂肪酶失活来进行。
据以前报道,M37脂肪酶即使在高甲醇浓度中也明显地显示高稳定性。当采用1步甲醇进料(3摩尔当量)法时,M37脂肪酶导致70%转化产率,而CalB脂肪酶(南极假丝酵母脂肪酶B)仅能使少量的油转化为生物柴油。
进行下面的实验以评价当与两亲性肽缔合时M37脂肪酶(其甚至在高甲醇浓度中也是稳定的)的转化产率是否增加。
测定NKC-融合的M37脂肪酶针对高甲醇浓度的稳定性。为此,测量甲醇处理后剩余的残留活性以评价酶稳定性。在0%、3.3%、5%和10%甲醇溶液中在4℃和40℃测量CalB脂肪酶、野生型M37脂肪酶和NKC-M37脂肪酶的稳定性12h。
结果,在4℃在3.3%、5%和10%甲醇溶液中野生型M37脂肪酶和NKC-融合的M37脂肪酶保持其活性。当在酯交换反应的实际温度(40℃)下测量时,在10%甲醇溶液中,NKC-M37脂肪酶对甲醇的稳定性稍稍低于野生型M37脂肪酶,而CalB脂肪酶在40℃在10%甲醇溶液中快速失活(图9)。因此,NKC-M37脂肪酶与野生型M37脂肪酶一样在甲醇中十分稳定,表明本发明的缀合物可以有效地生产生物柴油。
实施例5:使用NKC-融合的M37脂肪酶制备生物柴油
如图7中所示,与野生型M37脂肪酶相比,NKC-M37脂肪酶显示10-倍高的催化活性,表明两亲性肽诸如NKC通过增加脂肪酶和脂类底物之间的可接近性而高度有效地提高M37脂肪酶的催化活性。在此背景下,使用具有提高的催化活性的NKC-M37脂肪酶进行生物柴油生产反应过程,和橄榄油的酯交换。
对于生物柴油生产,将化学计量摩尔比的油/甲醇置于反应烧瓶中并加热至反应温度,并同时搅拌。总体上,与油相比,当脂肪酶经受包含多于1摩尔当量甲醇的混合物时失活。因此,通过以多步方式添加甲醇来进行生物柴油生产反应。然而,如实施例4中所证明,甚至在3摩尔当量甲醇的存在下野生型M37脂肪酶和NKC-M37脂肪酶均是稳定的。
首先,采用3步甲醇进料(1摩尔当量)法。使用气相色谱和薄层色谱两者分析生产的生物柴油的量(图10a)。
薄层色谱分析显示,发现大多数的橄榄油转化为生物柴油。图10显示对于野生型M37脂肪酶和NKC-M37脂肪酶达到95%转化所花费的时间。气相色谱分析证明,使用野生型M37脂肪酶的生物柴油工艺在36小时反应后导致95%的转化产率。然而,NKC-M37脂肪酶仅需15小时来达到95%的转化产率(图10a)。此数据提示根据本发明的两亲性肽-融合的脂肪酶可用于经济和有效的生产生物柴油。
如前所提到,由于对甲醇的低耐受性,酶法生物柴油生产工艺目前利用3步甲醇进料法。因此,为了生产经济和可行的生物柴油,做出尝试以开发可以利用2步甲醇加料法的酶法生物柴油生产工艺。当使用2步甲醇进料(2摩尔当量)法时,根据本发明的具有高度提高的催化活性的NKC-M37脂肪酶在21小时的反应内达到至少90%的转化率,而野生型M37脂肪酶则需要长达48小时达到相同的转化率(图10b),这证明根据本发明的两亲性肽-融合的脂肪酶与野生型脂肪酶相比是非常有效的催化剂。单独地,在1步甲醇进料法下,发现NKC-M37脂肪酶达到最大转化率比野生型M37快得多(图10c)。
另外,生物柴油成本的变化极大地取决于原料的成本。已有报道,原料的成本占生物柴油生产成本的70%以上。较高的生产成本可能引起较少的商业用途。为了使生物柴油成本比石化柴油更有竞争性,低成本原料诸如废食用油、牛油、猪油和黄牛油正在研究中。然而,废油中的杂质、游离脂肪酸和高含水量极大地降低了生物柴油的生产产率。以前的报道公开了,M37脂肪酶不受废油中的游离脂肪酸和水组分影响。当使用NKC-M37脂肪酶来利用废油时,以与橄榄油和棕榈油相似的程度生产生物柴油。总之,结果表明本发明的NKC-M37脂肪酶可以用来以极高的效率生产生物柴油。
尽管已经参照前面优选的和可选的实施方式具体地显示和描述了本发明,但本领域技术人员应当理解在不背离如由下面权利要求所限定的本发明的精神和范围的前提下,在实施本发明时可以采用对本文所述的本发明的实施方式的各种替代方式。意图下面的权利要求限定本发明的范围,并且由此而涵盖在这些权利要求范围内的方法和设备以及它们的等同物。本发明的这种描述应当被理解为包括本文所述的要素的所有新的和非显而易见的组合,并且在本申请或以后的申请中可以对这些要素的任意新的和非显而易见的组合提出多个权利要求。
- 还没有人留言评论。精彩留言会获得点赞!