一种表达载体及表达猪氨肽酶N的Vero细胞系的制作方法
本发明涉及生物工程技术领域,尤其涉及一种表达载体及表达猪氨肽酶N的Vero细胞系。
背景技术:
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种严重的病毒性传染病,它会导致哺乳期仔猪发生严重的腹泻、呕吐、脱水等症状,并且致死率极高。该疾病在欧洲和亚洲传播非常广泛,每年都会对一些国家和地区造成严重的经济损失,给养猪业带来了巨大的危害,所以对于猪流行性腹泻的防治是当务之急。
对于大多数的病毒性腹泻疾病来说,防治措施一般都会选择接种疫苗免疫。虽然现在市场上已经有多种针对猪流行性腹泻病毒的疫苗产品,但其免疫效果并不理想,该病毒仍然可以在已免疫猪群中被发现,猪流行性腹泻病毒所造成的损害仍然在持续加重。近年来,有关猪流行性腹泻病毒疫苗的研究和生产虽然已经取得了一定的进展,但目前仍面临着在种毒制备的过程中培养条件复杂、病毒生长速度较慢、获得的病毒滴度较低等问题,这些都严重阻碍了猪流行性腹泻疫苗的生产和研制。因此构建一种能够促进PEDV复制、可用于高效生产PEDV疫苗的工程细胞系十分必要。
由于冠状病毒都是利用自身的S蛋白和相应宿主细胞表面受体结合随后进入宿主细胞的,冠状病毒对受体的依赖性以及受体本身的特异性也决定了冠状病毒对感染宿主的范围的局限性,以及感染宿主器官部位的靶向性。猪氨肽酶N(porcine Aminopeptidase N,pAPN)是PEDV侵染宿主细胞时的天然受体。有研究表明,PEDV入侵宿主细胞与该细胞膜上pAPN的含量多少有关,而与pAPN作为酶的活性无关。在不能被PEDV侵染的真核细胞系如ST细胞系、293T细胞系中过表达pAPN能够使该细胞变成PEDV的易感细胞。
Vero细胞系是世界卫生组织(WHO)允许用于疫苗生产的细胞株,它对多种病毒敏感,其中也包括猪流行性腹泻病毒。Vero生长需要培养条件简单, 生长速度快,被广泛的用于多种病毒疫苗的生产,包括流感疫苗,狂犬疫苗,登革热疫苗等。
当前用于工业生产PEDV疫苗的细胞系就是Vero细胞系,但PEDV的天然宿主是猪,而其天然宿主细胞是猪的小肠上皮细胞。Vero细胞系是非洲绿猴的肾细胞系,不是PEDV的天然宿主细胞,不能真实的反映PEDV自然侵染宿主细胞的过程。而且Vero细胞系上没有PEDV的天然受体猪氨肽酶N,其入侵Vero细胞的效率与入侵天然宿主细胞相比的必然受到影响。
另有发明构建了一种能稳定传代的猪肠道上皮细胞系。该细胞系对PEDV高度敏感、PEDV感染的毒价可以达到104.9TCID50/mL以上,在流行毒株培养方面优于Vero细胞。该细胞系可用于PEDV的分离和培养,也能用于PEDV细胞受体和致病机制的研究。PEDV易感的猪肠道上皮细胞系的建立,避免了原代猪肠道上皮细胞制备繁琐、稳定性差、难于培养的一系列缺点,为PEDV的培养提供了一个备选细胞系,为PEDV的深入研究提供了靶细胞,对PEDV疫苗生产具有重要意义。但是该细胞系自身的增殖能力与Vero细胞系相比仍有差别,生长较缓慢;且其培养条件较为复杂,需要添加生长因子等,成本较大;并且上皮细胞系也不是疫苗生产常用的细胞系,实际应用不太现实,且生物安全性还有待评估。
因此,构建表面存在pAPN受体的Vero细胞,必定会促进PEDV的入侵天然宿主的过程的研究。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种表达载体及表达猪氨肽酶N的vero细胞系,本发明提供的vero细胞系能够表达猪氨肽酶N,且表达量较高,且能够有效促进PEDV在vero细胞中的增殖。
本发明提供了一种表达载体,在pcDNA3.1(+)载体中插入puro抗性基因和pAPN序列。
本发明提供的表达载体的图谱如图1所示,其中,所述pAPN序列为pAPN的CDS序列,为了便于后期在蛋白水平上检测pAPN的过表达,通过引物在其N端添加flag-tag标签。本发明中,pAPN序列如SEQ ID NO:1所示。pAPN序列的插入位点为Hind III和BamH I酶切位点之间。
pAPN的CDS序列的获得方法采用分段扩增法,扩增共分为3步。
第一步扩增以小肠组织cDNA为模板,扩增共分为3段;扩增第一段的引物序列如SEQ ID NO:3~4所示;扩增第二段的引物序列如SEQ ID NO:5~6所示;扩增第三段的引物序列如SEQ ID NO:7~8所示。
第二步扩增以第一步扩增产物(选自3个片段中的2个)为模板。
第三步扩增以第二步扩增产物和剩余的1个扩增产物为模板。
flag-tag标签的添加采用PCR法,所述PCR采用pAPN的CDS序列为模板,扩增引物如SEQ ID NO:9~10所示。
puro抗性指嘌呤霉素(Puromycin)抗性,本发明中puro抗性基因的序列如SEQ ID NO:2所示。
在本发明的实施例中,puro抗性基因的插入位点为Sma I和Sal I酶切位点之间;
采用脂质体转染法将本发明提供的表达载体=瞬时转染293T细胞系,培养48h后,分别进行western blot和细胞免疫荧光试验鉴定结果表明,该细胞能在蛋白水平上检测到pAPN的显著过表达。因此,将本发明提供的表达载体转染vero细胞系,能够使vero细胞系表达pAPN。
本发明提供的表达载体在制备表达猪氨肽酶N的Vero细胞系中的应用。
本发明还提供了一种表达猪氨肽酶N的Vero细胞系其保藏编号为CGMCC NO.12675。
本发明提供的表达猪氨肽酶N的vero细胞系的制备方法,为以本发明提供的表达载体转染vero细胞系。
转染前需将表达载体线性化,本发明中,表达载体经pvu I酶切线性化。
本发明中,转染为脂质体转染。
转染后,置于37℃,5%CO2培养48h。
转染后,还包括以puromycin筛选的步骤。
所述puromycin的浓度为2.0μg/mL。
所述筛选具体为,转然后培养48h后分板,分板24h后以含有2.0μg/mLpuromycin的10%DMEM培养液,培养8~10天,每天更换培养液及时清除死亡的细胞。
将筛选获得的细胞裂解后,以PCR法鉴定所获得细胞是否含有pAPN。
所述PCR鉴定的引物序列如SEQ ID NO:11~12。
鉴定为阳性的细胞,扩大培养,以western blot法用anti-Flag一抗鉴定每个克隆中pAPN蛋白水平的表达情况,将能够稳定表达pAPN蛋白的细胞株保藏至中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号为CGMCC NO.12675。
扩大培养采用的培养基为10%DMEM培养液;
扩大培养的培养条件为37℃,5%CO2。
保藏编号为CGMCC NO.12675的表达猪氨肽酶N的vero细胞系在促进PEDV增殖中的应用。
以PEDV病毒对本发明提供的细胞系进行攻毒试验,结果表明,PEDV病毒在本发明提供的细胞系中具有更高的拷贝数,约为未经改造的vero细胞系拷贝数的十倍。说明保藏编号为CGMCC NO.12675的表达猪氨肽酶N的vero细胞系能够有效地促进PEDV在Vero细胞中的增殖。
本发明提供的细胞系易于被PEDV侵染,因此,本发明提供的细胞系能够用于实验室PEDV病毒的培养、致病机理的研究或PEDV疫苗的生产。由于本发明提供的细胞系能够促进PEDV的复制、增殖作用,故而,以其制备PEDV疫苗,能够具有更高的效率。
保藏编号为CGMCC NO.12675的表达猪氨肽酶N的vero细胞系在制备PEDV疫苗中的应用。
本发明检测PEDV的拷贝数采用real-time PCR法。
用于荧光定量检测的为PEDV基因组中保守性较高的M基因;引物如SEQ ID NO:13~14。
本发明提供了一种表达载体,并提供了以该载体制备用于表达猪氨肽酶N的Vero细胞系,同时提供了该细胞系制备的方法。该细胞系保藏于CGMCC,其保藏编号为CGMCC NO.12675。该细胞系具有易于被PEDV病毒的侵染,促进PEDV在宿主细胞内复制的作用,使用该细胞系培养PEDV能够获得病毒拷贝数度和滴度更高的病毒。本细胞系既可用于实验室PEDV病毒的培养、致病机理的研究等,也可用于工业化中PEDV疫苗的高效生产。
生物保藏说明
非洲绿猴肾细胞系vero-Apclone 11:分类命名:非洲绿猴肾细胞系,于2016年06月28日保藏在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏中心地址为:北京市朝阳区北辰西路1号院3号,保藏编号为CGMCC NO.12675。
附图说明
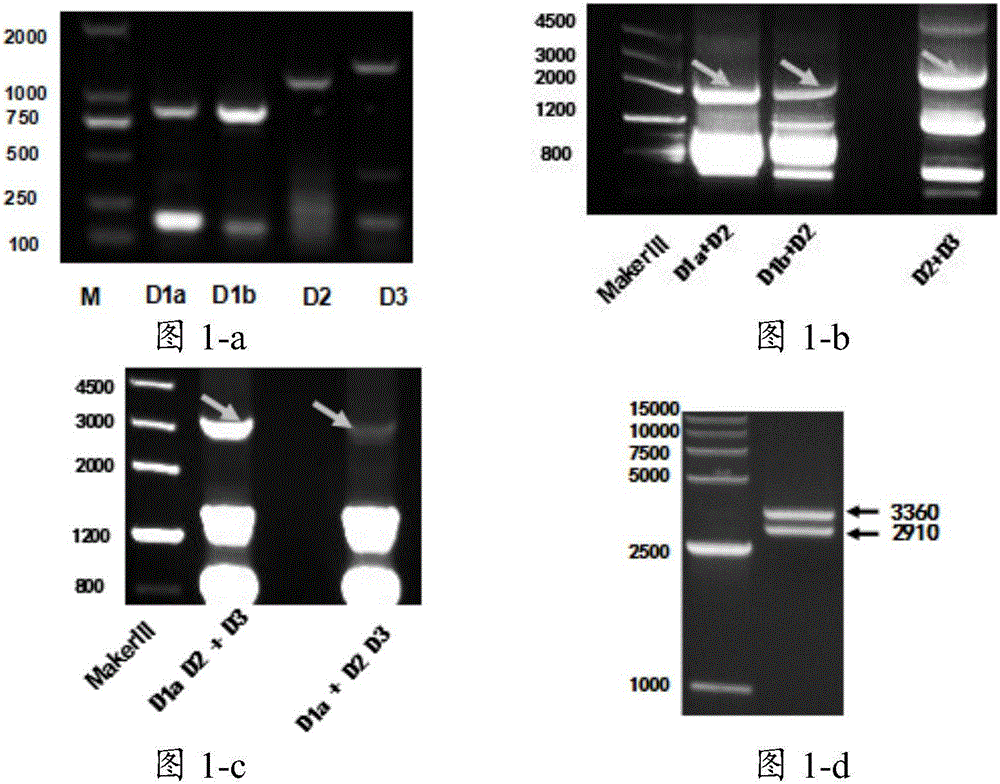
图1示pAPN分段扩增、拼接、连接到pLB载体上的过程;其中,图1-a示pAPN分成三段PCR;图1-b示三段PCR产物两段之间分别连接;图1-c示最后两段拼接后得到的目的片段;图1-d示连接完成后酶切鉴定;
图2示pcDNA3.1(+)-puro-pAPN-flag-N以Hind III和BamH I酶切鉴定
图3示pAPN蛋白的表达效果;其中,图3-a示western blot检测细胞蛋白表达结果;图3-b示免疫荧光检测转化pcDNA3.1(+)-puro的293T细胞蛋白中pAPN表达情况;图3-c示免疫荧光检测转化pcDNA3.1(+)-puro-pAPN-flag-N的293T细胞中pAPN蛋白表达情况;
图4示pcDNA3.1(+)-puro-pAPN-flag-N质粒图谱;
图5示PCR鉴定细胞系基因型;
图6示western blot检测各细胞系蛋白表达;
图7示细胞病变;其中,图7-a示vero细胞的病变;图7-b示11号细胞系的病变;
图8示细胞中PEDV病毒拷贝数;其中,图8-a示细胞内PEDV病毒拷贝数;图8-b示培养上清PEDV病毒拷贝数;**示存在显著性差异,p<0.01。
具体实施方式
本发明提供了一种表达载体及表达猪氨肽酶N的Vero细胞系,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动 或适当变更与组合,来实现和应用本发明技术。
本发明采用的仪器皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1 pAPN真核过表达质粒的构建
pAPN的真核过表达质粒的以pcDNA3.1(+)-puro为载体质粒,为便于后期在蛋白水平上检测pAPN的过表达,通过引物在其N端添加flag-tag标签。构建过程如下:
1材料
猪小肠组织、pcDNA3.1(+)质粒为本实验室留存
2试验过程
1、构建pcDNA3.1(+)-puro质粒
获得puro抗性基因,所述puro抗性基因的序列如SEQ ID NO:2所示,将puro抗性基因片段以酶切位点Sma I和Sal I,连接入pcDNA3.1(+)质粒构建pcDNA3.1(+)-puro质粒。
2、pAPN基因的CDS序列(SEQ ID NO:1)的获取
由于编码pAPN的mRNA全长为3387bp,完整的猪的氨肽酶N的CDS序列长度为2892bp,长度较长,且在小肠组织提取RNA反转的cDNA中含量相对较低,前期预实验直接针对扩增完整的CDS区设计的引物并不能扩增出完整的pAPN的CDS片段。所以本试验将采用分段法扩增,将接近3000bp的CDS区分为三段扩增,设计分段引物时相邻两个片段之间有50~100bp的重叠区间,然后将相邻两个片段两两相连最终拼接成完整pAPN的CDS片段。分段法扩增pAPN的CDS序列引物如下:
第一段:
pANP-D1-F:5’-CGAGCTCCCTTCTCACCCTCAC-3’(SEQ ID NO:3)
pANP-D1-R:5’-CATTTTGGGCCGTTTCATTCAC-3’(SEQ ID NO:4)
第二段:
pANP-D2-F:5’-TACATCGTGAGCGAGTTCCAGAGC-3’(SEQ ID NO:5)
pANP-D2-R:5’-GAAGAGGGTGTTGTCCAGAGCCAG-3’(SEQ ID NO:6)
第三段:
pANP-D3-F:5’-TACGACGAGGACAACTGGAGGATG-3’(SEQ ID NO:7)
pANP-D3-R:5’-TCTGATGCCCTGTTGATTCTCAGG-3’(SEQ ID NO:8)
将三段片段两两相连(第一次PCR的模板是小肠组织cDNA,扩增结果是获得三段pAPN片段,第二次PCR的模板是两条具有50-100bp重叠区的pAPN片段(第一次PCR的产物),第三次pcr的模板为第二次pcr产物(较长片段)和第一次pcr产物的一个片段),拼接完整后连接到pLB载体上构建pLB-pAPN质粒,测序后冻存备用。pAPN分段扩增、拼接、连接到pLB载体上的过程如图1所示。
3、添加酶切位点和flag-tag标签
为了便于将pAPN的CDS序列连接到pcDNA3.1(+)-puro上,通过引物在该序列的两段分别添加双酶切位点。所设计的引物在pAPN的CDS序列的5,端添加Hind III酶切位点和flag-tag标签序列、3,端添加BamH I酶切位点。引物的序列如下:
pAPN-CDS-F:(SEQ ID NO:9)
5’-CGAAGCTTATGGATTACAAGGATGACGACGATAAGGCCAAGGGATTCTACATTTCC-3’ (Hind III)
pAPN-CDS-R:(SEQ ID NO:10)
5’-CGGGATCCTCCATCATCCATCAAGGGCTTCTGCTCATC-3’ (BamH I)
(其中斜体加粗序列为酶切位点,加框的碱基为起始密码子,有下划线的碱基序列编码的是flag-tag氨基酸序列。)
以pLB-pAPN质粒为模板,扩增pAPN的CDS序列。
1)、pcDNA3.1(+)-puro-pAPN-flag-N的构建
通过Hind III和BamH I双酶切反应酶切2)中扩增获得的pAPN的CDS序列和pcDNA3.1(+)-puro,使用T4DNA连接酶将具有粘性末端的pAPN的CDS序列和pcDNA3.1(+)-puro连接过夜。获得的质粒结果酶切鉴定和测序正确后,转化DH5α,大提质粒后备用。所获得的pcDNA3.1(+)-puro-pAPN-flag-N经过酶切鉴定如图2。
2)、瞬转293T细胞验证pAPN真核表达质粒的效果
把pcDNA3.1(+)-puro-pAPN-flag-N质粒经过乙醇沉淀后,使用 3000试剂瞬时转染293T细胞系,培养48h后,分别进行western blot和细胞免疫荧光试验鉴定pAPN蛋白的表达效果,结果如图3所示。
3结果
本试验通过分段法扩增获得了pAPN的CDS序列,并构建出了pAPN的真核表达质粒pcDNA3.1(+)-puro-pAPN-flag-N(质粒图谱如图4),该质粒通过酶切鉴定和测序鉴定均正确。脂质体瞬时转染293T细胞,能在蛋白水平上检测到pAPN的显著过表达。说明成功构建了pAPN的真核过表达质粒,可用于下一步构建稳定表达pAPN的Vero细胞系。
实施例2稳定表达pAPN的Vero细胞系的筛选
1材料
实施例1构建的pcDNA3.1(+)-puro-pAPN-flag-N质粒,Vero细胞系购于中国科学院典型培养物保藏委员会细胞库;
2试验过程
1)、质粒线性化
使用pvu I对pcDNA3.1(+)-puro-pAPN-flag-N进行酶切,将质粒线性化的同时不影响pAPN的表达。将获得的线性化质粒进行乙醇沉淀后用高压灭菌的ddH2O溶解后,测浓度备用。质粒线性化的结果如图2所示。
2)、脂质体转染
将上一步获得的线性化的表达质粒,使用3000试剂转染Vero细胞系,步骤参考InvitrogenTM公司的3000试剂盒。转染后,置于37℃,5%CO2培养48h,分板筛克隆。
3)、puromycin筛选
根据之前的预实验得出,筛选Vero细胞中阳性克隆时,puromycin的最佳浓度为2.0μg/mL,在分板后24h后,加入含有2.0μg/mLpuromycin的10%DMEM培养液,每天更换培养液及时清除死亡的细胞,8~10天时,10cm皿上单克隆的细胞团的大小刚好最合适。使用克隆环小心挑取单细胞簇,将获得的每个克隆置于24孔板中继续培养,并编号。
4)、细胞基因型的鉴定
当24孔板中挑取的克隆细胞长满时,用0.5%胰酶将细胞消化下来,取一半的细胞继续置于24孔板中培养,另一半细胞置于离心管中,3000r/min,离 心10min,弃去上清,将得到的细胞用NP40工作液裂解,并与PCR仪中,56℃、1h,95℃、10min处理,获得该克隆的基因组。以每个克隆的基因组为模板,以针对pAPN基因设计的引物为鉴定引物,鉴定获得的克隆基因组是否有外源pAPN的插入。鉴定引物的序列如下:
Vero-apclone-JD-F:5’-CCCACTGCTTACTGGCTTATCG-3’(SEQ ID NO:11)
Vero-apclone-JD-R:5’-CGGCATTCTTGTTCTTCTCCTG-3’(SEQ ID NO:12)
基因型的鉴定结果如图5所示。
5)、基因型阳性的细胞pAPN蛋白水平的表达
将上一步中鉴定得到的基因型为阳性的克隆扩大培养,将它们分别铺到6孔板上,待细胞长满时,收蛋白,并做western blot,用anti-Flag一抗鉴定每个克隆中pAPN蛋白水平的表达情况。
扩大培养采用的培养基为10%DMEM培养液;
扩大培养的培养条件为 37℃,5%CO2。
3结果
通过puromycin筛选出45个克隆,记为apclone 1~45。采用鉴定引物(SEQ ID NO:11和SEQ ID NO:12),鉴定他们的基因型,有部分克隆的基因组中插入了外源pAPN的基因片段,分别是9、11、14、17、21、22、25、28、32、35、36、43,鉴定结果如图5所示。将这些基因型为阳性的克隆扩大培养到六孔板中,待细胞长满后收取各组蛋白,进行western blot试验,可以看出,克隆9和11在150kDa的目的条带区有一条明显的条带,其余克隆在该位置条带不明显,鉴定结果如图6所示。将获得蛋白量更大的11号细胞系保藏于CGMCC,保藏编号为CGMCC NO.12675。
实施例3:PEDV攻毒试验验证过表达pAPN的Vero细胞系对PEDV的增殖效果
1材料
Vero细胞系购于中国科学院典型培养物保藏委员会细胞库;Vero-11为实施例2筛选得到的能够稳定过表达pAPN的Vero细胞系;PEDV疫苗毒为吉林正业生化科技公司赠送;
2试验过程
将Vero空白对照细胞和鉴定得到的pAPN过表达阳性克隆细胞系Vero-11,分别按照1.5×106个/孔的密度铺在6cm板中,8h后细胞汇合率大约是70%~80%左右,将PEDV病毒按照MOI为0.1的接种量接种到对应的细胞中,48h后分别收接毒细胞和上清中的RNA,并反转为cDNA。细胞中的RNA直接使用TRNzol A+试剂提取。上清中的RNA提取,将混匀后的上清吸取200μL,在其中加入等量的未接毒处理的Vero细胞,细胞的个数控制在2×106个左右最宜,然后加入TRNzol A+试剂,其余步骤和细胞提RNA步骤相同。采用本研究建立的实时荧光定量的方法检测样品中病毒拷贝数,并把实验组Vero-11和对照组Vero细胞的细胞内和上清中病毒的拷贝数进行对比。为保证实验数据的可信度,实验组和对照组均设有三个重复。
用于荧光定量检测的为PEDV基因组中保守性较高的M基因;引物为:
PEDV-DL-F:5’-TCTCACTACTTCTGTGATGGGC-3’(SEQ ID NO:13)
PEDV-DL-R:5’-GATGAAGCATTGACTGAACGAC-3’(SEQ ID NO:14)
3结果
本实验以未经改造的Vero细胞为对照组,以筛选出的pAPN表达相对较高的11号细胞系为试验组,分别进行PEDV接毒培养试验,在48h后分别收取细胞和上清培养液里的总RNA,测定其中病毒拷贝数的含量。在收毒之前,观察两种细胞系形成的细胞病变CPE,如图7所示,可以明显看出,11形成的CPE较Vero-con相比较多,细胞多核体和空泡比较多。对细胞内以及上清中病毒的拷贝数进行测定,结果如图8所示,可以看出,11在细胞中PEDV的病毒拷贝数约是Vero-con的两倍,在上清中病毒的拷贝数约是对照组的十倍。结果说明本发明构建的过表达pAPN的Vero细胞系能够有效地促进PEDV在Vero细胞中的增殖。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!