靶向VEGF与mucin1的抗肿瘤疫苗、编码基因、表达载体、表达工程菌及应用的制作方法
本发明涉及一种靶向VEGF与mucin1的抗肿瘤疫苗,同时还涉及编码该抗肿瘤疫苗的基因、抗肿瘤疫苗表达载体、表达工程菌及应用,属于生物技术领域。
背景技术:
目前,恶性肿瘤已成为国民健康的最大威胁。而肿瘤常规治疗方法如手术、放化疗等均有其各自的局限,这也使得免疫治疗成为继常规疗法之后的一种补充疗法。在免疫疗法中,各种针对肿瘤相关抗原或免疫检验点的单抗在肿瘤治疗中起着至关重要的作用。但其代价高昂,需要长期给药,且存在肿瘤细胞易产生抗性等问题。理论上,肿瘤疫苗具有高度特异性,其利用患者自身的免疫系统产生抗肿瘤反应,可产生长期的免疫记忆以阻止肿瘤复发。另外,肿瘤疫苗相对容易制备,与常规疗法相比具有副作用小、特异性高、作用持续时间长等优点。在临床实验中已证实能够有效预防肿瘤复发。
肿瘤的发生与发展过程极为复杂,仅依靠对单一靶点的作用抑制肿瘤生长与转移是极为不现实的。所以肿瘤疫苗靶向的多靶标已成为目前疫苗研究的一个共识。Kaumaya等研究认为同时靶向VEGF和HER2的肿瘤疫苗能够为癌症的免疫治疗提供一种新范式(Future Oncol,2012)。
Mucin1(MUC1)是一种黏蛋白,在正常组织中均有表达,但在前列腺癌、胃癌、子宫颈癌、乳腺癌等的上皮恶性肿瘤中过表达,且其N端胞外域变低或者异常糖基化,且随着碳水化合物侧链的缩短,核心肽上覆盖的表位暴露出来。由于不完全糖基化,核心肽骨架上数目可变的串联重复区域也暴露出来,成为一个潜在的细胞与体液免疫反应的靶标。其中,位于mucin1蛋白串联重复区的一个肽段由B细胞(弱)及T细胞联合表位(STAPPAHGVTSAPDTRPAPGSTAPP)组成,在临床实验中已显示在某种程度上可对抗早期发现的小肿瘤或者防治已接受手术等常规疗法的过表达mucin1患者的肿瘤复发与扩散(Pol J,2015)。但是,由肽段组成的表位疫苗往往存在分子量小、免疫原性弱等问题,易于降解,因此需要与载体蛋白连接以增强其免疫原性,延长半衰期。
在过去十年中,针对VEGF-A的抗血管治疗已经普遍用于各种肿瘤治疗中(Crit Rev Oncol Hematol,2014)。研究认为,阻断VEGF不仅能够抑制血管生成,还有助于打破肿瘤诱导的免疫抑制(Voron T,2014)。所以,同时靶向VEGF和肿瘤相关抗原mucin1,从理论上讲既可以通过抑制血管生成干扰肿瘤细胞的营养供应,又可以诱导出靶向过表达mucin1的T细胞,直接靶向肿瘤细胞对其进行杀伤,达到协同抗肿瘤的效果。
目前,国内外多数研究集中在将肿瘤相关抗原作为靶标,尤其是多表位抗原,用牛血清蛋白或者铜蓝蛋白作为载体增强免疫反应。然而却未有将VEGF蛋白作为肿瘤表位载体的研究。
技术实现要素:
本发明的目的是提供一种靶向VEGF与mucin1的抗肿瘤疫苗融合蛋白,其中VEGF既作为表位载体增强与之连接的mucin1表位的抗原性,杀伤过表达mucin1的肿瘤细胞,其自身又作为抗原,产生针对VEGF的抗体,抑制肿瘤血管生成,切断肿瘤营养供应,具有双靶向作用。
同时,本发明还提供一种编码上述融合蛋白的基因。
再者,本发明提供一种靶向VEGF与mucin1的抗肿瘤疫苗表达载体和表达工程菌。
最后,本发明再提供一种抗肿瘤组合物及相关应用。
为了实现以上目的,本发明所采用的技术方案是:
靶向VEGF与mucin1的抗肿瘤疫苗融合蛋白,具体为:在VEGF165、VEGF165b或其相应改构的VEGF突变体的N端或C端融合有至少一段肿瘤相关抗原mucin1的表位肽段。其中,VEGF165、VEGF165b或其相应改构的VEGF突变体作为肿瘤相关抗原mucin1的表位肽段的载体。
所述VEGF突变体的氨基酸序列至少有与天然的VEGF165或VEGF165b序列60%的相似性,其突变区域不包含外显子6a。
所述肿瘤相关抗原mucin1的表位肽段的氨基酸序列如SEQ ID NO.3所示。优选的,肿瘤相关抗原mucin1的表位肽段融合在载体的C端,并以连接肽GGSAAY与载体连接。当肿瘤相关抗原mucin1的表位肽段的数目多于一段时,表位肽段之间以AAY连接。
更具体的,抗肿瘤疫苗融合蛋白以突变的VEGF165b(也即mVEGF165b)作为载体,在mVEGF165b的C端融合有一段肿瘤相关抗原mucin1的表位肽段,其氨基酸序列如SEQ ID NO.1所示,简写为mVEGF165b-muc1。编码该融合蛋白的核苷酸序列如SEQ ID NO.2所示。
靶向VEGF与mucin1的抗肿瘤疫苗表达载体,其上连接有如SEQ ID NO.2所示的核苷酸序列。
靶向VEGF与mucin1的抗肿瘤疫苗表达工程菌,包含上述抗肿瘤疫苗表达载体。
表达载体、表达工程菌的构建均可采用常规技术。
抗肿瘤组合物,包含上述融合蛋白或表达载体,以及药用赋形剂和/或载体。
一种细胞,包含上述抗肿瘤疫苗表达载体。
上述抗肿瘤疫苗融合蛋白、表达载体、表达工程菌、细胞或抗肿瘤组合物在制备肿瘤免疫预防和/或治疗的药物中的应用。
本发明的有益效果:
本发明中靶向VEGF与mucin1的抗肿瘤疫苗融合蛋白以VEGF165、VEGF165b或其相应改构的VEGF突变体为表位载体,通过在载体的N端或C端连接一段或数段肿瘤相关抗原mucin1的表位肽段,构成具有双靶向作用的抗肿瘤疫苗,该疫苗中VEGF既能作为表位载体增强与之连接的mucin1表位的抗原性,杀伤过表达mucin1的肿瘤细胞,其自身又能作为抗原,产生针对VEGF的抗体,也即诱导出机体对血管生成的抑制,从而抑制肿瘤血管生成,切断肿瘤的营养供给。同时,VEGF165、VEGF165b及其突变体具有肝素结合域,可以与肝素琼脂糖凝胶结合,有利于后续的蛋白纯化操作,融合蛋白的亲和层析更加方便、快捷。
本发明以突变的VEGF165b为表位载体,在C端串联上一段肿瘤相关抗原mucin1的表位肽段,载体与肽段之间以GGSAAY连接,构成mVEGF165b-muc1抗肿瘤疫苗。相较单独的VEGF165b或mucin1表位免疫,mVEGF165b-muc1能够刺激机体同时产生靶向mVEGF165b和过表达mucin1的免疫反应,二者具有协同抑制肿瘤生长的作用。ELISA与Western blot试验证实,该疫苗免疫动物后免疫血清不仅能产生针对mVEGF165b的抗体,还能抑制脐带静脉内皮细胞的增殖,同时动物试验证实mVEGF165b-muc1能够抑制过表达mucin1肿瘤在体内生长。试验证明,VEGF165b-muc1抗肿瘤疫苗具有双靶向性,既能通过抑制血管生成阻碍肿瘤生长,又能直接杀伤肿瘤细胞,可用于制备肿瘤的免疫预防和/或治疗的药物。
附图说明
图1为mVEGF165b-muc1融合蛋白纯化结果;
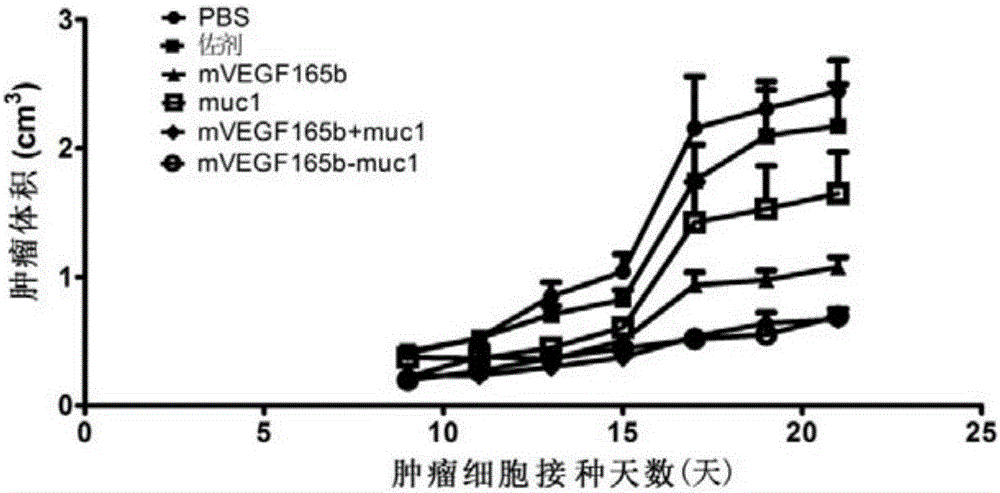
图2为预防背景下VEGF165b-muc1对过表达mucin1的乳腺癌体内抑制效果;
图3为治疗背景下VEGF165b-muc1对过表达mucin1的乳腺癌体内抑制效果;
图4为疫苗免疫诱导的针对VEGF165免疫血清的滴度检测结果;
图5为免疫血清结合VEGF165的western blot检测结果;
图6为疫苗免疫诱导的针对小肽muc免疫血清的滴度检测结果;
图7为补体介导的抗血清对HUVEC杀伤的检测结果。
具体实施方式
下述实施例仅对本发明作进一步详细说明,但不构成对本发明的任何限制。
实施例1
靶向VEGF与mucin1的抗肿瘤疫苗融合蛋白mVEGF165b-muc1,以突变的VEGF165b作为肿瘤相关抗原mucin1的表位肽段的载体,在其C端融合有一段mucin1的表位肽段,mVEGF165b与mucin1之间以GGSAAY连接,其氨基酸序列如下:
其中,正体部分为mVEGF165b的氨基酸序列,下划线部分为连接肽GGSAAY的氨基酸序列,斜体部分为肿瘤相关抗原mucin1的表位肽段的氨基酸序列。
编码上述氨基酸序列的核苷酸序列如下:
其中,正体部分为mVEGF165b的核苷酸序列,下划线部分为连接肽GGSAAY的核苷酸序列,斜体部分为肿瘤相关抗原mucin1的表位肽段的核苷酸序列。
实施例2
靶向VEGF与mucin1的抗肿瘤疫苗表达载体,其构建步骤为:
1)使用限制性内切酶Not I、EcoR I分别双酶切pPIC9K载体和mVEGF165b-muc1基因序列(如SEQ ID NO.4所示,其两端包含Not I、EcoR I酶切识别序列和相应的保护碱基,由苏州金唯智生物技术有限公司合成),酶切反应体系及反应条件如下:
pPIC9K载体的酶切反应体系(100μl):pPIC9K载体(75ng/μl)26.7μl,内切酶Not I(10U/μl)2μl,内切酶EcoR I(10U/μl)2μl,10×H Buffer(酶切缓冲液)10μl,0.1%BSA(牛血清白蛋白)10μl,灭菌蒸馏水49.3μl;酶切反应条件:在37℃下反应3小时;
mVEGF165b-muc1基因序列的酶切反应体系(100μl):mVEGF165b-muc1基因片段(149ng/μl)13.4μl,内切酶Not I(10U/μl)2μl,内切酶EcoR I(10U/μl)2μl,10×H Buffer(酶切缓冲液)10μl,0.1%BSA(牛血清白蛋白)10μl,灭菌蒸馏水62.6μl;酶切反应条件:在37℃下反应3小时。
两端包含Not I、EcoR I酶切识别序列及相应保护碱基的mVEGF165b-muc1基因序列:
其中,下划线部分为Not I、EcoR I酶切识别序列。
2)取酶切后线性化的pPIC9K载体和酶切后的mVEGF165b-muc1基因片段,采用T4DNA连接酶体系,在16℃下孵育过夜,连接反应体系如下:
pPIC9K载体与mVEGF165b-muc1基因片段的连接反应体系(10μl):线性pPIC9K载体(0.15μg/μl)3μl,mVEGF165b-muc1基因片段(0.015μg/μl)1.6μl,T4DNA连接酶(350U/μl)1.0μl,10×T4DNA连接酶缓冲液1.0μl,灭菌蒸馏水3.4μl。
3)取连接产物转化感受态细胞,筛选阳性菌落,提取阳性菌落的质粒,得到pPIC9K-mVEGF165b-muc1表达载体,具体操作为:
转化感受态细胞:在100μl细胞浓度为1.5×109个/ml的大肠杆菌TOP10感受态细胞中,加入10μl上述连接体系,充分混匀,置于冰浴中冷却30分钟后,立即置于42℃水浴中热休克90秒,再置于冰浴中冷却2分钟;然后加入800μl的LB液体培养基(先置于37℃水浴中预热),在37℃、100rpm条件下振荡培养45分钟;然后以4000rmp的转速离心1分钟后,弃去750μl的上清液,余下菌液充分混悬;
重组载体的鉴定:将上述菌液均匀涂布于含50μg/ml氨苄青霉素的LB平板培养基上,于37℃倒置培养14小时(12~16小时均可),挑取阳性菌落接种在5ml含有50μg/ml氨苄青霉素的LB液体培养基中,于37℃培养过夜;然后对菌液部分进行保存,同时取菌液进行PCR反应鉴定,反应产物经凝胶电泳检测和基因测序(由苏州金唯智生物科技有限公司提供)鉴定,结果显示与目标产物一致;
重组载体的提取:吸取保存的经测序验证正确的克隆菌液10μl,接种于5ml含50μg/ml氨苄的LB培养液中培养过夜,然后转接于50ml氨苄LB培养液中,于37℃培养12小时,7000rpm离心10分钟,收集菌体;采用OMEGA-midi质粒提取试剂盒(美国Omega Bio-Tek公司,产品货号为D6904-01)进行质粒提取,得到pPIC9K-mVEGF165b-muc1表达载体,载体用Nanodrop超微量分光光度计(购自美国热电(上海)科技仪器有限公司,型号NanoDrop 2000)测浓度,为264ng/μl。
实施例3
靶向VEGF与mucin1的抗肿瘤疫苗表达工程菌,其构建流程为:使用限制性内切酶Sal I酶切上述pPIC9K-mVEGF165b-muc1表达载体,得到线性化的pPIC9K-mVEGF165b-muc1表达载体,然后转化毕赤酵母GS115感受态细胞,筛选阳性菌落,并培养高拷贝阳性克隆菌落,具体操作为:
1)pPIC9K-mVEGF165b-muc1表达载体的线性化
采用限制性内切酶Sal I对pPIC9K-mVEGF165b-muc1表达载体进行酶切,酶切产物加入20μl 3mol/L的NaAc溶液(pH=5.2)和400μl的无水乙醇进行沉淀,在4℃下以12000rpm的转速离心10分钟,沉淀物用70%(v/v)的酒精洗涤,再以12000rpm的转速离心10分钟,沉淀物晾干后溶于20μl的无菌去离子水中,取1μl作琼脂糖凝胶电泳鉴定,以判断pPIC9K-mVEGF165b-muc1表达载体是否完全线性化,其余置于-20℃保存备用;
酶切反应体系如下(200μl):pPIC9K-mVEGF165b-muc1表达载体(264ng/μl)75.7μl,Sal I内切酶(10U/μl)4μl,酶切缓冲液(10×H buffer)20μl,无菌去离子水100.3μl;酶切反应条件:37℃下酶切反应3小时,65℃下灭活20分钟;
2)毕赤酵母GS115感受态细胞的制备
取单个毕赤酵母GS115菌落,接种于3ml YPD培养液中,于30℃振荡培养过夜,次日转接于100ml YPD培养液中,培养至OD值为1.3;菌液分装于两个50ml的离心管中,分别以4500rmp的转速离心5分钟,弃上清,分别加入100ml无菌预冷去离子水,吹打重悬;离心弃上清,加入50ml无菌去离子水,吹打重悬,再离心弃上清,加入20ml 1M山梨醇溶液,吹打重悬,然后再次离心弃上清,将毕赤酵母细胞重悬于500μl 1M山梨醇溶液中,置于冰上待用;
3)线性化pPIC9K-mVEGF165b-muc1表达载体转化毕赤酵母GS115感受态细胞
将BIO-RAD电转仪的参数设置为:电压1500v,电阻200Ω,电容25uF;并将电转杯烘干,置于冰上预冷;将15μl线性化的pPIC9K-mVEGF165b-muc1表达载体加入100μl毕赤酵母GS115感受态细胞(His氨基酸缺陷型酵母菌)溶液中混匀,置于冰上预冷5分钟,然后加到电转杯中,启动电转仪,脉冲为4.35ms,并迅速加入1ml预冷的1M山梨醇溶液混匀,吸取200μl细胞溶液涂布于MD平板培养基(His营养缺陷型培养基)上,于30℃培养2天,长出His阳性克隆菌落,His阳性克隆菌落的总数在4000以上;
4)高拷贝G418抗性克隆菌落的筛选
用YPD培养液将MD平板培养基上长出的全部阳性菌落冲洗下来,测定酵母菌悬液的OD值;按照1OD约等于5×107cell/ml的量,将其稀释至每200μl中含有的细胞数量为2×106个;然后涂布于浓度为4mg/ml的G418-YPD平板培养基上,于30℃培养2天,挑选长出的高拷贝阳性克隆菌落。
研究发现,多个重组基因拷贝整合到毕赤酵母中已被证实可以增加目的基因的表达产量。pPIC9K载体可以在酵母中整合多个拷贝,载体上含有卡那霉素基因,卡那霉素基因赋予酵母对遗传霉素(Geneticin,G418)的抗性。并且,G418的抗性水平依赖于卡那霉素基因整合在酵母中的数目。单个拷贝的pPIC9K整合在酵母基因组上仅对浓度约为0.25mg/ml的G418有抗性。多拷贝的pPIC9K整合在酵母基因组上可使酵母对G418的抗性由0.5mg/ml(1~2拷贝)提高到4mg/ml(7~12个拷贝)。因此,采用浓度为4mg/ml的G418-YPD平板培养基即能够筛选出高拷贝的G418抗性克隆菌落。
实施例4
靶向VEGF与mucin1的抗肿瘤疫苗表达工程菌的应用,表现为mVEGF165b-muc1抗肿瘤疫苗融合蛋白的诱导表达和分离纯化,具体操作为:
1)mVEGF165b-muc1的诱导表达
取上述高拷贝酵母菌株单克隆接种于5ml YPD培养液中,于30℃振荡培养过夜,次日吸取100μl培养物接种于25ml BMGY培养液中,于29℃(28~30℃均可)继续振荡培养至OD值为3.6,以4500rmp的转速离心,收集菌体,重悬于200ml BMMY培养液中,加入2ml甲醇,继续于29℃振荡培养,诱导表达mVEGF165b-muc1,连续4天在固定时间补加2ml甲醇,发酵4天后,于8000rpm的转速离心10分钟,取上清液;
2)mVEGF165b-muc1的分离纯化
将离心后得到的上清液加入含有0.1M NaCl、浓度20mmol/L的Tris-HCl溶液(PH=8.0)中,于4℃透析平衡过夜,经0.45μm滤器过滤后,上样于肝素琼脂糖亲和柱(Heparin-Sepharose CL6B亲和柱),用含有0.5M NaCl、浓度20mmol/L的Tris-HCl溶液(PH=8.0)进行洗脱,流速为1ml/min,OD280nm检测出峰情况,收集最后一个出峰的组分,并采用SDS-PAGE电泳分别对变性(打开二硫键,即上样缓冲液中含β-巯基乙醇)与非变性融合蛋白(即上样缓冲液中不含β-巯基乙醇)进行检测,检测结果见图1,图1中M为marker,1为目标产物mVEGF165b-muc1抗肿瘤疫苗融合蛋白(非变性状态,即以二聚体形式存在),2为目标产物mVEGF165b-muc1抗肿瘤疫苗融合蛋白(变性状态)。
试验例
一、动物免疫检测抗肿瘤疫苗在预防背景与治疗背景下对过表达mucin1肿瘤生长影响
预防背景下,mVEGF165b-muc1免疫对小鼠过表达mucin1乳腺癌的生长抑制能力测试:取50μg mVEGF165b-muc1溶于100μl PBS中与100μl佐剂混合,总体积200μl,免疫BAL B/c小鼠,初次采用完全弗氏佐剂与cpG混合物为佐剂,加强免疫采用不完全佐剂与cpG混合物为佐剂,5点皮下注射(四肢腋下及背部1点),每间隔1周免疫1次,共4次;对照组分别为200μl PBS(PBS组),100μl佐剂混合100μl PBS(佐剂组),50μg mVEGF165b溶于100μl PBS与100μl佐剂混合(mVEGF165b组),50μg muc1小肽溶于100μl PBS与100μl佐剂混合(muc1组),混合100μl佐剂43.5μg mVEGF165b与溶于100μl PBS的6.5μg muc1小肽混合(mVEGF165b+muc1组)。距最后一次免疫1周,小鼠前肢下接种过表达人mucin1的小鼠乳腺癌细胞株EMT6(1×106),待肿瘤可见时,用游标卡尺每天测量肿瘤的长宽,肿瘤大小用下式计算:肿瘤体积=0.5×长×宽2。当测到22天后,停止测量,结果如图2所示。结果显示,抗肿瘤疫苗组mVEGF165b-muc1与突变VEGF165b混合mucin1小肽组一样,可以显著抑制过表达mucin1肿瘤在小鼠体内的生长,但mVEGF165b-muc1的抑制作用最强。
治疗背景下,mVEGF165b-muc1免疫对小鼠过表达人mucin1乳腺癌的生长抑制能力测试:在小鼠前肢腋下接种100μl(1×106/ml)过表达人mucin1的小鼠乳腺癌细胞株EMT6,当肿瘤可见时(可以摸到但无法测量,约7天时),取50μg mVEGF165b-muc1溶于100μl PBS中与100μl佐剂混合,总体积200μl,免疫BAL B/c小鼠,初次采用完全弗氏佐剂与cpG混合物为佐剂,加强免疫采用不完全佐剂与cpG混合物为佐剂,5点皮下注射(四肢腋下及背部1点),每间隔1周免疫1次,共3次;对照组分别为200μl PBS(PBS组),100μl佐剂混合100μl PBS(佐剂组),50μg mVEGF165b溶于100μl PBS与100μl佐剂混合(mVEGF165b组),50μg muc1小肽溶于100μl PBS与100μl佐剂混合(muc1组),混合100μl佐剂43.5μg mVEGF165b与溶于100μl PBS的6.5μg muc1小肽混合(mVEGF165b+muc组)。待肿瘤可见时,用游标卡尺每天测量肿瘤的长宽,肿瘤大小用下式计算:肿瘤体积=0.5×长×宽2。当测到26天后,停止测量,结果如图3所示。结果显示,抗肿瘤疫苗组mVEGF165b-muc1可以在治疗背景下显著抑制过表达mucin1肿瘤在小鼠体内的生长。
二、肿瘤免疫效果的检测
1)体液免疫效果检测
检测步骤为:1)在免疫过程中,每周1次眼底静脉丛取血,室温3000rpm离心5min得到血清;取VEGFm165蛋白用碳酸盐缓冲溶液(0.05mol/L pH9.6的碳酸盐缓冲液,4℃保存;其中Na2CO3 0.15g,NaHCO3 0.293g,蒸馏水稀释至100mL)稀释成浓度为10μg/mL的包被液,每孔加入100μL抗原包被液,并以不加标准抗原的三孔为对照,为反应的0%值,同时设置三孔加100μL封闭液(5%脱脂奶粉溶于PBS中)作为对照;将反应板置于4℃下过夜;2)封闭板:将包被好的酶标板孔内的液体倾去,每孔加200μL洗涤液(0.01mol/L pH7.4PBS+0.5%Tween20)后室温下放置1min,倒掉,如此重复4次后,在吸水纸上拍干,加封闭液进行封闭,在37℃放置45min(注意:空白孔也要加封闭液);封闭后,如前述洗涤;3)加梯度稀释的小鼠血清,37℃放置1h,洗涤;4)加入HRP标记的山羊抗小鼠IgG:洗涤后每孔加100μL稀释好的HRP-羊抗兔IgG,37℃放置1h,洗涤;5)加入TMB底物:洗板4次后,每孔加入100μL底物溶液,于37℃暗处振荡反应20min后,每孔加入50μL结束反应液以终止反应;6)吸收测定:用酶联免疫检测仪测定波长为450nm下的吸光值;7)数据处理:抗体滴度,就是将抗体稀释成不同浓度,如果在某一浓度下抗体测定OD与阴性对照OD比值刚好呈阳性(比值大于等于2.1),此时的稀释度就看作抗体滴度。结果如图4所示,mVEGF165b-muc1组4次免疫后的抗体滴度可达到60万倍。
将免疫血清分别稀释100倍、500倍、1000倍,分别用western blot验证,检测血清是否诱导出针对native VEGF165b蛋白的抗体。结果如图5所示,免疫血清诱导出可以与VEGF165结合的抗体。图5中M代表marker,1为mVEGF165b与来源于PBS组免疫血清的结合结果;2为mVEGF165b与稀释1000倍小鼠血清孵育的western Blot结果;3为mVEGF165b与稀释500倍小鼠血清孵育的western Blot结果;4为mVEGF165b与稀释100倍小鼠血清孵育的western Blot结果。
将mucin1小肽偶联到牛血清白蛋白BSA上,然后用上述方法包被到ELISA包被板上,ELISA检测免疫血清中针对mucin1小肽的抗体滴度,如图6所示,4次免疫后的抗体滴度可达到8000倍左右。
2)补体依赖的抗体中和VEGF165刺激HUVEC细胞增殖试验
将亚融合的HUVECs细胞(1×104个,100μL/孔)接种于96孔板中,孔板中盛装有含5%胎牛血清与50ng/ml VEGF165的ECM培养基,培养过夜。然后加1μL(1%)、5μL(5%)与10μL(10%)免疫血清和相应量的正常小鼠血清作为对照,加入10μL豚鼠血清做为补体来源,孵育24h。孵育结束,加入20μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,5mg/mL),细胞于37℃继续培养4h。最后在培养液中加入100μL DMSO裂解细胞,测其在570nm的吸光度。结果如图7所示,5%、10%的来自于mVEGF165b-muc1组的免疫血清可以抑制HUVEC的增殖。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!