鉴定细菌的多重PCR引物对组合及鉴定方法与流程
本发明属于生物技术领域,涉及细菌的鉴定方法。
背景技术:
16S rRNA为核糖体RNA的一个亚基,16S rDNA为编码该亚基的基因。由于16S rDNA序列的保守性和存在的普遍性,以及核酸序列本身的稳定性,序列分析的重现性极高[1]。根据这些保守区可以设计出细菌通用引物,从而能够扩增出所有细菌的16S rDNA片段,并且这些引物仅对细菌是特异性的,也就是说这些引物不会与非细菌的DNA互补。而细菌的16S rDNA可变区的差异可以用来区分不同的菌。因此,16S rDNA被认为是细菌鉴定的金标准。
细菌16S rDNA含有9个可变区[2],命名为V1~V9区。除V2、V3、V4区稍长外,其他各可变区的序列都很短。Schmalenberger等人[3]通过SSCP PCR技术研究16S rRNA V4~V5可变区可以区分13种细菌。Claesson等人[4]指出在使用罗氏454测序仪或者Illumina测序仪时,测定细菌16S rDNA的V3~V4和V4~V5可变区能够得到最为精确的细菌种属的鉴定结果。Chakravorty等[5]对113份完整的病原菌16S rDNA的V1~V8区序列进行详细研究。结果显示,V1区能区分金黄色葡萄球菌与血浆凝固酶阴性葡萄球菌;V2和V3区能将除肠杆菌科以外的细菌鉴别至属的水平,V2区尤其适合于鉴别分枝杆菌属内的菌种,V3区能很好区别嗜血杆菌属内各种细菌;V6区也能区分除肠杆菌科以外的大多数菌种,特别是通过单核苷酸多态性(single nucleotide polymorphism,SNP)分析可将炭疽芽胞杆菌从与其生物学性状非常相似的蜡样芽胞杆菌群细菌中区分开来。上述说明,确定某个可变区内具有细菌种特异性的序列就可能获得细菌实验室诊断的有用靶点。但是Baker等[6]指出目前的研究并不能通过单一可变区来区分所有的细菌。
技术实现要素:
本发明的目的是利用多重PCR的方式,对细菌16S rDNA的可变区进行扩增、测序,从而实现快速区分、鉴定细菌种类的目的。
在第一个方面,本发明提供一种鉴定细菌的多重PCR引物对组合,所述组合包括用于扩增16S rDNA的V1-V8可变区的引物对P1、P3、P5和P6,其中,引物对P1的扩增产物覆盖可变区V1和V2,引物对P3的扩增产物覆盖可变区V3和V4,引物对P5的扩增产物覆盖可变区V5和V6,引物对P6的扩增产物覆盖可变区V7和V8,其中引物对P1与P5组合使用,P3与P6组合使用;每个引物对均包含正向引物和反向引物,每条正向引物和反向引物的序列分别由以下部分组成:从5’端到3’端依次为:与测序通用引物互补的序列、标签序列和与16S rDNA保守区结合的序列;其中,所述测序通用引物和标签序列根据不同的测序公司所提供的测序系统而不同,这些都属于公知技术。
优选地,所述与测序通用引物互补的序列的长度为16~22个核苷酸,所述与16S rDNA保守区结合的序列的长度为14~24个核苷酸。
在一种优选的实施方式中,所述各引物对中正向引物和反向引物的序列分别为:
P1:
正向引物:
ACACGACGCTCTTCCGATCT+标签序列+AGAGTTTGATCCTGGCTNAG;
反向引物:
GACGTGTGCTCTTCCGATCT+标签序列+CTGCTGCCTYNCGTA;
P3:
正向引物:
ACACGACGCTCTTCCGATCT+标签序列+CCTACGGGNGGCWGCAG;
反向引物:
GACGTGTGCTCTTCCGATCT+标签序列+GACTACHVGGGTATCTAATCC;
P5:
正向引物:
ACACGACGCTCTTCCGATCT+标签序列+RGGATTANATACCC;
反向引物:
GACGTGTGCTCTTCCGATCT+标签序列+CGACRRCCATNCANCACCT;
P6:
正向引物:
ACACGACGCTCTTCCGATCT+标签序列+GYAACGAGCNCAACCC;
反向引物:
GACGTGTGCTCTTCCGATCT+标签序列+GACGNGCGGTGWGTRC。
在一种优选的实施方式中,各引物对中正向引物和反向引物的序列分别为:
P1:正向引物:SEQ ID NO:1,反向引物:SEQ ID NO:2;
P3:正向引物:SEQ ID NO:3,反向引物:SEQ ID NO:4;
P5:正向引物:SEQ ID NO:5,反向引物:SEQ ID NO:6;
P6:正向引物:SEQ ID NO:7,反向引物:SEQ ID NO:8。
在第二个方面,本发明提供一种鉴定细菌的试剂盒,所述试剂盒包括本发明的PCR引物对组合。优选地,所述试剂盒还包括PCR缓冲液、DNA聚合酶。
在第三个方面,本发明提供一种鉴定细菌的系统,包括本发明的PCR引物对或试剂盒;优选地,所述系统还包括用于高通量测序的仪器和/或系统。
在第四个方面,本发明提供一种鉴定细菌的方法,包括用本发明的PCR引物对组合扩增细菌DNA。优选地,所述细菌DNA为细菌基因组DNA。
在一种优选的实施方案中,所述方法包括利用引物对P1和P5将细菌16S rDNA的V1~V2可变区联合V5~V6可变区同时扩增,利用引物对P3和P6将V3~V4可变区联合V7~V8可变区同时扩增,然后将两种扩增得到的核酸混合到一起,构建文库,进行下一代测序(Next Generation Sequencing),对测序结果进行分析,从而鉴定细菌种类。
优选地,各PCR引物对中的各正向引物和反向引物在反应体系中的浓度分别为1~5μM。
在本发明中,所述引物对的扩增产物覆盖可变区,其实质上是指引物对的扩增产物覆盖了所述引物对两条引物5’端位置之间的可变区和保守区。例如,引物对P1的扩增产物覆盖可变区V1和V2,其实质上覆盖了P1正向引物5’位置与V1之间的保守区、V1、V1和V2之间的保守区、V2以及V2与P1反向引物5’位置之间的保守区。通过本发明的4个引物对,实质上扩增了细菌16S rDNA除V9以外的所有序列。以此进行比对,提高了比对效率和成功率。
本发明在现有技术的基础上,经过无数次试验,设计了能够有效扩增16S rDNA的8个可变区(含两侧及其中的保守区)的引物,对8个可变区进行了组合,利用引物对组合对可变区组合进行扩增,有效得到可变区序列;结合下一代测序和分析,能够灵敏、高效地鉴定细菌种属。
附图说明
图1:通过PE touch检测引物对P1+P5组合的扩增嗜肺军团菌基因组DNA结果图。
图2:通过PE touch检测引物对P1+P6组合的扩增嗜肺军团菌基因组DNA结果图。
图3:通过PE touch检测引物对P3+P6组合的扩增嗜肺军团菌基因组DNA结果图。
图4:通过PE touch检测引物对P5+P6组合的扩增嗜肺军团菌基因组DNA结果图。
图5:通过PE touch检测引物对P1+P5+P6组合的扩增嗜肺军团菌基因组DNA结果图。
图6:6种模拟菌株测序结果图(P1+P5;P3+P6)。
图7:6种模拟菌株测序优势情况图(P1+P5;P3+P6)。
图8:第1例临床血液样本菌株测序结果图(P1+P5;P3+P6)。
图9:第1例临床血液样本菌株测序优势情况图(P1+P5;P3+P6)。
图10:第2例临床血液样本菌株测序结果图(P1+P5;P3+P6)。
图11:第2例临床血液样本菌株测序优势情况图(P1+P5;P3+P6)。
具体实施方式
以下将通过具体实施例描述本发明,但本发明内容不限于此。如没有特殊说明,以下实施例中所使用的试剂、仪器均为本领域常规试剂、仪器,可以从商购途径获得;本发明中所使用的方法为本领域常规实验方法,本领域技术人员根据常识完全可以实现所述方法。
实施例一:引物对组合的设计
1、引物对的设计
根据16S rDNA的保守区序列设计扩增8个可变区的引物对,其中,V1和V2区使用P1引物对扩增,V3和V4区使用P3引物对扩增,V5和V6区使用P5引物对扩增,V7和V8区使用P6引物对扩增(表1a,1b)。
表1a和1b中,下划线标记引物序列为与16S rDNA保守区结合的序列,未用下划线标记引物序列为与Illumina Miseq V1-V2试剂盒测序通用引物互补的序列。在与测序引物互补的序列和与16S rDNA保守区结合的序列之间,可根据最终文库样本数加入不同的标签序列,如index序列或者barcode序列,通过不同的index(或者barcode)序列将不同样本的测序数据分开。Index序列(或barcode序列)可根据使用的测序平台和测序试剂盒不同,按照测序商提供的index(或barcode)序列信息选择。例如,可以选择Illumina测序平台提供的index表中的序列或ROCHE测序平台提供的barcode表中的序列作为标签序列。这样的index(或barcode)序列是本领域的公知技术,本领域技术人员完全知道如何获得和选择这样的序列并实现本发明的技术效果。也可根据“4种碱基达到平衡”的原则自己设计,最终满足标签序列测序质量要求,能够把下机测序数据按样本分类即可。
表1a:正向引物序列
表1b:反向引物序列
表1a和表1b的引物序列中的N、W、Y、R、H、V为简并碱基,分别表示:
N=A/T/C/G,W=A/T,Y=C/T,R=A/G,H=A/T/C,V=G/A/C。
2、引物对组合的设计
根据PCR实验要求和引物序列特点(引物对P3与引物对P1、P5有序列重叠部分,需要避免扩增时出现引物自连),设计表2所示的引物对组合。
表2:引物对组合
实施例二:引物对组合的筛选
1、提取细菌核酸
1)使用DNA Purification from Blood or Body Fluids(Spin Protocol)(Qiagen Cat.NO.51306)试剂盒提取嗜肺军团菌(购买自北京北纳创联生物技术研究院)基因组DNA。
2)用分光光度计对收集管内的DNA定量。用于通量检测的DNA的要求为:浓度:≥10ng/μl;纯度:OD260/280为1.8-2.0;核酸总量:≥1μg。-20℃可短期保存;-80℃可长期保存。
2、PCR扩增
1)合成P1、P3、P5、P6引物对中各引物并分别稀释成5μM使用液;
本实施例中仅有一个样本,因此标签序列选择一个,为Illumina测序平台提供的index序列“TGAACCTT”;即,P1、P3、P5、P6引物对中各引物的序列为:
P1F:5’-ACACGACGCTCTTCCGATCTTGAACCTTAGAGTTTGATCCTGGCTNAG-3’(SEQ ID NO:1);
P1R:5’-GACGTGTGCTCTTCCGATCTTGAACCTT CTGCTGCCTYNCGTA-3’(SEQ ID NO:2);
P3F:5’-ACACGACGCTCTTCCGATCTTGAACCTTCCTACGGGNGGCWGCAG-3’(SEQ ID NO:3);
P3R:5’-GACGTGTGCTCTTCCGATCTTGAACCTTGACTACHVGGGTATCTAATCC-3’(SEQ IDNO:4);
P5F:5’-ACACGACGCTCTTCCGATCTTGAACCTTRGGATTANATACCC-3’(SEQ ID NO:5);
P5R:5’-GACGTGTGCTCTTCCGATCTTGAACCTTCGACRRCCATNCANCACCT-3’(SEQ ID NO:6);
P6F:5’-ACACGACGCTCTTCCGATCTTGAACCTTGYAACGAGCNCAACCC-3’(SEQ ID NO:7);
P6R:5’-GACGTGTGCTCTTCCGATCT TGAACCTTGACGNGCGGTGWGTRC-3’(SEQ ID NO:8)。
2)定量嗜肺军团菌基因组DNA样本,保证每个引物对组合的PCR模板DNA浓度一致;
3)以嗜肺军团菌基因组DNA为模板,按照表2中的引物对组合1~5在PCR管中添加引物,以下述PCR反应体系和扩增程序进行扩增(2×Q5Master Mix:Q5热启动超保真PCR预混液,货号:#M0494S):
表3:PCR反应体系
扩增程序:94℃预变性5min;94℃1min,55℃1min,72℃1min,25个循环;72℃延伸10min,4℃保存。
3、PCR产物检测
使用PerkinElmer生产的LabChip GX Touch微流控毛细管电泳系统对纯化后的PCR产物进行检测。
1)芯片准备
使用仪器配套试剂盒(HT DNA Sensitivity Reagent Kit,PN CLS760672),严格按照说明书进行芯片清洗。
2)将PCR产物和Ladder加入样品板
使用仪器配套试剂盒(PN CLS960008),严格按照说明书操作步骤,向样品板中加入20μl PCR产物,记录加样顺序。
3)上机检测
a.打开软件(LabChip GX Touch),将芯片放入仪器内,软件自动识别芯片;
b.依次放入试剂盒提供的DNA Ladder管和样品板;
c.在软件中编辑样品名称后开始检测;
d.检测结束后,保存峰图结果。
4、检测结果与分析
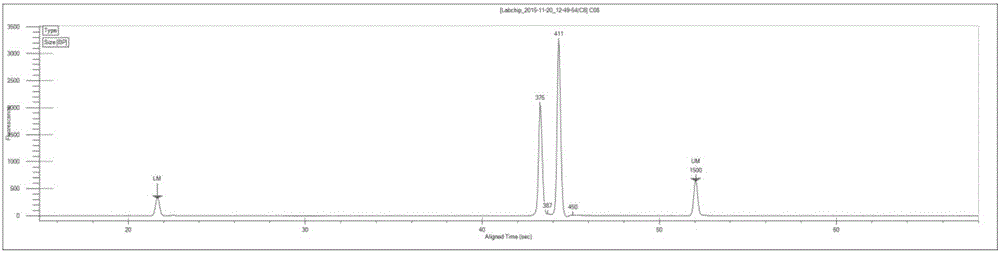
PCR产物经LabChip GX Touch微流控毛细管电泳系统检测,得到的峰图如图1-5所示。
最优引物组合的筛选原则为:每个组合的引物在进行PCR时,尽量保证组合中的每对引物所得的峰图的峰面积(即图中最高的两个峰)是一致的或者相差较小,并且避免出现杂峰。如图4和5所示,引物P5+P6组合以及引物P1+P5+P6组合杂峰较多,首先舍弃这两种组合。最终确定的引物组合方案为,P1(5μM)+P5(5μM);P3(5μM)+P6(5μM)。
实施例三:利用引物对组合鉴定细菌
1、菌种
选取6种菌株(艰难梭菌、屎肠球菌、大肠杆菌、粪肠球菌、鲍氏不动杆菌、金黄色葡萄球菌,购买自北京北纳创联生物技术研究院)作为模拟实验菌株,使用已经确定的最优引物组合和最合适的引物浓度进行两步PCR,通过高通量测序分析鉴定菌种。
2、第一步PCR扩增
选用引物对组合P1(5μM)+P5(5μM);P3(5μM)+P6(5μM),各引物的序列同实施例二的步骤2。实验步骤参照实施例二中的步骤2进行第一步PCR扩增。
3、第一步PCR产物纯化
a.配置80%乙醇溶液;
b.向本实施例步骤2的每管PCR产物中加入50μl Ampμre Beads(Beckman AMPure XP Beads,Lot:15622200)中,吹吸混匀,轻微震荡,室温静置5min;
c.离心,将样本置于磁力架(Life tech,Lot:3615)上,吸附5min至液体清澈;
d.弃去上清;
e.加200μl 80%乙醇溶液于样本中,吹吸冲洗磁珠,将样本在磁力架上静置2min,弃去上清;
f.重复步骤e两次后,吸出残余的乙醇,开盖放置5min;
g.将样本从磁力架上取出,向样本中加入30μl ddH2O,轻微震荡混匀,室温放置2min,短暂离心;
h.将样本重新置于磁力架上,吸附2min,将上清液吸出到新的1.5ml EP管中;
i.用Nanodrop超微量紫外分光光度计(Thermo Fisher,货号:ND-ONE-W)对收集管内的核酸进行定量。
4、第二步PCR扩增
调整每管纯化后的第一步PCR产物浓度为15ng/μl,作为模板。
第二步PCR目的是加入与Illumina Miseq测序仪flow cell上固相结合物互补的序列P5/P7,以及用于区分实验样本的index序列,用于后续的高通量测序。序列如下表4所示,其中下划线标注序列为与第一轮PCR产物结合的illumina通用测序引物序列,正向引物(PCR 2F)中未用下划线标注序列为P5序列,反向引物(PCR 2R)中未用下划线标注序列为P7序列。可根据文库容量需要在P5/P7序列与通用测序引物序列间加标签序列index,其中index的序列为“TGAACCTT”。
表4:第二轮PCR中的引物序列
表5:第二次PCR体系
5、第二步PCR产物纯化
PCR产物纯化的操作步骤详见本实施例步骤3。
6、qPCR文库质检
将步骤5得到的纯化产物混匀在同一管中,称之为文库。
a.向1.5ml EP管中加入198μl 0.05%吐温ddH2O;
b.向步骤a的EP管中加入2μl文库样本进行第一次稀释,漩涡混匀40s;
c.从第一次稀释文库样本中取2μl按照步骤a和步骤b进行第二次稀释;第二次稀释所得稀释液待用;
d.制备标准品(Illumina DNA Standards and Primer Premin Kit,货号:KK4808),标准品浓度设置20pM、2pM、0.2pM、0.02pM、0.002pM、0.0002pM,涡旋混匀,设置水作为阴性对照,绘制1条标准曲线,并做一个重复;
e.分别将4μl的标准品,4μl第二次稀释所得样本和4μl水,与16μl反应混合物(KAPA SYBR FAST Universal qPCR Kit,货号:KK4601)混合均匀,加入PCR管中,每孔设置三个重复;
f.预热qPCR仪,打开qPCR软件,按照仪器说明设置程序:95℃预变性10min;95℃10s,60℃30s,40个循环;设置溶解曲线;
g.浓度换算:文库浓度=qPCR读数×452/文库片段大小×10000(稀释倍数)/1000;qPCR质控要求为:浓度≥1μM;总量≥10μl;
h.琼脂糖凝胶电泳确定文库片段大小。
质控要求为:文库条带大小位于300-500bp之间,无小于120bp左右条带的污染。
7、文库Miseq上机测序
1)实验前准备
a.提前16小时将Illumina Miseq V2/V3试剂盒(货号:MS-102-2001)试剂置于4℃冰箱中。
b.试剂融化后,颠倒混匀10次。
2)稀释NaOH
取100μl 2N NaOH和900μl H2O混匀,得到0.2N NaOH。
3)文库变性、稀释
a.5μl 4nM文库与5μl 0.2N NaOH室温变性5分钟;
b.10μl 2nM文库与990μl HT1缓冲液混匀得到20pM文库;
c.360μl 20pM文库与240μl HT1缓冲液混匀得到12pM文库;
d.将600μl 12pM文库加入Load Sample孔中。
4)上机操作步骤按《系统用户指南》完成。
8、高通量测序数据分析
Miseq测序结束后,经生物信息学分析,结果如图6和7所示:
序列比对结果显示:测序得到的reads与细菌数据库比对,完全并唯一比对上的reads分别与艰难梭菌、屎肠球菌、大肠杆菌、粪肠球菌、鲍氏不动杆菌、金黄色葡萄球菌的序列一致,并且代表序列符合“至少有两个不同可变区唯一覆盖,唯一识别reads数>5条”的生物信息分析判断标准。通过最佳引物组合进行两步PCR扩增建库,高通量测序分析检测鉴定得到的细菌种类与模拟实验中预设菌种类完全一致。图7中柱形图的高低代表细菌的拷贝数优势。柱形图Y值>0,表明测序数据结果分析可以鉴定到样本中拷贝数具有差异的混合细菌的不同种类。
实施例四:血流感染测序鉴定及临床血培实验
实验所用的2例临床血液样本由医院提供。按照实施例三的实验方法,对2例血液样本进行两步PCR建库,文库质检,上机测序。同时将这2例血液样本按照临床血培养的标准操作规程进行培养。
本实施例检测了2个样本,第一例样本选用的标签序列为Illumina测序平台提供的index序列表(表4)中的A502序列“TGCTAAGT”;第二例样本选用的是A503序列“TGTTCTCT”。
结果与分析:
两例临床血液样本的高通量测序检测分析结果如图8-11所示:
第1例血液样本检测分析结果显示,测序得到的reads,能够与库序列中肺炎克雷伯氏菌与溶血性葡萄球菌完全比对上,唯一识别reads数均>5。
第2例血液测序结果显示,测序得到的reads,能够与库序列中鲍曼不动杆菌完全比对上,唯一识别reads数均>5。
两例临床血培检测结果见表6,第1例临床血培结果显示能检测到肺炎克雷伯氏菌与溶血性葡萄球菌,第2例临床血陪结果显示能检测到鲍曼不动杆菌,临床血培与测序结果作比对,结果一致。
表6:临床血培检测结果
从鉴定的准确率来看,本研究采用16S rDNA靶向扩增的下一代测序技术,对扩增引物组合进行优化,可以得到满意的扩增结果;将两种扩增产物混合后得到的文库进行下一代测序,分析测序结果,可以达到快速准确鉴定细菌种属的目的。
参考文献
[1]Clarridge J E,Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases.Clin Microbiol Rev,2004,17(4):840-862;
[2]Jumpstart Consortium Human Microbiome Project Data Generation Working Group,Evaluation of 16S rDNA-based community profiling for human microbiome research.PLoS One,2012,7(6):e39315;
[3]Schmalenberger A,Schwieger F,Tebbe C C,Effect of primers hybridizing to different evolutionarily conserved regions of the small-subunit rRNA gene in PCR-based microbial community analyses and genetic profiling.Appl Environ Microbiol,2001,67(8):3557-63;
[4]Claesson M J,Wang Q,O'Sullivan O,Greene-Diniz R,Cole J R,Ross R P,O'Toole P W,Comparison of two next-generation sequencing technologies for resolving highly complex microbiota composition using tandem variable 16S rRNA gene regions.Nucleic Acids Res,2010,38(22):e200;
[5]Chakravorty S,Helb D,Burday M,Connel N,Aland D,A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria.J Microbiol Methods,2007,69(2):330-339;
[6]Baker G C,Smith J,Cowan D A,Review and re-analysis of domain-specific 16S primers.J Microbiol Methods,2003,55(3):541-555。
- 还没有人留言评论。精彩留言会获得点赞!