一种钙依赖型蛋白激酶CPK32及其编码基因和应用的制作方法
本发明涉及基因工程
技术领域:
,具体地说,涉及一种钙依赖型蛋白激酶CPK32及其编码基因和应用。
背景技术:
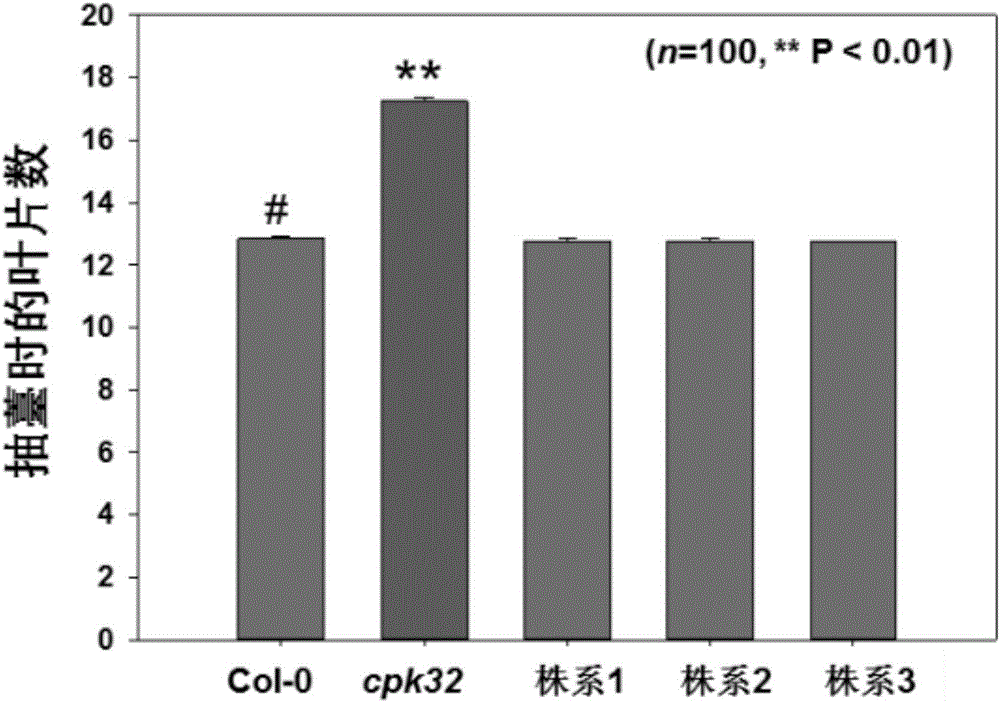
:在植物生命周期中,需要经历三次生长发育的重要转变。种子萌发是植物由胚胎发育到胚后期发育转变的重要标志;第二个重要的转变是种子萌发后由幼苗营养生长状态到成熟的营养生长状态的变化,此时植物可以感受并响应各种成花诱导信号;第三个重要的转变即是成花诱导这一由营养生长到生殖生长阶段的转变。开花是植物由营养生长到生殖生长的重要转变,是植物发育成熟的标志。成花诱导的成功与否直接关系到其后代的延续,其对于种子的形成也至关重要。在农业生产应用上,作物适时的开花对于引种、育种、稳产和增产都有重要的意义。植物的成花诱导受到精细而复杂的调控,以确保植物在适宜的条件下开花、结实。Ca2+作为重要的第二信使广泛参与植物对多种生物和非生物胁迫的响应,例如低温、干旱、盐胁迫、渗透胁迫、机械刺激以及病原菌侵染等。钙在植物的整个生长发育过程中起着十分重要的作用,如胚胎发育、种子成熟、种子萌发及细胞的极性生长等方面。在高等生物中,钙依赖型蛋白激酶作为植物所特有的钙感受器蛋白,介导植物体内多种钙信号传递,将外界生物及非生物胁迫信号转导入植物体内,广泛参与植物生长发育调节及多种逆境信号的传递过程。作为重要的钙感受器蛋白,CDPK参与了植物生长发育调控、植物激素信号转导、营养代谢、病原菌防御反应及对各种生物胁迫和非生物胁迫的响应过程。FLC是植物体内重要的开花抑制因子,是植物开花时间调控的关键基因,其通过抑制开花促进因子基因的表达发挥作用。FLC主要在植物的根尖、茎尖等分裂活跃的组织中表达,其表达量与对开花的抑制程度呈正相关。目前,钙信号以及钙依赖型蛋白激酶介导的磷酸化修饰作用在植物成花诱导过程中的作用机制研究还鲜有报道,因此研究钙依赖型蛋白激酶对植物开花时间的调节机制对于调节花期、提高结实率进而调节农作物产量具有重要的理论意义和研究价值。技术实现要素:本发明的目的是提供一种钙依赖型蛋白激酶CPK32及其编码基因和应用。本发明提供的钙依赖型蛋白激酶CPK32来自拟南芥,该蛋白包含:(a)由SEQIDNO.1所示的氨基酸序列组成的蛋白;或(b)将SEQIDNO.1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加由SEQIDNO.1衍生的且保持SEQIDNO.1所示的蛋白功能使得植物具有调节开花时间的功能蛋白。为了使(a)中的CPK32蛋白便于纯化和检测,可在由SEQIDNO.1所示的氨基酸序列组成的蛋白的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列FLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-Myc10EQKLISEEDL上述(b)中的CPK32蛋白可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的CPK32蛋白的编码基因可通过将SEQIDNO.2所示的多核苷酸序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。本发明提供了编码所述CPK32蛋白的基因(CPK32基因)。其核苷酸序列为:i)SEQIDNO.2所示的核苷酸序列;或ii)SEQIDNO.2所示的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能蛋白质的核苷酸序列;或iii)在严格条件下与SEQIDNO.2所示序列杂交且表达相同功能蛋白的核苷酸序列,所述严格条件为在含0.1%SDS的0.1×SSPE或含0.1%SDS的0.1×SSC溶液中,在65℃下杂交,并用该溶液洗膜;或iv)与i)、ii)或iii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列。本发明提供了含有所述CPK32基因的生物材料。所述生物材料为重组表达载体、表达盒、重组菌或宿主细胞。可用现有的植物表达载体构建含有CPK32基因的重组表达载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。使用CPK32基因构建重组表达载体时,可在其转录起始核苷酸前加上任何一种增强型、组成型、组织特异型或诱导型启动子,它们可单独使用或与其它的植物启动子结合使用;此外,使用CPK32基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入在植物中表达可产生颜色变化的酶或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以开花时间为表型筛选转化植株。所述重组表达载体具体可为在Super1300载体的多克隆位点插入所述CPK32基因得到的重组质粒。所述重组表达载体更具体可为将Super1300载体XbaⅠ和SacⅠ之间的小片段取代为序列表的SEQIDNO.2所示的双链DNA分子得到的重组质粒。本发明还保护所述CPK32蛋白的应用,为如下至少一种:调控植物的开花时间;或调控植物抽薹时的叶片数;或调控植物体内FLC基因的表达。进一步地,本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在调控植物开花时间中的应用。进一步地,本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在促进植物开花时间提前中的应用。本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在调控植物抽薹时的叶片数目中的应用。进一步地,本发明CPK32蛋白或其编码基因或含有该编码基因的生物材料在减少植物抽薹时的叶片数目中的应用。本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在调控植物中FLC的表达量中的应用。进一步地,本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在降低植物中FLC的表达量中的应用。本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在调节植物开花表型中的应用。本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在制备转基因植物中的应用。本发明提供了CPK32蛋白或其编码基因或含有该编码基因的生物材料在植物种质资源改良中的应用。上述应用中,所述植物为单子叶植物或双子叶植物。所述双子叶植物具体可为拟南芥,例如拟南芥cpk32突变株。本发明还保护一种培育转基因植物的方法,是将所述CPK32基因导入目的植物中,得到转基因植物;所述转基因植物满足如下至少一种表型:调节所述目的植物的开花时间;或调节所述目的植物抽薹时的叶片数目;或调节所述目的植物中FLC的表达量。携带有所述CPK32基因的重组表达载体可通过Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化到植物细胞或组织中。所述目的植物为单子叶植物或双子叶植物。所述双子叶植物具体可为拟南芥,例如拟南芥cpk32突变株。本发明提供了一种用于克隆拟南芥CPK32蛋白编码基因开放阅读框的引物对,其核苷酸序列如SEQIDNO.5-6所示。本发明还提供了一种用于克隆拟南芥CPK32基因组的引物对,其核苷酸序列如SEQIDNO.7-8所示。所述拟南芥CPK32基因组的核苷酸序列如SEQIDNO.3所示。本发明中,通过试验证实了将CPK32基因导入目的植物中后能够调节目的植物的开花时间、调节抽薹时的叶片数目或调节目的植物中FLC的表达量。本发明的钙依赖型蛋白激酶CPK32对于改良作物的开花时间具有重要调节作用,在作物的种质资源改良中具有较大应用价值。附图说明图1A为长日照光周期条件下野生型Col-0、cpk32突变体拟南芥及株系1、株系2和株系3表型观察。MS培养基上萌发生长7天的幼苗,移栽到营养土中长日照光周期条件下继续培养,材料抽薹后照相记录。图1B为长日照光周期条件下,萌发40天后,野生型Col-0、cpk32突变体及株系1、株系2和株系3抽薹时的叶片数统计。MS培养基上萌发生长7天的幼苗,移栽到营养土中长日照光周期条件下继续培养,材料抽薹后统计总叶片数。统计分析数值显示为平均值±标准误,t检验,n=100,**P<0.01。图1C为短日照光周期条件下野生型Col-0、cpk32突变体及株系1、株系2和株系3表型观察。MS培养基上萌发生长7天的幼苗,移栽到营养土中短日照光周期(SD:8小时光照/16小时黑暗)条件下继续培养,材料抽薹后照相记录。图1D为短日照光周期条件下,萌发120天后,野生型Col-0、cpk32突变体及株系1、株系2和株系3抽薹时的叶片数统计。MS培养基上萌发生长7天的幼苗,移栽到营养土中短日照光周期条件下继续培养,材料抽薹后统计总叶片数。统计分析数值显示为平均值±标准误,t检验,n=30,**P<0.01。图2为本发明实施例2的拟南芥cpk32突变体及其恢复突变材料株系1、株系2和株系3的经过GA处理及其对照处理条件下抽薹时的叶片数统计结果图。MS培养基上萌发生长7天的幼苗,移栽到营养土中长日照光周期条件下继续培养,喷施100μM的GA直至材料开花,材料抽薹后统计总叶片数。统计分析数值显示为平均值±标准误,t检验,n=100,**P<0.01。图3长日照光周期条件下,野生型Col-0、cpk32突变体及株系1、株系2和株系3春化处理前后抽薹时的总叶片数统计结果图。MS培养基上萌发生长7天的幼苗,转移到4℃培养4-6周后,移栽到营养土中长日照光周期条件下继续培养,材料抽薹后统计总叶片数。统计分析数值显示为平均值±标准误,t检验,n=100,**P<0.01。图4本发明实施例3的Northernblot分析野生型Col-0、cpk32突变体及株系1、株系2和株系3中FLC基因的表达水平。长日照条件下MS培养基上生长7天的幼苗提取总RNA。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(SambrookJ&RussellDW,MolecularCloning:aLaboratoryManual,2001),或按照制造厂商说明书建议的条件。以下实施例中的定量实验,均设置三次重复实验,结果取平均值。Super1300载体:购自上海北诺生物科技有限公司,货号为addgene0595。农杆菌菌株GV3101:CloughSJ,BentAF(1998)Floraldip:asimplifiedmethodforAgrobacterium-mediatedtransformationofArabidopsisthaliana.PlantJ.16:735-743。哥伦比亚生态型拟南芥,用Col-0表示。从ABRC(ArabidopsisBiologicalResourceCenter)购买编号为SALK_112665的T-DNA插入突变体(插入位置位于CPK32基因的启动子上),将其命名为拟南芥cpk32突变株。经测序,拟南芥cpk32突变株为纯合突变株,T-DNA插入在起始密码子ATG前第368位,造成CPK32在转录水平和翻译水平均显著低于Col-0。MS液体培养基(pH5.8):每升含1650mgNH4NO3,1900mgKNO3,370mgMgSO4·7H2O,170mgKH2PO4,440mgCaCl2·2H2O,22.3mgMnSO4·4H2O,0.83mgKI,0.025mgCuSO4·5H2O,6.25mgH3BO5,0.025mgCoCl·6H2O,8.65mgZnSO4·7H2O,0.25mgNa2MoO4·2H2O,27.8mgFeSO4·7H2O和37.3mgNa2-EDTA,用电阻大于18MΩ的去离子水定容至1L。MS固体培养基:在MS液体培养基的基础上,每升加入30g蔗糖、8g琼脂粉。实施例1CPK32蛋白及其编码基因和基因组核酸序列的克隆(1)CPK32蛋白编码基因的克隆Trizol(Invitrogen)法提取拟南芥长日照光周期生长室(16小时光照/8小时黑暗)培养7天的幼苗(100-200mg)总RNA,经甲醛变性RNA琼脂糖凝胶电泳检查RNA的完整性。按照SUPERSCRIPTII的使用说明合成单链cDNA。将合成的单链cDNA稀释10倍并作为模板DNA,采用Primer1和Primer2组成的引物对进行PCR反应。Primer1:5'-gctctagaATGGGTAATTGTTGCG-3';(SEQIDNO.5)Primer2:5'-cgagctcTCATCTTGTATCACCA-3'(SEQIDNO.6)。PCR体系(50μL):5μL10×Ex-taqPCRBuffer,4μL2.5mMdNTPmix,2.5μLPrimer1(10μM),2.5μLPrimer2(10μM),1μL模板DNA,1.5μLDMSO,0.5μLEx-taqDNAPolymerase(2U/μL)。PCR程序:94℃预变性5分钟;94℃30秒,60℃30秒,72℃1分钟45秒,35个循环;72℃延伸5分钟,10℃保存PCR产物。回收约1617bp的PCR产物,连接到pMD18-T载体,依次进行酶切和测序鉴定。测序结果表明,PCR产物中具有SEQIDNO.2所示的开放阅读框,编码SEQIDNO.1所示的蛋白质,重组载体命名为pMD18-T-CPK32-CDS。将序列表中的SEQIDNO.1所示蛋白命名为CPK32蛋白。将编码CPK32蛋白的基因命名为CPK32基因,其开放阅读框如SEQIDNO.2所示。(2)CPK32蛋白基因组核酸序列的克隆CTAB法提取拟南芥长日照光周期生长室(16小时光照/8小时黑暗)培养7天的幼苗DNA,经琼脂糖凝胶电泳检查DNA的完整性。以基因组DNA为模板,采用Primer3和Primer4组成的引物对进行PCR反应。Primer3:5'-ggatccGTATTTCAGGAATGGAATTTCGAACCCACTAA-3';(SEQIDNO.7)Primer4:5'-gtcgacTCATCTTGTATCACCATTGACCTGCAACGA-3'(SEQIDNO.8)。PCR体系(50μL):5μL5×PhusionPCRBuffer,4μL2.5mMdNTPmix,2.5μLPrimer1(10μM),2.5μLPrimer2(10μM),1μL模板DNA,1.5μLDMSO,0.5μLPhusionDNAPolymerase(2U/μL)。PCR程序:98℃预变性3分钟;98℃20秒,60℃20秒,72℃2分钟30秒,35个循环;72℃延伸5秒,10℃保存PCR产物。回收约4300bp的PCR产物,连接到pMD18-T载体,依次进行酶切和测序鉴定。测序结果表明,PCR产物中具有如SEQIDNO.3所示CPK32基因组核酸序列,其转录后经剪切加工编码SEQIDNO.2所示开放阅读框及SEQIDNO.1所示蛋白氨基酸序列,重组载体命名为pMD18-T-CPK32-GENOME。实施例2CPK32蛋白的功能验证一、构建重组质粒1、以pMD18-T-CPK32-GENOME质粒DNA分子为模板,采用Primer3和Primer4组成的引物对(SEQIDNO.7-8所示)进行PCR扩增,得到PCR扩增产物,回收约4300bp的DNA片段。2、用限制性内切酶BamHⅠ和SalⅠ双酶切步骤1得到的DNA片段,回收酶切产物。3、用限制性内切酶BamHⅠ和SalⅠ双酶切pCAMBIA1300载体(该质粒又称植物表达载体pCAMBIA1300-AT,GENBANKACCESSIONNO.FJ362601,VERSIONFJ362601.1,GI:213876770),回收约10000bp左右的载体骨架。4、将步骤2的酶切产物和步骤3的载体骨架连接,得到重组质粒甲。根据测序结果,对重组质粒甲进行结构描述如下:将pCAMBIA1300载体BamHⅠ和SalⅠ之间的小片段取代为序列表中的SEQIDNO.3所示的双链DNA分子。5、以pMD18-T-CPK32-CDS质粒DNA分子为模板,采用Primer1和Primer2组成的引物对进行PCR扩增,得到PCR扩增产物,回收约1617bp的DNA片段。Primer1:5'-gctctagaATGGGTAATTGTTGCG-3';Primer2:5'-cgagctcTCATCTTGTATCACCA-3'。6、用限制性内切酶XbaⅠ和SacⅠ双酶切步骤5得到的DNA片段,回收酶切产物。7、用限制性内切酶XbaⅠ和SacⅠ双酶切Super1300载体,回收约10000bp左右的载体骨架。8、将步骤6的酶切产物和步骤7的载体骨架连接,得到重组质粒乙。根据测序结果,对重组质粒乙进行结构描述如下:将Super1300载体XbaⅠ和SacⅠ之间的小片段取代为序列表的SEQIDNO.2所示的多核苷酸分子。二、培育转基因植物1、将重组质粒甲导入农杆菌菌株GV3101,得到重组农杆菌。2、采用花芽浸泡法(CloughandBent,Floraldip:asimplifiedmethodforAgrobacterium-mediatedtransformationofArabidopsisthaliana.PlantJournal1998,16:735-743),用步骤1得到的重组农杆菌侵染拟南芥cpk32突变株,收获T1代种子。T2代表示T1代自交产生的种子及由它所长成的植株,T3代表示T2代自交产生的种子及由它所长成的植株。在含50μg/L潮霉素的MS固体培养基平板上筛选T1代植株并进行T2代和T3代的分离比统计,在T3代得到转CPK32基因拟南芥单拷贝纯合株系,随机取三个株系,命名为株系1、株系2和株系3。三、表型检测待测植物分别为:株系1的T3代植株、株系2的T3代植株、株系3的T3代植株、拟南芥cpk32突变株和哥伦比亚生态型拟南芥Col-0。开花时间表型观察:取适量干燥的拟南芥种子于1.5mL的离心管中,加入1mL消毒液(0.5%NaClO+0.01%TritonX-100),轻弹离心管使种子与消毒液充分接触,翻转混匀消毒10-15分钟,吸出消毒液,用无菌水反复漂洗3-5次,充分洗掉残留的消毒液,悬浮于无菌水。4℃低温处理3-4天后,用枪头将种子点播于固体培养基上;放入22℃光照培养箱/生长室中培养,光照强度为80-120μmol·m-2·s-1。一周后,幼苗移栽入蛭石:营养土为1:1的盆土中,于生长室中继续培养。培养条件为:22±1℃;光周期:16小时光照/8小时黑暗,相对湿度60%,光照强度为80-120μmol·m-2·s-1。植物材料每周浇一次水。(1)光周期处理移栽到土中的野生型和突变体幼苗放置于温室中,分别在长日照(16小时光照/8小时黑暗)和短日照(8小时光照/16小时黑暗)条件下生长,抽薹后统计莲座叶和茎生叶的总叶片数目。(2)春化处理移栽到土中的野生型和突变体幼苗分别在4℃弱光条件下处理至少6周,然后移到长日照条件下继续生长,抽薹后统计叶片数目。(3)GA处理野生型及突变体幼苗生长在长日照条件下,从长出真叶开始每周喷施100μM的GA三次,对照喷施相应的乙醇溶液(100mM的GA3母液用50%的乙醇配制),抽薹后统计叶片数目。表型观察实验结果表明:不论是在长日照还是在短日照光周期条件下,与野生型拟南芥相比,cpk32突变体拟南芥均表现出晚花表型,且抽薹时的叶片数目显著多于野生型拟南芥材料,在长日照和短日照光周期条件下,cpk32突变体抽薹时的总叶片数目分别是野生型对照材料的134%和137%。株系1、株系2和株系3无论是在开花时间还是抽薹时的叶片数统计结果均能够恢复到野生型拟南芥的水平。短日照条件下,cpk32突变体拟南芥的开花时间显著晚于在长日照光周期条件下,而且抽薹时的叶片数也显著多于长日照条件下。这就说明cpk32突变体拟南芥能够正常地感受和传递光周期信号,因此CPK32不是通过光周期途径参与对拟南芥开花时间的调控(见图1A-图1D)。进一步说明CPK32能够促进开花时间提前,减少抽薹时叶片数数目。春化处理后拟南芥cpk32突变体抽薹时的叶片数目显著少于对照处理材料(春化处理为对照处理的76%),Col-0和拟南芥cpk32突变体的恢复突变材料株系1、株系2和株系3抽薹时的叶片数也少于对照处理材料。拟南芥cpk32突变体抽薹时的叶片数仍然多于野生型拟南芥,说明拟南芥cpk32突变体能够正常地响应春化处理,CPK32是通过春化途径之外的其它途径参与拟南芥开花时间调控(见图2)。GA处理能显著促进拟南芥cpk32突变体开花,拟南芥cpk32突变体抽薹时的叶片数目显著少于对照处理(GA处理为对照处理的79%),而且GA处理之后拟南芥cpk32突变体抽薹时的叶片数仍然多于野生型拟南芥对照材料,说明CPK32基因的突变并不影响该突变体对GA的响应,CPK32是通过GA途径之外的其它途径参与拟南芥开花时间的调控(见图3)。实施例3FLC表达量检测待测植物分别为:株系1的T3代植株、株系2的T3代植株、株系3的T3代植株、拟南芥cpk32突变株和哥伦比亚生态型拟南芥Col-0。实验材料在长日照光周期(16小时光照/8小时黑暗)生长7天后,Trizol法提取总RNA。(1)甲醛变性胶1.2%琼脂糖胶于1×MOPS(MOPS0.2M,NaAc(2)样品准备:取15-20μgRNA到1.5mLRNase-free离心管中,加DEPC水至20μL,加20μL样品缓冲液,在65℃加热5分钟后,冰上冷却,加3μLLoadingbuffer,混匀。(3)把胶放入电泳槽中,用1×MOPS溶液把胶覆盖,预电泳15分钟。(4)点样,100-120V(5V/cm),电泳2-2.5小时。(5)电泳期间,准备转膜所需溶液(10×SSC,1.5MNaCl,0.15Msodiumcitrate),1条17×25cm的滤纸条,大量吸水纸。毛细管吸印转移(1)电泳完毕,将凝胶在10×SSC溶液中清洗一遍,去除凝胶上没有点样的部分,并在左上角切去一小角以作为凝胶定位的标记。(2)在搪瓷盘内加入10×SSC溶液,用一块玻璃板作为平台,在其上平铺一张17×25cm的滤纸条,完全湿透后,用玻璃棒赶走滤纸和玻璃板之间的气泡。(3)裁剪一张和凝胶大小相同的带正电的Hybond-N+尼龙膜,然后将Hybond-N+膜浸入10×SSC溶液中至少10分钟。(4)将凝胶倒扣在平台的滤纸中央,用玻璃棒赶走凝胶和滤纸之间的气泡。(5)用parafilm在凝胶四周围一圈,以此作为屏障,阻止转膜液直接流至胶上方的吸水纸中。然后将尼龙膜置于凝胶上,赶走气泡。(6)在尼龙膜上放3-4张浸湿的滤纸,在其上放置一叠5-8cm厚的吸水纸,然后在上面放置400g重物。(7)前期,每30分钟更换浸透的吸水纸,重复3次。(8)RNA转移24小时,中间更换浸透的吸水纸2-3次。(9)转膜完毕,取出尼龙膜紫外交联2分钟,使RNA固定于(10)将膜于真空干燥仪中,80℃处理2小时。标记探针探针模板的准备Trizol(Invitrogen)法提取拟南芥长日照光周期生长室(16小时光照/8小时黑暗)培养7天的幼苗(100-200mg)的总RNA,经甲醛变性RNA琼脂糖凝胶电泳检查RNA的完整性。按照SUPERSCRIPTII的使用说明合成单链cDNA。将合成的单链cDNA稀释10倍并作为模板DNA,采用Primer5和Primer6组成的引物对进行PCR反应,扩增SEQIDNO.4。Primer5:5'-ATGGGAAGAAAAAAACTAGA-3';(SEQIDNO.9)Primer6:5'-CTAATTAAGTAGTGGGAGAGT-3'(SEQIDNO.10)。PCR体系(50μL):5μL10×Ex-taqPCRBuffer,4μL2.5mMdNTPmix,2.5μLPrimer1(10μM),2.5μLPrimer2(10μM),1μL模板DNA,1.5μLDMSO,0.5μLEx-taqDNAPolymerase(2U/μL)。PCR程序:94℃预变性5分钟;94℃30秒,60℃30秒,72℃1分钟45秒,35个循环;72℃延伸5分钟,10℃保存PCR产物。回收约591bp的PCR产物。(1)将25ngDNA模板稀释于45μLTE缓冲液中。(2)DNA样品在95-100℃沸水浴中变性5分钟,迅速置于冰上冷却5分钟。(3)将变性后的DNA模板加入到AmershamRediprimeIIDNALabeling反应管中,并加入5μL[α-32P]dCTP,充分混匀,37℃反应30分钟。(4)使用前在95-100℃加热5分钟后,置于冰上待用。杂交预杂交:将膜的反面贴紧杂交瓶,加入10mL杂交液(BSA1%(w/v),EDTA1mM,Phosphatebuffer0.5M,SDS7%(w/v)),65℃预杂交至少1小时。(1)换新的杂交液,加入标记好的变性探针,42℃杂交12-16小时。洗膜(1)倒掉杂交液,用2×SSC溶液轻轻清洗一次。(2)用1/4体积的预热的2×SSC溶液(0.1%SDS)65℃洗膜两次,每次5分钟。(3)用1/4体积的预热的1×SSC溶液(0.1%SDS)65℃洗膜两次,每次10分钟。(4)用1/4体积的预热的0.1×SSC溶液(0.1%SDS)65℃洗膜四次,每次5分钟。(5)用保鲜膜将尼龙膜包好,压X光片或磷屏。实验结果如图4所示,与野生型拟南芥材料Col-0相比,拟南芥cpk32突变体中FLC的表达量明显升高,其恢复突变材料株系1、株系2和株系3中FLC的表达量与野生型材料较为接近,这与表型观察结果相互对应,较为一致。说明本发明CPK32蛋白具有降低FLC表达量的功能。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 细胞外cAMP依赖的蛋白激酶-ECPKA的应用的制作方法
- 用钙调蛋白激酶Ⅱ抑制剂治疗结构性心脏病中的心肌功能障碍的制作方法
- 一种人血清中钙依赖分泌蛋白1的质谱检测方法
- 用作细胞周期蛋白依赖性激酶抑制剂的2-苯氨基-嘧啶衍生物的制作方法
- 依赖细胞周期蛋白的激酶的n-[5-[[[5-烷基-2-噁唑基]甲基]硫基]-2-噻唑基 ...的制作方法
- 依赖细胞周期蛋白的激酶的n-[5-[[[5-烷基-2-噁唑基]甲基]硫基]-2-噻唑基 ...的制作方法
- 白念珠菌ctd蛋白激酶基因及其用途的制作方法
- 与g蛋白激酶信号途径修饰剂形成的n-甲酰基肽受体复合物的制作方法
- 一种新的多肽——人cAMP依赖的蛋白激酶调节亚单位8.8和编码这种多肽的多核苷酸的制作方法
- 依赖细胞周期蛋白的激酶抑制剂及其组合物和相关用途的制作方法
- 用作细胞周期蛋白依赖性激酶抑制剂的2-苯氨基-嘧啶衍生物的制作方法
- 依赖细胞周期蛋白的激酶的n-[5-[[[5-烷基-2-噁唑基]甲基]硫基]-2-噻唑基 ...的制作方法
- 依赖细胞周期蛋白的激酶的n-[5-[[[5-烷基-2-噁唑基]甲基]硫基]-2-噻唑基 ...的制作方法
- 一种新的多肽——人周期蛋白依赖激酶16.82 和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人cAMP依赖的蛋白激酶调节亚单位8.8和编码这种多肽的多核苷酸的制作方法
- 抑制发动蛋白依赖性的细胞内摄作用的方法和药剂的制作方法
- 人钙离子/钙调蛋白依赖性蛋白激酶II抑制性蛋白α,其编码序列及用途的制作方法
- 作为抗癌剂的细胞周期蛋白依赖性激酶抑制剂的制作方法
- 人环腺苷酸依赖蛋白激酶抑制剂-9和编码该多肽的多核苷酸的制作方法
- 用作细胞周期蛋白依赖性激酶抑制剂的新的吡唑并嘧啶化合物的制作方法