本发明公开了一种适用于牧草青贮的乳酸菌菌剂及其应用,属于家畜饲料中的青贮饲料加工技术领域。
背景技术:
青贮是通过乳酸菌的增殖,将原料中的发酵底物转化成乳酸等酸性物质,维持酸性厌氧环境,以利于青贮作物长期保存的一种贮藏方式。青贮饲料颜色黄绿、气味酸香、柔软多汁、适口性好,在畜牧业生产中广泛应用,尤其在反刍动物饲养中,已成为重要的优质粗饲料来源。与牧草晾晒成干草相比,牧草青贮可以大幅度缩短从收割到贮藏的时间,避免不良天气造成的饲草损失,使青绿饲草的营养成分得到最大限度的保存。
乳酸菌是近年来正在推广的青贮微生物添加剂,其主要作用是调节青贮物料内微生物组成,迅速成为优势菌群,竞争抑制有害微生物生长,快速转化有限的糖分,显著地降低青贮pH值,从而有效提高青贮饲料的质量,具有较大潜力和广阔的发展前景。目前,对青贮乳酸菌的研制主要集中在植物乳杆菌等单一菌种。专利文献《一种植物乳杆菌及其在暖季型牧草青贮中的应用(CN2016100121 45.2)》提供了从天然牧草青贮饲料中分离得到的一株植物乳杆菌。但是青贮从前期、中期以及开封后的后期,青贮饲草的微生物组成、理化性质及所处环境都会发生一系列的变化。单一的乳酸菌产品无法满足变化的青贮要求。另一方面,乳酸菌按发酵类型分为同型发酵乳酸菌和异型发酵乳酸菌。同型发酵乳酸菌利用水溶性碳水化合物(WSC)产生较多的乳酸,改善青贮发酵品质,但抑制好氧变质的能力普遍较差。异型发酵乳酸菌利用WSC产生较多的乙酸,抑制了好氧性细菌、酵母和霉菌及青贮饲料好氧变质。专利文献《一种用于制备青贮饲料的微生物添加剂(CN 201410677476.9)》提供了一种新型植物乳杆菌ZJY-6及包含该菌的微生物添加剂,微生物添加剂还包含布氏乳杆菌、干酪乳杆菌、嗜热乳杆菌、肠球菌、戊糖片球菌、短小芽孢杆菌、乳酸片球菌中的任意一种。专利文献《用布氏乳杆菌和植物乳杆菌制备甘蔗尾青贮饲料的方法(CN20141063295 3.X)》公开了用布氏乳杆菌和植物乳杆菌的菌剂组合来青贮甘蔗尾的方法。但是 这两份专利文献中,植物乳杆菌、布氏乳杆菌一个分离自青贮玉米,一个购自菌株库。在微生物菌种资源中,每个菌种都有上百个甚至上千上性能不同的亚种(菌株)。根据微生物对生境的适应性和特异性原理,从牧草物料中分离乳酸菌,将乳酸菌再应用于牧草,乳酸菌能更迅速得在牧草青贮中定植,形成优势菌群。因此从牧草中分离乳酸菌,选用功能互补的乳酸菌菌株,制备牧草专属的乳酸菌菌剂,是提高牧草青贮饲料品质的重要保证。
技术实现要素:
本发明针对现有技术的不足,其目的在于提供一种适用于牧草青贮的乳酸菌菌剂及其应用。
本发明的第一个发明目的是提供一种适用于牧草青贮的乳酸菌菌剂,所述的乳酸菌菌剂由植物乳杆菌冻干粉和布氏乳杆菌冻干粉组成,所述的植物乳杆菌和布氏乳杆菌均从黑麦草秸秆中分离得到,植物乳杆菌为同型发酵乳酸菌,布氏乳杆菌为异型发酵乳杆菌,两株菌株于2016年5月25日保藏于中国典型培养物保藏中心,所述植物乳杆菌的菌株为L.plantarumZRR,保藏号为CCTCC No:M2016281,所述布氏乳杆菌的菌株为L.buchneriBR2,保藏号为CCTCC No:M2016280;
所述的乳酸菌菌剂中,植物乳杆菌冻干粉和布氏乳杆菌冻干粉的重量比为2:1,植物乳杆菌冻干粉中的活菌数达到8×109cfu/g,布氏乳杆菌冻干粉中的活菌数达到4×109cfu/g,乳酸菌菌剂的活菌数达到1.2×1010cfu/g;
所述的乳酸菌菌剂在牧草青贮饲料的添加量为2.4×105cfu/g。
所述的适用于牧草青贮的乳酸菌菌剂中,所述植物乳杆菌的16S rDNA基因序列如SEQ ID No.1所示,所述布氏乳杆菌的16S rDNA基因序列如SEQ ID No.2所示。
本发明的植物乳杆菌(L.plantarum ZRR)是从牧草秸秆上筛选出来的具有产酸速度快、生长能力强、良好耐酸性的乳酸菌;该菌株已保藏于中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学校内,分类命名:植物乳杆菌Lactobacillus plantarum,保藏号:CCTCC No:M2016281,保藏日期为:2016年5月25日。
所述植物乳杆菌(Lactobacillus plantarum)ZRR的菌落呈乳白色,边缘整齐; 细胞显微形态为短杆状,无芽孢,革兰氏染色阳性;接触酶阴性,氧化酶阴性;具有较强的生长及产酸性能,在起始pH值为3.0-8.0的培养基上能生长,在10℃条件下呈现微弱生长,在15℃—40℃条件下生长状况良好,在不大于6.5%NaCl的条件下生长状况良好。
本发明的布氏乳杆菌(L.buchneriBR2)是从牧草秸秆上筛选出来的具有产乙酸、良好耐酸性的乳酸菌;该菌株已保藏于中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学校内,分类命名:布氏乳杆菌Lactobacillus buchneri,保藏号:CCTCC No:M2016280,保藏日期为:2016年5月25日。
所述布氏乳杆菌(Lactobacillus buchneri)BR2的菌落呈灰白色,粘稠、边缘整齐;细胞显微形态为中杆状,无芽孢,革兰氏染色阳性;接触酶阴性,氧化酶阴性;具有较强的生长及产酸性能,在起始pH值为3.0—7.5的培养基上能生长,在10℃条件下呈现微弱生长,在15℃—40℃条件下生长状况良好,在不大于6.5%NaCl的条件下生长状况良好。
本发明的第二个发明目的是提供上述乳酸菌菌剂在制备牧草青贮饲料中的应用。所述的牧草青贮饲料制备方法如下:
原料准备:牧草刈割后,保证清洁、无霉烂变质,并将其切断至2-3cm。
菌株活化:将冷冻保存的L.plantarumZRR、L.buchneriBR2分别接种于MRS液体培养基中,在温度37℃下培养18-24h,如此传代培养2-3次得到所述的活化L.plantarumZRR、L.buchneriBR2菌种;所述的MRS液体培养基组成如下:10g蛋白胨、5g牛肉膏、4g酵母浸粉、20g葡萄糖、2g磷酸氢二钾、5g乙酸钠、2g柠檬酸三钠、1mL吐温80、0.2g硫酸镁、0.05g硫酸锰加入1000mL蒸馏水,调节pH至6.5,121℃灭菌15min。
菌粉的制备:将上述活化的菌种分别接种发酵、冷冻干燥、粉碎、辅料混合制成冻干菌粉,L.plantarumZRR、L.buchneriBR2的冻干粉按照2:1的重量比例混合,使乳酸菌菌剂冻干粉的活菌数达到1.2×1010cfu/g。
牧草青贮的调制:牧草原料青贮时的水分含量控制在65%-70%,称取200g牧草原料装入真空包装塑料袋中,将上述制备的菌粉以2.4×105cfu/g的接种量接种到原料中,采用真空包装机真空包装后,置于储藏室进行发酵。
所述发酵的条件为:发酵温度为15-25℃,发酵时间为30-60d。青贮牧草的品质检测:发酵成熟后,取出部分青贮牧草进行微生物组成和发酵品质分析。
本发明提供的乳酸菌菌剂具有下述的积极效果:
(1)根据微生物对生境的适应性和特异性原理,从牧草中筛选出提高牧草青贮品质的专属菌L.plantarumZRR、L.buchneriBR2。(2)本发明经过创造性劳动,发现乳酸菌菌剂效果最好的配比是植物乳杆菌和布氏乳杆菌,其重量比为2:1,乳酸菌菌剂在牧草青贮饲料的添加量为2.4×105cfu/g。(3)与现有的单一乳酸菌相比,接种L.plantarumZRR、L.buchneriBR2的乳酸菌菌剂,在发酵前期可以快速成为优势菌群,降低pH值;乳酸的含量显著提高,氨态氮含量下降,有利于改善青贮饲料的适口性,提高了牧草青贮的发酵品质;显著提高乙酸含量,降低乙醇的含量,开袋后抑制青贮饲料中霉菌、酵母等真菌的生长,提高有氧稳定性,从而有利于延长青贮饲料的保存期限。
因此本发明所述的乳酸菌菌剂具有加速牧草青贮成熟、提高牧草青贮品质、提高有氧稳定性等优点,可广泛应用于牧草青贮饲料制备领域。
附图说明
图1-1为不同添加量青贮象草pH动态变化;
图1-2为不同添加量青贮象草乳酸菌动态变化;
图1-3为不同添加量青贮象草细菌动态变化;
图1-4为不同添加量青贮象草霉菌动态变化;
图2-1为不同菌剂青贮黑麦草pH动态变化;
图2-2为不同菌剂青贮黑麦草乳酸菌动态变化;
图2-3为不同菌剂青贮黑麦草细菌动态变;
图2-4为不同菌剂青贮黑麦草霉菌动态变化;
图3-1为不同菌剂青贮黑麦草青贮时及有氧暴露后的霉菌动态变化;
图3-2为不同菌剂青贮黑麦草青贮时及有氧暴露后的酵母动态变化。
具体实施方式
下面结合附图和实施例对本发明做进一步说明,以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1植物乳杆菌(Lactobacillus plantarum)ZRR、布氏乳杆菌(Lactobacillus buchneri)BR2的分离与鉴定
1、分离纯化
从黑麦草秸秆中分离纯化到植物乳杆菌ZRR和布氏乳杆菌BR2,分别是为同型发酵乳酸菌和异型发酵乳杆菌,具体如下:称取10g黑麦草秸秆样品加入灭菌的90ml蒸馏水中,利用恒温摇床震荡1h,然后10倍梯度稀释,分别取10-3、10-4和10-5倍样品稀释液涂布在MRS固体培养基上,培养48h,然后将其取出,依据菌落的大小、形态和颜色,挑取MRS上生长的单菌落,进行过氧化氢酶实验及革兰氏染色。将过氧化氢酶阴性及革兰氏染色阳性者暂定为乳酸菌,于MRS固体培养基上继续划线纯化2次。-80℃保存于25%甘油的MRS培养基中,菌株分别命名为ZRR、BR2。
2、生理生化检测
乳酸菌ZRR在起始pH值为3.0-8.0的培养基上能生长,在10℃条件下呈现微弱生长,在15℃-40℃条件下生长状况良好,在不大于6.5%NaCl的条件下生长状况良好。乳酸菌BR2在起始pH值为3.0-7.5的培养基上能生长,在10℃条件下呈现微弱生长,在15℃-40℃条件下生长状况良好,能够耐受3.0%的盐浓度。部分理化特性如表1所示。菌株ZRR、BR2能够利用的碳源如表2所示。
3、分子鉴定
将固体平板上培养48h的乳酸菌菌株ZRR、BR2,采用菌落PCR扩增,进行16rRNA基因序列鉴定。引物选用细菌的16S rRNA基因扩增通用引物:27F和1492R。PCR反应体系为50μl:Premix Taq25μl,27F和1492R(均为20μM)1μl,补充灭菌蒸馏水至50μl,直接将菌落加入反应体系,进行PCR扩增,得到PCR产物。将PCR产物送去测序,结果为序列表中序列1、2所示。
表1菌株ZRR、BR2的生理生化特性
表2菌株ZRR、BR2的碳源发酵试验结果
注:+代表反应为阳性;—代表反应为阴性;w代表反应为弱阳性
经过上述鉴定,乳酸菌菌株ZRR、BR2于2016年5月25日,已保藏于中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学校内,分类命名:植物乳杆菌Lactobacillus plantarum,保藏号:CCTCC No:M2016281,分类命名:布氏乳杆菌Lactobacillus buchneri,保藏号:CCTCC No:M2016280。
实施例2不同菌株在黑麦草青贮中的应用
原料准备:黑麦草刈割后,保证清洁、无霉烂变质,并将其切断至2-3cm。
菌株活化:将冷冻保存的L.plantarumZRR、L.buchneriBR2分别接种于MRS液体培养基中,在温度37℃下培养18-24h,如此传代培养2-3次得到所述的活化L.plantarumZRR、L.buchneriBR2菌种;所述的MRS液体培养基组成如下:10g蛋 白胨、5g牛肉膏、4g酵母浸粉、20g葡萄糖、2g磷酸氢二钾、5g乙酸钠、2g柠檬酸三钠、1mL吐温80、0.2g硫酸镁、0.05g硫酸锰加入1000mL蒸馏水,调节pH至6.5,121℃灭菌15min。
菌粉的制备:将上述活化的菌种分别接种发酵、冷冻干燥、粉碎、辅料混合制成冻干菌粉,植物乳杆菌L.plantarumZRR(以下简称ZRR)、布氏乳杆菌L.buchneri BR2(以下简称BR2)的冻干粉按照不同的重量比例混合,使乳酸菌冻干粉的活菌数达到1.2×1010cfu/g。
五组不同菌种组的混合重量比例分别是:
试验组1:100%植物乳杆菌ZRR;
试验组2:100%布氏乳杆菌BR2;
试验组3:33%植物乳杆菌ZRR、67%布氏乳杆菌BR2(1:2);
试验组4:50%植物乳杆菌ZRR、50%布氏乳杆菌BR2(1:1);
试验组5:67%植物乳杆菌ZRR、33%布氏乳杆菌BR2(2:1);
黑麦草青贮的调制:黑麦草原料青贮时的水分含量控制在65%-70%,称取200g牧草原料装入真空包装塑料袋中,将上述制备的菌粉按0.04‰(即4.8×105cfu/g)的接种量接种到原料中,采用真空包装机真空包装后,置于储藏室进行发酵。
在42d发酵成熟后,取青贮样品进行品质分析。青贮样品加入90ml灭菌水,充分震荡,取适量液体进行pH和有机酸的测定,并取适量青贮饲料置于65℃烘箱中风干至恒重,测定其干物质。添加不同菌种对黑麦草青贮品质的影响见表3.
由表3可知,试验组1单独添加ZRR,乳酸含量最高,pH和乙醇含量最低,表明筛选的专属菌ZRR能迅速在牧草中定植,转化糖为乳酸,抑制其他细菌转化糖为乙醇,快速酸化,提高青贮品质,但乙酸含量最低,不利于发酵后期的有氧稳定性。试验组2单独添加BR2,乙酸含量最高,但产乳酸量在试验组中最低,pH和乙醇含量最高。单独添加ZRR或BR2,不能满足青贮品质和有氧稳定性两方面的技术要求。因此,复配两株菌株,筛选不同的添加比例组合。试验组3,4,5的结果表明:试验组5的乳酸含量最高为10.31%,乙醇含量最低为0.81%,且100%、67%、33%的BR2三组间的乙酸含量没有差异。因此,试验组5即67%ZRR、33%BR2(2:1)的添加比例组合,可以快速将黑麦草中的可溶性糖转化为乳酸和乙酸, 降低pH,显著降低乙醇含量,提高有氧稳定性。
表3:添加不同菌种对黑麦草青贮品质的影响(%/干物质)
注:同列数据上标不同字母表示差异显著(P<0.05)
实施例3不同添加量的乳酸菌菌剂在象草青贮中的应用
原料准备、菌种活化、菌粉制备、象草青贮调制等实施步骤参照实施例2,在菌粉的制备中按照实施例2的结果将L.plantarumZRR、L.buchneri BR2的冻干粉按照2:1的比例混合,使乳酸菌菌剂冻干粉的活菌数达到1.2×1010cfu/g。将制备的菌粉分别以0.01‰、0.02‰、0.04‰、0.1‰、0.2‰(即1.2×105、2.4×105、4.8×105、1.2×106、2.4×106cfu/g)的接种量接种到象草中,采用真空包装机真空包装后,置于储藏室进行发酵。
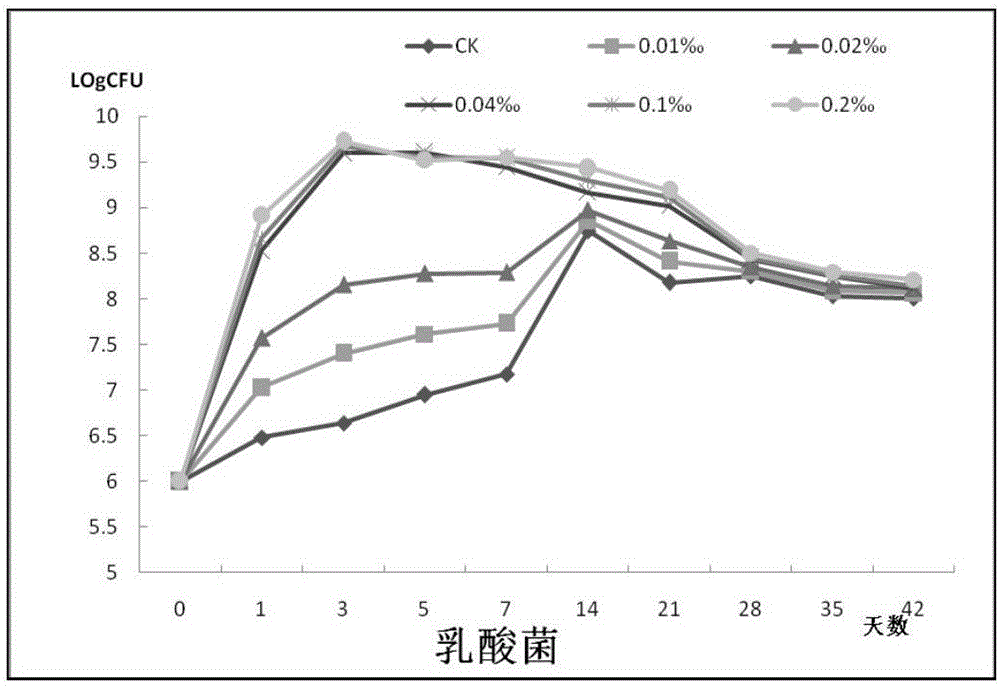
青贮象草的微生物动态变化检测:分别在青贮第0、1、3、5、7、14、21、28、35、42d,取出部分青贮象草,进行pH检测和微生物组成分析。微生物组成分析包括乳酸菌、霉菌、细菌的计数。称取10g青贮饲料,加入90ml灭菌水,充分震荡,再用灭菌水以10倍稀释法对样品进行梯度稀释,分别选取适当的稀释液涂布于MRS培养基、马铃薯葡萄糖琼脂培养基、营养琼脂上,并置于恒温培养箱中培养,分别对乳酸菌、霉菌、好氧细菌进行计数。不同添加量的乳酸菌菌剂青贮象草的微生物动态结果如图1-1、1-2、1-3、1-4所示。
通过图1-1、1-2、1-3、1-4中微生物组成分析可知,添加乳酸菌的青贮象草和对照组相比,pH显著下降,乳酸菌数量显著增加,细菌和霉菌的生长菌完全被抑制。与高添加量的0.04‰、0.1‰、0.2‰(即1.2×105、2.4×105、4.8×105、1.2×106、2.4×106cfu/g)相比,0.02‰的(即2.4×105cfu/g)低添加量,乳酸菌菌剂即可在象草青贮体系中成为优势乳酸菌,酸化青贮饲料,抑制青贮饲料中的细菌、霉菌 的生长。
实施例4乳酸菌菌剂在黑麦草青贮中的应用。
原料准备、菌种活化、菌粉制备、黑麦草青贮调制等实施步骤参照实施例2,在黑麦草青贮调制中设置四个试验组,分别是对照组,商品菌剂,植物乳杆菌ZRR,乳酸菌菌剂,商品菌剂是从市场上购买,用于牧草、玉米等秸秆青贮,产品标示为乳酸菌。三种菌剂的添加量为实施例3中的试验结果——0.02‰(即2.4×105cfu/g)。分别在青贮第0、1、3、5、7、14、21、28、35、42d,取出部分青贮黑麦草,进行pH检测和微生物组成分析。微生物的检测方法参照实施例3。另外在42d发酵成熟后,取青贮样品进行品质分析。青贮样品加入90ml灭菌水,充分震荡,取适量液体进行有机酸和氨态氮的测定,并取适量青贮饲料置于65℃烘箱中风干至恒重,测定其干物质量。同时测定青贮黑麦草有氧暴露后,不同菌剂的微生物动态变化。不同菌剂青贮黑麦草的pH及微生物动态变化如图2-1、2-2、2-3、2-4所示。不同菌剂青贮黑麦草有氧暴露后的的微生物动态变化如图3-1、3-2所示。
图2-1、2-2、2-3、2-4为不同菌剂青贮黑麦草青贮时及有氧暴露后的微生物动态变化,分别为对照组、商品菌剂,植物乳杆菌ZRR和乳酸菌菌剂组。商品菌剂,植物乳杆菌ZRR和乳酸菌菌剂组均能快速产酸,迅速降低pH,抑制细菌及霉菌生长,但商品菌剂在青贮后期乳酸菌呈减少趋势,乳酸菌菌剂的处理组中乳酸菌能稳定存活。表4是添加不同菌剂对黑麦草青贮品质的影响。与对照组相比,商品菌剂,植物乳杆菌ZRR和乳酸菌菌剂均能显著提高青贮饲料的乳酸含量,显著降低氨态氮和乙醇、丙酸、丁酸等有机酸的含量,其中植物乳杆菌ZRR和乳酸菌菌剂组的乳酸含量均高于商品菌剂组。同时乳酸菌菌剂组的乙酸含量最高,显著高于商品菌剂,植物乳杆菌ZRR组。图3-1、3-2为不同菌剂青贮黑麦草有氧暴露后的的微生物动态变化。在有氧暴露后,由于乳酸菌菌剂组产乙酸及大量乳酸菌的存在,能有效抑制霉菌、酵母的生长,提高有氧稳定性。
表4添加不同菌剂对黑麦草青贮品质的影响(%/干物质)
注:同列数据上标不同字母表示差异显著(P<0.05)
因此,通过图2-1、2-2、2-3、2-4、图3-1、3-2与表4的结果表明,与对照组、商品菌剂,植物乳杆菌ZRR相比,通过在青贮原料中添加本发明所述的乳酸菌菌剂,能有效提高所得青贮饲料中乳酸的总含量,降低氨态氮、丙酸、丁酸的含量,从而有利于改善青贮饲料的适口性,提高营养价值;显著降低乙醇的含量,提高乙酸含量,抑制青贮饲料中霉菌、酵母等真菌的生长,提高其有氧稳定性,从而有利于延长青贮饲料的保存期限,取得了意料不到的技术效果。
<110> OrganizationName : 江苏省农业科学院
Application Project
-------------------
<120> Title : 一种适用于牧草青贮的乳酸菌菌剂及其应用
<130> AppFileReference :
<140> CurrentAppNumber :
<141> CurrentFilingDate : ____-__-__
Sequence
--------
<213> OrganismName : Lactobacillus plantarum
<400> PreSequenceString :
tggcgtggga ccgagtctac atgcagtcga acgaactctg gtattgattg gtgcttgcat 60
catgatttac atttgagtga gtggcgaact ggtgagtaac acgtgggaaa cctgcccaga 120
agcgggggat aacacctgga aacagatgct aataccgcat aacaacttgg accgcatggt 180
ccgagcttga aagatggctt cggctatcac ttttggatgg tcccgcggcg tattagctag 240
atggtggggt aacggctcac catggcaatg atacgtagcc gacctgagag ggtaatcggc 300
cacattggga ctgagacacg gcccaaactc ctacgggagg cagcagtagg gaatcttcca 360
caatggacga aagtctgatg gagcaacgcc gcgtgagtga agaagggttt cggctcgtaa 420
aactctgttg ttaaagaaga acatatctga gagtaactgt tcaggtattg acggtattta 480
accagaaagc cacggctaac tacgtgccag cagccgcggt aatacgtagg tggcaagcgt 540
tgtccggatt tattgggcgt aaagcgagcg caggcggttt tttaagtctg atgtgaaagc 600
cttcggctca accgaagaag tgcatcggaa actgggaaac ttgagtgcag aagaggacag 660
tggaactcca tgtgtagcgg tgaaatgcgt agatatatgg aagaacacca gtggcgaagg 720
cggctgtctg gtctgtaact gacgctgagg ctcgaaagta tgggtagcaa acaggattag 780
ataccctggt agtccatacc gtaaacgatg aatgctaagt gttggagggt ttccgccctt 840
cagtgctgca gctaacgcat taagcattcc gcctggggag tacggccgca aggctgaaac 900
tcaaaggaat tgacgggggc ccgcacaagc ggtggagcat gtggtttaat tcgaagctac 960
gcgaagaacc ttaccaggtc ttgacatact atgcaaatct aagagattag acgttccctt 1020
cggggacatg gatacaggtg gtgcatggtt gtcgtcagct cgtgtcgtga gatgttgggt 1080
taagtcccgc aacgagcgca acccttatta tcagttgcca gcattaagtt gggcactctg 1140
gtgagactgc cggtgacaaa ccggaggaag gtggggatga cgtcaaatca tcatgcccct 1200
tatgacctgg gctacacacg tgctacaatg gatggtacaa cgagttgcga actcgcgaga 1260
gtaagctaat ctcttaaagc cattctcagt tcggattgta ggctgcaact cgcctacatg 1320
aagtcggaat cgctagtaat cgcggatcag catgccgcgg tgaatacgtt cccgggcctt 1380
gtacacaccg cccgtcacac catgagagtt tgtaacaccc aaagtcggtg gggtaacctt 1440
ctaggaactc agccgctaga gtgtaacaga agtccggg 1478
<212> Type : DNA
<211> Length : 1478
SequenceName : 1
SequenceDescription :
Sequence
--------
<213> OrganismName : Lactobacillus buchneri
<400> PreSequenceString :
cttgcacttg aaagatttaa cattgagacg agtggcgaac tggtgagtaa cacgtgggta 60
acctgccctt gaagtagggg ataacacttg gaaacaggtg ctaataccgt ataacaacca 120
aaaccacctg gttttggttt aaaagacggc ttcggctgtc actttaggat ggacccgcgg 180
cgtattagct tgttggtaag gtaacggcct accaaggcga tgatacgtag ccgacctgag 240
agggtaatcg gccacattgg gactgagaca cggcccaaac tcctacggga ggcagcagta 300
gggaatcttc cacaatggac gaaagtctga tggagcaacg ccgcgtgagt gatgaagggt 360
ttcggctcgt aaaactctgt tgttggagaa gaacaggtgt cagagtaact gttgacatct 420
tgacggtatc caaccagaaa gccacggcta actacgtgcc agcagccgcg gtaatacgta 480
ggtggcaagc gttgtccgga tttattgggc gtaaagcgag cgcaggcggt tttttaggtc 540
tgatgtgaaa gccttcggct taaccggaga agtgcatcgg aaaccgggag acttgagtgc 600
agaagaggac agtggaactc catgtgtagc ggtgaaatgc gtagatatat ggaagaacac 660
cagtggcgaa ggcggctgtc tggtctgtaa ctgacgctga ggctcgaaag catgggtagc 720
gaacaggatt agataccctg gtagtccatg ccgtaaacga tgagtgctaa gtgttggagg 780
gtttccgccc ttcagtgctg cagctaacgc attaagcact ccgcctgggg agtacgaccg 840
caaggttgaa actcaaagga attgacgggg gcccgcacaa gcggtggagc atgtggttta 900
attcgatgct acgcgaagaa ccttaccagg tcttgacatc ttctgccaac ctaagagatt 960
aggcgttccc ttcggggaca gaatgacagg tggtgcatgg ttgtcgtcag ctcgtgtcgt 1020
gagatgttgg gttaagtccc gcaacgagcg caacccttat tgttagttgc cagcattcag 1080
ttgggcactc tagcaagact gccggtgaca aaccggagga aggtggggat gacgtcaaat 1140
catcatgccc cttatgacct gggctacaca cgtgctacaa tggacggtac aacgagtcgc 1200
gaaaccgcga ggtcaagcta atctcttaaa gccgttctca gttcggattg taggctgcaa 1260
ctcgcctaca tgaagttgga atcgctagta atcgtggatc agcatgccac ggtgaatacg 1320
ttcccgggcc ttgtacacac cgcccgtcac a 1351
<212> Type : DNA
<211> Length : 1351
SequenceName : 2
SequenceDescription :