本发明属于生物医药技术领域,涉及鹿茸多肽在促肾上皮细胞增殖中的应用。
背景技术:
鹿茸——归肝、肾经,补肾阳、益精血、强筋骨。属于传统中药之一。中华人民共和国药典(2005年版一部)将鹿茸功能与主治叙述为:壮肾阳,益精血,强筋骨,调冲任,托疮毒。用于阳痿滑精,冷宫不孕,赢瘦,神疲,畏寒,眩晕耳鸣耳聋,腰膝冷痛,筋骨冷软,崩漏带下,阴疽不敛。
鹿茸是隶属于脊索动物门哺乳纲鹿科的动物,它是梅花鹿或马鹿的雄鹿未骨化并且密生绒毛的幼角。鹿茸史载于《神农本草经》,指出:“鹿茸专入命门、督,兼入肝。甘咸气温,禀纯阳之质,含发生之气”,属中品。李时珍曰:“龟、鹿皆灵而有寿。鹿鼻常反向尾,能通督脉,故取其角,以补命、补精、补气,皆以养阳也。乃物理之玄微,神工之能事”。而且,现代药理研究亦表明,鹿茸有抗炎作用,可抑制和清除自由基,延缓衰老,促进创伤愈合等作用,鹿茸中提取的鹿茸多肽能够促进体外软骨细胞、成骨细胞的增殖和分化,抑制软骨细胞调亡,同时,文献研究也提示,以鹿茸等为代表的归肝、肾经药物在治疗“痹症”的方剂中使用频率占到39.3%。
鹿茸中含有比较复杂的化学成分,氨基酸的种类有19种以上,其中包括人体自身不能合成的必需氨基酸,10种磷脂成分,9种脂肪酸(生物活性最强的油酸、亚油酸、亚麻酸含量较高)、糖脂、糖,固醇类、激素样物质、前列腺素、脑素、核糖核酸、去氧核糖核酸、三磷酸腺苷、硫酸软骨素、多胺、肽类、脂蛋白、维生素、酶类及各种微量元素等。
本发明所用鹿茸多肽为利用离子交换层析、凝胶过滤层析及反相高效液相色谱层析等生物化学技术,从梅花鹿茸中分离得到的1个新多肽,SDS-PAGE电泳显示为一条带,HPLC图谱为单一峰,MALDI-TOF MS给出该多肽的精确分子量为3263.4,其等电点pI=8.15.一级结构研究表明,该多肽是由32个氨基酸残基组成的直链多肽,不含半胱氨酸,富含缬氨酸、赖氨酸、亮氨酸和甘氨酸。(张郑瑶等."梅花鹿茸多肽的化学结构及生物活性."高等学校化学学报33.9(2012):2000-2004.)
肾损伤有以下特点;①合并伤多见,特别是肝、脾、胃肠道及胸部;②伤情重、休克发生率高;③多有血尿、腰痛、腹部包块等症状;④并发症多且较严重,如尿外渗、感染、高血压或肾功能不全等。肾损伤患者经常出现.血尿、休克等症状。表现有创伤性休克和出血性休克,甚至危及生命。而且大多数患者表现为疼痛及腹部包块,有时还可因输尿管血块阻塞引起肾绞痛。当肾周围血肿和尿外渗形成时,局部发生肿胀而形成肿块。高热及伤口流血也是肾损伤并发的症状。肾损伤后并发症分为早期和晚期两类。所谓早期并发症是指损伤后6周之内所发生的那些威胁病人生命,或者使损伤的肾脏丧失的情况,如继发性出血、尿外渗、肾周围脓肿、急性肾小管坏死、尿瘘等。晚期并发症包括高血压、肾积水、结石、慢性肾盂肾炎、慢性肾功衰竭、动静脉瘘等。这两类并发症大都发生于严重肾损伤之后,个别例外。高血压是晚期并发症中最常见者,发病率为0.7%~33%。主要原因是由于肾缺血引起肾素-血管紧张素系统活性增加,如肾蒂周围血肿、肾周围血肿、肾被膜下血肿机化、肾实质广泛瘢痕形成、肾内假性动脉瘤等对肾实质压迫造成供血不足,导致近球细胞及颗粒斑分泌肾素增多而继发肾素性高血压。肾损伤分为闭合性损伤和开放性损伤两种类型,主要由闭合性肾损伤及开放性肾损伤引起。肾损伤严重危机人的生命,因而,寻找到能够治疗肾损伤的药物,受到广泛的关注。本次实验所用鹿茸多肽,可以通过促进肾细胞的增殖来促进肾损伤修复,对临床治疗肾损伤具有借鉴意义。
技术实现要素:
为克服现有技术中存在的问题,本发明提供了一种鹿茸多肽在促肾上皮细胞增殖中的应用。
本发明的技术方案为:
一种鹿茸多肽的氨基酸序列,其序列
VLSATDKTNVLAAWGKVGGNAPAFGAEALERM。
上述的鹿茸多肽在促肾上皮细胞增殖中的应用,包括如下步骤:
第一步,细胞培养;培养细胞为肾上皮细胞,使用高糖型培养基,在37℃、5%CO2培养箱中进行培养。
第二步,细胞消化;取处于对数生长期的肾上皮细胞,进行常规消化,得到单细胞悬液。
第三步,离心;将单细胞悬液放入离心管中进行离心;吸去上清液,加入培养基吹打细胞,使细胞分散均匀。
第四步,细胞计数;调节细胞个数为5×104~10×104/ml。
第五步,种板;将分散均匀的细胞接种于孔板;孔板每列设置3~6个复孔;在37℃,5%CO2培养箱中培养。
第六步,加入该氨基酸序列的鹿茸多肽;当肾上皮细胞处于对数生长期时,向孔板中加入0~500ug/ml的鹿茸多肽;在37℃,5%CO2培养箱中培养24~48h。
第七步:采用MTT法检测细胞增值情况。
上述的肾上皮细胞为转染腺病毒基因的人肾上皮细胞派生得到。
上述的培养基为DMEM培养基。
上述第五步在接种细胞的周围孔中加入含有双抗的PBS溶液。
本发明的有益效果为,具有该种氨基酸结构的鹿茸多肽具有促进293T细胞增值的作用,在浓度为500ug/ml,作用时间为48h时效果最为显著,有助于促进肾损伤修复。
附图说明
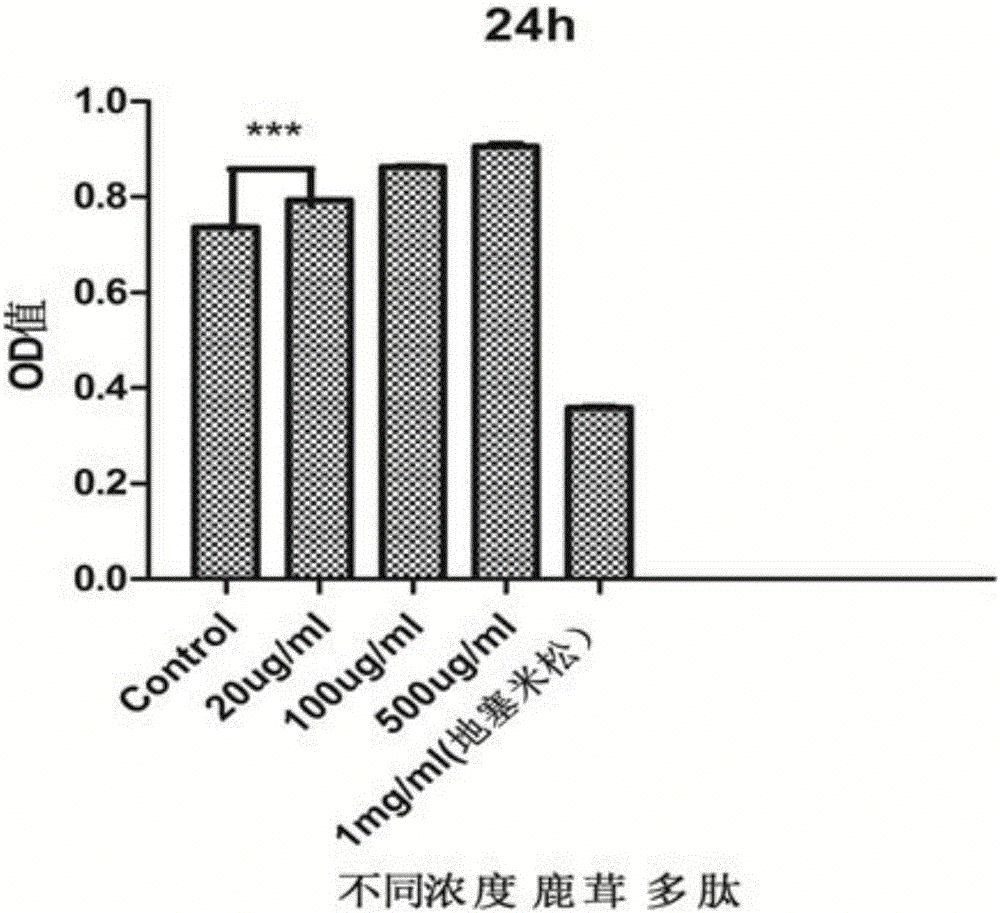
图1表示不同浓度鹿茸多肽作用于293T细胞24h后,通过MTT法检测细胞增值的实验结果。
图2表示不同浓度鹿茸多肽作用于293T细胞48h后,通过MTT法检测细胞增值的实验结果。
具体实施方式
下面结合附图和具体实施例,进一步阐述本发明。
实施例1
通过MTT法检测不同浓度鹿茸多肽作用于细胞24h后,对细胞增值的影响。
第一步:细胞培养。细胞培养使用高糖型DMEM培养基,血清含量为10%,使用75cm2细胞培养瓶,在37℃、5%CO2培养箱中进行培养。
第二步:细胞消化。取处于对数生长期的生长状况良好的肾上皮细胞(293T),常规消化。消化时,先加入4ml PBS对肾上皮细胞(293T)进行清洗,清洗两次,洗去残留的培养基,防止残留培养基与胰酶发生中和作用。然后加入4ml胰酶,放入37℃、5%CO2培养箱中消化1min。细胞皱缩时加入等量培养基终止消化。用一次性无菌塑料管吹打细胞瓶壁,将细胞从细胞培养瓶壁上吹打下来,制成单细胞悬液。
第三步:离心。将单细胞悬液放入离心管中进行离心,1000rpm/min离心5分钟。吸去上清液,加入培养基吹打细胞,使细胞分散均匀。
第四步:细胞计数。使用细胞计数板计数,调节细胞个数为10×104/ml(每孔加100ul,相当于每孔10000个细胞)。
第五步:种板。将分散均匀的细胞接种于96孔板,每孔加100ul,肾上皮细胞(293T)每列加5个孔,共需2.5ml,考虑到种板过程中细胞液的损失,需要配置3ml。四周孔中加入200ul含有双抗的无菌PBS。在第二列至第六列加入肾上皮细胞(293T),每列设置5个复孔。37℃CO2培养箱中培养24小时。
操作过程中需要注意的是:1.每次加入细胞都使枪头贴着孔壁(最好相同位置),缓慢加入100ul细胞悬液。2.孔加入顺序:可从上到下,从右到左依次加入。3.为了保证细胞密度均匀,最好每加1列细胞混匀一下细胞悬液,避免因重力沉降导致细胞密度不均。4.每块96孔板加完细胞后,静置30min,使细胞贴壁。
第六步:加入鹿茸多肽。向孔板中分别加入不同浓度的鹿茸多肽、地塞米松及DMEM培养基。第二列至第四列中鹿茸多肽浓度分别为20ug/ml、100ug/ml、500ug/ml,第五列加入1mg/ml地塞米松,第六列加入等量的培养基。37℃CO2培养箱中培养24h。
第七步:MTT法检测细胞增值情况。24h后取出孔板,每孔加入20ulMTT溶液(MTT溶液现用现配,也可以一次性配好后放于-20℃冰箱中长期冻存),继续孵育4h后终止。快速、轻轻翻转培养板,弃上清,注意不能把结晶移走。每孔加入150ul DMSO,震荡10分钟,使MTT蓝紫色结晶逐渐溶解。用酶标仪检测490nm处各孔OD值(吸光值),求每列平均值,只加入培养基孔的OD值为对照。最后,以时间为横轴,以OD值为纵轴绘制柱状图。此实验重复三次。
所得结果如图1所示,24h后实验组与对照组相比,实验组OD值明显大于对照组,呈现差异显著性,说明鹿茸多肽作用24h后显著促进细胞增值。
实施例2
通过MTT法检测不同浓度鹿茸多肽作用于细胞48h后,对细胞增值的影响。
第一步:细胞培养。细胞培养使用高糖型DMEM培养基,血清含量为10%,使用75cm2细胞培养瓶,在37℃、5%CO2培养箱中进行培养。
第二步:细胞消化。取处于对数生长期的生长状况良好的肾上皮细胞(293T),常规消化。消化时,先加入4ml PBS对肾上皮细胞(293T)进行清洗,清洗两次,洗去残留的培养基,防止残留培养基与胰酶发生中和作用。然后加入4ml胰酶,放入37℃、5%CO2培养箱中消化1min。细胞皱缩时加入等量培养基终止消化。用一次性无菌塑料管吹打细胞瓶壁,将细胞从细胞培养瓶壁上吹打下来,制成单细胞悬液。
第三步:离心。将单细胞悬液放入离心管中进行离心,1000rpm/min离心5分钟。吸去上清液,加入培养基吹打细胞,使细胞分散均匀。
第四步:细胞计数。使用细胞计数板计数,调节细胞个数为10×104/ml(每孔加100ul,相当于每孔10000个细胞)。
第五步:种板。将分散均匀的细胞接种于96孔板,每孔加100ul,肾上皮细胞(293T)每列加5个孔,共需2.5ml,考虑到种板过程中细胞液的损失,需要配置3ml。四周孔中加入200ul含有双抗的无菌PBS。在第二列至第六列加入肾上皮细胞(293T),每列设置5个复孔。37℃CO2培养箱中培养24小时。
操作过程中需要注意的是:1.每次加入细胞都使枪头贴着孔壁(最好相同位置),缓慢加入100ul细胞悬液。2.孔加入顺序:可从上到下,从右到左依次加入。3.为了保证细胞密度均匀,最好每加1列细胞混匀一下细胞悬液,避免因重力沉降导致细胞密度不均。4.每块96孔板加完细胞后,静置30min,使细胞贴壁。
第六步:加入鹿茸多肽。向孔板中分别加入不同浓度的鹿茸多肽、地塞米松及DMEM培养基。第二列至第四列中鹿茸多肽浓度分别为20ug/ml、100ug/ml、500ug/ml,第五列加入1mg/ml地塞米松,第六列加入等量的培养基。37℃CO2培养箱中培养48h。
第七步:MTT法检测细胞增值情况。48h后取出孔板,每孔加入20ulMTT溶液(MTT溶液现用现配,也可以一次性配好后放于-20℃冰箱中长期冻存),继续孵育4h后终止。快速、轻轻翻转培养板,弃上清,注意不能把结晶移走。每孔加入150ul DMSO,震荡10分钟,使MTT蓝紫色结晶逐渐溶解。用酶标仪检测490nm处各孔OD值(吸光值),求每列平均值,只加入培养基孔的OD值为对照。最后,以时间为横轴,以OD值为纵轴绘制柱状图。此实验重复三次。
所得结果如图2所示,48h后实验组与对照组相比,OD值具有明显的差别,说明鹿茸多肽作用48h后可以明显促进细胞增值,并且鹿茸多肽浓度为500ug/ml时促增值作用最为显著。
鹿茸多肽的氨基酸序列为:
VLSATDKTNVLAAWGKVGGNAPAFGAEALERM