一株蒂莫内马赛菌新菌株及其用途的制作方法
本发明涉及一株蒂莫内马赛菌新菌株,还涉及该蒂莫内马赛菌新菌株在石油污染生物修复中的用途,属于生物技术领域。
背景技术:
石油属于可燃性矿物质,是地球在形成的不同历史时期,由植物或动物等有机物残骸生成的。烷烃是组成石油的主要成分,随相对分子质量的增加,烷烃分别以气、液、固三态存在于石油中。芳香烃占石油含量的2-4%,有单环类(如苯、甲苯、二甲苯),还含有双环(主要是萘)、三环芳烃(如菲)和三环以上多环烃。
石油对生物的毒性可分为两类,一类是大量石油造成的急性中毒;另一类是长期低浓度石油的毒性效应。一般轻质油的炼制油品毒性比原油大,石油及石油产品的毒性与其中含有的可溶性芳烃衍生物(苯、萘、菲等)的含量成正比关系。石油在水体中的毒性效应大多来自水溶性大的相对分子质量低的正烷烃和单环芳烃。其中芳烃对生物的毒性最大。
目前在石油污染的治理中,采取的技术有物理、化学和生物方法,其中物理方法是对石油烃进行稀释、聚集或将其迁移到其他环境中,而化学方法很难将石油烃彻底降解,且化学方法会造成二次污染。相比之下,生物修复具有安全、经济性强、应用范围广、去除效率高和无明显的二次污染等显著优点。
许多研究表明,生物表面活性剂在石油降解中有很好的促进作用。不同微生物往往产生不同结构的表面活性剂,主要有糖脂、脂肽、多糖-蛋白络合物、磷脂、脂肪酸和中性脂等。生物表面活性剂一方面可以增加非水溶性物质的表面积,,提高碳氢化合物的溶解度从而利于生物利用;另一方面表面活性剂可以产生大量的生物乳化剂从而有助于生物降解过程。这都可以大大的提高可降解石油细菌的生长能力并提高这些细菌对石油烃的利用。同时发现细菌生长代谢可引起的石油-水体系表面张力的减少,表面张力的减小可以增加石油在水中的溶解性以及分散性能,从而增加了石油-水的接触面面积与离散程度以及细菌与石油的接触面积,对细菌的石油降解有促进作用。而温度、pH与石油的降解密切相关,因为它可直接影响微生物的生长和活性。
因此本课题组通过在湘江挖沙船区域底泥筛选菌种,以期得到具有良好的产生物表面活性剂能力、乳化活性、降低液体表面张力能力且石油降解率更高的新菌株,为降解石油污染物修复环境提供更高效更多的菌株来源。
技术实现要素:
本发明的目的是提供一种具有良好的表面活性剂能力、乳化活性、降低液体表面张力能力且具有石油降解能力的新菌株J42。
本发明的另一个目的是提出所述的蒂莫内马赛菌属的新菌株在修复污染环境中的应用。
为实现上述发明的目的,本发明采取的技术方案如下:
一种具有良好的产生物表面活性剂能力、乳化活性、且具有石油降解能力的新菌株,所述新菌株名称为:J42;
所述J42菌系从湘江挖沙船区域底泥分离,筛选,纯化和培育出来,经形态学和分子生物学鉴定,确定该菌株为蒂莫内马赛菌属,与Massiliatimonae strain UR/MT95同源性96%。
所述B11菌主要形态学特征为:橙黄色,圆形凸起,边缘整齐,湿润。
与现有技术相比,本发明的有益效果主要体现在:从湘江挖沙船区域底泥中分离得到一株罕见的具有石油降解能力的蒂莫内马赛菌-新菌株J42,该菌株不仅具有良好的产生物表面活性剂能力而且具有良好的乳化活性和降低液体表面张力能力。
附图说明
下面参照附图结合实施例对本发明做进一步的描述。
图1为甲苯含量标准曲线;
图2培养液中甲苯含量随时间变化情况;
具体实施方式
下面通过具体实施例,对本发明的技术方案做进一步具体的说明,但是本发明并不限于这些实施例。
实施例1
1)采集湘江挖沙船区底泥作为样品,4℃冰箱保存。称取供试土壤样品30g接入100ml无菌水中,加入10g玻璃珠。放置于180rpm的恒温摇床中,振荡30min。
2)振荡完成后取出三角瓶,于室温下静置20min,取1ml上清液,在无菌条件下进行10倍系列梯度稀释至10-7,分别取10-3、10-5、10-7的三个浓度的稀释菌悬液25μL涂布在事先涂布了甲苯的酵母固体无机盐培养基,置于真空干燥器中室温条件培养24h,待平板表面不再有水滴时倒置平板。
3)根据酵母培养基上菌落长出的时间以及菌落的形态的不同,从培养基平板上挑取单菌落划线至固体无机盐培养基中进一步培养。反复划线培养细菌直至平板长出的单菌落形态完全一致,并且单菌落细菌菌体在显微镜下个体形态也完全一致则可确认为纯培养。
4)挑取已经纯化好的细菌,分别接种到含甲苯的液体无机盐培养基中。培养前期在50ml体系的培养基中需加入500μL浓度为2%(w/v)的酵母粉溶液。传代两次后,不再加酵母粉溶液,得到能以甲苯为唯一碳源的,能在液体培养基中良好生长的目的菌株。
含甲苯的酵母固体无机盐培养基的配制:吸取25μL甲苯转移至酵母固体无机盐培养基上,并用无菌涂布棒将其均匀涂抹在培养基表面。
含酵母的固体无机盐培养基的配制:即在1L体系的固体无机盐培养基中多加入2.0g尿素和1.0g酵母。
固体无机盐培养基配制:向液体无机盐培养基中加入1.5%(W/V)的琼脂。
其中,液体无机盐培养基配方为:碳酸盐缓冲液1000mL、MgSO4·7H2O0.1g、NH4Cl 0.5g、Na2HPO40.5g、CaCl2·6H2O 0.01g、FeSO4.7H2O 0.005g、微量元素1mL;其中,微量元素的配方为:ZnSO4·7H2O 0.44g、CuSO4·5H2O 0.20g、MnSO4·2H2O 0.17g、Na2MoO4·2H2O 0.06g、H3BO30.10g、CoCl2·6H2O 0.08g、用蒸馏水定容至1000mL;碳酸盐缓冲液的配方为:Na2CO30.105g、NaHCO30.756g、用蒸馏水定容至1000mL,pH8.0。
实施例2
本发明的J42菌株形态学及分子生物学研究。
其中,本实施例用的LB培养基配方为:酵母提取物5.0g、蛋白胨10.0g、氯化钠10.0g、琼脂15.0g,pH 7.2-7.4。
将本发明得到的J42菌株接种到LB固体培养基平板上,在30℃条件下倒置培养24h,观察其菌落形态。
所述新菌株形态学特征为:橙黄色,圆形凸起,边缘整齐,表面光滑湿润。
菌种鉴定
取200μL的无菌EP管,向管中加入50μL无菌双蒸水,再取少量本发明得到的J42菌株菌体悬浮于EP管中,最后用移液器反复吸打EP管内液体使菌体充分混匀制成菌悬液。将菌悬液于PCR仪中99℃处理5min得到破壁菌悬液。用细菌16SrRNA通用引物(上游引物27f,下游引物1492r)扩增纯化菌株的16SrRNA。
PCR扩增反应的条件为:94℃预变性5min,进入循环,94℃变性30S,72℃延伸1.5min,72℃延伸10min后保存4℃状态。反应结束后,对PCR扩增产物进行1.0%琼脂糖凝胶电泳检测,结果经扩增获得了大约1600bp的单一条带。从PCR反应物体系中回收PCR扩增条带,送至长沙博尚生物测序。将测序结果于NCBI数据库中比对。选取得分最高的同源序列保存菌株名与碱基序列,用于构建系统发育树。
经过测序,菌株J42的16S rDNA与Massiliatimonae strain UR/MT95同源性高达96%。
综合形态学观察及16S rDNA测序结果,可以确定该新菌株J42为蒂莫内马赛菌。
实施例3
菌株的表面活性剂产生特性研究
本实施例所用的液体培养培养基配方为:碳酸盐缓冲液1000mL、MgSO4·7H2O 0.1g、NH4Cl 0.5g、Na2HPO40.5g、CaCl2·6H2O 0.01g、FeSO4.7H2O0.005g、甲苯5g、微量元素1mL;其中,微量元素的配方为:ZnSO4·7H2O 0.44g、CuSO4·5H2O 0.20g、MnSO4·2H2O0.17g、Na2MoO4·2H2O 0.06g、H3BO30.10g、CoCl2·6H2O 0.08g、用蒸馏水定容至1000mL;碳酸盐缓冲液的配方为:Na2CO30.105g、NaHCO30.756g、用蒸馏水定容至1000mL,pH8.0。
选取石油降解菌新菌株B11,接种到液体培养基中,控制初始接种浓度为1O7cells/mL,恒温空气浴摇床中30℃,180rpm培养5天。五天后吸取细菌培养液进行生物表面活性剂产生能力测试实验。具体步骤为:
向微量滴定板板盖上滴加2μL的原油,并在室温下放置1小时,之后向当中加入5μL的细菌培养液。室温条件下等待1分钟,观察细菌培养液液滴的形状。结果发现细菌培养液呈平铺开状且面积较大。由此可知,此细菌有良好的生产生物表面活性剂的能力。
实施例4
蒂莫内马赛菌J42乳化性
分别考察培养温度、培养基初始pH值和菌浓度三个因素对细菌乳化活性大小的影响。
本实施例所用的液体培养培养基配方为:碳酸盐缓冲液1000mL、MgSO4·7H2O 0.1g、NH4Cl 0.5g、Na2HPO40.5g、CaCl2·6H2O 0.01g、FeSO4.7H2O0.005g、甲苯5g、微量元素1mL;其中,微量元素的配方为:ZnSO4·7H2O 0.44g、CuSO4·5H2O 0.20g、MnSO4·2H2O 0.17g、Na2MoO4·2H2O 0.06g、H3BO30.10g、CoCl2·6H2O 0.08g、用蒸馏水定容至1000mL;碳酸盐缓冲液的配方为:Na2CO30.105g、NaHCO30.756g、用蒸馏水定容至1000mL,pH 8.0。
1)培养温度对细菌乳化活性的影响
接入实施例1获得的初始接种浓度为107cells/ml的菌株J42,在pH值为6以及摇床转速为180rpm,培养温度梯度为25℃、30℃和35℃的条件下液体培养5天。完成细菌培养后振荡混匀细菌培养液,取当中液体进行乳化实验,具体步骤为:
分别向3个洗净烘干的比色皿中各加入1ml的正十六烷,之后再分别加入对应的细菌培养液各1ml。均在室温条件下高速震荡混匀2min并静置10min,分别观察并记录乳化层厚度与液体总厚度,并用它们的比值表示石油降解菌的在不同温度下的乳化活性大小。
结果显示J42菌在培养温度为25℃、30℃和35℃时,其乳化活性分别为0%、47.76%和15.82%,培养温度为30℃时乳化活性效果最好,在偏低温和偏高温条件下细菌乳化活性都受到抑制。
2)培养基初始pH值对细菌乳化活性的影响
接入实施例1获得的初始接种浓度为107cells/ml的菌株J42,在温度30℃以及摇床转速180rpm,培养基初始pH值梯度为6、7、8的条件下液体培养5天。完成细菌培养后振荡混匀细菌培养液,取当中液体进行乳化实验,具体步骤为:
分别向3个洗净烘干的比色皿中各加入1ml的正十六烷和对应的细菌培养液各1ml。高速震荡混匀2min并静置10min,观察并分别记录乳化层厚度与液体总厚度及它们的比值。
结果显示J42菌在pH值为6、7和8时,其乳化活性分别为47.76%、57.48%和50.25%,表面在pH值为7时J42菌乳化效果最好。
3)菌浓度对细菌乳化活性大小的影响
接入实施例1获得的初始接种浓度为107cells/ml的菌株J42,在温度30℃以及摇床转速180rpm的条件下液体培养5天。完成细菌培养后10000rpm条件下离心15min,分离细菌菌体与上清液。以无菌水稀释细菌菌体制备菌悬液,控制细菌稀释后菌浓度为106cells/ml、107cells/ml和108cells/ml,进行乳化实验,具体步骤为:
结果表明J42菌在细菌浓度为106cells/ml、1O7cells/ml和108cells/ml时,其乳化活性分别为0%、10.00%和47.76%,菌浓度越高乳化活性越强。
由此可知,在30℃培养温度、培养基初始pH为7且菌浓越大的情况下,J42菌具有良好的乳化活性。
实施例5
分别考察培养温度和培养基初始pH值对细菌培养液表面张力的影响。
本实施例所用的液体培养培养基配方为:碳酸盐缓冲液1000mL、MgSO4·7H2O 0.1g、NH4Cl 0.5g、Na2HPO40.5g、CaCl2·6H2O 0.01g、FeSO4.7H2O0.005g、甲苯5g、微量元素1mL;其中,微量元素的配方为:ZnSO4·7H2O 0.44g、CuSO4·5H2O 0.20g、MnSO4·2H2O 0.17g、Na2MoO4·2H2O 0.06g、H3BO30.10g、CoCl2·6H2O 0.08g、用蒸馏水定容至1000mL;碳酸盐缓冲液的配方为:Na2CO30.105g、NaHCO30.756g、用蒸馏水定容至1000mL,pH8.0。
细菌表面张力实验开始前,先用全自动表/界面张力仪测定实验材料的表面张力,具体步骤为:
先打开仪器电源开关和测定仪防风门,用镊子取下白金板挂钩于酒精灯外焰上烧去白金板上面的杂质,最后将白金板挂回仪器挂钩上。再用去离子水洗干净培养皿,烘干后倒入液体培养基使液面高度为3-7mm,放置于白金板正下方平台上。接着关上防风门,待白金板挂钩稳定不动后按下去皮键,数据显示屏显示数值稳定后再按下“向上”,等待出现实验结果。读出实验结果后按“向下”,等白金板脱离液体后按“停止”结束实验。重复测量3次,取平均值作为液体培养基的表面张力。
实验结果表明培养基在加入甲苯前,表面张力为72.16mN/m。
1)培养温度对细菌乳化活性大小的影响
接入实施例1获得的初始接种浓度为107cells/ml的菌株J42,在pH值为6以及摇床转速为180rpm,培养温度梯度为25℃、30℃和35℃的条件下液体培养5天。完成细菌培养后,10000rpm条件下离心15min,分离细菌菌体与上清液。收集离心后上清液用于表面张力测定。
实验结果显示J42菌在培养温度为25℃、30℃和35℃时,培养五天后培养液的表面张力分别为34.86mN/m、53.35mN/m和46.71mN/m。结果表明培养温度为25℃时对降低液体表面张力有明显作用。
2)培养基不同初始pH值条件下细菌培养液的表面张力
接入实施例1获得的初始接种浓度为107cells/ml的菌株J42,在温度30℃以及摇床转速180rpm,培养基初始pH值梯度为6、7、8的条件下液体培养5天。完成细菌培养后,10000rpm条件下离心15min,分离细菌菌体与上清液。收集离心后上清液,用于表面张力测定。
实验结果显示J42菌在培养基初始pH值为6、7和8时,培养五天后培养液的表面张力分别为53.35mN/m、54.18mN/m和54.39mN/m。表面J42菌具有一定的降低表面张力的能力。
由此可知J42菌株在25℃及特定条件下具有明显的降低液体表面张力的作用。
实施例6
新菌株J42对甲苯单体的降解应用
本实施例用的LB培养基配方为:酵母提取物5.0g、蛋白胨10.0g、氯化钠10.0g、琼脂15.0g,pH 7.2-7.4。
本实施例所用的液体培养培养基配方为:碳酸盐缓冲液1000mL、MgSO4·7H2O 0.1g、NH4Cl 0.5g、Na2HPO40.5g、CaCl2·6H2O 0.01g、FeSO4.7H2O0.005g、甲苯5g、微量元素1mL;其中,微量元素的配方为:ZnSO4·7H2O 0.44g、CuSO4·5H2O 0.20g、MnSO4·2H2O0.17g、Na2MoO4·2H2O 0.06g、H3BO30.10g、CoCl2·6H2O 0.08g、用蒸馏水定容至1000mL;碳酸盐缓冲液的配方为:Na2CO30.105g、NaHCO30.756g、用蒸馏水定容至1000mL,pH 8.0。
取一定量分析纯的甲苯试剂,溶解于分析纯甲醇中,分别配制成浓度为10,20,30,40,50,60μg/ml的甲苯的标准溶液,用0.45μm孔径的微孔滤膜过滤后用于实验。用高效液相色谱法进行甲苯标准曲线的测定。
实验结果显示甲苯在C18的液相色谱柱中的保留时间为9.18min。以峰面积为纵坐标、苯浓度为横坐标,甲苯的标准曲线如图1所示,得到甲苯标准方程为:y=-8.388+2.717x。
将上述甲苯单体驯化保存的J42单菌落接种到LB培养基中活化48h后得到富集菌液,用来进行甲苯单体的降解实验。
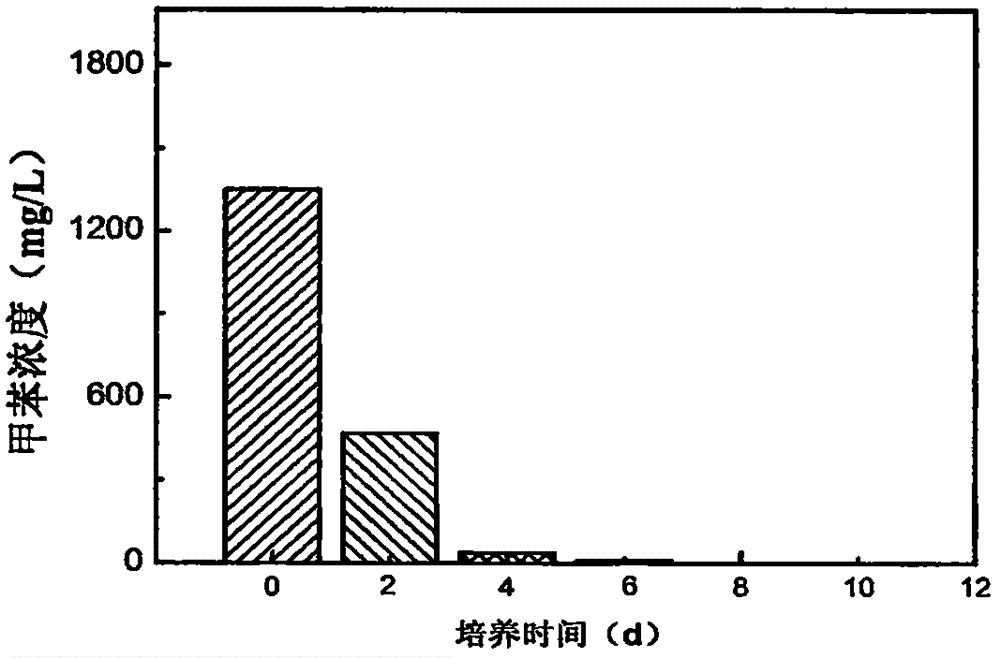
实验中由于甲苯有一定的挥发性,所以样品需取样后立即分析,而且一旦打开铝盖就不能再度将培养瓶放回摇床中继续培养。所以实验时J42菌设置五个重复,其培养条件均为:初始接种浓度107cells/ml,温度30℃,pH值为6,摇床转速180rpm。培养第2、4、6、8、10天时各打开一个瓶子进行高效液相色谱,检测当中甲苯的含量。同时在设置1个空白试验,即培养条件与上述培养一致,唯独不接种细菌。在摇床中放置1、10天时,检测当中甲苯含量。
图2中第0天时的数据来自于空白对照第1天时的甲苯含量。由图2知J42菌处理甲苯水溶液时,在第8天时水中检测不出甲苯含量。图中显示降解甲苯的速率先快后慢,可能原因为随着细菌的生长代谢细菌产生的生物表面活性剂越来越多、乳化活性也越来越强,导致甲苯在水溶液的溶解度加大,而随着甲苯含量的降低,挥发的气体甲苯也开始重新回到溶液当中,从而被B11细菌降解掉。实验结果表明J42菌对溶液中甲苯的降解达到100%。
实施例7
本发明实施例还提供了上述新菌株对石油废水中COD的降解应用,如下:
将上述甲苯单体驯化的J42菌以107cells/ml的接种量接种到100ml 10%原油无机盐培养基中,温度30℃,摇床转速180rpm的条件下培养7天。
所述10%原油无机盐培养基:即在900ml体系的无机盐培养基中加入100ml原油。
所述无机盐培养基包括:碳酸盐缓冲液1000mL、MgSO4·7H2O 0.1g、NH4Cl 0.5g、Na2HPO40.5g、CaCl2·6H2O 0.01g、FeSO4.7H2O 0.005g、微量元素1mL。
所述碳酸盐缓冲液包括:Na2CO30.105g、NaHCO30.756g、pH8.0与蒸馏水1000mL。
所述微量元素包括:ZnSO4·7H2O 0.44g、CuSO4·5H2O 0.20g、MnSO4·2H2O0.17g、Na2MoO4·2H2O 0.06g、H3BO30.10g、CoCl2·6H2O 0.08g、蒸馏水1000mL。
每隔一天从各瓶吸取1.5ml菌悬液于1.5ml的EP管中12000rpm离心吸取上清液1ml于10ml比色管中,分别加入9ml蒸馏水稀释。先称取0.12g HgSO4于消解管,加入50ul H2SO4和450ul H2O震荡至消解。加入6ml H2SO4与Ag2SO4混合溶液,再加入1ml K2CrO4溶液,加入3ml样品(空白管加入3ml蒸馏水)混匀,置于消解仪165℃消解15分钟。再在消解仪中冷却2分钟取出继续冷却后,加入3ml H2O,混匀,至沉淀(管内溶液无明显漂浮颗粒)测量COD值。比色皿润洗晾干后加入空白管中溶液,COD测量仪显示屏点击空白键,再点击测量键,此时COD值显示为0。依次加入各样品于比色皿中测量COD值。
测定结果表明实验J42菌在处理炼油废水时在第七天COD值由6030mg/L降低到3290mg/L,COD去除率在第七天接近50%,并且COD降解率有进一步提高可能。
通过以上实例,表明新菌株J42具有良好的产生物表面活性剂能力、乳化活性、降低液体表面张力能力且石油降解率高。
- 还没有人留言评论。精彩留言会获得点赞!