抗肿瘤化合物、其制备方法及其用途与流程
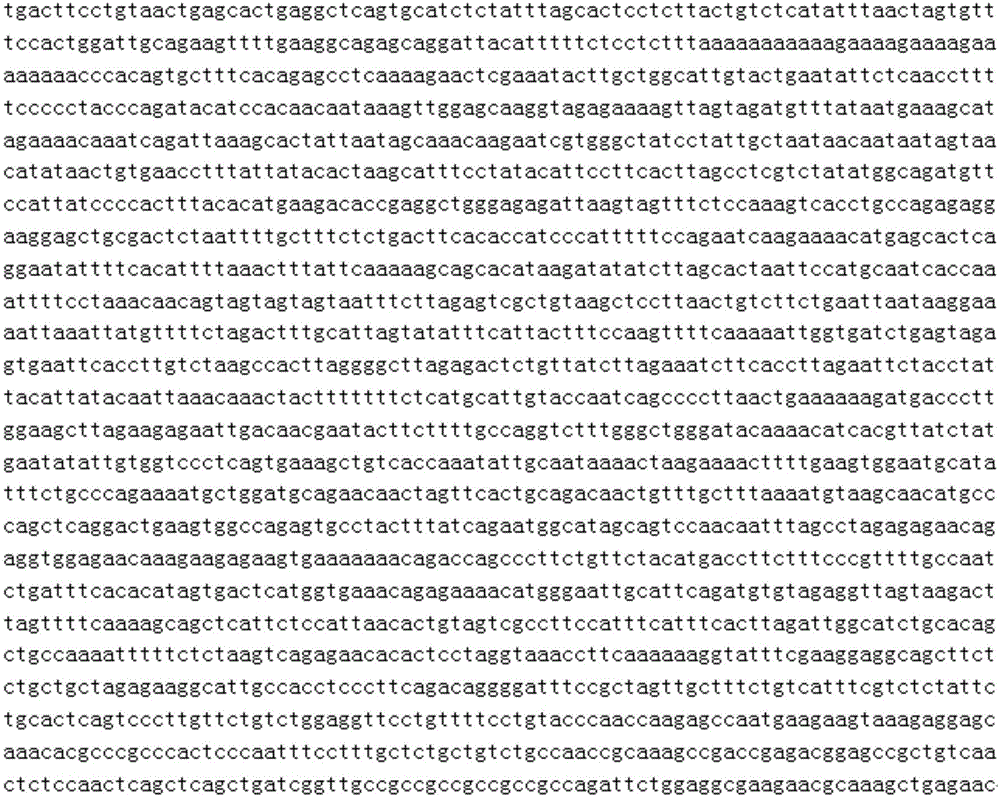
本发明涉及抗肿瘤化合物,通过激活JWA基因表达来实现抗肿瘤作用,同时还涉及相应的制备方法及用途,属于抗肿瘤药物技术领域。
背景技术:
癌症是世界范围内导致人类死亡的第二大病因,其中90%以上癌症患者死于肿瘤转移。虽然癌症早期诊断和综合治疗已取得显著进展,但迄今还没有专门防治癌症转移的有效手段。癌症转移是导致患者生存率低的根本原因,它是多步骤和多分子参与的复杂过程,包括单个肿瘤细胞从原发部位脱落,穿过基底膜及细胞外基质,游走于脉管系统定植在远处器官形成微转移,并持续增殖,最终发展为临床可检测到的转移灶。癌细胞与机体环境相互适应是癌症得以转移的必要条件,肿瘤的异质性和个体差异是导致其难治的根本原因,这一过程受到相关分子构成的信号网络调控。因此,寻找调节肿瘤细胞中信号网络的关键节点分子并实施干预是有效抑制癌症转移的良策。
JWA基因,又名ARL6IP5(GenBank AF070523,1998)是本专利发明人周建伟等发现和克隆并长期聚焦研究的新的环境应答基因,其编码蛋白是细胞骨架结合蛋白。JWA具有活跃的生物学功能,正常组织细胞内一般均有JWA基因的适度表达,当环境理化因素作用于细胞时,JWA基因快速应答,增加表达,发挥抑制氧化应激、修复DNA损伤等作用(Nucleic Acids Res 2009,37(6):1936-1950;Free Radic Biol Med 2007,42(11):1704-1714)。JWA基因通过调节多个下游节点分子,可抑制肿瘤细胞的增殖、凋亡和转移。研究已证实JWA可通过MAPK-FAK通路调节TPA和As2O3对肿瘤细胞迁移的作用(Cell Signal 2007,19(6):1315-1327);JWA通过Sp1阻断其下游integrinαVβ3-ILK和MMP2信号通路,抑制黑色素瘤和胃癌细胞的体内转移和血管生成(Carcinogenesis 2014,35(2):442-451);JWA还对肿瘤细胞表面多个膜蛋白(CXCR4、CCR5、HER2)的表达有抑制作用,阻断膜蛋白介导的PI3K-Akt-FAK通路对肿瘤细胞迁移、侵袭、浸润的调节(Uncotarget,2016)。以上结果均说明JWA是有效抑制多种恶性肿瘤生长和转移的上游重要分子,其生物学功能是通过调节不同的信号网络实现的。人群研究发现,JWA在多种癌组织中表达显著低于癌旁组织,癌组织中JWA蛋白表达低的患者肿瘤浸润深度、淋巴结转移以及TNM分期明显恶化;JWA与FAK、CD31、MMP2、ILK、CXCR4、CCR5等分子表达水平均呈现出负相关,并且在预测患者预后方面有协同作用(Carcinogenesis 2014,35(2):442-451;J Gastroenterol 2013,48(9):1034-1044)。本专利发明人在筛选获得JWA多肽(PJP1)基础上进一步设计成靶向整合素(integrin)的特异性多肽(PJP1-R),发现该靶向多肽本身对细胞和动物没有明显毒作用,但能很好地抑制黑色素瘤和胃癌细胞荷瘤小鼠肿瘤生长,并能有效阻止黑色素瘤转移;该研究成果已获得国家发明专利,专利号为201310178099.X,授权公告号为CN103239710B。
综上所述,JWA是一个新的抑制肿瘤转移的靶点分子,但目前国内外尚无激活机体组织器官JWA基因表达的小分子化合物,亟待更加深入地研究。
技术实现要素:
本发明所要解决的技术问题是:基于现有技术,提出一类抗肿瘤化合物,能够特异性激活JWA基因表达实现抗肿瘤作用,并能够有效抑制肿瘤转移。同时,还提供该类化合物的制备方法和用途。
本发明的主要技术构思如下:发明人构建了含有JWA基因启动子序列的报告基因的细胞模型,并通过该细胞模型进行高通量筛选,以期发现能激活JWA基因表达的新的小分子化合物,并以体内外模型探索该化合物激活JWA基因表达的活力,在此基础上再以细胞模型和小鼠模型验证该化合物抑制肿瘤生长和转移的能力。发明人以此为主要技术构思,经深入地反复实践研究后,终于筛选出能有效激活细胞和小鼠体内组织器官JWA表达的小分子化合物。
本发明的抗肿瘤化合物如下:
式Ⅰ化合物:
其中,R1选自未取代的C1~C6烷基、未取代的C1~C6烷氧基、CN、CF3、NO2、NH2、H、F、Cl、Br、I、SH、OH、SO3H、COR3、COOR3或CONHR3;且R3选自H、未取代的C1~C6烷基、未取代或取代的苯基、未取代或取代的芳杂环基;
R2选自H、未取代的C1~C6烷基、未取代或取代的苯基、未取代或取代的联苯基、未取代或取代的萘基、未取代或取代的芳杂环基;
所述芳杂环基含有1~3个杂原子,各杂原子分别选自氮、硫或氧;
所述取代的苯基、取代的芳杂环基、取代的联苯基、取代的萘基分别含有1~4个选自未取代的C1~C6烷基、未取代的C1~C6烷氧基、CN、CF3、NO2、NH2、H、F、Cl、Br、I、SH、OH、SO3H、COR4、COOR4或CONHR4的取代基;且R4选自H、未取代的C1~C6烷基、未取代的苯基、未取代的萘基、未取代的联苯基或未取代的芳杂环基。
此类化合物为1,4-苯并二噁烷取代1,3,4-噁二唑-2-硫醚类化合物。
优选地,R1为甲基、乙基、甲氧基、乙氧基、乙酰基、丙酰基、CN、CF3、NO2、NH2、H、F、Cl、Br、I、SH、OH、SO3H、CO2H、CO2CH3或CO2NH2;R2为吡啶-2-基甲基、吡啶-3-基甲基、吡啶-4-基甲基、呋喃-2-基甲基、呋喃-3-基甲基、噻吩-2-基甲基、噻吩-3-基甲基、苯甲基或2-硝基苯甲基。
本发明还提供:
前文所述式Ⅰ化合物的制备方法,其特征是,包括以下步骤:
第一步、式Ⅱ化合物与二硫化碳反应生成式Ⅲ化合物;
第二步、式Ⅲ化合物与式Ⅳ化合物反应生成式Ⅰ化合物;
式Ⅱ化合物、式Ⅲ化合物中的R1与式Ⅰ化合物的R1相同;式Ⅳ化合物中的R2与式Ⅰ化合物中的R2相同;
式Ⅳ化合物中的X为Cl、Br或I。
优选地,第一步的具体过程为:将式Ⅱ化合物溶解于预定溶剂中,然后滴入含预定辅助物质的二硫化碳混合液中,回流搅拌反应;之后,向反应液中加水,过滤收集滤液;以盐酸溶液调节滤液pH值至3.0~4.0使滤液中析出固体,过滤收集固体,干燥后即得式Ⅲ化合物;
第一步采用的预定溶剂为四氢呋喃、甲醇、乙醇、异丙醇、乙二醇、二氯甲烷、二甲基亚砜、N,N-二甲基甲酰胺、乙醚或二氧六环;第一步采用的预定辅助物质为氢氧化钠、氢氧化钾、叔丁醇钾、氢化钠、碳酸钾、碳酸钠、醋酸钠、吡啶、哌啶、4-二甲氨基吡啶或三乙胺;
第二步的具体过程为:将式Ⅲ化合物溶解于预定溶剂中,加入式Ⅳ化合物和预定辅助物质,搅拌反应;之后,先向反应液中加水,再用乙酸乙酯萃取并取有机层,以盐酸溶液、饱和食盐水洗涤有机层后,加入无水硫酸钠干燥;减压蒸干溶剂后,经柱层析纯化,最终所得固体即为式Ⅰ化合物;
第二步采用的预定溶剂为四氢呋喃、甲醇、乙醇、异丙醇、乙二醇、N,N-二甲基甲酰胺、二甲基亚砜或二氧六环;第二步采用的预定辅助物质为氢氧化钠、氢氧化钾、叔丁醇钾、氢化钠、碳酸钾、碳酸钠、醋酸钠或三乙胺。
更优选地,第一步采用的预定溶剂为乙醇;第一步采用的预定辅助物质为氢氧化钾;第一步中,回流搅拌反应时间为至少30h,盐酸溶液的浓度为0.5~2mol/L;第二步采用的预定溶剂为N,N-二甲基甲酰胺;第二步采用的预定辅助物质为碳酸钾;第二步中,搅拌反应时间为至少24h,盐酸溶液的浓度为0.5~2mol/L,柱层析纯化的洗脱剂由石油醚与乙酸乙酯按体积比20:1混合而成。
本发明还提供:
前文所述式Ⅰ化合物的药用盐或药用溶剂合物。
优选地,所述药用盐为式Ⅰ化合物与盐酸、硫酸、苯磺酸、对甲苯磺酸、磷酸、氢溴酸、马来酸、富马酸或苹果酸形成的盐;所述药用溶剂合物为式Ⅰ化合物与水、乙醇、正丁醇、异丙醇、乙醚或丙酮形成的溶剂合物。
此外,本发明还分别提供:
含有前文所述式Ⅰ化合物、或者前文所述式Ⅰ化合物的药用盐或药用溶剂合物的药物组合物。
至于药物组合物的具体剂型,则可根据现有技术视实际需要进行选择,如片剂、散剂、丸剂、胶囊剂、栓剂、颗粒剂、混悬剂、口服液、注射剂等药学上的剂型;其中,口服用药片和胶囊含有传统的赋形剂如:填充物、润滑剂、分散剂、稀释剂以及粘合剂。
前文所述式Ⅰ化合物、或者前文所述式Ⅰ化合物的药用盐或药用溶剂合物用于制备抗肿瘤药物的用途。具体地,所述肿瘤为与JWA基因低表达相关的肿瘤,包括胃癌、食管癌、黑色素瘤、肺癌、乳腺癌、脑胶质瘤、肝癌和宫颈癌等;所述抗肿瘤药物为通过激活JWA蛋白的表达来实现抗肿瘤作用的药物。
与现有技术相比,本发明的式Ⅰ所示1,4-苯并二噁烷取代1,3,4-噁二唑-2-硫醚类化合物能够有效激活JWA蛋白的表达,从而抑制肿瘤的转移;同时,式Ⅰ所示化合物在较低剂量下即显示出显著的治疗肿瘤的活性,并且对正常组织细胞无毒性,具有广阔的应用前景。
附图说明
图1为本发明实施例8中已知JWA基因转录起始点上游2012bp的DNA序列。
图2为本发明实施例9中得到含有JWA启动子序列的目的pGL3-JWA-Neo载体图谱。
图3为本发明实施例10中,不同浓度的小分子化合物JAC-4处理HBE细胞,激活JWA蛋白表达的Western Blot的结果图。其中tubulin为内参蛋白。
图4为本发明实施例11中,不同浓度的小分子化合物JAC-4处理HBE细胞,对HBE细胞增殖影响的结果图。
图5为本发明实施例12中,不同浓度的小分子化合物JAC-4处理胃癌细胞HGC-27,对HGC-27细胞迁移作用的Transwell小室结果图。
图6为本发明实施例12中,不同浓度的小分子化合物JAC-4处理胃癌细胞HGC-27,对HGC-27细胞迁移作用的小室迁移细胞统计结果图。
图7为本发明实施例13中,黑色素瘤被动转移模型中,小分子化合物JAC-4处理组与溶剂对照组小鼠体重变化结果图。
图8为本发明实施例13中,黑色素瘤被动转移模型中,小分子化合物JAC-4处理组与溶剂对照组小鼠出现死亡结局截点时间结果图。
图9为本发明实施例13中,黑色素瘤被动转移模型中,小分子化合物JAC-4处理组与溶剂对照组小鼠生存曲线结果图。图中,溶剂对照组的曲线比JAC-4处理组的曲线更靠近Y轴。
具体实施方式
下面参照附图并结合实施例对本发明作进一步详细描述。但是本发明不限于所给出的例子。
实施例1
5-(1,4-苯并二噁烷-2-基)-2-((吡啶-2-基甲基)硫代)-1,3,4-噁二唑(Ⅰ-1)的制备
将1,4-苯并二噁烷-2-羧酸酰肼(300mg,1.54mmol)溶解在5mL乙醇中,慢慢滴入氢氧化钾(99mg,1.77mmol)和二硫化碳(469mg,6.16mmol)的混合液中,回流搅拌30~32h。TLC检测原料消失后,将适量的水加入反应液中,过滤不溶物,收集滤液。使用1mol/L盐酸调节滤液pH值到3.0~4.0,析出白色固体,过滤,干燥,不经纯化用于下一步。
将上一步所得1,3,4-噁二唑化合物溶解在3mL N,N-二甲基甲酰胺中,依次加入2-氯甲基吡啶盐酸盐(253mg,1.54mmol)和碳酸钾(425mg,3.08mmol)。室温搅拌24h,TLC检测原料消失后,加入20mL水,用乙酸乙酯萃取(3×5mL),合并有机层,有机层分别用1mol/L盐酸和饱和食盐水洗涤,无水硫酸钠干燥。减压蒸干溶剂,经快速柱层析(石油醚:乙酸乙酯=20:1)得到白色固体Ⅰ-1(428mg),总收率85%。
1H NMR(300MHz,CDCl3)δ8.57(d,J=4.7Hz,1H),7.63-7.68(m,1H),7.47(d,J=7.8Hz,1H),7.20-7.26(m,1H),6.88-6.97(m,4H),5.43-5.46(m,1H),4.61(s,2H),4.54-4.57(m,1H),4.42-4.53(m,1H);
ESI MS m/z 350.0[M+Na]+。
实施例2
5-(1,4-苯并二噁烷-2-基)-2-((吡啶-3-基甲基)硫代)-1,3,4-噁二唑(Ⅰ-2)的制备
参照实施例1所示的方法,其中2-氯甲基吡啶盐酸盐替换成为3-氯甲基吡啶盐酸盐,得到白色固体Ⅰ-2(392mg),总收率78%。
1H NMR(300MHz,CDCl3)δ8.72(s,1H),8.59(d,J=4.7Hz,1H),7.84(d,J=7.9Hz,1H),7.37-7.26(m,1H),7.11-6.82(m,4H),5.50(dd,J=6.6,2.5Hz,1H),4.60(dd,J=11.6,2.5Hz,1H),4.48-4.52(m,3H);
ESI MS m/z 350.0[M+Na]+。
实施例3
5-(1,4-苯并二噁烷-2-基)-2-((吡啶-4-基甲基)硫代)-1,3,4-噁二唑(Ⅰ-3)的制备
参照实施例1所示的方法,其中2-氯甲基吡啶盐酸盐替换成为4-氯甲基吡啶盐酸盐,得到白色固体Ⅰ-3(362mg),收率72%。
1H NMR(300MHz,CDCl3)δ8.61(d,J=4.5Hz,2H),7.40(d,J=4.6Hz,2H),7.04-6.88(m,4H),5.49(dd,J=6.4,2.5Hz,1H),4.58(dd,J=11.6,2.5Hz,1H),4.52-4.48(m,1H),4.44(s,2H);
ESI MS m/z 350.1[M+Na]+。
实施例4
5-(1,4-苯并二噁烷-2-基)-2-(苯甲基硫代)-1,3,4-噁二唑(Ⅰ-4)的制备
参照实施例1所示的方法,其中2-氯甲基吡啶盐酸盐替换成为溴苄,得到白色固体Ⅰ-4(452mg),收率90%。
1H NMR(300MHz,CDCl3)δ7.31-7.48(m,5H),7.00-7.03(m,4H),5.48-5.50(m,1H),4.58-4.61(m,1H),4.51(s,2H),4.48-4.50(m,1H);
ESI MS m/z 349.1[M+Na]+。
实施例5
5-(1,4-苯并二噁烷-2-基)-2-((2-硝基苯甲基)硫代)-1,3,4-噁二唑(Ⅰ-5)的制备
参照实施例1所示的方法,其中2-氯甲基吡啶盐酸盐替换成为2-硝基溴苄,得到白色固体Ⅰ-5(514mg),收率90%。
1H NMR(300MHz,CDCl3)δ8.18(d,J=8.1Hz,1H),7.82(d,J=7.6Hz,1H),7.63(t,J=7.5Hz,1H),7.53(t,J=7.8Hz,1H),7.05-6.89(m,4H),5.48(dd,J=6.4,2.4Hz,1H),4.85(s,2H),4.58(dd,J=11.6,2.4Hz,1H),4.50(dd,J=11.6,6.5Hz,1H);
ESI MS m/z 394.0[M+Na]+。
实施例6
5-(6-乙酰基-1,4-苯并二噁烷-2-基)-2-((吡啶-2-基甲基)硫代)-1,3,4-噁二唑(Ⅰ-6)的制备
参照实施例1所示的方法,其中1,4-苯并二噁烷-2-羧酸酰肼替换成为6-乙酰基-1,4-苯并二噁烷-2-羧酸酰肼,得到白色固体Ⅰ-6(432mg),收率76%。
1H NMR(300MHz,CDCl3)δ8.57(d,J=4.7Hz,1H),7.67(t,J=7.7Hz,1H),7.52-7.61(m,2H),7.48(d,J=7.8Hz,1H),7.18-7.25(m,1H),7.00(t,J=8.7Hz,1H),5.44-5.55(m,1H),4.63(d,J=5.7Hz,2H),4.45-4.60(m,2H),2.53(s,3H).
ESI MS m/z 392.1[M+Na]+。
实施例7
5-(6-硝基-1,4-苯并二噁烷-2-基)-2-((吡啶-2-基甲基)硫代)-1,3,4-噁二唑(Ⅰ-7)的制备
参照实施例1所示的方法,其中1,4-苯并二噁烷-2-羧酸酰肼替换成为6-硝基-1,4-苯并二噁烷-2-羧酸酰肼,得到淡黄色固体Ⅰ-7(458mg),收率80%。
1H NMR(300MHz,CDCl3)δ8.58(d,J=4.2Hz,1H),7.80-7.93(m,2H),7.73(t,J=7.7Hz,1H),7.55(d,J=7.7Hz,1H),7.30(d,J=6.7Hz,1H),7.05(t,J=8.8Hz,1H),5.50-5.58(m,1H),4.67(s,2H),4.50-4.65(m,2H).
ESI MS m/z 395.0[M+Na]+。
实施例8
构建带有新霉素抗性的环境应答基因JWA启动子报告基因质粒
本实施例的目的是构建带有JWA启动子的报告基因载体质粒,用于后续的能够有效激活JWA基因表达的化合物的筛选。
根据人源性JWA启动子序列(图1),先利用RT-PCR的方法扩增出JWA转录起始位点上游2012bp的片段,利用KpnI和NheI两个限制性酶切位点将克隆序列插入到pGL3-Neo载体中,从而得到含有启动子序列的目的载体(图2)。再将连接所得的重组载体转化至E Coli.(DH5α)大肠杆菌,测序进一步证实转化阳性克隆序列的准确性,从而成功构建带有新霉素抗性的JWA启动子报告基因质粒,构建成功的质粒和相应的菌株于-70℃保存。
实施例9
JWA的特异性调节分子筛选
本实施例的目的是通过JWA启动子报告基因实验,从多个化合物中筛选出能够显著激活JWA表达的化合物。
用384孔板进行细胞接种,每孔种3000个细胞,待贴壁进行转染。将质粒DNA(0.04μg)与海肾荧光素酶phRL-tk(0.01μg)按4:1比例加入6.25μL无血清无抗生素的DMEM为A液,混匀,室温孵育5min。将1μL lipofe2000转染试剂加入6.25μL无血清无抗生素的DMEM为B液,混匀,室温孵育5min。A+B混匀(B加入A),室温孵育20min。吸出384孔板中的培养液,用PBS洗2-3遍,加入有血清无抗生素的DMEM 25μL。孵育时间完毕,即加入AB混合液,摇匀,至细胞培养孵箱培养,24h后,倒出旧培养液,换为完全DMEM。利用不同化合物以一定的浓度处理细胞24h。
孵育时间结束,取出384细胞培养板,将试剂和细胞平衡至室温18-22℃,每孔吸出60μL培养液(每孔剩余培养液20μL),再加入等体积(20μL)的检测试剂,室温避光在摇床上孵育30min。采用Promega公司的双报告基因检测试剂盒检测荧光素酶活性,检测仪器为化学发光仪(3010C化学发光测定仪),所有实验严格平行操作(3平行)。
我们以荧光值>X+3SD为标准选取能够显著激活JWA表达的化合物。40000多个化合物中一共得到数百个能明显激活JWA表达的小分子化合物,均具备制成抗肿瘤药物的前景;其中65个具有良好的剂量效应关系,包括实施例1至7的化合物Ⅰ-1~Ⅰ-7;选取实施例1的化合物Ⅰ-1,将其命名为JAC-4,在以下实施例中做进一步研究。
实施例10
小分子化合物JAC-4对人支气管上皮细胞HBE中JWA蛋白表达水平的影响
本实施例的目的是通过细胞模型验证筛选结果的准确性,明确JAC-4确实提高JWA蛋白表达的作用。
常规消化处于对数生长期的HBE细胞,以5×105/孔均匀接种在60mm细胞培养皿中,不同剂量小分子化合物JAC-4处理细胞24h和48h后,加入0.18mL RIPA(含0.5%PMSF)细胞裂解液收取蛋白,12000g离心15min后取上清,测蛋白浓度,煮蛋白。选用12.5%浓度的聚丙烯酰胺凝胶进行蛋白电泳,每孔加入70μg蛋白,电泳条件选用60V 30min,90V,1-1.5h。电泳完毕后半干转法转膜,使得蛋白从凝胶内转移至PVDF膜上。转膜完毕后,5%脱脂牛奶常温下封闭1-2h,TBST(含0.1%Tween20)洗膜3次,每次5min,4℃孵育相应抗体过夜。次日,TBS(含0.1%Tween20)洗膜3次,每次5min,室温孵育二抗1-2h,TBST(含0.1%Tween20)洗膜8次,每次5min。膜上滴加ECL发光液,曝光。
实验结果如图3所示,JAC-4在浓度为1、10、100μmol/L分别处理24h和48h,能有效激活HBE细胞中JWA的蛋白表达。
实施例11
小分子化合物JAC-4对人支气管上皮细胞HBE增殖能力的影响。
本实施例的目的是观察小分子化合物JAC-4处理后,对细胞增殖和细胞毒性的作用。
取对数生长期的HBE细胞,以5×103个/孔的密度均匀种于96孔板,24h贴壁后更换为含有不同剂量(0、0.1、1、10μmol/L)的小分子化合物分别处理细胞12、24、48、72h。观察时间终止时,吸去96孔内原有培养液,每孔加入CCK-8试剂与新培养液体积比1:10的比例混合液,2h后于波长为450nm测吸光值。每组设4个平行样,实验重复3次。
实验结果如图4所示,与对照组相比,不同剂量的小分子化合物JAC-4体外作用于HBE细胞后,并未发现JAC-4对细胞活性的影响。
实施例12
小分子化合物JAC-4对肿瘤细胞迁移的影响
本实施例的目的是通过Transwell迁移实验,检测小分子化合物JAC-4对胃癌细胞HGC-27细胞迁移能力的作用。
取对数生长期的HGC-27细胞,以1×106个/2mL铺于6孔板中,待细胞贴壁后加药,JAC-4终浓度分别0、0.1、1和10μmol/L。阴性对照组为含5%DMSO的1640培养液。
Transwell小室铺胶:实验前一天,准备24孔板,若干个Transwell小室。将FN稀释,母液1mg/mL,稀释10倍到终浓度100μg/mL。每个小室的底部涂FN 50μL,在超净台中放置2h风干,细胞培养箱中过夜。
实验当天,用0.25%的胰酶消化细胞,悬浮到无血清的培养基中,细胞计数,调整细胞密度为5×105个/mL,种100μL到Transwell小室的上层。小室的外面加入600μL的10%FBS培养基。培养箱中培养12h后,将Transwell小室取出,用95%甲醇固定20min。用PBS洗3遍,用结晶紫染色30min。再用PBS洗3遍,用棉签轻轻擦去上室的细胞。最后将小室放在载玻片上,在倒置显微镜下观察并拍照,每个小室上、下、左、右、中各拍一个视野。并统计分析。
实验结果见图5、图6所示,较DMSO阴性对照组,实验组均有显著性差异(P<0.05),JAC-4能够显著抑制胃癌细胞HGC-27细胞迁移穿过FN胶的能力。
实施例13
小分子化合物JAC-4对发生黑色素瘤转移的小鼠寿命的影响
本实施例的目的是通过建立黑色素瘤被动转移模型,探讨在该模型中JAC-4对小鼠寿命的作用。
取对数生长期的鼠黑色素瘤细胞B16F10细胞,在无菌条件下制备成2×105/100μL细胞悬液,并通过尾静脉注射到小鼠体内,同时给小鼠编号。小鼠按照体重大小随机分为两分别组,为JAC-4组和溶剂对照组,进行相应的化合物干预实验。两组小鼠均在接种黑色素瘤细胞的次日起经灌胃给予JAC-4或相应溶剂,每天给予,从给药之日起,每隔两天对小鼠称重。观察小鼠的状态,记录小鼠自然死亡的时间。生存延长率(%)=(实验组存活天数-对照组存活天数)/对照组存活天数×100%。
从此次实验结果发现:对照组与JAC-4组记录的存活时间分别为:对照组(22.00±1.82)d,JAC-4组(24.00±1.76)d。组间小鼠平均体重差异无统计学意义(图7);对照组较JAC-4组在较早时间出现小鼠死亡(图8);绘制生存曲线图,使用log-rank检验进行两组生存曲线比较,JAC-4处理可以抑制黑色素瘤的体内转移,延长小鼠生存时间,P<0.05,生存时间(天)延长率为10.34%(图9)。
需要说明的是,以上实施例中所使用的细胞系HBE、NIH3T3和HGC-27细胞均购自中国科学院上海细胞生物研究所。小鼠黑色素瘤细胞B16F10购自ATCC细胞库。
HBE细胞和HGC-27细胞培养方法如下:将细胞接种于含100μg/mL链霉素、100μg/mL青霉素和10%胎牛血清的RPMI1640培养液中,置于37摄氏度、体积分数为5%的CO2培养箱中常规培养。
NIH3T3细胞和B16F10细胞培养方法如下:将细胞接种于含100μg/mL链霉素、100μg/mL青霉素和10%胎牛血清的DMEM培养液中,置于37摄氏度、体积分数为5%的CO2培养箱中常规培养。
雄性C57BL/6小鼠(8-10周龄)购自国家啮齿类实验动物种子中心上海分中心。所有小鼠相关操作均在南京医科大学动物保护和使用委员会许可下进行,并符合美国国立卫生研究院实验动物相关规程。
实施例14
药用组合物的制备:片剂
将式Ⅰ所示的1,4-苯并二噁烷取代1,3,4-噁二唑-2-硫醚类化合物或其药学上可接受的盐(1g)与乳糖(23g)和微晶纤维素(5.7g)用混合机混合。用滚轴压紧机将所得混合物压制成型,值得薄片状压制物料。用锤式粉碎机将所述薄片状压制物料研磨成粉,使所得粉状物料通过20目筛过筛。将一份轻质二氧化硅(0.3g)和硬脂酸镁(0.3g)加入到已过筛的物料中,并混合。所得混合产物用压片机压片,制备片剂。
实施例15
药用组合物的制备:明胶胶囊剂
将式Ⅰ所示的1,4-苯并二噁烷取代1,3,4-噁二唑-2-硫醚类化合物或其药学上可接受的盐(1g)与微晶纤维素(0.35g)和乳糖(0.15g)用水制粒,然后将该颗粒与铰链羧甲基纤维素钠(0.04g)和硬脂酸镁(0.01g)混合。所得混合产物填充明胶胶囊,制备明胶胶囊剂。(本发明中所用的明胶胶囊由中国苏州胶囊有限公司生产,该明胶胶囊符合药用标准)
实施例16
前述实施例仅举出了本发明筛选所得的部分化合物,事实上在实施例9中,经筛选获得的、能明显激活JWA表达的小分子化合物还包括下表所示的式Ⅰ化合物。
注:当表中化合物的取代基可存在于多个取代位置、或化合物存在多个同分异构体时,则表示包括所有可能的化合物。
表中化合物在实施例9的筛选试验当中,均表现出能明显激活JWA表达的特性,均具备制成抗肿瘤药物的前景,因此,这些化合物均应当包含入本发明的保护范围。
本发明的小分子化合物还可与其他药物和其他治疗手段联合使用,以增强治疗恶性肿瘤的效果。
- 还没有人留言评论。精彩留言会获得点赞!