本发明属于miRNA递送载体生物技术领域,具体涉及一种基于超小(小于10nm)金纳米颗粒的表面改性得到的miRNA递送载体,该载体负载miRNA后能够进入细胞,可以促进骨髓来源间充质干细胞成骨分化。
背景技术:
作为具有功能的生物分子,miRNAs经常被用于骨组织缺损再生及疾病治疗(Stegen,S.;van Gastel,N.et al.Bone 2015,70,19-27;Li,Y.;Fan,L.et al.Biomaterials 2013,34,5048-58;Zhang,X.;Li,Y.et al.Nat.Commun.2016,7)。很多结果都表明可以递送miRNA到组织再生区域和靶细胞。
但是,由于miRNA和细胞膜都拥有相同类型的电荷——负电荷,很难独自穿过细胞膜。递送miRNA经常在体内很快被降解(Kai,Z.S.;Pasquinelli,A.E.et al.Nat.Struct.Mol.Biol.2010,17,5-10)。因此,探索一种可以保护和递送miRNA到靶细胞的高效低毒性的载体是非常必要的。病毒载体和脂质体作为基因载体已经被广泛研究,但是仍然有研究表明它们有很多缺点比如免疫反应以及在血液中并不稳定(Bozzuto,G.;Molinari,A.Int.J.Nanomed.2015,10,975;Pattni,B.S.;Chupin,V.V.et al.Chem.Rev.2015,115,10938-10966)。并且,人工合成的阳离子PEI已经被广泛应用于在体内和体外递送miRNA进入细胞(Yin,H.;Kanasty,R.L.et al.Nat.Rev.Genet.2014,15,541-555;Wang,W.;Li,W.et al.Curr.Pharm.Biotechno.2013,14,46-60)。但是,高分子量的PEI(25KD)在拥有良好的转染能力的同时细胞毒性很强,低分子量的PEI(低于2KD)几乎没有细胞毒性但是转染效率很低(Arote,R.;Kim,T.-H.et al.Biomaterials 2007,28,735-744;Xiong,M.P.;Forrest,M.L.et al.Biomaterials 2007,28,4889-4900)。探索出一种新的miRNA递送体系,同时拥有高转染效率,低细胞毒性已经成为了组织再生和癌症疗法的研究热点(Conde,J.;Edelman,E.R.et al.Adv.Drug Deliver.Rev.2015,81,169-183;Dong,H.;Dai,W.et al.ACS Appl.Mater.Inter.2015,7,11015-11023;Xinluan,W.;Yuxiao,L.et al.Curr.Pharm.Design 2015,21,1575-1583)。
金纳米颗粒因为易于制备、大小及分布可控、有很好的生物相容性,并且容易表面功能化改性而被认为是一种新兴的无毒基因递送载体(Ding,Y.;Jiang,Z.et al.Mol.Ther 2014,22,1075-1083;Almeida,J.P.M.;Figueroa,E.R.et al.Nanomed-Nanotechnol.2014,10,503-514;Austin,L.A.;Mackey,M.A.et al.Arch.Toxicol.2014,88,1391-1417)。金纳米颗粒已经非常成功地运用保护和递送基因包括DNA,siRNA和miRNA(Ghosh,R.;Singh,L.C.et al.Biomaterials 2013,34,807-816;Wang,H.;Jiang,Y.et al.Adv.Drug Deliver.Rev.2015,81,142-160;Bishop,C.J.;Tzeng,S.Y.et al.Acta Biomater.2015,11,393-403)。然而用于基因递送的一般的金纳米颗粒大于10nm会累积在不同的组织中,很难经肾脏清除出去,可能会引起长期毒性(Longmire,M.;Choyke,P.L.et al.Nanomedicine 2008,3,703-717;Wang,B.;He,X.;et al.Accounts of chemical research 2013,46,761-769.Karmali,P.P.;Simberg,D.Expert opinion on drug delivery 2011,8,343-357)。目前用金纳米颗粒制备miRNA递送载体的方法为化学接枝方法,但是该方法具有反应温度高、时间长和副反应严重等缺点。
技术实现要素:
本发明的目的在于提供一种基于超小金纳米颗粒的miRNA递送载体及其制备方法和应用,该载体中金纳米颗粒的粒径小于10nm,不会产生肾脏毒性,而且其制备方法采用逐层组装的方法,具有方便简单,可控性高等优点,并且该载体与miRNA负载后可被细胞内吞,可以促进骨髓来源间充质干细胞成骨分化。
为达到上述目的,本发明采用的技术方案为:
一种基于超小金纳米颗粒的miRNA递送载体,该miRNA递送载体以粒径小于10nm的超小金纳米颗粒为核,在核表面组装有聚乙烯亚胺或脂质体,或者在核表面由内到外依次组装有聚乙烯亚胺和脂质体。
所述的基于超小金纳米颗粒的miRNA递送载体的制备方法,包括以下步骤:
1)超小金纳米颗粒的制备
按照(0.2~1.5):(0.2~1.2)的摩尔比将氯金酸与柠檬酸加入去离子水中,搅拌条件下加入硼氢化钠溶液,得到反应液,继续搅拌反应5~12h,反应结束后,对反应体系离心、用水重悬,得到粒径小于10nm的超小金纳米颗粒;其中加入的硼氢化钠溶液中的硼氢化钠与氯金酸的摩尔比为(12~30):(0.5~1.3);
2)超小金纳米颗粒的改性
将步骤1)制得的超小金纳米颗粒溶解在pH=9~14的氢氧化钠溶液中,加入16-巯基十六烷基酸,室温下搅拌反应10~14小时,反应结束后,离心、洗涤,再用水重悬得到改性后的超小金纳米颗粒,然后将改性后的超小金纳米颗粒重悬在磷酸盐缓冲液中,得到超小金纳米颗粒的重悬液;其中超小金纳米颗粒与16-巯基十六烷基酸的摩尔比为(0.2~1.5):(0.3~1.8);
3)超小金纳米颗粒的逐层组装
按体积比为(1~3):(2~45)向超小金纳米颗粒的重悬液中加入聚乙烯亚胺,在30~40℃混合20~60分钟进行逐层组装,得到表面组装有聚乙烯亚胺的超小金纳米颗粒载体,记为Au@PEI;按体积比为(1~10):(2~10)向超小金纳米颗粒的重悬液中加入脂质体,在30~40℃混合20~60分钟进行逐层组装,得到表面组装有脂质体的超小金纳米颗粒载体,记为Au@Lipo;再按照体积比为(0.2~1.5):(0.3~1.4)将Au@PEI和Au@Lipo在30~40℃混合20~60分钟进行第二次逐层组装,得到超小金纳米颗粒表面从内到外依次组装有聚乙烯亚胺和脂质体的载体,记为Au@PEI@Lipo;其中符号A@B表示B组装在A表面;得到的Au@PEI、Au@Lipo和Au@PEI@Lipo即为基于超小金纳米颗粒的miRNA递送载体。
所述步骤1)的反应液中氯金酸的浓度为2~5mmol/L,柠檬酸的浓度为2~8mmol/L,硼氢化钠的浓度为0.04~0.12mol/L。
所述步骤2)中将每0.01~0.05mmol的超小金纳米颗粒溶解在15~30mL氢氧化钠溶液中,将每0.5~1.2mmol的改性后的超小金纳米颗粒重悬在2~5mL pH值为7.0~8.5的磷酸盐缓冲溶液中。
所述步骤3)中聚乙烯亚胺的浓度为0.5~5mg/L,脂质体的浓度为0.5~5mg/L,逐层组装在Opti-Mem培养基(Thermo Fisher)中进行。
所述的基于超小金纳米颗粒的miRNA递送载体负载miRNA的方法,其具体步骤为:按体积比为(20~50):(0.8~3.5)将基于超小金纳米颗粒的miRNA递送载体与miRNA溶液在30~40℃的Opti-Mem培养基中混合并在孵育20~60分钟,然后离心,再用新鲜的Opti-MEM培养基重悬,即在基于超小金纳米颗粒的miRNA递送载体的表面负载上了miRNA;其中miRNA溶液的浓度为0.1~1.5mg/mL。
所述的基于超小金纳米颗粒的miRNA递送载体作为将miRNA递送至细胞内部的载体的应用。
所述的基于超小金纳米颗粒的miRNA递送载体与miRNA负载后阻止miRNA被血清中的酶降解方面的应用。
所述的基于超小金纳米颗粒的miRNA递送载体与miRNA负载后促进骨髓来源间充质干细胞成骨分化方面的应用。
所述的基于超小金纳米颗粒的miRNA递送载体与miRNA负载后提高细胞成骨分化基因表达方面的应用,所述的细胞成骨分化基因为Alp、Runx2、Ocn和Sox9。
相对于现有技术,本发明的有益效果为:
本发明提供的基于超小金纳米颗粒的miRNA递送载体,以粒径小于10nm的超小金纳米颗粒为核,在核表面组装有聚乙烯亚胺或脂质体,或者在核表面由内到外依次组装有聚乙烯亚胺和脂质体。该载体中金纳米颗粒的粒径小于10nm,不会产生肾脏毒性,并且该载体具有良好的细胞相容性,能够提高miRNA的递送效率,该载体与miRNA负载后可被细胞内吞,可以促进骨髓来源间充质干细胞成骨分化。
本发明提供的基于超小金纳米颗粒的miRNA递送载体的制备方法,采用逐层组装的方法,在超小金纳米颗粒表面组装有聚乙烯亚胺或脂质体,或者在超小金纳米颗粒表面由内到外依次组装有聚乙烯亚胺和脂质体,得到基于超小金纳米颗粒的miRNA递送载体。该方法能够增加脂质体的稳定性,降低PEI的毒性,并且能够充分应用超小金纳米颗粒的优势。与现有的化学接枝方法来固定miRNA相比,本发明的逐层组装法具有很多的优点,比如方便简单、可控性高等。
本发明还具有以下优点:
(1)本发明制得的逐层组装的基于超小金纳米颗粒的miRNA递送载体易于制备,制得的该载体溶液检测出zeta电势为正的32mV和37.5mV,便于miRNA等带负电荷的生物分子与其结合。
(2)本发明制得的逐层组装的基于超小金纳米颗粒的miRNA递送载体,使用逐层组装的方式,使得其负载的miRNA稳定性高。在3h左右观察发现,裸miRNA已经没有完整的miRNA分子存在。而基于超小金纳米颗粒的miRNA递送载体负载miRNA后,即使在血清环境中也能存在较长时间,在24h后,仍有超过80%的完整miRNA稳定存在。
(3)本发明制得的逐层组装的基于超小金纳米颗粒的miRNA递送载体的递送效率较高,48h时,已有67.87%的细胞转染入Au@Lipo负载的miRNA,35.54%的细胞转入Au@PEI@Lipo负载的miRNA,比单纯用脂质体(Lipo)递送miRNA组的27.42%高很多。
(4)本发明制得的逐层组装的基于超小金纳米颗粒的miRNA递送载体具有很好的生物相容性,在24h左右,用本发明的基于超小金纳米颗粒的miRNA递送载体递送miRNA组比单纯用聚乙烯亚胺(PEI)递送miR组和单纯用脂质体(Lipo)递送miRNA组的细胞相容性高很多,表明本发明制得的逐层组装的基于超小金纳米颗粒的miRNA递送载体对细胞毒性可以忽略不计。
(5)本发明制得的逐层组装的基于超小金纳米颗粒的miRNA递送载体将miR-5106递送至细胞内后,能显著促进骨髓来源间充质基质细胞很好地分化为类成骨细胞,成骨相关标记基因Alp、Runx2和Ocn的表达量较其他组上调明显。
附图说明
图1是本发明的基于超小金纳米颗粒的miRNA递送载体负载miRNA之后的力学性能表征图,其中a是基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的透射电镜表征;b是基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的颗粒大小表征;c是基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的UV-vis紫外光谱表征;d是基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的zeta点位分析图;e是基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的凝胶电泳阻滞图;f是结合miRNA后基于超小金纳米颗粒的miRNA递送载体的血清稳定性试验结果图。
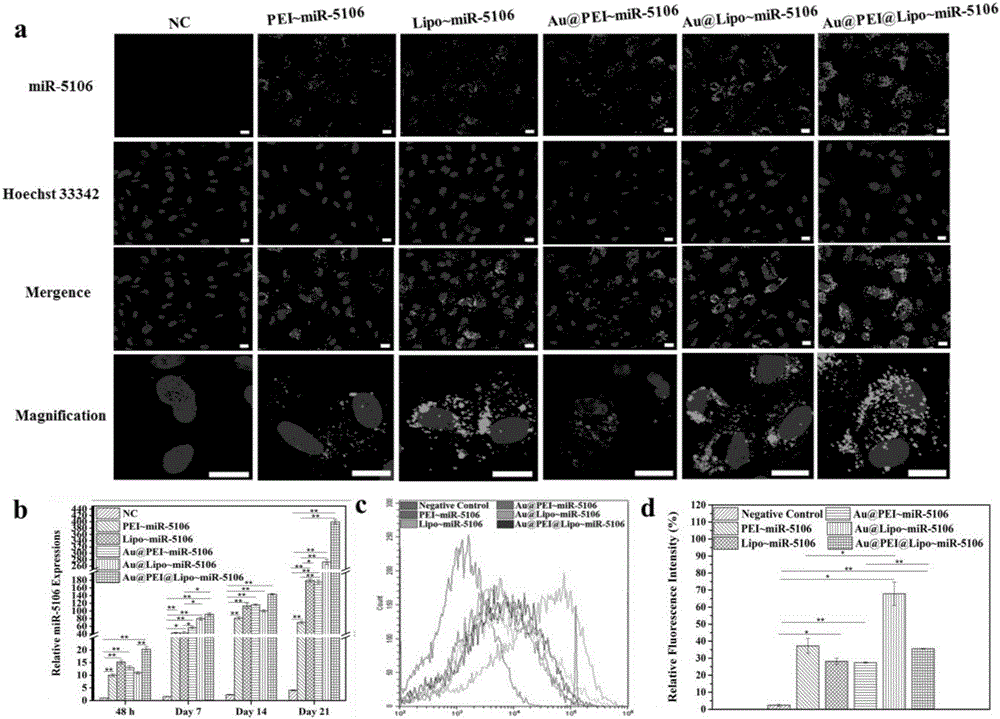
图2是本发明的基于超小金纳米颗粒的miRNA递送载体结合荧光标记的miRNAs后转染效率表征图,其中a是BMSCs转染miRNAs后荧光共聚焦图片;b是BMSCs转染miRNAs后miRNAs表达量的图;c是流式细胞表征图;d是流式细胞结果的定量图。
图3是基于超小金纳米颗粒的miRNA递送载体转染miR-5106后细胞活性评价图,其中a是转染miR-5106后1-7天细胞增殖数据图;b是转染miR-5106后24小时live/dead染色图。
图4是基于超小金纳米颗粒的miRNA递送载体转染miR-5106后BMSCs的ALP活性、钙矿化的表征图,其中a是7天、14天、21天的BMSCs的alp活性数据图;b-c是转染miR-5106后BMSCs茜素红染色图;d是14天和21天钙含量检测数据图。
图5是基于超小金纳米颗粒的miRNA递送载体转染miR-5106后BMSCs的成骨分化相关标记基因表达量的检测图,其中a是Alp;b是Runx2;c是Ocn;d是Sox9。
具体实施方式
为了更好的理解本发明,下面结合具体实施方式对本发明进行详细说明,其中聚乙烯亚胺以PEI 25KD、LIPO以lipofectamineTM 2000、miRNA以小鼠miR-5106为代表说明,以@表明逐层组装的过程,但本发明的内容不仅仅局限于下面的实施例。
本发明提供了一种表面改性的超小金纳米粒子负载miR-5106及其促进骨髓来源间充质干细胞成骨分化的应用,将miR-5106用改性过的超小金纳米离子负载及转染进细胞后,可研究miR-5106对骨组织来源基质多能细胞成骨相关基因表达的调控作用。
本发明中将超小金纳米颗粒表面改性并逐层组装PEI和脂质体用于miRNA递送,发现这种金包裹PEI包裹脂质体的纳米体系可以展现出好的细胞相容性(相比于PEI),提高miR-5106的递送效率(相比于脂质体)并且显著提高BMSCs的成骨分化能力。
实施例1
1)超小金纳米颗粒的制备:按照1:0.9的摩尔比将氯金酸与柠檬酸加入去离子水中,剧烈搅拌并快速滴加入新鲜制备的的硼氢化钠溶液,得到反应液,继续搅拌反应5h,反应结束后,对反应体系离心、用水重悬,得到大小在8nm左右的柠檬酸封端的超小金纳米颗粒。其中加入的硼氢化钠溶液中的硼氢化钠与氯金酸的摩尔比为22.5:1,反应液中氯金酸的浓度为4mmol/L,柠檬酸的浓度为3.6mmol/L,硼氢化钠的浓度为0.09mol/L。
2)超小金纳米颗粒的改性:将步骤1)制得的0.04mmol的超小金纳米颗粒溶解在pH=10的15mL氢氧化钠溶液中,加入0.036mmol 16-巯基十六烷基酸(MHA),室温下搅拌反应12小时,反应结束后,离心、用水洗涤、再离心,然后用水重悬,得到MHA改性后的羧基封端的超小金纳米颗粒,然后将0.5mmol改性后的超小金纳米颗粒重悬在pH=7.0的2mL磷酸盐缓冲液中,得到超小金纳米颗粒的重悬液;其中超小金纳米颗粒与16-巯基十六烷基酸的摩尔比为1:0.9;
3)超小金纳米颗粒的逐层组装:按体积比为1:2向超小金纳米颗粒的重悬液中加入浓度为1mg/L的聚乙烯亚胺(PEI),在32℃Opti-Mem培养基中混合40分钟进行逐层组装,得到表面组装有聚乙烯亚胺的超小金纳米颗粒载体,记为Au@PEI;按体积比为1:2向超小金纳米颗粒的重悬液中加入浓度为1mg/L的脂质体(Lipo),在32℃Opti-Mem培养基中混合40分钟进行逐层组装,得到表面组装有脂质体的超小金纳米颗粒载体,记为Au@Lipo;再按照体积比为0.3:0.5将Au@PEI和Au@Lipo在32℃Opti-Mem培养基中混合40分钟进行第二次逐层组装,得到超小金纳米颗粒表面从内到外依次组装有聚乙烯亚胺和脂质体的载体,记为Au@PEI@Lipo;得到的Au@PEI、Au@Lipo和Au@PEI@Lipo即为基于超小金纳米颗粒的miRNA递送载体。
4)基于超小金纳米颗粒的miRNA递送载体负载miRNA:按体积比为50:2分别将3种基于超小金纳米颗粒的miRNA递送载体Au@PEI、Au@Lipo和Au@PEI@Lipo与浓度为1mg/mL的miR-5106溶液在32℃Opti-Mem培养基中混合并孵育40分钟,然后12000rpm离心30分钟,再用新鲜的Opti-MEM培养基重悬,即在基于超小金纳米颗粒的miRNA递送载体的表面负载上了miR-5106;得到Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106。
实施例2
1)超小金纳米颗粒的制备:按照0.2:0.2的摩尔比将氯金酸与柠檬酸加入去离子水中,剧烈搅拌并快速滴加入新鲜制备的的硼氢化钠溶液,得到反应液,继续搅拌反应6h,反应结束后,对反应体系离心、用水重悬,得到大小在9nm左右的柠檬酸封端的超小金纳米颗粒。其中加入的硼氢化钠溶液中的硼氢化钠与氯金酸的摩尔比为12:0.6,反应液中氯金酸的浓度为2mmol/L,柠檬酸的浓度为2mmol/L,硼氢化钠的浓度为0.04mol/L。
2)超小金纳米颗粒的改性:将步骤1)制得的0.01mmol的超小金纳米颗粒溶解在pH=9的20mL氢氧化钠溶液中,加入0.015mmol 16-巯基十六烷基酸(MHA),室温下搅拌反应10小时,反应结束后,离心、用水洗涤、再离心,然后用水重悬,得到MHA改性后的羧基封端的超小金纳米颗粒,然后将0.6mmol改性后的超小金纳米颗粒重悬在pH=7.5的3mL磷酸盐缓冲液中,得到超小金纳米颗粒的重悬液;其中超小金纳米颗粒与16-巯基十六烷基酸的摩尔比为0.2:0.3;
3)超小金纳米颗粒的逐层组装:按体积比为1.5:5向超小金纳米颗粒的重悬液中加入浓度为0.5mg/L的聚乙烯亚胺(PEI),在30℃Opti-Mem培养基中混合60分钟进行逐层组装,得到表面组装有聚乙烯亚胺的超小金纳米颗粒载体,记为Au@PEI;按体积比为2:3向超小金纳米颗粒的重悬液中加入浓度为0.5mg/L的脂质体(Lipo),在30℃Opti-Mem培养基中混合60分钟进行逐层组装,得到表面组装有脂质体的超小金纳米颗粒载体,记为Au@Lipo;再按照体积比为0.2:0.3将Au@PEI和Au@Lipo在30℃Opti-Mem培养基中混合60分钟进行第二次逐层组装,得到超小金纳米颗粒表面从内到外依次组装有聚乙烯亚胺和脂质体的载体,记为Au@PEI@Lipo;得到的Au@PEI、Au@Lipo和Au@PEI@Lipo即为基于超小金纳米颗粒的miRNA递送载体。
4)基于超小金纳米颗粒的miRNA递送载体负载miRNA:按体积比为20:0.8分别将3种基于超小金纳米颗粒的miRNA递送载体Au@PEI、Au@Lipo和Au@PEI@Lipo与浓度为0.1mg/mL的miR-5106溶液在30℃Opti-Mem培养基中混合并孵育60分钟,然后12000rpm离心30分钟,再用新鲜的Opti-MEM培养基重悬,即在基于超小金纳米颗粒的miRNA递送载体的表面负载上了miR-5106;得到Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106。
实施例3
1)超小金纳米颗粒的制备:按照0.625:1的摩尔比将氯金酸与柠檬酸加入去离子水中,剧烈搅拌并快速滴加入新鲜制备的的硼氢化钠溶液,得到反应液,继续搅拌反应8h,反应结束后,对反应体系离心、用水重悬,得到大小在10nm左右的柠檬酸封端的超小金纳米颗粒。其中加入的硼氢化钠溶液中的硼氢化钠与氯金酸的摩尔比为30:1.25,反应液中氯金酸的浓度为5mmol/L,柠檬酸的浓度为8mmol/L,硼氢化钠的浓度为0.12mol/L。
2)超小金纳米颗粒的改性:将步骤1)制得的0.02mmol的超小金纳米颗粒溶解在pH=11的25mL氢氧化钠溶液中,加入0.02mmol 16-巯基十六烷基酸(MHA),室温下搅拌反应11小时,反应结束后,离心、用水洗涤、再离心,然后用水重悬,得到MHA改性后的羧基封端的超小金纳米颗粒,然后将0.8mmol改性后的超小金纳米颗粒重悬在pH=8.0的4mL磷酸盐缓冲液中,得到超小金纳米颗粒的重悬液;其中超小金纳米颗粒与16-巯基十六烷基酸的摩尔比为0.7:0.7;
3)超小金纳米颗粒的逐层组装:按体积比为3:45向超小金纳米颗粒的重悬液中加入浓度为2mg/L的聚乙烯亚胺(PEI),在40℃Opti-Mem培养基中混合20分钟进行逐层组装,得到表面组装有聚乙烯亚胺的超小金纳米颗粒载体,记为Au@PEI;按体积比为10:8向超小金纳米颗粒的重悬液中加入浓度为2mg/L的脂质体(Lipo),在40℃Opti-Mem培养基中混合20分钟进行逐层组装,得到表面组装有脂质体的超小金纳米颗粒载体,记为Au@Lipo;再按照体积比为1.5:1.4将Au@PEI和Au@Lipo在40℃Opti-Mem培养基中混合20分钟进行第二次逐层组装,得到超小金纳米颗粒表面从内到外依次组装有聚乙烯亚胺和脂质体的载体,记为Au@PEI@Lipo;得到的Au@PEI、Au@Lipo和Au@PEI@Lipo即为基于超小金纳米颗粒的miRNA递送载体。
4)基于超小金纳米颗粒的miRNA递送载体负载miRNA:按体积比为40:3.5分别将3种基于超小金纳米颗粒的miRNA递送载体Au@PEI、Au@Lipo和Au@PEI@Lipo与浓度为0.5mg/mL的miR-5106溶液在40℃Opti-Mem培养基中混合并孵育20分钟,然后12000rpm离心30分钟,再用新鲜的Opti-MEM培养基重悬,即在基于超小金纳米颗粒的miRNA递送载体的表面负载上了miR-5106;得到Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106。
实施例4
1)超小金纳米颗粒的制备:按照1.5:1的摩尔比将氯金酸与柠檬酸加入去离子水中,剧烈搅拌并快速滴加入新鲜制备的的硼氢化钠溶液,得到反应液,继续搅拌反应10h,反应结束后,对反应体系离心、用水重悬,得到大小在8.5nm左右的柠檬酸封端的超小金纳米颗粒。其中加入的硼氢化钠溶液中的硼氢化钠与氯金酸的摩尔比为18:0.5,反应液中氯金酸的浓度为3mmol/L,柠檬酸的浓度为2mmol/L,硼氢化钠的浓度为0.108mol/L。
2)超小金纳米颗粒的改性:将步骤1)制得的0.03mmol的超小金纳米颗粒溶解在pH=12的30mL氢氧化钠溶液中,加入0.036mmol 16-巯基十六烷基酸(MHA),室温下搅拌反应13小时,反应结束后,离心、用水洗涤、再离心,然后用水重悬,得到MHA改性后的羧基封端的超小金纳米颗粒,然后将1mmol改性后的超小金纳米颗粒重悬在pH=8.5的5mL磷酸盐缓冲液中,得到超小金纳米颗粒的重悬液;其中超小金纳米颗粒与16-巯基十六烷基酸的摩尔比为1.5:1.8;
3)超小金纳米颗粒的逐层组装:按体积比为2.5:30向超小金纳米颗粒的重悬液中加入浓度为3mg/L的聚乙烯亚胺(PEI),在37℃Opti-Mem培养基中混合30分钟进行逐层组装,得到表面组装有聚乙烯亚胺的超小金纳米颗粒载体,记为Au@PEI;按体积比为5:6向超小金纳米颗粒的重悬液中加入浓度为3mg/L的脂质体(Lipo),在37℃Opti-Mem培养基中混合30分钟进行逐层组装,得到表面组装有脂质体的超小金纳米颗粒载体,记为Au@Lipo;再按照体积比为1:1将Au@PEI和Au@Lipo在37℃Opti-Mem培养基中混合30分钟进行第二次逐层组装,得到超小金纳米颗粒表面从内到外依次组装有聚乙烯亚胺和脂质体的载体,记为Au@PEI@Lipo;得到的Au@PEI、Au@Lipo和Au@PEI@Lipo即为基于超小金纳米颗粒的miRNA递送载体。
4)基于超小金纳米颗粒的miRNA递送载体负载miRNA:按体积比为30:1分别将3种基于超小金纳米颗粒的miRNA递送载体Au@PEI、Au@Lipo和Au@PEI@Lipo与浓度为1.5mg/mL的miR-5106溶液在37℃Opti-Mem培养基中混合并孵育30分钟,然后12000rpm离心30分钟,再用新鲜的Opti-MEM培养基重悬,即在基于超小金纳米颗粒的miRNA递送载体的表面负载上了miR-5106;得到Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106。
实施例5
1)超小金纳米颗粒的制备:按照0.8:1.2的摩尔比将氯金酸与柠檬酸加入去离子水中,剧烈搅拌并快速滴加入新鲜制备的的硼氢化钠溶液,得到反应液,继续搅拌反应12h,反应结束后,对反应体系离心、用水重悬,得到大小在9.5nm左右的柠檬酸封端的超小金纳米颗粒。其中加入的硼氢化钠溶液中的硼氢化钠与氯金酸的摩尔比为26:1.3,反应液中氯金酸的浓度为3.5mmol/L,柠檬酸的浓度为5.25mmol/L,硼氢化钠的浓度为0.07mol/L。
2)超小金纳米颗粒的改性:将步骤1)制得的0.05mmol的超小金纳米颗粒溶解在pH=14的18mL氢氧化钠溶液中,加入0.0625mmol 16-巯基十六烷基酸(MHA),室温下搅拌反应14小时,反应结束后,离心、用水洗涤、再离心,然后用水重悬,得到MHA改性后的羧基封端的超小金纳米颗粒,然后将1.2mmol改性后的超小金纳米颗粒重悬在pH=7.8的3.5mL磷酸盐缓冲液中,得到超小金纳米颗粒的重悬液;其中超小金纳米颗粒与16-巯基十六烷基酸的摩尔比为1.2:1.5;
3)超小金纳米颗粒的逐层组装:按体积比为2:15向超小金纳米颗粒的重悬液中加入浓度为5mg/L的聚乙烯亚胺(PEI),在35℃Opti-Mem培养基中混合35分钟进行逐层组装,得到表面组装有聚乙烯亚胺的超小金纳米颗粒载体,记为Au@PEI;按体积比为8:10向超小金纳米颗粒的重悬液中加入浓度为5mg/L的脂质体(Lipo),在35℃Opti-Mem培养基中混合35分钟进行逐层组装,得到表面组装有脂质体的超小金纳米颗粒载体,记为Au@Lipo;再按照体积比为0.8:1.2将Au@PEI和Au@Lipo在35℃Opti-Mem培养基中混合35分钟进行第二次逐层组装,得到超小金纳米颗粒表面从内到外依次组装有聚乙烯亚胺和脂质体的载体,记为Au@PEI@Lipo;得到的Au@PEI、Au@Lipo和Au@PEI@Lipo即为基于超小金纳米颗粒的miRNA递送载体。
4)基于超小金纳米颗粒的miRNA递送载体负载miRNA:按体积比为35:1.5分别将3种基于超小金纳米颗粒的miRNA递送载体Au@PEI、Au@Lipo和Au@PEI@Lipo与浓度为0.8mg/mL的miR-5106溶液在35℃Opti-Mem培养基中混合并孵育35分钟,然后12000rpm离心30分钟,再用新鲜的Opti-MEM培养基重悬,即在基于超小金纳米颗粒的miRNA递送载体的表面负载上了miR-5106;得到Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106。
本发明中将制得的逐层组装好的Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106用于细胞转染并检测细胞毒性及成骨分化的效率。具体进行了以下检测:
(1)透射电子显微镜。测定负载miR-5106与未负载miR-5106的基于超小金纳米颗粒的miRNA递送载体的粒径大小是否不同。颗粒大小测定需要取TEM图片中50个基于超小金纳米颗粒的miRNA递送载体做测定;
(2)zeta电势测定。用动态光散射仪器测定负载miR-5106与未负载miR-5106的基于超小金纳米颗粒的miRNA递送载体的zeta电势是否不同。
(3)UV-vis紫外测定。测定负载miR-5106与未负载miR-5106的基于超小金纳米颗粒的miRNA递送载体的紫外图谱是否有峰的变化。
(4)凝胶阻滞实验。测定负载miR-5106与未负载miR-5106的基于超小金纳米颗粒的miRNA递送载体在凝胶中体现在条带的变化。
将制好的Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106及miR-5106、PEI~miR-5106、Lipo~miR-5106一起进行凝胶阻滞电泳。将这些混合溶液震荡10秒,加6×loading buffer在2%琼脂糖凝胶上进行电泳20分钟(115V)。
(5)血清稳定性测试。按体积比为1:4将胎牛血清和得到的Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106混合,然后放入37℃水浴锅孵育,并按照不同时间取样(0、0.25、0.5、1、3、6、12和24h),加入1μL RNase抑制剂放于-20度冰箱保存。所有样品取样结束后,加入肝素钠在32℃水浴锅孵育1h进行miRNA的竞争性释放。将处理好的样品进行4%琼脂糖凝胶(115V)电泳20min。
(6)在细胞培养孔板中接种骨髓来源间充质基质细胞,浓度为1×104细胞/孔。细胞培养条件是37℃-5%CO2培养箱,培养基为alpha-MEM+20%FBS。接种细胞后24h,细胞用PBS洗3次,加入100μg/mL Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106到培养板中。在1、3、5、7天时,分别加入10%的Alamar blue进行细胞增殖活性的测定,使用Spectramax@荧光读数比较细胞增殖状态。在1天时,同时做每组样品的live/dead染色45min,用PBS洗2次,用IX53倒置荧光显微镜观察细胞死活状态。
(7)在Opti-MEM环境中转染制得的Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106,同时以NC、PEI~miR-5106、Lipo~miR-5106作为对照。在细胞培养孔板中接种骨髓来源间充质基质细胞,浓度为1×104细胞/孔。细胞培养条件是37℃-5%CO2培养箱,培养基为alpha-MEM+20%FBS。为了验证转染的效率,使用FAM标记过的miR-5106。细胞被转染后24h后换液,换为新鲜的alpha-MEM+20%FBS培养液。用IX53倒置荧光显微镜观察细胞的荧光比例。
在细胞被转染48h后收样,用PBS洗3次,胰酶消化后离心收集细胞,用含有2%FBS的PBS洗一遍细胞,再用新的2%FBS的PBS重悬细胞,加入4%多聚甲醛(PFA)固定细胞,2h后用CytExpert流式细胞仪检测阳性(绿色荧光)比例。
(8)检测miR-5106诱导细胞的碱性磷酸酶(Alp)活性。在细胞培养孔板中接种骨髓来源间充质基质细胞,浓度为2×104细胞/孔。细胞培养条件是37℃-5%CO2培养箱,培养基为alpha-MEM+20%FBS。细胞转染入制得的Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106,同时以NC、PEI~miR-5106、Lipo~miR-5106为对照。在第7、14、21天时,消化离心收集细胞。细胞用PBS洗2次,用裂解液裂解细胞。离心后,细胞上清液用pNPP试剂盒,Spectramax@酶标仪405nm读数测定Alp含量。
(9)钙含量及细胞外基质矿化检测。
在上述实验(8)中BMSCs诱导分化14天及21天时,细胞用PBS洗2次,用alizarin red染色试剂盒固定及染色来检测细胞外基质矿化情况。
在上述实验(8)中BMSCs诱导分化14天及21天时,细胞用PBS洗2次,胰酶消化离心后,用ddH2O重悬细胞,加入钙染色试剂盒中的染色试剂来检测细胞中钙含量。Spectramax@酶标仪610nm读数测定钙含量。
(10)定量PCR检测成骨相关标记基因的表达。在3、7、14、21天时,用Trizol收集细胞,提RNA,并用逆转录试剂盒将RNA逆转录为cDNA。之后做定量PCR反应,加入相应的引物,检测miR-5106、Alp、Runx2、Ocn、Opn、Sox9等基因的表达情况。
通过上述实验,发现本发明所制备的超小金纳米颗粒大小均匀,在8nm左右,其结合miRNA的能力随着与PEI,Lipo等逐层组装而增加。并且在负载miRNA前,Au@PEI、Au@Lipo和Au@PEI@Lipo的细胞毒性较小;负载miRNA后,Au@PEI@Lipo~miR-5106的促进成骨细胞分化的能力很好,下面结合实验数据详细分析。
图1是基于超小金纳米颗粒的miRNA递送载体负载miRNA之后的力学性能表征图。其中a是基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的TEM图片,可以看出基于超小金纳米颗粒的miRNA递送载体的大小均匀,分散性很好;结合miRNA后的基于超小金纳米颗粒的miRNA递送载体有集中的趋势,并且外层有类似薄膜的物质。b是TEM检测的基于超小金纳米颗粒的miRNA递送载体结合miRNA前后的颗粒大小分布图,可以看出结合miRNA后,基于超小金纳米颗粒的miRNA递送载体的大小并没有显著性增加。c是UV-VIS检测分布图,可以看出结合miRNA后的基于超小金纳米颗粒的miRNA递送载体的峰有向右红移的趋势。d是基于超小金纳米颗粒的miRNA递送载体的zeta电势水合粒径的分布图,可以看出结合miRNA之后,基于超小金纳米颗粒的miRNA递送载体的zeta电势有显著性提升。有助于细胞转染进入细胞膜。e是基于超小金纳米颗粒的miRNA递送载体结合miRNA后的凝胶阻滞图,可以发现结合miRNA之后,胶上已看不出miRNA的条带,可能是基于超小金纳米颗粒的miRNA递送载体较大,miRNA被包裹在基于超小金纳米颗粒的miRNA递送载体的内部,不能经染料染色。f是结合miRNA后基于超小金纳米颗粒的miRNA递送载体的血清稳定性试验,从图中可以看出,裸miRNA在加入25%FBS后,在大约1小时的时候已经被降解完全,而经过逐层组装的基于超小金纳米颗粒的miRNA递送载体可以保护miRNA不被血清中的酶降解,这样基于超小金纳米颗粒的miRNA递送载体负载的miRNA就更加稳定,适合进一步的实验。
图2是基于超小金纳米颗粒的miRNA递送载体结合miRNA后转染细胞的转染效率及流式细胞仪检测结果。其中a是FAM标记的miR-5106被各种复合物转染进细胞48h后拍摄的共聚焦显微图片,可以看出,经过逐层组装后的基于超小金纳米颗粒的miRNA递送载体可以很好地递送miRNA,并且能将miRNA递送进细胞核周围的区域。b是miR-5106转染后的定量PCR检测结果,可以看出通过基于超小金纳米颗粒的miRNA递送载体递送的组,miR-5106随着时间的增加呈现表达量增加的趋势。c-d是流式细胞仪检测基于超小金纳米颗粒的miRNA递送载体递送miRNA荧光表达情况,可以看出Au@Lipo~miR-5106组的荧光值最高,Au@PEI@Lipo~miR-5106组也较Lipo~miR-5106组更好。
图3是基于超小金纳米颗粒的miRNA递送载体转染miR-5106后的细胞增殖活性检测。其中a是alamar blue检测,从图中可以看出,PEI对于细胞的增殖影响较大,而其他基于超小金纳米颗粒的miRNA递送载体对细胞增殖影响不大,毒性可以忽略。b是24小时live/dead细胞死活染色图,从图中可以看出,Au@PEI~miR-5106、Au@Lipo~miR-5106和Au@PEI@Lipo~miR-5106组的细胞死亡较少。
图4是基于超小金纳米颗粒的miRNA递送载体转染miR-5106后的细胞体外Alp活性、矿化及钙含量检测。其中a是7天、14天、21天的BMSCs的alp活性数据图;b-c是转染miR-5106后BMSCs茜素红染色图;d是14天和21天钙含量检测数据图。从图中可以发现,Au@PEI~miRNA组在细胞成骨分化中作用明显,钙矿化的程度更明显(颜色较深),钙含量检测也与Alp活性检测结果一致。
图5是基于超小金纳米颗粒的miRNA递送载体转染miRNA后的细胞成骨分化相关基因的检测。a-d分别是基因Alp、Runx2、Ocn、Sox9的表达,可以发现,Sox9作为miR-5106的靶基因,有随着miRNA表达量增加而增加的趋势,而且与成骨分化相关的基因都表达量较高。
通过上述实验可以看出,本发明中制备的基于超小金纳米颗粒的miRNA递送载体,其制备过程简单,无有机溶剂残留,具有均匀的颗粒大小,细胞毒性很小;能够成功递送miRNA,并能显著地促进骨组织来源间充质基质细胞的成骨分化。本发明的基于超小金纳米颗粒的miRNA递送载体在骨组织工程、药物递送和转运有着很好的应用前景。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效结构变换,均仍属于本发明技术方案的保护范围内。