本发明属于生物医药领域,具体的涉及一种以组氨酸激酶AgrC为靶点的药物筛选模型。
背景技术:
附属基因调节系统(accessory gene regulator,agr)是葡萄球菌最重要的毒力因子调控系统,与多种毒力因子的产生和生物被膜的形成密切相关。agr系统由信号受体AgrC和反应调节子AgrA组成,属于典型的双组份信号转导系统(two component signal transduction system,TCST)。组氨酸蛋白激酶AgrC作为TCST的信号受体,能被外界环境中的同源信号分子激活,发生自我转移磷酸化,磷酸化后的AgrC使AgrA磷酸化,活化后的AgrA可以与下游启动子RNAII和RNAIII间的重复序列发生特异性的结合,从而调控葡萄球菌毒力因子的表达和生物被膜的形成。如能抑制AgrC蛋白的激酶活性,阻断其自身磷酸化,进而抑制其对反应调节因子AgrA的磷酸化,则能有效阻断agr信号通路,减少毒力因子的表达,降低葡萄球菌的致病性。因此以agr系统作为治疗葡萄球菌的药物靶点,开发新型抗菌药物,对于攻克葡萄球菌的致病性和耐药性具有重要的意义。
然而,从众多的单体化合物中筛选出对AgrC蛋白的激酶活性具有特异性抑制作用的药物异常艰难。一方面,生物膜组分高度复杂,在原位考察药物单体对AgrC蛋白的作用效果较为困难;另一方面,多种膜组分的存在影响到对药物单体确切作用靶点的判断。因此,急需寻找一种高通量、特异性强、操作便捷的实验方法用于筛选对组氨酸激酶AgrC具有特异抑制活性的药物单体化合物。
近年来出现的蛋白脂质体为在生物体系外研究膜蛋白的结构与功能提供了有效平台,现已成功应用到许多膜蛋白结构和功能的研究中,如肌浆网中的ATP激酶,粪肠球菌的感受激酶等。目前,组氨酸激酶AgrC蛋白脂质体的研究主要集中在蛋白脂质体的构建方面,王丽娜等将金黄色葡萄球菌AgrC蛋白的第6和第7两个跨膜区AgrCTM6-7C蛋白截取出来,构建了AgrCTM6-7C蛋白脂质体(PLoS ONE,2013,8(11):e80400);张旭宁等则以金黄色葡萄球菌全长的AgrC蛋白为基础,构建了AgrC蛋白脂质体(张旭宁,大连工业大学硕士论文,2015)。但以AgrC蛋白脂质体为基础构建药物筛选模型,并成功筛选出对AgrC蛋白的激酶活性具有较强抑制作用的药物单体化合物还未见报道。
技术实现要素:
为解决上述技术问题,本发明的第一个目的是,以AgrC蛋白脂质体为基础,构建以组氨酸激酶AgrC为靶点的药物筛选模型。
本发明的第二个目的是,从14种中药单体化合物中筛选出对组氨酸激酶AgrC的激酶活性具有较强抑制作用的药物单体化合物。
一种以组氨酸激酶AgrC为靶点的药物筛选模型,是按照如下方法构建的:
(1)采用常规膜蛋白的制备方法对AgrC蛋白进行提取与纯化
将携带pET-28a-AgrC重组质粒的大肠杆菌(Escherichia coli)。经摇床培养、诱导表达、冰上摇床孵育后,低温超高压破碎收集细胞膜沉淀。分离得到AgrC蛋白粗提液,经金属离子螯合层析、尺寸排阻层析得到AgrC蛋白纯品。
(2)对纯化后的AgrC蛋白进行定量检测,以确定其浓度
根据上海生工BCA法蛋白浓度测定试剂盒的说明书定量检测纯化后的AgrC蛋白。
(3)以二油酰磷脂酰胆碱(DOPC)和1,2-二软脂酰基-sn-甘油基-3-膦钠盐(DPPA)两种磷脂以及胆固醇(CHOL)为原料制备脂质体。
(4)利用表面活性剂介导的方法将提取并纯化后的AgrC蛋白镶嵌到脂质体中形成蛋白脂质体,并测定蛋白脂质体中AgrC蛋白的激酶活性。所述的表面活性剂为本领域常规的试剂,如十二烷基聚乙二醇醚(Brij-35),十二烷基二甲基氧化胺(LDAO),FOS-维生素B-12(FOS)。
(5)构建以组氨酸激酶AgrC为靶点的药物筛选模型,并对药物筛选模型进行评价
根据AgrC蛋白能够发生自我磷酸化的特性构建药物筛选模型。AgrC蛋白作为组氨酸激酶可通过其自身的激酶活性域催化磷酸基从ATP向其自身的组氨酸残基转移。当反应结束后,体系中剩余的ATP与甲壳荧光素发生反应,形成氧化荧光素发出荧光。向上述体系中加入的药物单体化合物如能与AgrC蛋白发生作用,则会影响其激酶活性,从而使体系发光情况发生改变。依此原理构建药物筛选模型,可以用于AgrC蛋白酶活抑制剂的筛选。考察溶剂、缓冲液、空白脂质体等条件对药物筛选模型的影响。
(6)对组氨酸激酶AgrC具有较强抑制活性药物单体化合物的筛选
将待筛选药物单体化合物添加到上述药物筛选模型中,根据体系荧光强度的变化计算药物单体化合物对AgrC蛋白的激酶活性抑制率。根据抑制率的大小筛选出对组氨酸激酶AgrC蛋白具有较强抑制作用的药物单体化合物。
以等体积的空脂质体代替蛋白脂质体作为阳性对照组,以等体积的DMSO代替药物单体化合物作为阴性对照组,以等体积的空脂质体及等体积的DMSO分别代替蛋白脂质体和药物单体化合物作为空白对照组,测定各组荧光值;
根据荧光值计算酶活抑制率,计算公式如下:
酶活抑制率=[1-(LP-LY/LK-LN)]×100%; (A)
其中:LY代表样品实验组的荧光值;LP代表阳性对照组的荧光值;LN代表阴性对照组的荧光值;LK代表空白对照组的荧光值。
本发明同时请求保护保护大黄素、芦荟大黄素、葛根素和芹菜素在抑制AgrC蛋白的激酶活性中用途。
本发明的有益效果如下:
(1)本发明构建的药物筛选模型,适用于筛选对组氨酸激酶AgrC具有较强抑制效果的药物单体化合物,筛选出的化合物作用位点明确。
(2)在96孔板中,采用此药物筛选模型对药物单体化合物的筛选具有高通量、特异性强、操作便捷等优点。
(3)本发明中脂质体重构的过程并不仅仅局限于AgrC蛋白,其它具有激酶活性的膜蛋白同样可以通过这一方法进行重构,从而构建出以不同膜蛋白受体为靶点的药物筛选模型。
附图说明
图1为AgrC蛋白SDS-聚丙烯酰胺凝胶电泳分析图;
图2为AgrC蛋白脂质体激酶活性测定结果;
图3为HEPES对药物筛选模型中AgrC蛋白激酶活性的影响;
图4为DMSO对药物筛选模型中AgrC蛋白激酶活性的影响;
图5为空脂质体对药物筛选模型中AgrC蛋白激酶活性的影响;
图6为14种中药单体化合物对组氨酸激酶AgrC的酶活抑制率。
其中:T-1、大黄酸,T-2、芦荟大黄素,T-3、葛根素,T-4、芹菜素,T-5、苦参碱,T-6、黄芩苷,T-7、绿原酸,T-8、柴胡皂苷A,T-9、水飞蓟素,T-10、木犀草苷,T-11、甜菜碱,T-12、黄芪甲苷,T-13、盐酸小檗碱,T-14、粉防己碱。
具体实施方式
下面结合具体实施例对本发明的技术方案作进一步的说明,但本发明不以任何形式受限于实施例内容。实施例中所述试验方法如无特殊说明,均为常规方法;如无特殊说明,所述试剂和生物材料,均可从商业途径获得。
大肠杆菌菌株购于Novagen公司,大肠杆菌菌株BL21(DE3),Tuner(DE3),C41(DE3),C43(DE3),BL21(DE3)-pLysS和BL21-CodonPlus(DE3)-RIL任意一种均用于AgrC蛋白的表达,优选C43(DE3)。选择六种大肠杆菌作为宿主对AgrC蛋白进行表达的目的是为了考察哪种菌株对AgrC蛋白的表达量最高。经筛选后,大肠杆菌菌株C43(DE3)中AgrC蛋白的表达量最高,因此后续实验用这种菌株作为蛋白表达的载体。
携带pET-28a-AgrC重组质粒的E.coli C43工程菌的构建:
大肠杆菌菌株C43(DE3)用于AgrC蛋白的表达。质粒pET-28a(+)(带T7启动子)用于表达载体的构建。
采用无限制克隆法(Restriction free cloning,RF cloning)构建表达载体,该方法不需要限制性酶切位点,只需两步PCR便可构建出质粒载体,节省了实验时间并降低了成本。
为构建表达载体pET-28a(+)-AgrC,首先利用PCR方法从金黄色葡萄球菌基因组上扩增目的片段agrC。引物的设计原则是与目的片段agrC具有20bp同源序列,与目标载体pET-28a(+)具有30bp同源序列。PCR扩增所用正反引物列于表1。100μL的PCR反应体系如下:0.01ng/μL DNA,0.2mM dNTPs,0.2μM引物F,0.2μM引物R,5×PCR反应缓冲液,高保真HS DNA聚合酶2.5U。PCR反应条件为:98℃变性5min;98℃变性10s、55℃退火15s、72℃延伸1.5min,30个循环;最后72℃延伸10min。所得PCR产物用1.0%琼脂糖凝胶电泳进行检测并切胶回收。
上述第一步PCR扩增出的产物作为大引物,与目标载体pET-28a(+)进行第二步PCR反应,扩增目标载体,从而实现目的基因插入到目标载体之中。50μL的PCR反应体系如下:1ng/μL质粒pET-28a(+),0.25mM dNTPs,10ng/μL大引物,5×PCR反应缓冲液,高保真HS DNA聚合酶2.5U。PCR反应条件为:98℃变性5min;98℃变性10s、55℃退火15s、72℃延伸14min,32个循环;最后72℃延伸12min。
表1 构建表达载体所用的引物
第二步PCR的产物包括已插入目的基因的表达载体和未插入目的基因的空载体,因此要经过DpnI消化,以去除甲基化的母系空载体。消化反应体系为:8μL样品,加入1μL DpnI和1μL 10×buffer,在37℃下消化10-12h。消化结束后取5μL反应产物电转到DH5α感受态细胞中。挑取单菌落,培养并提取质粒,DNA测序验证。构建好pET-28a(+)-AgrC。
一、采用常规膜蛋白制备方法从携带pET-28a-AgrC重组质粒的E.coli C43提取AgrC蛋白
(1)将携带pET-28a-AgrC重组质粒的大肠杆菌E.coli C43接种至含有卡那霉素的32Y培养基(32Y培养基的配方为:3.2%(w/v)酵母提取物,0.8%(w/v)蛋白胨,10mM Tris-HCl,100mM NaCl,pH 7.4。)中,置于220rpm摇床培养,培养温度为30℃。当OD600达到0.25时,向菌液中添加0.1mM IPTG(isopropyl-β-d-thiogalactoside),20℃,220rpm诱导表达24h。
(2)在蛋白诱导表达结束后,4℃,6000rpm离心收集菌体并称重,用PBS缓冲液清洗菌体三次。每1.0g湿菌体用6mLPBS缓冲液悬浮,向PBS悬浮液中添加1mM MgCl2和20mM咪唑,置于冰上摇床孵育2-3h。
(3)低温超高压破碎孵育后的菌体,压力为1200bar,共破碎三次。4℃,24,000×g离心去除细胞碎片,将收集的上清液置于4℃,300,000×g条件下超高速离心40min,细胞膜沉淀进行收集。
(4)用适量PBS缓冲液悬浮细胞膜沉淀,加入10×CMC的表面活性剂LDAO,置于冰上摇床过夜,4℃,300,000×g离心40min得到AgrC蛋白粗提液。
(5)对AgrC蛋白进行第一步纯化,纯化方式为金属离子螯合层析(Immobilized Metal Affinity Chromatography,IMAC)技术。用20mM咪唑平衡Ni-NTA琼脂糖凝胶20min,将蛋白粗提液添加到琼脂糖凝胶中作用5min,待目的蛋白与镍离子结合完成后,利用Binding buffer去除未结合的非特异性蛋白,最后用500mM的Elution buffer洗脱目的蛋白并收集。
(6)对AgrC蛋白进行第二步纯化,纯化方式为尺寸排阻层析(SizeExclusion Chromatography,SEC)技术。将用金属离子螯合层析纯化后的目的蛋白浓缩到5ml以内,通过Superdex 200层析柱进行二次纯化。流动相组成为:10mM HEPES,100mM NaCl,0.1%LDAO(5×CMC),10%甘油(v/v),pH 7.4。设置参数为:流速0.8ml/min,压力0.6MPa。
(7)利用SDS-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)检测经过两步纯化后的目的蛋白纯度和分子量大小。按照比例将蛋白样品与5×Protein loading buffer混匀,37℃孵育30min。200V电泳30min后染色并脱色,观察检测结果,如图1所示。
二、AgrC蛋白的定量检测
AgrC蛋白含量的测定可选用本领域任何一种检测蛋白浓度的方法。本发明根据上海生工BCA法蛋白浓度测定试剂盒的说明书定量检测纯化后的AgrC蛋白,具体步骤如下:
(1)按照上海生工BCA法蛋白浓度测定试剂盒说明书的要求配制BCA工作液,用1×PBS对标准蛋白做适当倍数的稀释,通过测定不同浓度的标准蛋白在A562下的吸光度制作标准曲线。
(2)取6个1.5ml离心管,其中两管作为空白对照,将纯化后的蛋白做适当浓度的稀释后分别添加到另外四个离心管中,每两管作为一组平行实验。
(3)向6个离心管中分别加入1ml BCA工作液,将液体迅速混匀后置于60℃水浴中作用30min,室温放置10min。
(4)利用分光光度计分别测定空白组和实验组的吸光值(562nm),在标准曲线上计算出该样品经过稀释后的蛋白浓度,最终根据稀释倍数得到原蛋白样品的浓度,计算公式如下:
蛋白质浓度(μg/mL)=稀释后的浓度×稀释倍数
三、脂质体的制备
制备5ml,2mM脂质体,磷脂组成为二油酰磷脂酰胆碱(DOPC)、1,2-二软脂酰基-sn-甘油基-3-膦钠盐(DPPA)、胆固醇(CHOL)(三者的摩尔比为2:2:1)。按比例称取DOPC、DPPA和胆固醇,将三种物质溶解在三氯甲烷和甲醇(三氯甲烷与甲醇的体积比为2:1)的混合液中漩涡震荡,待磷脂粉末完全溶解后打开瓶盖,旋转瓶身并加热,使液体自然挥发,最后在玻璃瓶内壁上形成均匀的脂膜;置于真空干燥箱中干燥3h以上,去除未蒸发的有机溶剂;用预热的HEPES缓冲液水化干燥后的脂膜,漩涡震荡使其充分溶解,并在高于磷脂相变温度的条件下孵育1h,漩涡震荡多次以形成多室的囊泡;水化后的悬液在60℃水浴中超声20min,最终得到均匀的单室囊泡。
四、蛋白脂质体的重构及活性测定
(1)蛋白脂质体的重构
利用表面活性剂介导的方法将提取并纯化后的AgrC蛋白镶嵌到脂质体中形成蛋白脂质体。
具体步骤如下:按照脂质体:蛋白=500:1(mol/mol)的比例将纯化后的AgrC蛋白加入到LDAO表面活性剂溶解后形成的胶束溶液中,置于室温下孵育40min。用甲醇清洗Bio-Beads SM-2,剧烈震荡30min,重复两次实验,用过膜水清洗三次,置于4℃冰箱中保存备用。向加入蛋白的胶束溶液中添加10mg Bio-Beads SM-2,冰上摇晃40min,重复三次实验。再添加10mg Bio-Beads SM-2,冰上摇晃过夜,保证表面活性剂被完全去除。10,000rpm离心5min,以去除未镶嵌的蛋白。
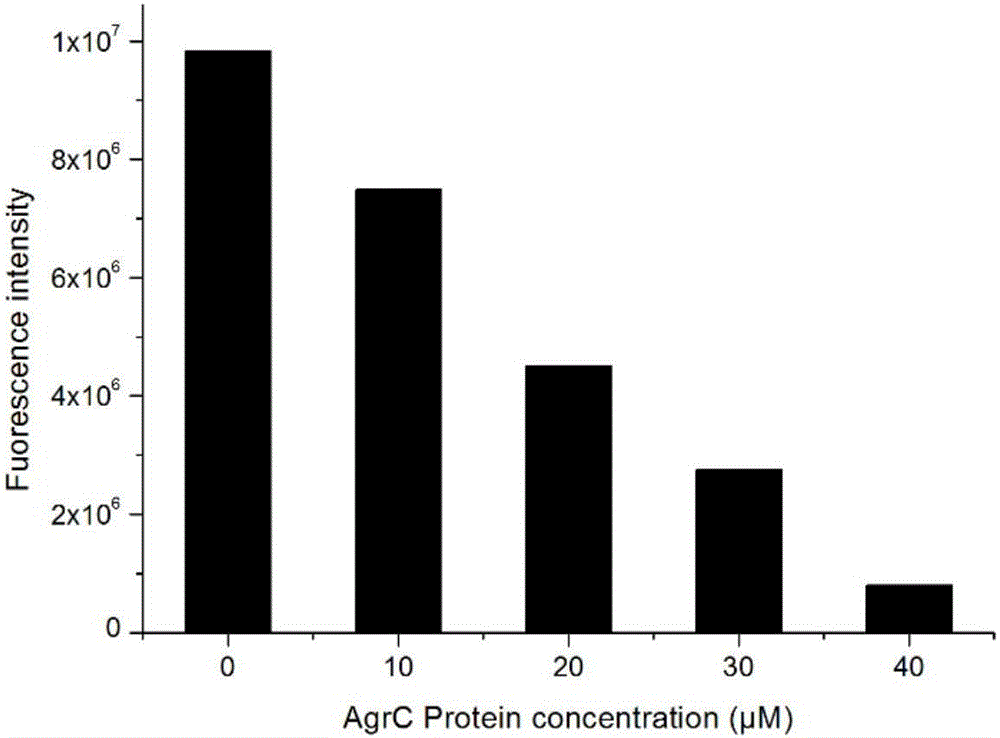
(2)重构蛋白脂质体的活性测定
本发明的药物筛选模型是根据药物单体对蛋白脂质体中AgrC蛋白激酶活性抑制率的大小来进行筛选。重构后蛋白脂质体中的AgrC蛋白还必须保持活激酶性,故需测定其活性。
蛋白脂质体激酶活性的测定实验在96孔板中进行,50μl反应体系中包括10mM MgCl2,2μM ATP,HEPES缓冲液以及梯度浓度的AgrC蛋白,37℃反应10min,向每个体系中添加50μl ATP荧光检测试剂,37℃反应10min,利用酶标仪测定反应结果,如图2所示。
五、药物筛选模型的构建及评价
(1)羟乙基哌嗪乙硫磺酸缓冲液(HEPES)缓冲液的影响
脂质体干燥成膜后,预热的HEPES缓冲液水化脂质体并使其呈现单室囊泡状态,因此本发明考察HEPES缓冲液对药物筛选模型使用情况的影响。反应条件:10mM MgCl2,2μM ATP,添加不同梯度浓度的HEPES缓冲液,其余部分用超纯水补足至50μL,37℃反应10min,加入50μL荧光染料,37℃反应10min后用酶标仪观测结果。如图3显示,HEPES缓冲液对药物筛选模型中的AgrC蛋白激酶活性无影响。
(2)二甲基亚砜(DMSO)的影响
由于大多数药物单体化合物均溶解于DMSO,因此本发明考察DMSO对药物筛选模型使用情况的影响。反应条件:10mM MgCl2,2μM ATP,添加不同梯度浓度的DMSO,其余部分用超纯水补足至50μL,37℃反应10min,加入50μL荧光染料,37℃反应10min后用酶标仪观测结果。如图4显示,DMSO对药物筛选模型中的AgrC蛋白激酶活性无影响。
(3)空脂质体的影响
为了模拟膜蛋白在细胞膜上的环境,所以将AgrC蛋白镶嵌到脂质体中形成蛋白脂质体,这是构建药物筛选模型的基础。因此本发明考察空白脂质体对药物筛选模型使用情况的影响。反应条件:10mMMgCl2,2μM ATP,添加不同梯度浓度的空脂质体,其余部分用超纯水补足至50μL,37℃反应10min,加入50μL荧光染料,37℃反应10min后用酶标仪观测结果。如图5显示,空白脂质体对药物筛选模型中的AgrC蛋白激酶活性无影响。
根据Kinase-Glo Luminescent Kinase Assay试剂盒说明书配制50μL反应体系,实验组中添加药物单体化合物。由上述结果可知,HEPES缓冲液、DMSO和脂质体对AgrC蛋白的激酶活性没有影响,然而为了最大程度的避免误差,在药物筛选模型中设置了三个对照,
阳性对照是以等体积的空脂质体代替蛋白脂质体;
阴性对照是以等体积的DMSO代替中药单体化合物;
空白对照是以等体积的空脂质体和等体积的DMSO分别代替蛋白脂质体和中药单体化合物。
酶活抑制率计算公式如下:
酶活抑制率=[1-(LP-LY/LK-LN)]×100% (A)
在上述的公式中,LY代表样品实验组的荧光值;LP代表阳性对照组的荧光值;LN代表阴性对照组的荧光值;LK代表空白对照组的荧光值。
其中阳性对照组和样品实验组的差值是指在添加的药物与目的蛋白发生作用,AgrC蛋白的激酶活性可能发生变化后,由于AgrC蛋白消耗ATP而使整个体系减少的荧光值,这部分不仅能够直观表示出药物对蛋白活性有无影响,同时也去除了药物本身对体系荧光值的影响。空白对照组和阴性对照组之间的差值表示,在没有其他药物抑制蛋白活性时,由于AgrC蛋白自身的激酶活性消耗ATP而使整个体系减少的荧光值。最后根据(A)所示的公式可计算出添加的药物对目的蛋白的酶活抑制率。
六、药物单体化合物的筛选
(1)药物单体预处理
对筛选出的具有不同功能特性的中药单体化合物进行预处理。DMSO对激酶活性测定实验没有明显影响,因此本发明统一使用DMSO作为溶剂溶解样品。在1mL DMSO中添加2mg中药单体,漩涡震荡使其完全溶解,取2μL作用于50μL反应体系,使其终浓度为80mg/L。
(2)单体对蛋白酶活抑制率的测定
在96孔板中进行,实验组包括10mM MgCl2,2μM ATP,2μL中药单体化合物以及一定量的AgrC蛋白脂质体,其余部分用HEPES补足至50μL;阳性对照以等体积的空脂质体代替蛋白脂质体;阴性对照以等体积的DMSO代替中药单体化合物;空白对照中不添加蛋白脂质体和中药单体,作为代替的分别是等体积的空白脂质体和DMSO。每组实验液混合均匀后,将96孔板置于37℃反应10min,每个反应孔内添加50μL荧光染料,37℃反应10min,用酶标仪观测荧光值的变化,按照公式(A)计算酶活抑制率。
本发明对14种中药单体化合物进行了酶活抑制剂的筛选,结果如图6所示:其中大黄酸(rhein)和芦荟大黄素(aloeemodin)对AgrC蛋白的酶活抑制率较高,分别为25.91%和21.19%;葛根素(puerarin)和芹菜素(apigenin)对AgrC蛋白的酶活抑制率处于10%-20%之间;其它10种中药单体化合物对蛋白的抑制效果较低,其中盐酸小檗碱(berberine hydrochloride)和粉防己碱(tetrandrine)的酶活抑制率仅2%和1.4%。
表2是现有文献报道的14种中药单体化合物的功能,分别为抗菌、抗肿瘤和抑制蛋白激酶活性,但目前未见关于这些化合物对AgrC蛋白激酶活性抑制的研究报道。
表2 中药单体化合物功效
此结果证明本发明提供的药物筛选模型具有良好的筛选效果,同时具有高通量、特异性强、操作便捷等优点。