一种诱导多能干细胞向间充质干细胞分化的方法与流程
本发明涉及一种将诱导多能干细胞(induced pluripotent stem cells)分化为间充质干细胞(mesenchymal stem cells)的方法。
背景技术:
间充质干细胞(MSC)来源于中胚层,是一种具有自我更新和多向分化潜能的细胞,最初在骨髓中发现,后来在脐带、胎盘、脂肪和肌肉等组织中相继发现。由于MSC具有可扩增性、多向分化和低免疫原性,还可调控免疫反应和旁分泌功能,因此被认为是组织工程中理想的种子细胞和临床细胞替代治疗的一种途径。然而,MSC组织来源复杂,使其增殖速度、分泌细胞因子谱和免疫调节能力等生物学特性具有差异,此外提取的可行性和可提取的数量等问题导致对细胞的质控较复杂。因此获得来源相同、质量统一的MSC非常重要。
诱导多能干细胞(iPSC)是由成体细胞经转录因子(Oct4、Sox2、Klf4和c-Myc)导入重编程而来的具有与胚胎干细胞相似功能的细胞,不但具备自我更新和多向分化潜能,还克服了胚胎干细胞存在的伦理和免疫原性等问题,成为研究人来疾病发病机制、组织细胞替代治疗的重要细胞来源。以iPSC作为来源细胞,可以将其在体外扩增并诱导分化为特定的组织细胞。
目前,从ESC和iPSC诱导分化为MSC的方法很多,以拟胚体(Embryoid body ,EB)法为主,主要存在诱导过程复杂、时间长和效率不高等缺点。
技术实现要素:
本发明的目的是提供一种诱导多能干细胞分化间充质干细胞的方法,可以解决传统方法诱导过程复杂、诱导时间长、诱导效率不高的缺点,为提供统一来源、足量、质优的MSC打下基础。
本发明建立了一个简便、高效诱导人多能干细胞分化为间充质干细胞的方法,不需经拟胚体形成,直接将iPSC诱导分化为MSC,其方案是先将iPSC解离为单细胞,随后使用分化培养基诱导其分化为间充质样干细胞,再进一步培养使其成熟,包括以下步骤:
(1)制备iPS单细胞悬液。
将iPSC解离成单个细胞后重悬。
其中可使用含ROCK抑制剂的 mTeSR 培养液重悬细胞。
(2)诱导分化。
将单细胞悬液接种于细胞培养板上,使用分化培养基B进行培养,再更换为分化培养基A。
细胞在37℃、5%CO2条件下分化培养基B培养24~48h;随后分化培养基A继续培养8~12d。
所述细胞培养板为I型胶原蛋白包被细胞培养板。
(3)诱导成熟。
将形成的MSC-Like细胞使用0.25%胰酶消化,MSC培养液重悬细胞,接种于新的I型胶原包被的细胞板中,采用MSC培养液进行培养。
所述MSC培养液为基础培养基中添加%FBS、GlutaMAX-I和非必需氨基酸的培养基。
本发明的另一个目的是提供一种诱导多能干细胞分化成间充质干细胞的分化培养基。
如上述步骤(1)中将iPSC解离为单个细胞所用解离液为Accutase,消化iPSC的温度为37℃,时间为7min。
如上述步骤(2)中所述,所述分化培养基A是在基础培养基中添加血小板衍生因子(PDGF AB)、地塞米松和10%胎牛血清(FBS)的培养基;所述分化培养基B为分化培养基A和mTeSR1培养基的混合液;所述细胞培养板为I型胶原蛋白包被细胞培养板。
如上所述分化培养基A中PDGF AB的终浓度为0.5~20ng/ml,地塞米松的终浓度为50~150Mm;所述分化培养基B中mTeSR1培养基的终浓度为30%~70%(体积百分含量)。
优选地,上述分化培养基A中PDGF AB的终浓度为5ng/ml,地塞米松的终浓度为100nM。优选地上述分化培养基B中mTeSR1的终浓度为50%。
如上述步骤(2)中,所述分化培养基A中的基础培养基为DMEM、α-MEM、DMEM/F12,优选地基础培养基为α-MEM。
如上述步骤(2)的培养条件为37℃培养24~48h, 优选48h,上述步骤(3)中培养条件37℃培养8~12d, 优选10d。
附图说明
图1为iPSC诱导分化为MSC的技术路线图。
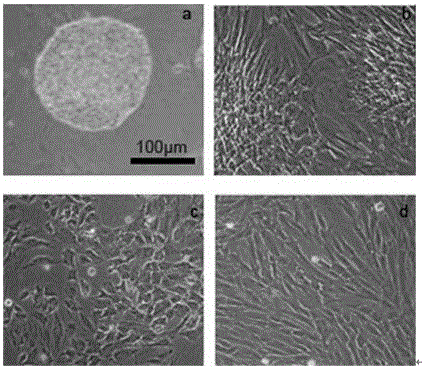
图2为iPSC和MSC形态图。左图为iPS集落明场图,右图为诱导分化后的白光下MSC中Scale bar=100μm。
图3为iPSC诱导分化为MSC过程中相关基因的相对表达量。
图4为流式细胞术检测由iPSC诱导分化的MSC表面标志物。
图5为iPSC诱导分化的MSC在体外培养过程中的生长曲线,呈“S”型生长。
图6为由iPSC诱导分化的MSC的成骨、成脂和软骨分化后染色鉴定图。a为诱导分化为成脂细胞的油红O染色鉴定;b为诱导分化的成脂细胞的茜素红S染色鉴定;c为诱导分化的软骨细胞阿辛蓝染色鉴定。其中放大倍数为100×。
图7为诱导分化的MSC的成骨、成脂和软骨分化后特异性基因表达检测图。
具体实施例
本发明公开了一种诱导多能干细胞分化间充质干细胞的方法,下面结合具体实施例对本发明作更进一步的说明,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
下述实施例中所用的实验方法如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明实施例对使用分化培养基培养方法使人iPSC向MSC分化诱导的情况进行说明。
(1)本发明的试验路线示意图(图1)。
(2)用于流式细胞术分选 MSC 的荧光标记抗体如下:
荧光素PE标记的抗人表面识别分子CD29抗体(SC59829,Santa Cruz )
荧光素APC标记的抗人表面识别分子CD44抗体(170441,Affymetrix eBioscience )
荧光素FITC标记的抗人表面识别分子CD34抗体(110349,Affymetrix eBioscience )
荧光素PerCP-Cyanine5.5标记的抗人表面识别分子CD90抗体(450909,Affymetrix eBioscience )
荧光素PE标记的同型对照抗体(sc2867,Santa Cruz)
荧光素APC标记的同型对照抗体(174031,Affymetrix eBioscience )
荧光素FITC标记的同型对照抗体(114714,Affymetrix eBioscience )
荧光素PerCP-Cyanine5.5标记的同型对照抗体(454714,Affymetrix eBioscience )
(3)用于qPCR和RT-PCR检测的引物序列如下:
实施例1 诱导人iPSC向MSC的分化
1.人iPS细胞的培养
本实施例中,使用的人iPS细胞(DYR0100,中国科学院细胞库)培养在Matrigel(BD,354277)上,用mTeSRTM1(STEMCELL TECHNOLOGIES,05850)维持培养,如图2a所示。具体培养方法包括以下步骤:
①从冰箱中取出培养基及所需试剂, 37℃水浴锅中预热15min左右;
②取出细胞,吸弃原培养基,用DPBS(no calcium, no magnesium)(Invitrogen ,14190250)将细胞洗一遍;
③加入1mg/ml胶原酶IV(溶解于HBSS缓冲液中,0.22μm过滤除菌)(Invitrogen 17104019)进行消化,置于37℃细胞培养箱中孵育5min左右,在显微镜下观察,克隆边缘卷起尚未完全脱离培养皿时终止消化;
④吸弃胶原酶IV,用DPBS洗涤后,加入适量mTeSRTM1培养基;
⑤用细胞刮刀或无菌玻璃管将细胞克隆从培养皿底部刮下,转移到离心管,轻轻吹打5~10次使细胞克隆变为大小较均一的小细胞团;
⑥取出提前用Matrigel包被的细胞培养皿,将小细胞团悬液均匀加入到细胞皿中,置于37℃细胞培养箱中培养。每天更换新鲜培养基,一般5~7天传代1次,但当出现细胞克隆过大或过密及出现自发分化等情况时则需及时进行处理。
人iPS细胞向MSC的诱导分化
分化培养基A:在基础培养基α-MEM培养基(Gibco)中添加血小板衍生因子(PDGF AB)(PeproTech,AF10014B)和地塞米松(Sigma,D4902)得到的培养基。分化培养基A中,PDGF AB的终浓度为5ng/ml,地塞米松的终浓度为100nM。
分化培养基B:分化培养基A和mTeSRTM1混合得到的培养基,其中mTeSRTM1培养基的终浓度为50%(体积百分含量)。
诱导人iPS细胞向MSC分化,包括以下步骤:
①解离为单细胞:取培养的iPSC,吸弃原培养液,使用DPBS洗涤1遍,加入Accutase(Invitrogen ,A1110501),在37℃处理5~10min,在显微镜下观察,细胞变圆、集落间细胞间隙变大、细胞开始脱落时终止消化,加入适量α-MEM培养基,吹打重悬细胞,1000rmp离心5min,弃上清,使用分化培养基B重悬细胞;
②诱导分化:取出I型胶原蛋白预包被细胞培养板(greiner bio-one)在室温预热,将iPS单细胞悬液加入到细胞培养板中使用分化培养基B进行培养,48h后更换为分化培养基A培养细胞,每2~3天更换新鲜培养基,培养直至10天;
③流式分选:将获得的MSC-Like细胞使用0.25%Trypsin-EDTA(Gibco)消化成单个细胞,加入1mlPBS后重悬,对细胞进行计数后调整密度,使用抗CD29和CD44的流式抗体(SANTA CRUZ)标记细胞后,使用流式细胞仪(BD FACS AriaII)先对IgG阴性对照组细胞悬液进行流式上样,选出阴性荧光信号区域作为阴性对照,收集荧光强度高于阴性对照组10倍以上的CD29+/CD44+双阳性细胞。
④CD29+/CD44+双阳性细胞的扩增:按5×104/cm2密度将细胞接种于新的细胞板中,加入适量MSC SFM(Gibco,A1033201)培养基对细胞进行培养,如图2所示,获得形态较均一的MSC。
实施例2 人iPS细胞向间充质细胞分化的检测
(1)相关基因在诱导分化过程中的表达情况
Trizol(Invitrogen)法抽提iPS诱导0、3、6、9、12d细胞和iPS-MSC-P2的总RNA,
采用M-MLV第一链合成系统(Invitrogen)反转录为cDNA及SYBR Premix Ex Taq(Takara)进行Realtime PCR检测Nanog、Oct4、CD73、CD105和内参基因actin的表达情况(图3)。随着诱导时间的延长,多能性基因Nanog和Oct4的表达量下降,而CD73和CD105的表达量逐渐升高,MSC-P2仅表达少量的Nnaog和Oct4,而CD73和CD105几乎100%表达。
(2)MSC表面Marker鉴定
将获得的MSC细胞(P2)消化成单细胞悬液,分别加入荧光标记的小鼠抗人单克隆抗体CD29、CD34、CD44和CD90和同型阴性对照小鼠抗小鼠IgG单克隆抗体并混匀,4℃避光孵育30min后加入1%牛血清白蛋白(BSA),混匀,1000rmp离心5min,弃上清,加入适量1%BSA,在流式细胞仪上进行检测相应抗原表达情况,图4所示,获得的MSC的CD29、CD44和CD90表达阳性,阳性率分别为100%、98.62%和99.1%,而CD34表达阴性。
实施例3 人iPS细胞分化的MSC的生长曲线的测定
取人iPS细胞分化的MSC(P5)消化成单细胞悬液,计数后按5×103/cm2的密度铺于24孔细胞中进行培养,分别在接种后每天取3孔细胞计数。图5可知,由人iPS细胞分化而来的MSC在培养过程中呈“S”型生长,2~5d为对数生长期,第6天进入平台期,表面由iPS细胞分化的MSC在体外培养过程中能很好地进行自我更新和增殖。
实施例4 人iPS细胞分化的MSC的三系分化能力的鉴定
取培养至第5代的由人iPS细胞分化而来的MSC,分别采用间充质干细胞成骨、成脂和成软骨分化培养基(Biowit)进行培养,每2~3日换液。
待培养至2~3周,分别对诱导后的成骨细胞、成脂细胞和软骨细胞进行茜素红、油红O和阿辛蓝染色鉴定,并用RT-PCR方法检测PPAR-γ、Osteopontin、ALP、 Aggrecan和Sox9基因的表达。
图6所示,a为诱导分化为成脂细胞的油红O染色鉴定;b为诱导分化的成脂细胞的茜素红S染色鉴定;c为诱导分化的软骨细胞阿辛蓝染色鉴定,均为阳性。对成脂细胞特异性基因PPAR-γ、成骨细胞特异性基因Osteopontin和ALP以及软骨细胞特异性基因Aggrecan和Sox9的RT-PCR检测均为阳性表达(图7)。表明由人iPS细胞分化的MSC具有成骨、成脂和软骨分化能力。
- 还没有人留言评论。精彩留言会获得点赞!