本发明涉及电生理学、分子生物学和植物遗传育种领域,具体地说,涉及一种鉴定棉花苗期耐盐性的方法。
背景技术:
盐碱地及次生盐碱地已成为世界性问题,是限制作物生长及产量的重要因素。我国是世界盐碱地大国之一,盐渍化土壤面积约占我国现有耕地的1/4,并且面积不断扩大,已严重威胁着我国的粮食安全和生态环境,因此准确了解植物对盐胁迫的生理响应已成为人们日益关注的焦点(萨如拉等,2014)。棉花是耐盐性较强的作物之一,它以其较好的耐盐性逐渐成为盐碱地一种新的优势作物。目前,我国已成为世界上盐碱地植棉规模最大的国家,据不完全统计,我国植棉区内盐碱地约有1.7×108hm2,其中2.7×106hm2先后开发植棉(刘雅辉等,2014),因此提高和改良棉花品种的抗盐碱能力已经成为棉花育种中重点目标,而建立棉花耐盐简便的鉴定方法对于耐盐性育种显得尤为重要。而从丰富的棉花品种资源中筛选鉴定适合在盐碱地开发的耐盐品种显得尤为重要,建立简便快速的耐盐性鉴定方法则是棉花耐盐品种选择和育种研究的基础。耐盐性的鉴定评价方法很多(刘国强等,1993;孙小芳等,2001;张国伟等,2011;王俊娟等,2011),如发芽期筛选法、苗期鉴定法、营养液筛选法、大田鉴定法等;但大多耐盐性鉴定方法复杂,测定周期长,且实际利用过程中由于处理条件、评价指标和分级标准的差异,往往导致同一材料耐性级别不同,限制了在实际生产中的应用(张鹏等,2013;姜静涵等,2013;彭振等,2014;刘学等,2015)。因此,建立一种操作简单、指标明确的鉴定方法对于我国棉花种质资源的快速筛选具有重要意义。
盐分协迫对植物的伤害主要是通过离子胁迫,使细胞质膜损伤,选择透性破坏,近年来关于盐胁迫下离子的吸收与积累的研究越来越受到重视。一些研究认为,许多植物能够忍耐土壤中高浓度的盐分,主要和植物自身在盐渍环境中维持细胞质中较低的Na+含量有关(Haq et al.2002;Takahashi et al.2007);在高盐条件下,促进Na+外排是减低植物细胞质中Na+含量的重要策略(Chinnusamy et al,2005)。Na+的外排主要依靠位于质膜上的Na+/H+逆向转运蛋白(SOS1)来完成(Zhu,2003),SOS1把细胞内的Na+分别泵到胞外,从而降低细胞质中的Na+浓度,进而减少Na+对细胞质中细胞器的毒害(Blumwald,2000;He et al,2015)。
技术实现要素:
本发明的目的是提供一种鉴定棉花苗期耐盐性的方法。
为了实现本发明目的,本发明的鉴定棉花苗期耐盐性的方法,利用非损伤微测技术测定盐胁迫下棉花幼苗胚轴和叶肉组织中Na+离子流,同时结合盐胁迫下棉花幼苗胚轴和叶肉组织中GhSOS1基因的表达情况,从而区分耐盐性差异的棉花种质材料。
本发明方法中,棉花幼苗的耐盐性与胚轴中Na+离子流呈负相关(偏相关系数为-0.77),与叶肉组织中Na+离子流呈正相关(偏相关系数为0.45)。
在盐胁迫48h内,GhSOS1基因的表达呈先增加后降低的单峰曲线变化,且在盐胁迫12-18h内品种间差异显著;棉花幼苗的耐盐性与胚轴中GhSOS1基因的表达呈负相关(偏相关系数为-0.69),与叶肉组织中GhSOS1基因的表达呈正相关(偏相关系数为0.53);且GhSOS1基因的表达水平与Na+离子流呈正相关。
本发明所述棉花种质材料包括但不限于中571、中棉所49、中棉所44和新陆中61。
前述方法中,棉花种子经消毒处理,用水漂洗后,在水中浸种催芽直至露白,然后播种于沙壤土中培养至三叶期,进行盐胁迫处理,然后利用非损伤微测技术测定棉花幼苗胚轴和叶肉组织中Na+离子流,同时利用qRT-PCR法测定胚轴和叶肉组织中GhSOS1基因的表达水平,从而区分耐盐性差异的棉花种质材料。
本发明的鉴定棉花苗期耐盐性的方法具体包括以下步骤:
1)棉花种子用9%的双氧水消毒30min,用水漂洗数次后用去离子水浸种催芽直至露白,播种于灭菌的沙壤土中培养至三叶期,进行盐胁迫处理,使其土壤终含盐量为0.3%;为保持土壤中的水分及营养,每隔两天浇100mL水,每隔5天浇100mL Hoagland营养液;
2)盐胁迫处理9天后,利用非损伤微测技术测定棉花幼苗胚轴及叶肉组织Na+离子流速,具体如下:从幼苗子叶节处切去地上部枝叶部分,保留地下部作为胚轴样品,切取第三叶片的中间部位作为叶肉组织样品;将测定的样品用去离子水冲洗干净,并将其浸没在蒸馏水中15min,浸入100mL测试液中平衡15min,再转入新的100mL测试液中开始测试;测试部位距样品位置300μm处;测试持续7-10min,舍弃前2-3min的数据;其中,所述测试液配方为:0.1mmol L-1KCl、0.1mmol L-1CaCl2、0.3mmol·L-1MES,pH 6.0;
3)盐胁迫处理9天后,利用qRT-PCR法测定胚轴和叶肉组织中GhSOS1基因的表达水平,以GhUBQ7基因作为内参;设计的qRT-PCR特异性引物分别为:
GhUBQ7-F:5′-GAAGGCATTCCACCTGACCAAC-3′
GhUBQ7-R:5′-CTTGACCTTCTTCTTCTTGTGCTTG-3′;以及
GhSOS1-F:5′-CCCTTCCTTCTAGTGTCCGC-3′
GhSOS1-R:5′-AAGCCCAACGTACTCCCATG-3′;
4)根据步骤2)和3)的分析结果,区分出耐盐性差异的棉花种质材料。
步骤1)中培养条件为:光照强度400μmol m-2s-1,光照/黑暗时长为14h/10h,光照时的培养温度为30±2℃,黑暗时的培养温度为20±2℃。
步骤3)qRT-PCR的反应条件为:95℃30s;95℃5s,60℃35s,40个循环;
反应体系为:2×UltraSYBR Mixture(With ROX1)10μl,正向引物0.4μl,反向引物0.4μl,DNA模板0.8μl,RNase-Free Water 8.4μl。
本发明进一步提供所述方法在筛选耐盐性棉花品种中的应用。
本发明首次利用非损伤微测技术测定棉花幼苗胚轴和叶肉组织中Na+离子的动态变化情况(而常规方法是测定根系中Na+离子变化),结果表明,幼苗的耐盐性与胚轴中Na+离子流呈反比,与叶肉组织中Na+离子流呈正比,可以有效地区分耐盐性差异的棉花种质材料。同时,本方法还从基因水平上研究盐胁迫下胚轴和叶肉组织中GhSOS1的表达情况。结果表明,在盐胁迫48h内,GhSOS1的表达呈先增加后降低的单峰曲线变化,且在盐胁迫12-18h内品种间差异较大;幼苗的耐盐性与胚轴中GhSOS1的表达呈反比,与叶肉组织中GhSOS1的表达呈正比,从基因角度进一步明确不同种质间耐盐性的遗传背景差异。
利用本发明方法,根据盐胁迫下不同耐盐性棉花品种在Na+吸收动态变化趋势上的明显差异,可以利用Na+离子流以及Na+平衡相关基因的差异快速、准确地鉴定棉花品种的耐盐性,具有一定的实用价值,是一种稳定高效简便的棉花苗期耐盐性鉴定的方法。
附图说明
图1为本发明实施例中利用SIET技术测定棉花幼苗的胚轴(a)和叶肉(b)组织中Na+离子流的示意图。
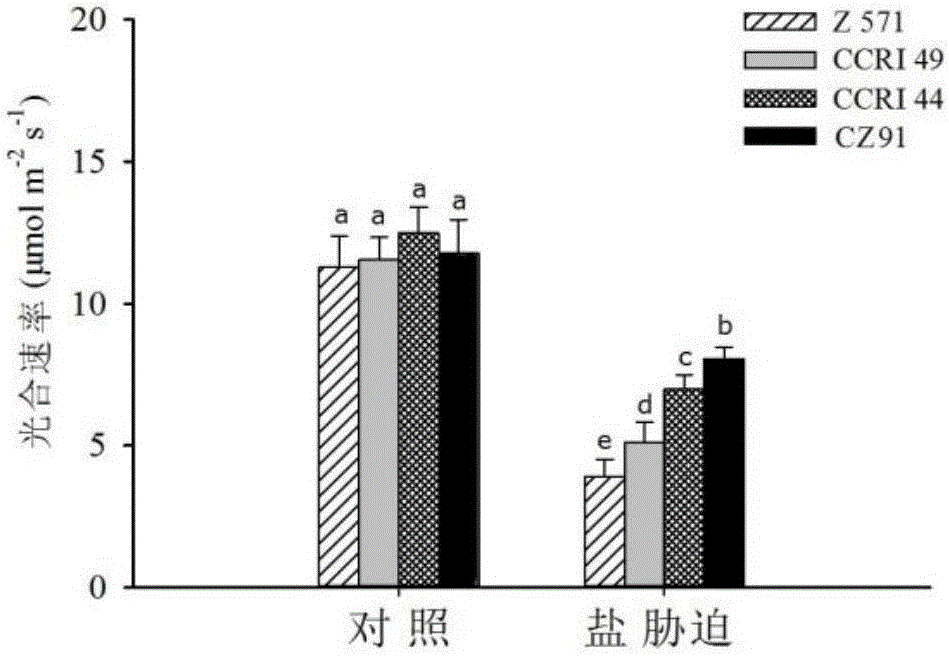
图2为本发明实施例中盐胁迫下不同棉花幼苗的光合速率变化情况;其中,标以不同字母的柱值在P<0.05水平上差异显著。
图3为本发明实施例中盐胁迫下不同棉花幼苗胚轴(a)和叶肉(b)组织中Na+离子流变化情况。
图4为本发明实施例中盐胁迫下不同棉花幼苗胚轴(a)和叶肉(b)组织中GhSOS1表达量变化情况;其中,标以不同字母的柱值在P<0.05水平上差异显著。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(Sambrook J&Russell DW,Molecular Cloning:a Laboratory Manual,2001),或按照制造厂商说明书建议的条件。
实施例 鉴定棉花苗期耐盐性的方法
1材料与方法
供试品种和盐胁迫处理;以盐敏感型中571(Z571)、中等耐盐型中棉所49(CCRI49)和中棉所44(CCRI 44)、强耐盐型CZ91(新陆中61优系)为研究对象,在中国农业科学院棉花研究所光照培养箱内进行,光照培养室温度为(30±2)℃/(20±2)℃,光照/黑暗时间为14h/10h,光照强度为400μmol m-2s-1。种子用9%的双氧水消毒30min,清水漂洗数次后用去离子水浸种催芽直至露白,均匀播于高温灭菌过的沙壤土中,在培养箱中培养到三叶期,进行盐胁迫处理,使其土壤终含盐量为0.3%;盐胁迫处理9天后,测定不同处理条件下各指标。为保持土壤中的水分及营养,每隔两天浇100ml的水,每隔五天浇100ml的Hoagland营养液。
光合速率的测定;在9:00~11:00之间用Li-6400(Li-COR,Lincoln,USA)光合仪测定幼苗倒4叶的净光合速率,测定时光照强度设定为1000μmol m-2s-1,CO2浓度为400μmol mol-1,叶室温度a为25℃。
Na+含量的测定;取盆中待测植株,先用去离子水浸泡10min后,再用蒸馏水冲洗干净,并用吸水纸吸去表面附着的水分;将幼苗根及地上部(茎和叶)分开,分别于105℃杀青30min后,80℃下烘直至恒重,称其干物质量.将烘干后的植株粉碎过筛,用1mol L-1HCl浸提12h并振荡30min后过滤,用原子吸收分光光度计(SpectAA-50/55,Varian,Australia)测定Na+浓度。
离子流速测定;采用非损伤微测技术(BIO-001A,Younger USA Sci.&Tech.Corp.,Amherst,MA,USA)测定幼苗胚轴及叶肉组织Na+离子流速;选生长整齐的棉花幼苗,用刀片从幼苗子叶节处切去地上部枝叶部分,保留地下部作为胚轴样品(见图1a),切取第三叶片的中间部位(约5×5mm)作为叶肉组织样品(见图1b);将测定的样品用去离子水冲洗干净,并将其浸没在蒸馏水15min,浸入100mL测试液中平衡15min,再转入新的100mL测试液中开始测试。测试液配方:0.1mmol L-1KCl、0.1mmol L-1CaCl2、0.3mmol·L-1MES,pH 6.0;每处理测定8株幼苗,测试部位距样品位置300μm处;测试持续7~10min(达到稳定状态),舍弃前2~3min的数据。
离子运转体表达;应用qRT-PCR技术研究盐胁迫3h、6h、12h、24h、48h后,胚轴和叶肉组织中Na+运转体GhSOS1基因表达水平。参照孟艳艳等(2011)改良的CTAB法提取总RNA,逆转录合成cDNA。采用Primer Express3.0软件设计qRT-PCR引物,以棉花中的GhUBQ7基因(GenBank登录号:DQ116441)作为内参,根据GhSOS1(GenBank登录号:KM986873)设计荧光定量PCR特异性引物,引物序列分别为:1)GhUBQ7-F:5′-GAAGGCATTCCACCTGACCAAC-3′,GhUBQ7-R:5′-CTTGACCTTCTTCTTCTTGTGCTTG-3′;2)GhSOS1-F:5′-CCCTTCCTTCTAGTGTCCGC-3′,GhSOS1-R:5′-AAGCCCAACGTACTCCCATG-3′。采用SYBR green Ⅱ荧光染料(TaKaRa,Japan)法进行荧光定量RT-PCR分析。反应体系为:2×UltraSYBR Mixture(With ROX1)10μl,正向引物0.4μl,反向引物0.4μl,DNA模板0.8μl,RNase-Free Water 8.4μl。扩增条件为:95℃30s;95℃5s,60℃35s,40个循环,结果采用对基因相对表达量进行分析(Livak et al.2001)。
数据统计;所有实验至少独立重复3次,各次结果趋势一致,取其中具有代表性的数值进行统计分析。采用SPSS 16.0(SPSS Inc.Chicago,USA)处理数据,以Duncan’s多重比较进行差异显著性检验(P<0.05)。
2结果与分析
在正常条件下,不同品种的光合速率在11.3~12.5μmol m-2s-1之间,且品种间无显著差异;盐胁迫处理显著的降了各品种的光合速率,光合速率在3.9-8.1μmol m-2s-1之间;其中,Z571的光合速率降低幅度最高(下降了65.4%),而CZ91的的光合速率降低幅度最的低(下降了31.6%)。
利用SIET技术探究了盐胁迫9天对不同棉花幼苗胚轴和叶肉组织中Na+离子流的影响(见图3)。结果表明,盐胁迫显著的提高了Na+离子向地上部的运输,且不同基因型棉花的Na+离子运转及再分配存在着明显的差异;盐胁迫下,Z571向地上部运输Na+的速率为39874pmol cm-2s-1,显著高于其他品种,运输Na+的速率最低的品种为CZ91,速率仅为8413pmol cm-2s-1。盐胁迫也显著的增加了叶片中Na+离子的外流,其中Na+离子外流速率最高的为CZ91,外流速率增加了96%。
盐胁迫下,各品种胚轴和叶肉组织中GhSOS1的表达呈先增加后降低的单峰曲线变化,且在盐胁迫12-18h内品种间差异较大;盐胁迫条件下,盐敏感品种Z571胚轴中GhSOS1的表达受影响最显著,表达增加了2.1倍(12-18h的平均值);而在叶肉组织中,强耐盐品种CZ91受盐胁迫影响最为显著,其中在盐胁迫处理12h时,CZ91的GhSOS1表达上调了4.5倍,显著高于其他品种(见图4)。
线性相关分析是研究2个变量间线性关系的一种基本方法。为了进一步明确离子流和GhSOS1基因与棉花耐盐性的关系,分别对上述指标与光合速率进行Pearson相关性分析。如表1所示,光合速率与胚轴Na+离子流、胚轴GhSOS1呈显著地负相关,相关系数分别为-0.77和-0.69;光合速率与叶肉组织Na+离子流、叶肉组织GhSOS1呈正相关,相关系数分别为0.45和0.53;与此同时,Na+离子流与GhSOS1呈显著地正相关,胚轴和叶肉组织中Na+离子流与GhSOS1的相关系数分别为0.97和0.94。
表1 不同耐盐性指标间的Pearson相关性
注:*表示在P<0.05水平上差异显著;GhSOS1表达量为12-18h平均值
本发明通过电生理和分子技术的相结合,建立了一种高效准确的室内鉴定棉花幼苗耐盐性的方法。利用非损伤微测技术测定棉花幼苗胚轴和叶肉组织中Na+离子流,可以有效地区分耐盐性差异的棉花种质材料;耐盐性与胚轴中Na+离子流呈显著的负相关,与叶肉组织中Na+离子流呈正相关。GhSOS1的表达水平在盐胁迫12-18h内品种间差异最大,且与Na+离子流呈显著地正相关,与各品种的耐盐性也具有较高的相关性。研究表明,可以通过电生理技术测定棉花种质胚轴和叶肉组织中Na+离子流有效的筛选耐盐性材料,同时通过盐胁迫下GhSOS1的表达情况,从基因的水平上进一步明确不同种质间耐盐性的遗传背景差异。
本发明选用4个耐盐性差异显著的棉花品种为材料,利用沙壤土为培养基质,种植在人工培养箱中,研究盐协迫下各品种各项生理指标,如Na+的积累和分配、光合速率等,同时采用非损伤微测技术(Scanning Ion-selective Electrode Technique,SIET)和qRT-PCR技术,测定了盐胁迫条件下Na+离子流以及Na+运转基因GhSOS1的变化情况。研究还表明,盐胁迫下不同耐盐性棉花品种在Na+吸收动态变化趋势上具有明显差异,可以利用Na+离子流以及Na+平衡相关基因的差异快速、准确地鉴定棉花品种的耐盐性,具有一定的实用价值,是一种稳定高效简便的棉花苗期耐盐性鉴定的方法。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献
[1]姜静涵,关荣霞,郭勇,常汝镇,邱丽娟.大豆苗期耐盐性的简便鉴定方法.作物学报,2013,39(7):1248-1256.
[2]刘国强,鲁黎明,刘金定.棉花品种资源耐盐性鉴定研究.作物品种资源,1993,(2):21.
[3]刘学,周璇,曾兴,张林,王振华,邸宏.玉米芽期和苗期耐盐性鉴定方法的比较分析.玉米科学2015,23(1):115-121.
[4]刘雅辉,王秀萍,鲁雪林,张国新,李九欢,李强.26份棉花耐盐相关种质资源遗传多样性SRAP分析.江苏农业学报,2014,30(1):219-221.
[5]孟艳艳,范术丽,宋美珍,庞朝友,喻树迅.NO对生长发育中棉花叶片NO含量及其对抗氧化物酶的影响.作物学报,2011,37(10):1828-1836.
[6]彭振,何守朴,孙君灵,许菲菲,贾银华,潘兆娥,王立如,杜雄明.陆地棉苗期耐盐性的高效鉴定方法.作物学报,2014,40(3):476-486.
[7]萨如拉,刘景辉,刘伟,焦伟红,白建慧,王占海.盐碱胁迫对燕麦幼苗Na+、K+含量及产量的影响.西北农业学报,2014,23(3):50-54.
[8]孙小芳,刘友良.棉花品种耐盐性鉴定指标可靠性的检验.作物学报,2001,27:794–796.
[9]王俊娟,王德龙,樊伟莉,宋贵方,王帅,叶武威.陆地棉萌发至三叶期不同生育阶段耐盐特性.生态学报,2011,31:3720–3726.
[10]张国伟,路海玲,张雷,陈兵林,周治国.棉花萌发期和苗期耐盐性评价及耐盐指标筛选.应用生态学报,2011,22:2045–2053.
[11]张鹏,徐晨,徐克章,张治安,李大勇,季平,冯引弟.大豆品种耐盐性的快速鉴定法及不同时期耐盐性的研究.中国油料作物学报,2013,35(5):572-578.
[12]Blumwald E.Sodium transport and salt tolerance in plants.Curr Opin Cell Biol,2000,12:431-434.
[13]Chinnusamy V,Jagendorf A,Zhu JK.Understanding and improving salt tolerance in plants.Crop Sci,2005,45:437-448.
[14]Haq TU,Akhtar J,Haq AU,et al.Effect of soil salinity on the concentration of Na+,K+and Cl–in the leaf sap of the four Brassica species.Int J Agric Biol,2002,4:385-388
[15]He Y,Fu J,Yu C,Wang X,Jiang Q,Hong J,Lu K,Xue G,Yan C,James A,Xu L,Chen J,Jiang D.Increasing cyclic electron flow is related to Na+sequestration into vacuoles for salt tolerance in soybean.J Exp Bot,2015,66(21):6877-89.
[16]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the method.Methods,2001,25(4):402-408.
[17]Takahashi R,Nishio T,Ichizen N,et al.Cloning and functional analysis of the K+transporter,PhaHAK2,from salt-sensitive and salt-tolerant reed plants.Biotechnol Lett,2007,29:501-506
[18]Zhu JK.Regulation of ion homeostasis under salt stress.Curr Opin Plant Biol,2003,6:1-5.
序列表
<110> 中国农业科学院棉花研究所
<120> 一种鉴定棉花苗期耐盐性的方法
<130> KHP161117393.4
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 22
<212> DNA
<213> 人工序列
<400> 1
gaaggcattc cacctgacca ac 22
<210> 2
<211> 25
<212> DNA
<213> 人工序列
<400> 2
cttgaccttc ttcttcttgt gcttg 25
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
cccttccttc tagtgtccgc 20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
aagcccaacg tactcccatg 20