真核细胞的培养方法与流程
本申请是申请日为2010年7月6日的、发明名称为“真核细胞的培养方法”的中国专利申请201080039284.5(pct/us2010/041082)的分案申请。
相关申请的交叉引用
本申请要求2009年6月6日提交的美国临时专利申请no.61/223,313号的权益,该临时申请的全部内容通过参考引用的形式并入本文。
本发明涉及在含碳酸氢盐的培养基中培养真核细胞的装置和方法,所述培养基允许在不直接向该培养基中添加碱的情况下维持细胞培养物的ph。
背景技术:
用于细胞建库、用于细胞产品的生产例如重组蛋白生产的细胞培养,受到细胞生长时条件变化的妨碍。虽然不锈钢生物反应器常被用于细胞生产,然而一次性用品(disposables)越来越多的在生物制品的制造的所有阶段中使用(rao等,2009)。在上游工艺中,相比不锈钢制品,一次性的生物反应器存在诸多的优势(从减少交叉污染到成本和时间的节省)。wavebioreactortm是在生物医药工业中用于重组蛋白生产的一次性上游技术的一个文献充分记载的实例(cronin等,2007;haldankar等,2006;ling等,2003;ye等,2009)。
由singh(singh,1999)所开发的wavebioreactortm系统包含预先消毒的、柔性的、一次性的培养室(cellbagtm),co2-和/或o2-空气混合控制器,和用于摇动和加热cellbagtm的气动控制平台。由该平台产生的摇摆(rock)运动在cellbagtm中提供了混合和气体传递。
wavebioreactortm系统可以进一步装备以提供在线ph和溶解氧(do)监控以及实时反馈控制(mikola等,2007;tang等,2007)。然而,对额外设备的需求以及对专门设计的以容纳ph和do探测器的袋子的需求,增加了运营成本和系统的复杂性。另外,在ph控制生物反应器中为使培养物ph增加到规定的设定点所需要的碱加入,会增加培养物的摩尔渗透压浓度。取决于生物反应器中摩尔渗透压浓度增加的程度,在细胞增长和存活力方面的相关衰减(dezengotita等,2002;zhu等,2005)可能抵消ph值控制的优势。另外,如果ph探测器发生故障,由此产生的ph值混乱可能改变细胞代谢并促进细胞死亡(miller等,1988;osman等,2002)。
对于某些细胞培养应用来说严格的ph值和do控制不是必须的,诸如,例如在小规模培养系统如摇瓶和转瓶中用于细胞的维持和扩大的常规细胞传代。然而,ph值和do的极值对细胞生长和生存力是不利的(lin等,1993;link等,2004;miller等,1988;osman等2001),并可影响产品质量(restelli等2006;yoon等,2005)。因此,对于生物制品制造的全阶段,对细胞的生长条件保持一些控制是极其重要的。研究人员先前证明,在6.8-7.3的ph值范围内和在10-100%空气饱和度的do值范围内的cho细胞培养是成功的(link等2004;restelli等2006;trummer等2006;yoon等2005)。
向常规生物反应器增加功能,如实时ph监测和do监控控制,将显著增加生物制品制造中细胞培养的成本和劳动强度。另外,这些功能的失灵或者故障可导致细胞培养的不可接受的变动和潜在的损失,这是非常耗费时间和资源的。
因此,需要用于培养真核细胞的改进方法,该方法将无需引入强碱以及无需额外地进行ph值和do的监测和实时控制。
发明概述
本发明提供了在细胞培养系统中无需加入碱即可维持ph值的装置和方法。在含碳酸氢盐的细胞培养基中,基于碳酸-碳酸氢盐缓冲液平衡(反应式1):
co2+hoh<===>h2co3<===>h++hco3-
ph=pk-log([co2]/[hco3-]),
培养基中co2的量将影响培养基的ph值。
因此,本发明利用这种关系,通过使用细胞培养体系中液相和气相的动态界面来增加或者减少溶解的co2浓度,无需添加强酸或者碱,调整细胞培养基的ph值。本发明提供了一种用于实现此调节的方法和用于实施该方法的装置。
一般地,向本发明的装置供给空气、氧气或者这些气体的组合,以维持细胞培养物的溶解氧。通过向装置的顶部空间提供气体混合物(可以操控其组成和引入速度),取决于液相和气相之间不同的co2浓度,co2可以被加入细胞培养基也可以从中移除。从顶部空间除去co2将增加培养ph值,这是因为培养基中的溶解co2会扩散进入到顶部空间中。相反,当以高于培养基中的浓度向所述装置添加co2时,co2将溶解到培养基中并且培养ph值将减小。本发明提供了一种允许co2转移入和转移出细胞培养物以维持培养ph值而无需添加碱的方法。
因此,本发明提供了一种用于培养真核细胞的方法,包括在容器中在含碳酸氢盐的培养液中培养真核细胞,其中所述容器具有封装细胞培养物的壁和位于所述细胞培养物上方的气相顶部空间。该容器还包括至少一个提供气体自所述顶部空间进出的口(port)。搅动该容器以提供在液相和气相之间的动态界面。可以监测培养物的ph,并且可以通过所述的口向顶部空间供应气体,其中所述气体包含一定量的co2,以随着更多的co2溶解到细胞培养物中而降低ph,或者可以通过该口,从顶部空间排出累积的co2,以使细胞培养物ph值增加。由此ph值被维持在一个预定的范围。
一般地,在细胞培养基中溶解的co2的分压维持在1至200mmhg的量。在某些实施方式中,溶解的co2的分压为10至180mmhg。在某些实施方式中,溶解的co2的分压为20至150mmhg。在某些实施方式中,溶解的co2的分压为100至180mmhg。在某些实施方式中,溶解的co2的分压为20至80mmhg。在某些实施方式中,溶解的co2的分压为30至60mmhg。在某些实施方式中,溶解的co2的分压为35至50mmhg。在某些实施方式中,溶解的co2的分压为40mmhg。
顶部空间清除可以连续地或间歇地进行。
一般地,do值维持在10%以上。在某些实施方式中,do值维持在20%以上。在某些实施方式中,do值维持在30%以上。在某些实施方式中,do值维持在40%以上。在某些实施方式中,do值维持在50%以上。在某些实施方式中,do值维持在60%以上。
在某些实施方式中,气体进入容器的流速是每分钟0.001顶部空间体积(hvm)。在某些实施方式中,气体进入容器的流速是0.005hvm。在某些实施方式中,气体进入容器的流速是0.01hvm。在某些实施方式中,气体进入容器的流速是0.02hvm。在某些实施方式中,气体进入容器的流速是0.05hvm。在某些实施方式中,气体进入容器的流速是0.1hvm。在某些实施方式中,气体进入容器的流速是0.2hvm。在某些实施方式中,气体进入容器的流速是0.5hvm。在某些实施方式中,气体进入容器的流速是0.9hvm。在某些实施方式中,气体进入容器的流速是1.0hvm。
真核细胞可以是脊椎动物细胞,例如但不限于青蛙、兔、啮齿动物、绵羊、山羊、狗、猫、牛、马、猪、非人类灵长类动物或人类的细胞。
该方法可以在具有硬的或者可塑的壁的容器中进行,例如塑料容器或者一次性培养袋。
所述的容器可以通过任何能够在容器中提供液相和气相之间的动态界面的工具来搅动。这种搅动(agitation)可以是例如摇摆(rocking)、定轨运动(orbitalmotion)、八字形运动、转动、振荡(shaking)等。
在某些实施方式中,搅动通过摇摆来实现。摇摆的速度和角度可以调整以达到所需的搅动。在某些实施方式中,摇摆的角度是20°、19°、18°、17°、16°、15°、14°、13°、12°、11°、10°、9°、8°、7°、6°、5°、4°、3°、2°、或者1°。在某些实施方式中,摇摆的角度是6-16°之间。在某些实施方式中,摇摆的角度是在7-16°之间。在某些实施方式中,摇摆的角度是在8-12°之间。
在某些实施方式中,摇摆速度是1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40rpm。在某些实施方式中,摇摆速度是在19-25rpm之间。在某些实施方式中,摇摆速度是在20-24rpm之间。在某些实施方式中,摇摆速度是在21-23rpm之间。
所述方法可以在包含允许气体进出培养物的顶部空间的单个口的容器中进行。或者,所述容器可以包含多数个进出口。
培养物的ph值可以连续地或者间歇性地监测,可以将气体注入到顶部空间,如此提供在顶部空间中的气体的co2水平,以增加或减少培养物液相中的溶解co2的浓度,从而将液相的ph值调整到预定值。
在一个备选实施方式中,所述的方法可以包括步骤:通过培养基进口,将新鲜的培养基灌注到细胞培养物中。所述新鲜的培养基具有在加入后能调节细胞培养物的总ph的ph值,由此通过新鲜培养基的ph值,部分地将细胞培养物维持在预定ph值范围。在培养方法中使用具有预定ph值的新鲜培养基来调整ph值是有帮助的,但是还不足以完全控制ph值。
所述的方法可以适应于任何尺寸的培养。在某些实施方式中,所述的方法在商业可得的一次性生物反应袋中进行。可用容积500ml,1l,2l,10l,20l,50l,100l,200l,500l和1000l的该生物反应袋。
培养的多个参数可以被监测和控制。参数可以通过计算机进行计算,在自动化过程中控制。可以单独或者组合控制的一些参数,包括但不限于,气体流量、ph值、溶解的co2浓度、温度和搅动。
本发明还提供了实施本发明方法的装置。
附图简介
图1显示本发明装置的一个例子,该装置包括灌注过滤器。所述装置包括气体入口和气体出口、用于向培养物提供新鲜培养基的口、用于排出用过的培养基的灌注过滤器、摇摆板和基部。摇摆运动允许搅动以提供在培养基内和外有效的o2和co2传递。
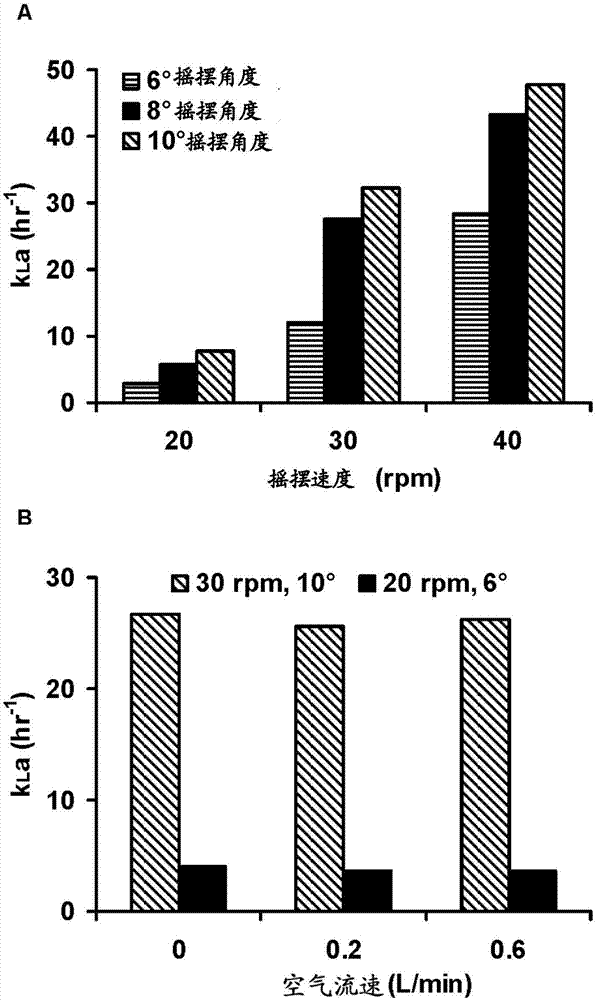
图2显示用于测量在wavebioreactortm中的氧气传递的无细胞研究。(图a)在恒定的0.2l/min空气流速下摇摆速度和摇摆角度对kla的影响;(图b)摇摆速度、摇摆角度和空气流速对kla的影响;(图c)对于不同的摇摆角度、摇摆速度和和恒定的0.2l/min(这里也被称为lpm)气体流速的原始do数据;(图d)对于两个的不同摇摆设定点,以不同的气体流速得到的原始do时间-进程数据。
图3显示:为评估在wavebioreactortm中co2剥离(stripping)速度进行的无细胞研究。(图a);在恒定的气体流速0.2lpm下不同摇摆角度和摇摆速度时原始ph值上升数据;(图b)不同气体流速下两个不同摇摆设定点的原始ph值上升时间-进程数据。(图c)对于图a所示的不同摇摆条件,计算的ph值变化速度;(图d)对于图b所示的不同摇摆条件和不同气体流速,计算的ph值变化速度。实心条是头5分钟的ph值变化速度,空心条是计算出的下面55分钟的ph值变化速度。
图4显示:对于wavebioreactortm分批培养,(图a)vcc,(图b)离线ph值,(图c)离线pco2,以及(图d)离线do曲线。工艺条件在下面表2中概述。对于(ⅰ)生产mabb的细胞系只评估了接种阶段,而对于(ⅱ)生产mabc的细胞系则评估了接种和规模放大阶段(在此期间,工作体积从6l增加到20l)。在每个阶段,在第一天泵入到顶部空间的空气以8%(v/v)、在第二天以5%(v/v)、其后以2%(v/v)补充了co2。
图5显示:对于wavebioreactortm灌流培养,使用生产maba的细胞系,在非优化条件下运行,(图a)vcc、(图b)培养物存活力、(图c)离线ph,以及(图d)do浓度。头6天细胞以分批方式培养,随后以灌流模式培养。在分批培养期间,cellbagtm中的工作容积首先用6l培养物接种,第3天,通过添加新鲜的培养基,将此培养物体积增加到25l。在灌流培养期间,以每天1体积的灌注速度,将培养体积维持在25l。对于这组实验,摇摆速度18rpm,摇摆角度是8度,而进入到顶部空间的空气流速是0.2l/min。对于整个培养持续期间,用5%co2(v/v)补充此空气。
图6显示:分批(0-6天)/灌流(6-14天)过程的细胞培养物生长曲线和ph曲线。(图a)用%pcv表示的收集细胞体积(packedcellvolume);(图b)细胞生活力;(图c)ph值曲线;(图d)由vicelltmas测量的以活细胞数(vcc)表示的细胞生长。
图7显示:来自不同的顶部空间清除速率(hvm)的培养性能。(图a)显示:以一步增加气流来实现顶部空间清除速率增加((◆)为0.1hvm和(-▲-)为0.02hvm)的2个实验。另一种顶部空间清除速率策略是在第10和11天的多步骤增加(0.007hvm至0.013hvm至0.02hvm)(-■-)。(图b)通过nova
图8显示:对于六种不同细胞系——每一种生产一种不同的mab,使用优化工艺进行wavebioreactortm培养,(图a)vcc、(图b)培养物生活力、(图c)离线ph以及(图d)do。在6l接种阶段,培养物以21rpm摇摆,并且进入到顶部空间的空气流速是0.2l/min。第一天以8%(v/v),第二天以5%(v/v),随后以2%(v/v),在该空气中补充co2。在20l放大阶段(第3-6天),重复该空气流方式。在20l灌流模式培养期间(自第6天起),进入顶部空间的空气流速维持在0.6l/min,无co2补充,而在进口气体中o2比空气的混合在第8天由0%(v/v)增加到30%(v/v),并且在剩余的培养期间维持在30%(v/v)。20l分批和灌流培养以23rpm摇摆。所有培养的摇摆角度恒定在10°。
图9显示:在wavebioreactortm(●)和搅拌釜生物反应器(□)中生产mabe的细胞系的平行培养物的(图a)vcc、(图b)生活力、(图c)离线ph以及(图d)离线do。
发明详述
本领域技术人员熟知很多用于培养真核细胞的方案和方法、以及用于该培养的许多培养基。在文献和教科书中描述了这样的方案和培养基,如动物细胞培养,一种实用方法,第2版,rickwood,d.和hames,b.d.编著,牛津大学出版社,纽约(1992)。一般的使用方法也可以在互联网上得到,如:protocol-online.org/prot/cell_biology/cell_culture。细胞培养基也可以从各种熟知的来源购买获得。这里引用的所有文献以参考的形式特此并入。
定义
本文述及或提及的一般细胞培养技术以及工艺是本领域技术人员所熟知、和惯常以常规方法进行使用的。如果适用的话,涉及使用商购试剂盒以及试剂的操作,除非另有说明,否则通常按照制造商所规定的操作方案和/或参数来进行。
在描述本发明方法之前,应当理解的是,本发明不限于所描述的具体方法学、操作方案、细胞系、动物种或属、构建体以及试剂,因为它们当然是可以变化的。还应当理解的是,这里使用的术语仅仅旨在用于描述特定实施方式,而不旨在对本发明范围构成限制,本发明范围仅由后附权利要求限定。
必须注意的是,除非上下文清楚地另有说明,这里以及在后附权利要求书中所使用的,单数形式“a”,“an”,和“the”包括复数对象。在说明书和相关权利要求中所述及的所有数字(例如,1-200mmhg等)应理解为受术语“约”修饰。
本文所提到的所有出版物通过参考而并入本文,以公开和描述与被引用的出版物有关的方法和/或材料。本文引用的出版物因其早于本申请的申请日的公开而被引用。在此无一应被解释为承认本发明人无权依据更早的优选权日或在先发明日而享有早于这些出版物的权利。此外,实际出版日可能不同于所示的日期,需要单独核实。
此处所使用“约”指比所述值多或少10%的值。
此处所使用的“搅动”是指扰动,以便培养物的液相和培养物上方的气相处于动态相互作用中。搅动可以是指运动如振荡、搅拌、摇摆、定轨振荡、滚动、八字型摇荡、或者能使液相处于非静止态从而增加气体在液相内和外的扩散的任何方式。
此处使用的“气体”是指纯气体或者气体的混合物,其可以包括氮气、氧气、以及二氧化碳。通常,氮气以总气体浓度的约60-90%的量存在,氧气以总气体浓度的约10-40%的量存在,二氧化碳以总气体浓度的约0-50%的量存在。
此处使用的“含碳酸氢盐的细胞培养液”是指用于培养真核细胞的合适培养基,其包含碳酸氢盐缓冲体系作为其组成的一部分。所述培养基还可包含其他缓冲剂如hepes或者mops等,但是必须包含碳酸氢盐基体系。
此处使用的“细胞培养物”是指在包含缓冲剂和对于活细胞的生长和/或维持所必须的营养素的液体培养基中包含真核细胞的液体制品。
此处所使用的“溶解co2的浓度”由以mmhg为单位的co2相对测量分压表示。因此,溶解co2的分压被用作溶解的co2的浓度的反映。
“do”是指溶解氧。
此处使用的“动态界面”是指由搅动细胞培养物引起的液相和气相之间的增强气体活跃交换。
此处所使用的“真核细胞”是指动物细胞,其可以是非脊椎动物或者脊椎动物的细胞。
此处所使用的“顶部空间”是指用于培养细胞的容器中位于细胞培养物的液相上方的气相。
此处使用的hvm是指每分钟顶部空间体积,其指示顶部空间中的气体被清除的速度。
kla是指体积氧传质系数(volumetricoxygentransfercoefficient)。
klaco2是指体积二氧化碳传质系数。
lpm是指每分钟的气流公升数。
此处使用的“调整/调节”是指实现值的增加或者减小。
此处使用的“监测”是指通过连续或者间歇地取样和分析以确定特定的值来跟踪该值。
pco2是指溶解的co2浓度的分压。
此处使用的“口”是指出入一个封闭系统的点。
此处使用的“预定的”是指针对一个具体参数提前选择的值,该值被用作目标值。
此处使用的“rpm”是指每分钟摇摆数。
vcc是指活细胞浓度。
此处使用的“容器”是指容纳器物(container)。此处使用的容器可以是,例如,摇瓶,生物反应器,一次性生物反应袋,培养室等。
此处使用的“vvm”是指每分钟的容器容积。
理论方面
在wavebioreactortm培养中o2的传质
为了确定wavebioreactortm中o2的传质速率,我们假定对在线do探测器有足够快的响应时间,在cellbagtm中理想的混合,以及由液相界面引起的传质阻力占主要。在这些假定条件下,以下质量平衡公式可以给出由气相到液相的氧气传质速率大概值:
其中o2*是培养基中饱和的do浓度,o2是培养基中do浓度。取时间0时的o2为0,则该公式得出:
作为时间的函数对
为了增加wavebioreactortm中氧气的传质速率(公式1),我们可以增加体系的kla,或者增加浓度梯度(o2*-o2),或者增加两者。为了增加wavebioreactortm体系的kla,我们可以增加摇摆速度、摇摆角度或者空气流速(mikola,2007;singh,1999)。为了增加浓度梯度(o2*-o2)(提供o2由气相转移至液相的驱动力),我们可以在进口气体中增加o2的百分比以增加o2*。
在wavebioreactortm培养中co2的传质
在简化模型中,在cellbagtm中气体的co2(co2(g))与在培养基中的溶解co2达成平衡而存在:
而co2(aq)又以在和碳酸(h2co3)的平衡中存在,碳酸可以解离为碳酸氢根(hco3-):
在ph4-8范围内hco3-向碳酸根(co32-)的进一步解离应是可以忽略不计的(royce和thornhill,1991)。
对于从培养基中放出co2的限速步骤应当是气-液传质(公式3)。假定界面处液体中的co2浓度处于与主气体(bulkgas)中的co2浓度的平衡中,下面的质量平衡公式将估计出由液相到气相的co2传质速率:
其中
在wavebioreactortm中无溶解co2探测器,不能进行实时co2测量来直接计算co2(aq)传质速率。然而,基于我们对在我们的培养基中的碳酸氢盐缓冲体系的认识,我们预计co2的离去可以增加培养物ph值,这是因为公式3和4中的平衡将向左边移动。如果对于在线ph探测器有足够快的响应时间,在动态co2(aq)传递研究中它产生的ph曲线应当提供对co2(aq)剥离速度的间接估计。
为了提高培养物ph值,我们可以通过增加体系的klaco2,或者通过增加co2传递的驱动力(co2(aq)-co2(g)),或者通过增加二者,来增加wavebioreactortm中co2剥离速度(公式5)。具体来说,为增加wavebioreactortm体系的klaco2,我们可以增加摇摆速度和摇摆角度。为了增加驱动力(co2(aq)-co2(g)),我们可以降低进口气体中co2的百分比以降低co2(g)。根据亨利定律(henry’slaw),cellbagtm顶部空间中co2(g)分压(pco2(g))将限制培养基中co2(aq)浓度:
其中h=co2的亨利定律常数。
相反,为减小培养物ph值,我们可以增加进口气体中co2(g)的浓度以增加co2(aq),由此,使公式4中的平衡向右移动。
本发明方法
本发明的方法中,真核细胞在合适的培养基以及温度下培养以允许细胞存活。本领域公知,不同的细胞类型可在不同的培养基中生长。本领域技术人员可以容易地选择对特定细胞类型和/或特定应用最合适的培养基。本发明的方法中,培养基必须包含碳酸氢盐缓冲体系,以允许通过co2调整ph。所述培养基可以包含其他作为缓冲剂的试剂。
可以在本发明方法中使用的真核细胞包括动物细胞,其可以是非脊椎动物细胞也可以是脊椎动物细胞。非脊椎动物细胞包括昆虫细胞(例如草地贪夜蛾(spodopterafrugiperda),家蚕(bombyxmori),粉纹夜蛾(trichoplusiani)细胞)。脊椎动物细胞包括哺乳类动物和非哺乳类动物细胞。脊椎动物细胞包括但不限于来自蛙(例如非洲瓜蟾(xenopuslaevis)),兔形目动物(lagomorpha)(例如,家兔和野兔),啮齿类动物(例如,大鼠,仓鼠,沙鼠(jirds),沙鼠(gerbils),小鼠),猫,狗,绵羊,牛,山羊,猪,马,非人类灵长类动物以及人类的细胞。
本发明方法中使用的细胞可以是重组的细胞或者非重组细胞。重组细胞可以包括表达特定蛋白质的工程化细胞(如稳定的或者瞬时转染的细胞)、或者产生特定rnas(例如,sirna,核酶等)的工程化细胞。
在合适培养基中的细胞被放入到培养容器中,将气体注入到顶部空间。在某些实施方式中,顶部空间的清除速率是在约0.002-0.1hvm范围内。在某些实施方式中,顶部空间的清除速率是在约0.007-0.08hvm范围内。在某些实施方式中,顶部空间的清除速率是在约0.009-0.06hvm范围内。在某些实施方式中,顶部空间的清除速率是在约0.01-0.04hvm范围内。在某些实施方式中,顶部空间的清除速率是在约0.02-0.03hvm范围内。在其他实施方式中,顶部空间的清除速率是在约0.009-0.024hvm范围内。在另外的实施方式中,顶部空间的清除速率是在约0.007-0.02hvm范围内。“hvm”是气体的体积流速(l/min)与顶部空间的体积(l)的比率。
在某些实施方式中,例如,在具有20l的培养物体积和30l的顶部空间体积的50lwavebioreactortm袋中,流入容器的气体流速是0.1l/min-1l/min。在某些实施方式中,流入袋中的气体流速是0.2l/min。在某些实施方式中,气体流速是0.3l/min。在其他实施方式中,气体流速是0.4l/min。在其他实施方式中,气体流速是0.5l/min。在其他实施方式中,气体流速是0.6l/min。在其他实施方式中,气体流速是0.7l/min。在其他实施方式中,气体流速是0.8l/min。在其他实施方式中,气体流速是0.9l/min。
通常,细胞培养物应当维持在约6-8的范围内。在某些实施方式中,ph值维持在约6.6-7.6的范围内。在某些实施方式中,ph值维持在约6.9-7.5的范围内。在某些实施方式中,ph值维持在约6.8-7.2的范围内。在某些实施方式中,ph值维持在约7.0-7.3的范围内。尽管本发明的方法无需监测ph值以维持利于细胞在培养中生长的ph值,但在本发明方法的某些实施方式中,培养物的ph值也可以被监测(间歇的或者连续的)。测量可以是原位或者离线进行。
在本发明方法的某些实施方式中,do值维持在10%以上。在其他实施方式中,do值维持在20%以上。在其他实施方式中,do值维持在30%以上。在其他实施方式中,do值维持在40%以上。在其他实施方式中,do值维持在50%以上。在其他实施方式中,do值维持在60%以上。在其他实施方式中,do值维持在70%以上。在其他实施方式中,do值维持在80%以上。在其他实施方式中,do值维持在90%以上。
液体培养基中co2浓度的监测是现有技术已知的,并可以使用商业上可用的技术来完成。测量可以原位或离线进行。
在本发明方法的一个特定的举例说明性实施方式中,使用分批工艺,其中细胞使用分步方式来培养。该方法中,使用具有20l培养物工作容积的50lwavebioreactortm系统袋,其中向顶部空间注入气体,该气体在第一天补充了8%co2(v/v)气体,第二天补充了5%co2(v/v)气体,随后补充了2%co2(v/v)气体。对于接种物,wavebioreactortm以10°和21rpm以及0.2l/min摇摆,然后,对于规模放大阶段,采用23rpm,10°摇摆角,0.2l/min。在这种安排中,由于ph可以通过所使用的参数被维持,故监测ph值不是必要的。
在本发明方法的一个特定举例说明性实施方式中,使用灌流工艺。该方法中,使用具有20l培养物工作体积的50lwavebioreactortm袋。在开始灌流后两天,向袋中注入补充30%(v/v)o2的气体。气体流速由第0天0.2l/min逐步增长,接着在第3天增加到0.4l/min,然后在第6天再次增加到0.6l/min。在这种安排中,由于ph可以通过使用的参数而维持,故监测ph值不是必要的。
在本发明方法的另外一个特定的举例说明性实施方式中,使用灌流工艺。该方法中,使用具有20l培养物工作体积的50lwavebioreactortm袋。在开始灌流后两天,向袋中注入用30%(v/v)o2补充的气体。气体流速维持在恒定的0.6l/min气体流速。在这种安排中,由于通过使用的参数可以维持ph值,故监测ph值不是必要的。
在本发明方法的再另外一个特定举例说明性实施方式中,使用灌流工艺。该方法中,使用具有20l培养物工作体积的50lwavebioreactortm袋。在开始灌流后两天,向袋中注入用30%(v/v)o2补充的气体。气体流速维持在恒定的1.0l/min流速。在这种安排中,因为通过使用的参数可以维持ph值,故监测ph值不是必要的。
对于本领域技术人员,明显地,培养条件的参数(气体浓度,流速,hmv,摇摆速度,摇摆角度等),可以使用本文教导来调整以实现具有期望范围的ph值。
装置
容纳细胞培养基的容器不限于任何特定尺寸。本发明的容器可以适用于常用生物反应器的尺寸以及本领域中使用的一次性培养袋的尺寸,也可以适用于更大的或者更小的培养。
容器对制造容器使用的材料没有限定。容器可以由固体材料制备,如玻璃或者硬塑料,或者可以由柔性材料制备,如软塑料,如用于生产一次性生物反应器袋的那些。
容器可任选地包含挡板以增加搅动时培养基的湍流。
容器可以配备一个或多个口以允许添加或者移除气体和液体。气体可以经由一个或多个口进入顶部空间和移出顶部空间。在一实施方式中,存在单一个允许气体进入和排出的口。在其他实施方式中,存在两个口:一个用于气体进入,一个用于气体排出。在其他实施方式中,使用多个口以允许气体进出。
在某些实施方式中,装置也可以包含ph值监测器,连续或者间歇监测细胞培养基ph值。可以使用ph值监测器,和自动化系统通讯,以向容器顶部空间进气和脱气以改变co2的浓度,由此调整培养基的ph值。
在某些实施方式中,本发明的装置包含co2监测器,其连续或者间歇性监测溶解co2的分压作为培养基中co2浓度的指示。可以使用co2监测器,和自动化系统通讯,以向容器顶部空间进气或脱气以改变溶解co2的浓度,从而调整由co2监测器测量到的co2实际浓度至预定值。
在某些实施方式中,本发明的装置包含有温度监测器,连续的或者间歇性的监测细胞培养基的温度。可以使用温度监测器,和自动化系统通讯,以增加或者降低温度,从而调整由监测器测量到的实际温度到预定的值。
各种参数监测器可以单独或者联合使用,并且可以使用由电脑控制的自动化控制系统进行控制。电脑可以编程以执行必要的计算来确定待用气体输入的或者待由顶部空间除去的co2的量以调整培养基的ph值。计算机还可以执行与温度、搅拌速度、培养基灌流和其他参数有关的计算和控制工具以自动化方式调整参数。
任选的,本发明的装置包括搅拌器以搅拌容器使得细胞培养基不是静态的而是出于与顶部空间气体的动态界面中。搅拌有利于气体进出细胞培养基的扩散。搅拌器可以是本领域中已知的任何形式,但包括非限制性的例子如摇床、定轨摇床、旋转混合器(rotator)、八字形摇床、摇摆式平台、旋转式平台等。
自动气体传输和气体清除系统(gaspurgingsystem)可包括阀门和泵系统以通过无菌过滤器递送加压气体,具有控制表用于控制气体流入容器的流速。任何本领域中已知的传输气体和排出气体的工具都可以使用。可以响应计算机计算的信号,在细胞培养基中溶解co2的浓度偏离预定值时,引入气体。当测量的co2浓度偏离预定值时,自动化系统计算需要添加到系统或者自系统移除的co2量,在现有气体通过出口被清除时,将具有合适量的co2的气体引入到顶部空间。计算机可以执行涉及在此定义的公式1,2和/或3的计算、以及如本领域技术人员基于现有文献、商业可用系统以及这里的教导可以知晓的,用于调节系统的其他计算。
备选地或者与使用监测的co2浓度的响应系统联合,该自动化系统也可以测量培养基的ph值,并且当测量的ph值偏离用于培养细胞的预定ph时做出响应。自动化系统可以对偏离的co2浓度和/或ph值做出响应,并且在清除现有气体的同时使用气体引入合适量的co2,如此以适当调整培养基的ph值。
现在参考图1,在一个非限制性的实例中描述本发明装置和方法。培养容器(40)包含细胞培养基和细胞(110)和顶部空间(130)。带有过滤器(50)的进气口(70)和容器(40)相连以允许气体注入到顶部空间(130)。带有过滤器(60)的出气口(80)和容器(40)相连以允许气体排出顶部空间(130)。容器安置在与摇摆装置(20)和基部(10)相连的平台(30)上,以允许细胞培养基(110)的摇摆运动和搅动。顶部空间(130)中的搅动和气流允许o2和co2扩散进出细胞培养基(110)。如果必需的话,用于保留细胞在培养容器中的任选灌流过滤器(90)经由管(100)与培养基口(120)相连,以允许自细胞培养物移除废培养基。
细胞在容器(40)中在细胞培养基(110)中培养。容器(40)中的顶部空间(130)充有气体。气体通过气体进口(70)流入和流出气体出口(80),使得气体可以流过顶部空间(130),以及使得当通过在连接基部(10)的摇摆装置上摇摆平台(30)来搅动培养物时自细胞培养基(110)扩散出到顶部空间中的co2流出。细胞培养基(110)中溶解co2的减少导致细胞培养基(110)的ph值增加。
细胞培养基(110)可以任选补充新鲜培养基,所述新鲜培养基经由培养基管(140)通过培养基口(150)供应,并穿过灌流过滤器(90)、向上经由培养基管(100)并通过培养基出口(120)向外排出。在本发明方法的此任选特征中,在最初的细胞培养基被耗尽营养以及在细胞废产物累积和ph值降低时,供应新鲜培养基。供应的新鲜培养基具有预定ph值,该ph值足以使混合后总的细胞培养基的ph值增加,致使细胞培养基达到预定的最佳ph范围。
实施例
a.原理:
由于大部分哺乳动物细胞培养体系利用含碳酸氢盐的细胞培养基,故主要通过碱/co2的添加来进行哺乳动物细胞培养中的ph值控制。该ph值控制利用碳酸-碳酸氢盐缓冲体系。已经发现,在这种系统例如一次性袋生物反应器中,培养物的ph值可以通过操控培养基中溶解co2的浓度来调整,培养基中溶解co2的浓度可以通过调整顶部空间co2的浓度来调整。在本实施例中证实,通过调整顶部空间co2的浓度,可以实现双向ph值调节。该方法使得无需使用碱来增加细胞培养生物反应器系统中的ph值。如果一次性生物反应器中细胞培养的ph值需要降低,可通过用co2补充进气来增加顶部空间中co2的浓度。这将使得co2可以转移到细胞培养物中。如果一次性袋中细胞培养物的ph值需要增加,可以降低顶部空间中co2的浓度或者可以增加顶部空间的清除速率,以利于co2从细胞培养物中移出。
这种ph值维持方法可以扩展到如下生物反应器体系,在该体系中气体在生物反应器中的传递主要是通过在生物反应器中产生的大表面积来推动的。
在细胞建库过程中基于co2添加或者移除的ph值维持策略:
在细胞培养的初始阶段,当存在相对较小数量的细胞时,细胞培养物的ph值通常是上升的。为了控制ph值,通常要将co2添加到生物反应器中以降低ph值。通常,在常规搅拌釜生物反应器中,此种添加通过将co2气体喷射入细胞培养物来完成。在本发明的一次性生物反应器中,通过改变顶部空间的二氧化碳浓度,使co2转移的方向从气相到液相。随着细胞浓度在培养过程中增加,细胞培养物中的co2浓度也增加,因此通常要降低ph值。在具有常规ph值反馈控制的常规搅拌釜生物反应器中,将添加碱以控制ph值。碱的添加可以增加细胞培养物的ph值。在本发明的一次性生物反应器中,ph值的增加可以通过反转co2转移的方向,通过降低顶部空间的co2浓度以及增加顶部空间的清除速率来完成。这种通过操作培养基中co2浓度来维持细胞培养物ph值的方法,允许消除碱的使用。根据需求(要么增加要么降低ph值),可以分别地降低或者增加顶部空间的co2浓度。
一次性生物反应器系统可用作产生高细胞密度细胞库的生物反应器系统,例如但不限于主细胞库(mcb)和工作细胞库(wcb)。灌流细胞培养工艺被认为可以在一次性生物反应器中产生高细胞密度细胞库。在开发用于产生mcbs和wcbs的细胞培养工艺时,建议通过co2添加/移出方法来维持ph值。除了通过该气体转移方法来维持ph值外,细胞培养物的灌流允许额外的维持ph的机会。在灌流细胞培养工艺中,在连续的移除废培养基的同时向生物反应器中连续地添加新鲜的细胞培养基。灌流允许移除细胞培养副产物(其可能会影响细胞培养物ph值)。除了移除细胞培养副产物,注入的新鲜细胞培养基的ph也可以改变细胞培养物的ph值。如果知道细胞培养物的ph值将降低,则可以增加进入的培养基的ph值以弥补该ph值降低。或者,也可以改变灌流速率以管理培养物ph值。所有上述方法对ph值都有影响,但是影响ph值最重要的因素是co2转移法。因为在一次性生物反应器中气流速度和co2补充可以被有效控制而没有太多问题,故co2转移也是一种更为可靠的方法。
当我们最初尝试在没有ph值和do反馈控制下在wavebioreactortm中培养cho细胞时,我们认识到几个挑战(图5):(1)分批培养阶段(第0-6天)以约0.3天-1缓慢生长;(2)灌流培养阶段(自第6天起)逐步更加缓慢的生长,从头3天期间的约0.5天-1降低至此后的少于0.3天-1;(3)初始培养物ph值有时超过7.3,并且随后的培养物ph值常常降到ph6.8以下;(4)在第6天灌流开始后,do水平往往低于20%空气饱和度。在使用生产其他mabs的cho细胞系(没有显示数据)时我们遇到了同样的挑战。我们将分批培养中的缓慢生长归咎于高的初始ph值,灌流培养中生长速率的降低归咎于ph值和do值的降低。
在无ph值反馈控制的wavebioreactortm中,这些碳酸氢盐缓冲的培养物中的ph值将取决于cellbagtm顶部空间中的co2含量。尽管在培养基中存在碳酸氢盐和hepes缓冲液,但是由于乳酸累积的结果,培养ph值应随着时间最终降低。为了将培养ph值维持在我们期望的6.8-7.2范围,我们的策略是操控cellbagtm中的co2浓度。在分批培养的早期阶段,我们增加向培养基中的co2转移以降低ph值。相反,在分批培养或者灌流培养的后期阶段,我们将从培养基中剥离co2以增加ph值。在无do反馈控制的wavebioreactortm中,do水平将随着细胞密度的增加而降低。为了维持do>20%空气饱和度,我们将通过增加wavebioreactortm系统的氧气体积传质系数(kla)以及通过用o2补充进口气体来增加向培养物中的o2转移。
b.材料和方法:
1.cho细胞系和培养基
实施例中使用的所有细胞系均源于适应在无血清悬浮培养中生长的cho二氢叶酸还原酶缺陷型(dhfr-)宿主。产生特定单克隆抗体(mab)的每个细胞系通过使用编码dhfr、mab轻链(lc)以及mab重链(hc)基因的dna质粒来转染dhfr-宿主得到。随后,稳定转染的细胞经过在包含氨甲蝶呤的化学成分明确的专利选择性培养基中每2-5天传代一次来维持。同样的培养基——除了专利营养混合物外还包含1.0g/lpluronicf-68,2.44g/l碳酸氢钠,以及15mmhepes——用来在wavebioreactortm中在分批和灌流模式下培养细胞。
2.wavebioreactortm系统
wavebioreactortm系统(gehealthcare,piscataway,nj,usa)——用于在分批或者灌流模式下培养cho细胞——包括摇摆平台、控制器组件和预消毒的柔性的一次性袋,袋子具有进气口和出气口气体过滤器以及多个采样口(singh,1999;tang等,2007)。每个系统都装配有加热垫和气体混合盒以分别提供温度控制和所需的进口气体组合物(o2和/或co2与空气混合)。所有的细胞培养实验都是使用50lcellbagtm在工作体积6或者20l,37℃温度设定点,19-25rpm的摇摆速度,8-12°的摇摆角下进行。在wavebioreactortm中没有安装在线ph或do探测器;相反,对不同气体混合物和气体流速策略,测试它们维持培养ph值和do水平在目标范围内的能力。
3.wavebioreactortm中的分批培养
分批培养以6l在wavebioreactortm中通过以~7.5×105细胞/ml接种常规或灌流cellbagtm而开始。接种后几天,当培养物积累了足够细胞质量时,加入新鲜的培养基以增加工作体积至20l。对于每一代,培养物在分批模式下维持2-5天。
4、在wavebioreactortm中灌流培养
除非另有说明,灌流培养在分批培养累积了足够的细胞质量后在灌流cellbagtm中以20l工作体积开始,具有23rpm的摇摆速度和10°的摇摆角度,以及每天1工作体积的灌流速率。在灌流cellbagtm中细胞保留装置为过滤器,在培养期间其浮在液体表面上(tang等,2007)。在连续地添加新鲜培养基和移除滤液时,灌流过滤器使细胞保留在cellbagtm中。通过使新鲜培养基添加速率匹配每天一个工作体积的滤液移除速率,在灌流wavebioreactortm中维持恒定的体积。
5.搅拌釜生物反应器培养
为了比较在wavebioreactortm中和搅拌釜生物反应器中培养物的性能,来自相同seedtrain源的细胞以~7.5×105细胞/ml接种到wavebioreactortm生物反应器中和20l不锈钢搅拌釜生物反应器(applikon,fostercity,ca,usa)中。细胞首先是在分批模式下培养,接着在累积足够的细胞质量后开始灌流。在搅拌釜生物反应器中工作体积是在分批模式下7l和在灌流模式下15l。培养温度,do以及搅拌分别维持在37℃、30%空气饱和度、以及125rpm的设定值。通过添加1m碳酸钠以增加ph值或者喷射co2气体以降低ph值来维持培养ph值在7.15,具有0.03的死区。在灌流操作期间,使用centritech离心机系统(centritechab,norsborg,sweden)将细胞从生长培养基中分离;通过离心机,细胞被保留并返回到生物反应器,而上清液被移除(johnson等,1996)。通过使新鲜培养基的添加速率匹配每天一个工作体积的上清液移除速率,维持生物反应器中的恒定体积。
6、离线样品分析
培养物被抽样并用于活细胞浓度(vcc)和存活力(vi-cellas,beckmancoulter,fullerton,ca,usa)、以及用于ph,do,pco2,葡萄糖和乳酸(bioprofile400,novabiomedical,waltham,ma,usa)分析。
实施例1:无细胞研究:气体传质测量
cellbagtm中气体传质特征影响培养性能,原因是它们对do和ph水平的影响。作为将ph和do维持在我们期望的范围内的第一步,进行了cellbagtm中无细胞研究以测量o2和co2的传质。
a.o2传质研究
在50l的cellbagtm中o2传质,使用模拟的培养基,通过计算在摇摆速度(20,30,以及40rpm)、摇摆角度(8°,10°,以及12°)和气流速(0.1,0.2,以及0.3l/min)的各种组合下o2体积传质系数(kla)来表征。经典的动态排气法(gassing-outmethod)被用来计算kla(dunn和einsele,1975)。用于这些研究的测试培养基被设计用来模拟专利细胞培养基:它是由1.0g/lpluronicf-68,2.44g/l碳酸氢纳,以及15mmhepes组成。来自同一制造商(broadley-jamescorporation,irvine,ca,usa)的连接到40型发送机(trasmitter)的
在用于o2传质测试的准备中,在将25l模拟培养基装入50-lcellbagtm后,使氮气(n2)通过气体进入口。摇摆袋子以促进n2转移到模拟培养基中。当模拟培养基的do含量跌到10%空气饱和度以下时停止进入顶部空间的氮气流。在此脱氧步骤后,按压袋子以从顶部空间中排出残留n2。然后在对液-气界面干扰最小化时,向袋子中的顶部空间添加压缩气体。一旦袋子完全膨胀,在所定义的摇摆速度、摇摆角度以及气流速测试条件下开始氧气传质测试。记录do浓度得到的增加,并用来确定体系的kla。此外,头5分钟内每一分钟,此后每5分钟测量离线do,以验证在线do读数的准确性。
在恒定的空气流速,可能是通过增加用于氧气传质的表面积,增加摇摆速度或者摇摆角度增加了kla(图2a)。我们在测试的最小摇摆速度(20rpm)得到的kla值比得上其他研究者所报道的wavebioreactortm系统的值(mikola等,2007;singh,1999)。这些kla值也比得上由我们的自制搅拌釜生物反应器所得到的值(数据没有显示)。
在以恒定的20rpm摇摆速度进行的wavebioreactortm系统的o2传质研究中,在2-l的规模下,空气流速从0.01vvm增加到0.05vvm使kla从~2h-1增加到~3h-1,在20-l的规模下,空气流速从0.01vvm增加到0.1vvm,使kla从~0.5h-1增加到~3h-1(singh,1999)。作为对比,在50-l规模的我们的研究中,在摇摆速度和摇摆角度的两种不同组合下气流速从0vvm增加到0.02vvm,没有增加kla(图2b)。我们使用的最大气流速可能太低,不能实现在气液界面的液体运动性,从而对kla没有任何显著的影响。
通过确定传质系数kla,评价了氧气在50l一次性袋中的传质能力。图2c显示,对于恒定气流速,随时间的do浓度。图2d显示气流速对溶解氧的影响。对于激烈的摇摆条件(更高摇摆速度和摇摆角度),传质系数是高的。然而,令人惊讶的是,顶部空间的清除速率对氧气传质的kla没有影响,在开始试验前,模拟培养基进行去氧化。气体中氧气的浓度高于模拟培养基中氧气的浓度。因此,氧气从气相传质到液相中。以激烈的摇摆条件,气液界面由于更多波的形成而增加(此处称作动态界面)。这种表面积的增加看起来导致高氧气传质速率。当气流速增加或者减少时,可以相应地变化顶部空间的清除速率。顶部空间清除的该变化不改变气相和液相之间的差异氧气浓度。因此,气流速看起来对氧气传质系数没有影响。当模拟培养基中氧气的浓度等于顶部空间中的浓度时,氧气传质将停止。
b.co2传质研究
在模拟培养基通过使用用于o2传质研究的方法去氧化后,将co2通过用于供应氮气的同样进气口,供应到cellbagtm。当在线ph值探测器读数7.0时,停止co2的供应,并且使用在o2传质研究中描述的同样的方法来清除顶部空间。当袋完全膨胀后,在所定义的摇摆速度、摇摆角度以及气流速测试条件下开始co2传质研究。用与同样的制造商(gehealthcare,piscataway,nj,usa)提供的ph20发送机相连的一次性在线ph探测器,记录引起的ph增加。ph值的增加是由于co2被从碳酸氢盐基模拟培养基中去除而引起。为了验证在线ph值读数的准确性,头5分钟内每一分钟,此后每5分钟测量模拟培养基的离线ph值。通过绘制在线ph测量值对时间的图像,最佳拟合线的斜率提供了ph值的变化速率,由此表明cellbagtm中co2从模拟培养基到顶部空间的传质速率。
尽管其他研究人员已经表征了wavebioreactortm中o2的传质(mikola等,2007;singh,1999),但我们没有发现关于在具有wave诱导的搅动的细胞培养系统中co2传质的报道。为了表征wavebioreactortm中co2的传质,以和我们的细胞培养培养基中同样的浓度(2.44g/l),我们使用了包含碳酸氢钠的模拟培养基。在这种碳酸氢盐缓冲的无细胞体系中,在无活跃ph值控制下,从液相中移出co2将会增加体系的ph值。代替依赖于co2探测器在模拟培养基中直接测量co2,我们使用了源于wavebioreactortm中在线ph探测器的ph曲线以估算相对co2剥离速度。
在该研究中,在wavebioreactortm中ph曲线被分成两个阶段(图3a和3b)。在第一阶段,在0-5分钟之间,ph值以每小时~1-4ph单位,迅速增加。在第二阶段,从5-60分钟,ph值以每小时<0.5ph单位,更为逐渐地增加。在第二阶段(5-60分钟),不同的摇摆速度和摇摆角度对ph值增加速度有微不足道的影响:在恒定的0.2l/min的空气流速下,ph值以每小时0.2单位增加,不论摇摆条件如何(图3a)。相反,在第二阶段(5-60分钟),较高的气流速增加了ph变化速率:当空气流速由0l/min增加到0.6l/min时,ph值的变化速率由每小时0-0.1单位增加到每小时0.4单位(图3b)。在无空气流时(0l/min),在第二阶段(5-60分钟)观察到最小ph增加(≤0.1单位每小时),表明在大约5分钟内在cellbagtm中模拟培养基和顶部空间之间的co2交换达到平衡。为在头5分钟以外实现额外的ph值增加,可以通过增加空气流速以增加顶部空间的清除速率并由此使顶部空间的co2浓度最小化,提高用于co2剥离的驱动力。
图3c显示了针对图3a数据的计算出的ph变化速率。图3d显示的是针对图3b数据的计算ph值变化速率。该两相行为可以通过高气体传质速率来解释,该高气体传质速率由波的高表面积和进入气体对顶部空间的连续清扫引起。高表面积促进了从液相到气相的迅速的co2传质。快速的传质是气相和液相之间差异co2浓度的结果。这种浓度的差别在实验开始阶段是最高的,并且随着更多的co2由液相传质到气相,这种差别持续减少。随着气相和液相之间的co2浓度差别减少,ph值变化速率也减少。图3a中,相比第二阶段(5-60分钟),第一阶段(0-5分钟)的ph值变化速率非常高。在图3a中显示的情形下气体流速保持相同。在co2开始传质后,co2的传质速率取决于顶部空间中的co2浓度。对于同样的顶部空间清除速率,在开始5分钟后的ph值变化速率是相同的,不管摇摆条件如何。ph值变化速率的计算值在图3c中显示。
当变化气体流速时,也变化顶部空间的清除速率。对于不同气体流速的ph值升高数据显示在图3b中。对于这些情况也观察到两相行为。然而,在具有相同气体流速的情况和气体流速变化的情况之间,差别在于第二阶段(5-60分钟)的ph值变化速率随气体流速的不同而变化,相比地在具有相同气体流速的情况下这是类似的。由于改变气体流速改变了顶部空间的清除速率,顶部空间的co2以不同的速度被移除。
初始快速的气体传质是一次性袋的性质造成大表面积的结果。初始气体传质主要依赖于摇摆条件(摇摆速度和摇摆角度)。然而,co2从培养基中的持续移出,依赖于顶部空间co2的浓度。顶部空间的清除速率取决于气体流速。
实施例2:细胞生长特性研究
a.分批培养
1.初始实验
细胞培养基:
无血清细胞培养基被用于中国仓鼠卵巢(cho)细胞生长。细胞培养基源自dmem和ham’sf-12的1:1混合物基培养基,其中改变某些组分如氨基酸、盐、糖和维生素。该培养基缺乏甘氨酸、次黄嘌呤和胸苷。该培养基包括15mmhepes(4-(2-羟乙基)-1-哌嗪乙磺酸)和2.44g/l碳酸氢钠。这些盐的浓度可以变化。培养基用微量元素、重组人胰岛素以及细胞保护剂lutrolf-68prill补充(可使用等价物)。
哺乳动物细胞培养:
自1ml或者10ml存储在液氮中的瓶库,生长转染的中国仓鼠卵巢(cho)细胞。在转瓶、摇瓶或者搅拌釜生物反应器中,将所选择的冷冻小瓶融化到包含碳酸氢钠的培养基中。每2-7天,传代细胞。该培养物被称为“seedtrain”。将来自seedtrain的细胞转移到一次性袋中以在一次性袋中开始细胞培养。
分析:
血气分析仪(nova
实施例3:使用几种cho细胞系的详细分析
a.分批工艺:
在分批培养的过程中通过降低向cellbagtm供应的气体中的co2浓度,我们应该能够降低起始的高ph值(>7.3),并且使wavebioreactortm系统中随后的ph值降低最小化。在使用几种cho细胞系在wavebioreactortm分批培养中测试不同co2气体重叠策略后,我们确定了对于接种和放大阶段的“8-5-2”分步策略:在第一天期间,泵入到cellbagtm中的空气以8%(v/v)补充co2气体,第二天以5%(v/v),随后以2%(v/v)补充。
基于由无细胞研究得到的结果,我们选择了下面的摇摆速度、摇摆角度和气体流速作为我们wavebioreactortm分批培养的工艺设定点:21rpm、10°摇摆角和0.2l/min用于接种;23rpm、10°摇摆角和0.2l/min用于放大阶段。为了测试这些工艺设定值的可靠性,我们设计了一种全因子实验(表1)。当工艺条件偏离中心点时,对于被测试的两种细胞系,我们观察到微不足道的对细胞生长和pco2曲线的影响,并且培养ph值保持在6.8-7.2和do>50%(图4)。
表1.在产生mabb和mabc的细胞系的wavebioreactortm分批培养中测试的条件(图4)。围绕3个工艺参数——摇摆速度、摇摆角度和进入顶部空间的空气流速,设计了全因子实验,用于分批培养中的接种和扩大阶段。
b.灌流培养
我们在wavebioreactortm中灌流培养的开始尝试中,在第6天灌流开始后,培养ph值通常跌倒6.8以下,do常跌倒30%空气饱和度以下(图5)。因为无细胞气体传质研究表明增加空气流速增加了ph值(图3),在不增加灌流速率下为了使ph的下降最小化,我们研究了增加进入cellbagtm的气体流速的可行性。为了克服do值下降,在灌流开始后两天,我们向进入cellbagtm的空气流补充30%(v/v)o2。我们选择这个时间是因为它和以前观察到的do下降吻合(图5)。
实施例4:分批-灌流工艺
该灌流工艺由两个分批步骤和接着的灌流步骤组成。在接种步骤,以目标细胞密度5-7.5x105细胞/ml,在6l工作体积,接种50l一次性袋。接种后3天,添加新鲜的培养基以将一次性袋子的体积增加到20l用于放大阶段。接种步骤和放大步骤构成分批步骤。如在分批工艺中所描述的,使用co2步降策略用于这些分批步骤。在3天的放大步骤结束时,开始灌流。向一次性袋连续加入新鲜培养基,并且废培养基被连续地移出一次性袋子而留下细胞。细胞培养基以每天20公升(每天1体积)的速度灌流。灌流的培养基ph设定值是在7.2单位。灌流开始时,进入气体中co2的浓度设定为0。增加顶部空间清除速率以促进co2移除。如图7中所示,顶部空间清除速率的增加要么按照单个步骤增加或者按照多个步骤增加。摇摆速度范围是在19-25rpm之间。摇摆角度范围是在8-12度之间。温度维持在37℃。在灌流开始后48小时补充氧气以满足细胞的氧气需求。在灌流开始后48小时,进入气体中氧气的浓度设定在30%。
图6显示了分批-灌流工艺的细胞培养性能(分批步骤(第0-6天)以及灌流步骤(第6-14天)(图6a)。图6b显示的是细胞存活力百分比。图7a显示的是用于三种不同实验的顶部空间清除速率设定值。对于灌流步骤的顶部空间清除速率设定值遵循不同的曲线(第6-14天):(1)两种恒定的空间清除速率:0.02hvm(-▲-)和0.1hvm(◆);以及(2)逐步增加的顶部空间清除速率:0.007hvm至0.013hvm至0.02hvm(-■-)。单个步骤增加以及多个步骤增加均被研究。图7b显示的是离线溶解co2浓度。图6d显示的是以活细胞数(vcc)计的细胞生长。用于图6和7的图例:◆,■,▲表示三种不同的运作。如图6c中所示,通过清除顶部空间调节co2,ph可以维持在期望的范围内。
实施例5:六种cho细胞系在“8-5-2”条件下的行为
为了测试该wavebioreactortm工艺在支持细胞生长和维持ph以及do在期望范围内的可靠性,我们选择了六种细胞系,覆盖通常在我们的内部cho细胞系中观察到的细胞生长以及代谢行为范围。
以优化的工艺条件,在整个分批和灌流培养阶段,所有六种细胞系生长,具有高生存力(图8)。在所有情况下,ph值维持在期望的6.8-7.2范围内,do超过20%空气饱和度。
实施例6:“8-5-2”wavebioreactortm法和常规的搅拌釜生物反应器培养之间的比较
为了比较本发明wavebioreactortm工艺和具有ph和do控制的搅拌釜生物反应器工艺之间的培养性能,我们在两个系统中进行了并行培养(图9)。两种生物反应器系统之间的生长和生活力曲线类似:在wavebioreactortm中和在搅拌釜生物反应器中的生长速度是相当的,~0.5天-1。尽管在wavebioreactortm系统中缺乏ph和do在线反馈控制,在两种生物反应器培养中ph和do曲线没有显著差异。
本发明提供了一种工艺控制方法,用于在wavebioreactortm系统中——在分批和灌流模式下运作——将培养ph维持在6.8-7.2范围内,do>20%空气饱和度,而无需依靠ph和do反馈控制。在鉴定在没有ph和do控制的wavebioreactortm系统中培养cho细胞的挑战后,我们进行了无细胞研究以确定摇摆速度、摇摆角度和气体流速对o2以及co2在wavebioreactortm系统中传质的影响。通过调整这些工艺参数以及输入气体中co2和o2的浓度,对于六种重组cho细胞系的分批和灌流培养,我们维持了培养ph和do在我们的期望范围内。通过消除对ph和do探测器的需求,该方法提供了一种在wavebioreactortm体系中更简单、更有成本效率的培养细胞的方法。还提供了一种在装有这些探测器的wavebioreactortm中在ph或者do探测器失效时用于细胞培养的替代方法。
应当理解的是,本文所描述的具体实例仅仅是举例说明性的而不是对本发明范围的限制。本发明仅仅由后附权利要求来限定。
参考文献
cronincn,limkb,rogersj.2007.productionofselenomethionyl-derivatizedproteinsinbaculovirus-infectedinsectcells.proteinsci16:2023-2029.
dunnij,einseleaj.1975.oxygentransfercoefficientsbythedynamicmodel.japplchembiotechnol25:707-720.
dezengotitavm,schmelzerae,millerwm.2002.characterizationofhybridomacellresponsestoelevatedpco2andosmolality:intracellularph,cellsize,apoptosis,andmetabolism.biotechnolbioeng77:369-380.
haldankarr,lid,saremiz,baikalovc,deshpander.2006.serum-freesuspensionlarge-scaletransienttransfectionofchocellsinwavebioreactors.molbiotechnol34:191-199.
johnsonm,lanthiers,massieb,lefebvregandkamena.1996.useofthecentritechlabcentrifugeforperfusioncultureofhybridomacellsinprotein-freemedium.biotechprog12:855-864.
langheinrichcandnienowaw.1999.controlofphinlarge-scale,freesuspensionanimalcellbioreactors:alkaliadditionandphexcursions.
biotechnolbioeng66:171-179.
lina,kimurar,millerwm.1993.productionoftpainrecombinantchocellsunderoxygen-limitedconditions.biotechnolbioeng42:339-350.
lingwlw,dengl,leporej,cutlerc,connon-carlsons,wangy,volochm.2003.improvementofmonoclonalantibodyproductioninhybridomacellsbydimethylsulfoxide.biotechnolprog19:158-162.
linkt,
millerwm,blanchhw,wilkecr.1988.akineticanalysisofhybridomagrowthandmetabolisminbatchandcontinuoussuspensionculture:effectofnutrientconcentration,dilutionrate,andph.biotechnolbioeng32:947-965.
mikolam,setoj,amanullaha.2007.evaluationofanovelwavebioreactorcellbagforaerobicyeastcultivation.bioprocessbiosysteng30:231-241.
osmanjj,birchj,varleyj.2001.theresponseofgs-ns0myelomacellstophshiftsandphperturbations.biotechnolbioeng75:63-73.
osmanjj,birchj,varleyj.2002.theresponseofgs-ns0myelomacellstosingleandmultiplephperturbations.biotechnolbioeng79:398-407.
raog,moreiraa,brorsonk.2009.disposablebioprocessing:thefuturehasarrived.biotechnolbioeng102:348-356.
restelliv,wangmd,huzeln,ethierm,perreaulth,butlerm.2006.
theeffectofdissolvedoxygenontheproductionandglycosylationprofileofrecombinanthumanerythropoietinproducedfromchocells.
biotechnolbioeng94:481-494.
roycepnc,thornhillnf.1991.estimationofdissolvedcarbondioxideconcentrationsinaerobicfermentations.aichej37l1680-1686.
singhv.1999.disposablebioreactorforcellcultureusingwave-inducedagitation.cytotechnology30:149-158.
tangyj,ohashir,hameljfp.2007.perfusioncultureofhybridomacellsforhyperproductionofigg2amonoclonalantibodyinawavebioreactor-perfusionculturesystem.biotechnolprog23:255-264.
- 还没有人留言评论。精彩留言会获得点赞!