一种接种液组合物及利用其构建恶性胸腔积液来源异种移植瘤动物模型的方法与流程
本发明属于医药模型领域。更具体而言,本发明涉及恶性胸腔积液来源的异种移植瘤动物模型的构建。
背景技术:
在我国,肺癌已代替肝癌成为首位恶性肿瘤死亡原因,而且发病率和死亡率仍在继续迅速上升。肺癌的高死亡率主要是因为60-70%的肺癌患者被发现时已是肺癌晚期,失去了手术机会无法根治。
肿瘤动物模型是进行肿瘤相关机制和药物筛选研究的重要平台。目前,临床前肿瘤动物模型多采用肿瘤细胞系进行皮下接种的方法,其具有易建立和易重复等优点。但肿瘤细胞系因在体外建立,脱离了自然的肿瘤微环境,使其遗传不稳定且不能概括患者肿瘤的异质性。因此该方法建立的肿瘤动物模型,不能完全反映癌症病人复杂的临床症状,具有很大局限性。为了克服这些问题,研究者们建立了癌症病人来源的异体移植肿瘤动物模型,即将来源于患者的手术肿瘤组织移植入免疫缺陷小鼠体内。该模型非常好得维持了肿瘤移植物的组织学特性、基因表达谱、SNP位点和拷贝数变异等多个特征,因此可应用于病人的个性化药物筛选、生物标志物鉴定、临床前肿瘤药物药效评价和生物学机制研究等,为药物临床试验结果的预测提供了更加准确的结果。
目前,肺癌患者来源肿瘤移植模型的建立方法主要是利用患者的手术组织移植入免疫缺陷小鼠皮下。虽然,在临床上很多肺癌患者经常合并发生的恶性胸腔积液,其他恶性肿瘤晚期也会伴发恶性胸腔积液,例如乳腺癌、淋巴瘤等恶性肿瘤(参见,林江涛等,胸膜活检联合胸水脱落细胞学检查在恶性胸腔积液诊断中的应用,《内科急危重症杂志》,2001,7(1))。然而,由于恶性胸腔积液中肿瘤细胞不仅数量较少,而且肿瘤细胞中含有已死亡或接近死亡的肿瘤细胞,除此之外胸水还含有免疫细胞及其他细胞,免疫细胞产生的炎症因子及其本身可能会杀伤肿瘤细胞。由于上述限制,一般认为,无法用恶性胸水来构建异种移植瘤动物模型。目前针对肺癌动物模型的研究方向主要是侧重于如何将手术采集到的肿瘤组织原位移植到动物中来构建异种移植瘤动物模型(王力伟等,移植性肺癌动物模型研究进展,《介入放射学杂志》,2015,24(7))。
综上所述,本领域迫切需要一种利用恶性胸腔积液构建异种移植瘤动物模型的方法。
技术实现要素:
根据本发明第一方面,提供了一种恶性胸腔积液来源异种移植瘤动物模型,所述动物模型由以下方法构建:
(a)采集临床恶性胸腔积液样本;
(b)富集所述恶性胸腔积液样本中的肿瘤细胞;以及
(c)将如步骤(b)富集所得到的肿瘤细胞接种至实验动物,饲养动物至肿瘤形成,从而获得恶性胸腔积液来源的异种移植瘤动物模型。
一个优选实施方式中,所述步骤(b)中使用FX系统进行细胞富集。
一个优选实施方式中,将所述步骤(b)所获得的肿瘤细胞进行H&E染色,CK免疫荧光染色,以检测所富集的细胞是否为肿瘤细胞。
一个优选实施方式中,将所述步骤(b)所获得的肿瘤细胞用无菌接种液处理,所述无菌接种液包含:45体积份的HBSS,5体积份的胎牛血清和50体积份的Matrigel胶,加入Thiazovivin,终浓度为10uM。
另一个优选实施方式中,所述实验动物为重症联合免疫缺陷(SCID)小鼠。
另外一个优选实施方式中,所述恶性胸腔积液样本选自含有以下的基因型:EGFR20号外显子T790M突变、EGFR 21号外显子L858R突变、和/或ALK融合基因。
根据本发明第二方面,提供一种无菌接种液组合物,包含以下组分:Hank′s平衡盐缓冲液和/或磷酸缓冲液PBS,胎牛血清,基底膜基质胶,和ROCK蛋白抑制剂。
一个优选实施方式中,所述基底膜基质胶选自Matrigel胶或Cultrex BME胶;所述ROCK蛋白抑制剂选自Thiazovivin、Y-27632、吡那地尔(Pinacidil)、法舒地尔(Fasudil)、Ripasudil、RKI-1447、GSK429286A,或它们的任意组合。
另一个优选实施方式中,所述Hank′s平衡盐缓冲液(购自Invitrogen,14170)为35-55体积份,胎牛血清为3-10体积份,基底膜基质胶为40-60体积份,并且ROCK蛋白抑制剂的终浓度为5-20uM。
根据本发明第三方面,提供一种构建恶性胸腔积液来源异种移植瘤动物模型的方法,包括以下步骤:
(a)采集临床恶性胸腔积液样本;
(b)富集所述恶性胸腔积液样本中的肿瘤细胞;
(c)使用根据本发明的无菌接种液组合物悬浮步骤(b)中富集的肿瘤细胞;以及
(d)将如步骤(c)所述悬浮于无菌接种液组合物中的肿瘤细胞接种至实验动物,饲养动物至肿瘤形成,从而获得恶性胸腔积液来源的异种移植瘤动物模型。
一个优选实施方式中,所述步骤(b)中使用FX系统进行细胞富集。
另一个优选实施方式中,所述实验动物为重症联合免疫缺陷(SCID)小鼠。
另外一个优选实施方式中,所述恶性胸腔积液样本来自肺癌、乳腺癌、淋巴瘤、或卵巢癌。
根据本发明第四方面,提供一种根据本发明的方法构建的动物模型在临床或科研研究中的应用。
一个优选实施方式中,所述应用选自药物筛选研究、药效学研究、药理学研究、患者响应性研究、基因特异性研究、生物标志物研究、和/或生物学机制研究。
另外一个优选实施方式中,所述动物模型应用于选自以下的基因型:EGFR20号外显子T790M突变、EGFR 21号外显子L858R突变、和/或ALK融合基因。
本发明提供的技术方案能够利用恶性胸腔积液建模,因恶性胸腔积液采集方便,同时对患者生活影响小等特点,因此可多次建模,提高成功率。本发明提供的恶性胸腔积液建模技术方案可以针对丧失手术机会的晚期肺癌患者恶性胸水进行建模,从而可在临床和科研中的有很大的实际应用价值。
本发明建立异种移植瘤动物模型的方法最大程度地保留了肿瘤的细胞生物学活性,忠实地还原了患者肿瘤细胞的相关特征,整个模型建立过程简单易行,成瘤率高达40%,因此可用于各种具有恶性胸腔积液的癌症特别是肺癌的药物筛选及机制研究。
下面通过参考附图和具体实施方式进一步详细阐述本发明,但这些阐述仅仅是为了使本领域技术人员更好地理解和实施本发明,并不对本发明做任何形式的限制。除非另有说明,否则本文所用的所有科学和技术术语具有本发明所属和相关技术领域的一般技术人员通常理解的含义。
附图说明
图1显示富集的肿瘤细胞的CK免疫荧光染色。
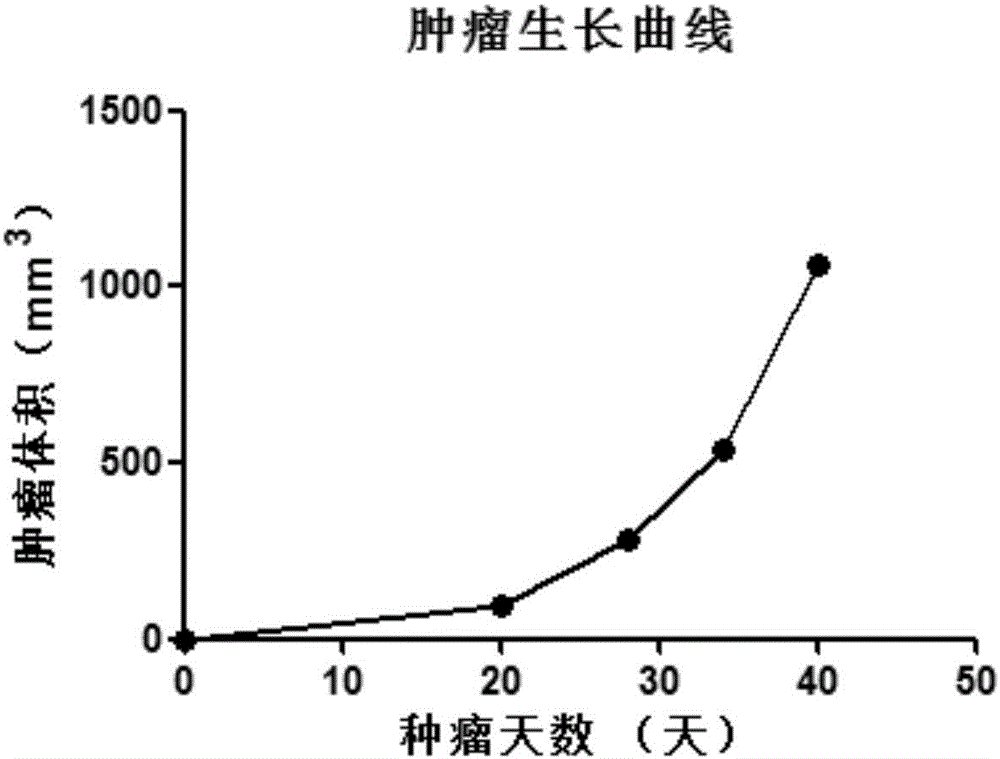
图2显示富集的肿瘤细胞移植入小鼠皮下之后的肿瘤生长曲线。
图3显示从恶性胸腔积液临床样本中富集的肿瘤细胞的苏木精伊红染色。
图4显示ALK融合基因模型CTC15012的克卓替尼(Crizotinib)药效实验。
图5显示EGFR 21号外显子L858R突变模型CTC15008的吉非替尼(Gefitnib)药效实验。
图6显示EGFR 20号外显子T790M突变模型CTC15015的埃罗替尼(Erlotinib)药效实验。
图7显示EGFR 20号外显子T790M突变模型CTC15015的AZD9291药效实验。
具体实施方式
在本申请上下文中,术语“接种液组合物”、“接种液”、“无菌接种液”、“无菌接种液组合物”可互换使用。
本申请上下文中的术语“包括”和“包含”可以相互替换使用,并同时涵盖了“由…组成”这一表述。
在本发明中,如果没有特别说明,本文所提到的所有技术特征以及优选技术特征可以相互组合形成新的技术方案。
在本发明中,如果没有特别说明,本文所提到的所有实施方式以及优选实施方式可以相互组合形成新的技术方案。
异种移植瘤动物模型是指将肿瘤组织或细胞移植到实验动物例如小鼠、大鼠等的体内所形成的肿瘤动物模型。移植性模型由于具有实验条件易于控制、实验周期较短而且可以在同种或同品系动物中连续移植等优点而被广泛用于癌症研究。
胸腔是由壁层胸膜与脏层胸膜所组成的一个封闭性腔隙,其内为负压,正常情况下两层胸膜之间存在很少量的起润滑作用的液体,以减少在呼吸活动过程中两层胸膜之间的摩擦。当发生某种病理情况影响到胸膜,无论是壁层胸膜产生胸水或是脏层胸膜吸收胸水的速率有变化,都可使胸腔内液体增多,形成所谓的胸腔积液(参见,中国专利申请CN102676456A)。
本发明人通过将恶性胸腔积液中的肿瘤细胞有针对性地富集,从而获得了恶性胸腔积液来源异种移植瘤动物模型。单纯通过富集的方法,建模方法成瘤率通常很低,一般低于10%。
本发明人还意外地发现,使用本发明所述的接种液,能够显著提高用恶性胸腔积液来源的癌症细胞构建异种移植瘤动物模型的成瘤率。
不受任何理论的约束,本发明人出乎意料地发现,使用本发明的方法,尤其是使用本发明所述的接种液,优选组合使用FX系统进行细胞富集,能够非常显著地提高用恶性胸腔积液来源的癌症细胞构建异种移植瘤动物模型的成瘤率。
本发明第一方面提供了一种恶性胸腔积液来源异种移植瘤动物模型,所述动物模型由以下方法构建:
(a)采集临床恶性胸腔积液样本;
(b)富集所述恶性胸腔积液样本中的肿瘤细胞;以及
(c)将如步骤(b)富集所得到的肿瘤细胞接种至实验动物,饲养动物至肿瘤形成,从而获得恶性胸腔积液来源的异种移植瘤动物模型。
一个优选实施方式中,所述步骤(b)中使用FX系统进行细胞富集。
一个优选实施方式中,将所述步骤(b)所获得的肿瘤细胞进行H&E染色,CK免疫荧光染色,以检测所富集的细胞是否为肿瘤细胞。
一个优选实施方式中,将所述步骤(b)所获得的肿瘤细胞用无菌接种液处理,所述无菌接种液包含:45体积份的HBSS,5体积份的胎牛血清和50体积份的Matrigel胶,加入Thiazovivin,终浓度为10uM。
另一个优选实施方式中,所述实验动物为重症联合免疫缺陷(SCID)小鼠。
另外一个优选实施方式中,所述恶性胸腔积液样本来自肺癌、乳腺癌、淋巴瘤、或卵巢癌。
本发明第二方面提供一种接种液组合物,该组合物包含以下组分:Hank′s平衡盐缓冲液,胎牛血清,基底膜基质胶,和ROCK蛋白抑制剂。
一种优选实施方式中,本发明提供一种接种液组合物,该接种液组合物由以下组分组成:Hank′s平衡盐缓冲液,胎牛血清,基底膜基质胶,和ROCK蛋白抑制剂。
Hank′s平衡盐缓冲液(Hank′s Balanced Salt Solution,HBSS)是用于细胞培养的常用缓冲液,可通过商业途径购得,例如可购自Sigma-Aldrich、ThermoFisher Scientific等公司。同样,本发明中使用的胎牛血清也可通过商业途径购得,例如可购自Sigma-Aldrich等公司。
基底膜基质胶(Basement Membrane Matrix),也称为基底膜细胞外基质、基底膜提取物、EHS基质等,是一种可溶性的基底膜制备物,提取自Engelbreth-Holm-Swarm(EHS)小鼠肉瘤,富含细胞外基质(ECM)蛋白诸如层粘连蛋白、胶原IV、巢蛋白和各种细胞因子(https://www.corning.com/worldwide/en/products/life-sciences/products/surfaces/matrigel-matrix.html)。由于含有细胞体外贴壁、生长和分化所需的多种化学物质,基底膜基质胶已被广泛用于2D和3D细胞体外培养。目前,市场上提供基底膜基质胶的公司主要有Sigma-Aldrich公司(Matrigel,例如商品号E1270),Corning公司(商品名),Trevigen公司(商品名BME)。这些基底膜基质胶都可以合适地用于本发明,例如优选使用或BME。
ROCK蛋白(Rho相关蛋白激酶)是一种蛋白激酶,属于丝氨酸-苏氨酸激酶的AGC家族。ROCK蛋白主要通过作用于细胞骨架来调控细胞的形状和移动。ROCK蛋白抑制剂是指靶向ROCK蛋白的一系列化合物,目前已知的ROCK蛋白抑制剂例如Thiazovivin、Y-27632、吡那地尔(Pinacidil)、法舒地尔(Fasudil)、Ripasudil、RKI-1447、GSK429286A等。本发明可使用任何合适的ROCK蛋白抑制剂,例如包括但不限于Thiazovivin、Y-27632、吡那地尔(Pinacidil)、法舒地尔(Fasudil)、Ripasudil、RKI-1447、GSK429286A,或它们的任意组合。不受任何理论的限制,但发明人相信,ROCK蛋白抑制剂可抑制细胞的凋亡,因此可能提高细胞的存活,增加建模的成功率。
一个优选实施方式中,所述Hank′s平衡盐缓冲液为35-55体积份,胎牛血清为3-10体积份,基底膜基质胶为40-60体积份,并且ROCK蛋白抑制剂的终浓度为5-20uM。更优选的,Hank′s平衡盐缓冲液为40-50体积份,胎牛血清为4-8体积份,基底膜基质胶为45-55体积份,并且ROCK蛋白抑制剂的终浓度为8-15uM。最优选的,Hank′s平衡盐缓冲液为45体积份,胎牛血清为5体积份,基底膜基质胶为50体积份,并且ROCK蛋白抑制剂的终浓度为10uM。
因此,一个优选实施方式中,本发明的无菌接种液由以下组分组成:Hank′s平衡盐缓冲液,胎牛血清,Matrigel胶,和Thiazovivin。例如,本发明的无菌接种液由以下组分组成:35-55体积份的Hank′s平衡盐缓冲液;3-10体积份的胎牛血清;40-60体积份的Matrigel胶;以及终浓度为5-20uM的Thiazovivin。优选的,本发明的无菌接种液由以下组分组成:40-50体积份的Hank′s平衡盐缓冲液;4-8体积份的胎牛血清;45-55体积份的Matrigel胶;以及终浓度为8-15uM的Thiazovivin。最优选的,本发明的无菌接种液由以下组分组成:45体积份的Hank′s平衡盐缓冲液;5体积份的胎牛血清;50体积份的Matrigel胶;以及终浓度为10uM的Thiazovivin。
本发明还提供一种构建恶性胸腔积液来源异种移植瘤动物模型的方法,该方法包括以下步骤:
(a)采集临床恶性胸腔积液样本;
(b)富集所述恶性胸腔积液样本中的肿瘤细胞;
(c)使用根据本发明的无菌接种液组合物悬浮步骤(b)中富集的肿瘤细胞;以及
(d)将如步骤(c)所述悬浮于无菌接种液组合物中的肿瘤细胞接种至实验动物,饲养动物至肿瘤形成,从而获得恶性胸腔积液来源的异种移植瘤动物模型。
优选地,步骤(b)中使用FX系统(Clearbridge BioMedics公司)进行细胞富集。FX系统使用微流控分选技术,其基于ClearCell CTChip FR1芯片驱动,无须标记细胞,即可达到肿瘤细胞的富集效果,是全球第一个采用全自动细胞检索系统进行活的肿瘤细胞的富集技术。与目前市场上常用的循环肿瘤细胞富集系统相比,FR系统具有三大优势:准确度、敏感度更高,且无需标记;富集到的循环肿瘤细胞纯度更高;富集活的肿瘤细胞,保持了较高的肿瘤细胞生物活性。本发明优选使用FX系统进行细胞富集,但本发明中癌细胞的分离和富集也可使用传统的离心沉淀等技术或者本领域知晓的从胸水中分离富集癌细胞的其他任何合适的方法(例如,参见中国专利申请CN102676456A)。
一个优选实施方式中,将所述步骤(b)所获得的肿瘤细胞进行H&E染色,CK免疫荧光染色,以检测所富集的细胞是否为肿瘤细胞。
另一个优选实施方式中,所述实验动物为小鼠或大鼠,更优选小鼠,最优选为重症联合免疫缺陷(SCID)小鼠。
另外一个优选实施方式中,所述恶性胸腔积液样本来自肺癌、乳腺癌、淋巴瘤、或卵巢癌。恶性胸水主要由胸腔脏器的恶性肿瘤引起,尤其常见于晚期肺癌(例如非小细胞肺癌),但也见于乳腺癌、淋巴瘤、卵巢癌等癌症。
优选地,在步骤(b)之后还包括鉴定所富集的细胞是否为肿瘤细胞的步骤,例如通过H&E染色、细胞角蛋白(Cytokeratin,CK)免疫荧光染色检测所富集的细胞是否为肿瘤细胞。另外一个实施方式中,在使用FX系统进行细胞富集之前,用PBS清洗细胞,加入红细胞裂解液裂解,并用PBS重悬细胞。
本发明第四方面提供一种根据本发明的方法构建的动物模型在临床或科研研究中的应用。根据本发明的方法构建的动物模型可应用于多种临床或科研研究中,包括但不限于药物筛选研究、药效学研究、药理学研究、患者响应性研究、基因特异性研究、生物标志物研究、和/或生物学机制研究。
另外,由于恶性胸腔积液多出现于晚期癌症患者,很多患者的积液出现于治疗耐药后,因此由此类样本所建立的模型多为较特殊的基因突变模型,例如EGFR20号外显子T790M突变和ALK融合基因耐药。因此,一个优选实施方式中,根据本发明的方法构建的动物模型应用于选自以下的基因型:EGFR20号外显子T790M突变、EGFR 21号外显子L858R突变、和/或ALK融合基因。
本发明可适用于晚期癌症尤其是肺癌(例如非小细胞肺癌)伴发恶性胸腔积液的患者,收集该类患者的恶性胸腔积液进行异源移植小鼠模型的建立。因为通过恶性胸腔积液建模成功率非常低且不稳定,所以恶性胸腔积液肿瘤细胞首先采用微流控技术进行高纯度富集,同时用本发明的无菌接种液悬浮富集的肿瘤细胞,最大程度保留了肿瘤细胞生物学活性,随后接种至重症联合免疫缺陷小鼠皮下生长,忠实地还原了患者肿瘤细胞的相关特征,整个模型建立过程简单易行,成瘤率高达40%,可用于肺癌药物筛选及肺癌的机制研究。通过本发明建立的肺癌患者恶性胸腔积液来源异种移植瘤模型具有制作过程操作简单方便,具可重复性,建模成功率高,易于推广等优点,适用于药物筛选及实验研究,且收集胸液过程中所施行的胸腔闭式引流术或胸腔穿刺术对患者影响小。
下面将结合具体实施例进一步阐述本发明。在以下实施例中,如无特别说明,所用的实验材料和试剂均可在常规生化试剂公司购得。所用的实验方法,如无特殊说明,均为常规方法。另外,这些实施例仅用于说明本发明而不以任何方式限制本发明的范围。本发明的范围仅由所附的权利要求书限定。本领域技术人员在阅读了本公开内容之后,可在不脱离本发明精神和范围的情况下对本发明做出多种改动和变化,这些改动和变化都应认为是本发明实施方式的等同形式而落在本发明的范围内。
实施例
实施例1肺癌恶性胸腔积液来源的异种移植瘤小鼠模型的构建
1.实验动物
从供应商订购4-5周龄的雌性重症联合免疫缺陷小鼠,饲养于SPF级别动物房,实验开始前动物至少适应性饲养三天。
2.实验过程
2.1肺癌临床恶性胸腔积液样本的采集
收取新鲜收集的非小细胞肺癌恶性胸腔积液样本各200ml于含抗凝剂的试管中,冰上运输,在24小时内运至实验室。共收集15例恶性胸腔积液。
2.2恶性胸腔积液中肿瘤细胞的富集
在生物安全柜中用一倍体积的PBS缓冲液(HyClone公司,SH30256.01)稀释恶性胸腔积液样本,500g离心10分钟,去上清,PBS重悬,重复离心清洗2次。
PBS重悬后,用70um滤网过滤,500g离心10分钟。去上清,加入红细胞裂解液,裂解3-5分钟,加2-3倍体积的PBS中和,500g离心10分钟。去上清,加入适量PBS重悬。细胞悬液上至肿瘤细胞富集仪ClearCell FX系统(Clearbridge BioMedics公司)中,进行肿瘤细胞的富集。
将富集的细胞取30000个细胞进行贴片,H&E染色,CK免疫荧光染色确定所富集的细胞为肿瘤细胞(结果见附图1),并经专业病理科医师确认。
2.3配制无菌接种液
混合45体积份的HBSS缓冲液,5体积份的胎牛血清和50体积份的Matrigel(SIGMA,E1270-10ml)胶,并加入ROCK蛋白抑制剂Thiazovivin(Selleck,S1459)至终浓度为10uM。将配制好的上述接种液灭菌。
2.4肺癌患者恶性胸腔积液来源肿瘤移植模型的建立
将富集的肿瘤细胞分为两份,一份不加无菌接种液,一份悬浮于上述制备的无菌接种液中,用注射器分别皮下移植到重症联合免疫缺陷小鼠右侧背部。细胞移植后,每天观察小鼠健康状况,定期检测肿瘤生长情况,用电子游标卡尺每周测量一次肿瘤的长和宽,肿瘤体积计算公式:TV=(长*宽2)/2。肿瘤生长情况参见附图2(该图是CTC15012的生长曲线)。
2.5肿瘤组织的病理学分析
用苏木精伊红染色对形成的肿瘤组织进行常规病理学检测(结果见附图3)。
3.实验结果
通过收集的15例恶性胸腔积液进行建模,不加无菌接种液组,仅成瘤2例,一例为ALK融合基因肺癌模型,另一例为EGFR 20号外显子插入突变肺癌模型,成瘤率为13.3%。而加无菌接种液组,最终建成6例异源移植小鼠模型,其中包含两例ALK融合基因(其中一例命名为CTC15012),一例EGFR 21号外显子L858R突变(命名为CTC15008),一例EGFR 20号外显子T790M突变(命名为CTC15015),一例EGFR 20号外显子插入突变及一例EGFR野生型,成瘤率达到40%。
实施例2在非小细胞肺癌模型CTC15012上进行的药效实验
为了验证本发明所建立的肺癌突变模型与临床反应一致,在所建立的动物模型上进行与临床病人所服用的药物一致的相应的药效实验。
雌性NU/NU裸小鼠皮下接种人源的ALK融合基因模型CTC15012肿瘤块。非小细胞肺癌模型CTC15012源自于一名55岁女性病人,该患者的病理诊断为支气管肺腺癌。将肿瘤于HBSS中剪成剪碎成小块接种到裸鼠的皮下,待肿瘤长至500-700mm3时,将肿瘤在HBSS培养液中剪成10-15mg的小块用于20只实验裸鼠皮下接种。具体接种方法为:碘伏对小鼠背部两侧皮肤消毒,用20号套管针将总量2×2×2mm3的肿瘤快组织于背部两侧刺入,针头走行于皮肤与肌肉间,最终将组织送入前肢肩背部皮下,压迫伤口至无出血。SPF级环境下常规饲养,待肿瘤体积长至平均约100-300mm3时,挑选12只肿瘤生长均一性较好的荷瘤小鼠,根据肿瘤大小和裸鼠体重随机分组给药,分组如下:
第一组:N=6,对照组,灌胃给药,一天一次;
第二组:N=6,克卓替尼,25mg/kg,灌胃给药,一天一次。
每组小鼠每天称重给药并观察小鼠健康状况,每周调查2次小鼠肿瘤体积。
结果如图4所示,ALK融合基因模型CTC15012对ALK抑制剂克卓替尼(Selleck,S1068)敏感。
实施例3在非小细胞肺癌模型CTC15008上进行的药效实验
雌性NU/NU裸小鼠皮下接种人源的EGFR 21号外显子L858R突变模型CTC15008肿瘤块。非小细胞肺癌模型CTC15008源自于一名71岁女性病人,该患者的病理诊断为支气管肺腺癌。将肿瘤于HBSS中剪成剪碎成小块接种到裸鼠的皮下,待肿瘤长至500-700mm3时,将肿瘤在HBSS培养液中剪成10-15mg的小块用于20只实验裸鼠皮下接种。具体接种方法为:碘伏对小鼠背部两侧皮肤消毒,用20号套管针将总量2×2×2mm3的肿瘤快组织于背部两侧刺入,针头走行于皮肤与肌肉间,最终将组织送入前肢肩背部皮下,压迫伤口至无出血。SPF级环境下常规饲养,待肿瘤体积长至平均约100-300mm3时,挑选12只肿瘤生长均一性较好的荷瘤小鼠,根据肿瘤大小和裸鼠体重随机分组给药,分组如下:
第一组:N=6,对照组,灌胃给药,一天一次;
第二组:N=6,吉非替尼,75mg/kg,灌胃给药,一天一次。
每组小鼠每天称重给药并观察小鼠健康状况,每周调查2次小鼠肿瘤体积。
结果如图5所示,EGFR 21号外显子L858R突变模型CTC15008对EGFR抑制剂吉非替尼(Selleck,S1025)敏感。
实施例4在非小细胞肺癌模型CTC15015上进行的药效实验
雌性NU/NU裸小鼠皮下接种人源的EGFR 20号外显子T790M突变模型CTC15015肿瘤块。非小细胞肺癌模型CTC15015源自于一名51岁男性病人,该患者的病理诊断为支气管肺腺癌,临床对埃罗替尼耐药。将肿瘤于HBSS中剪成剪碎成小块接种到裸鼠的皮下,待肿瘤长至500-700mm3时,将肿瘤在HBSS培养液中剪成10-15mg的小块用于30只实验裸鼠皮下接种。具体接种方法为:碘伏对小鼠背部两侧皮肤消毒,用20号套管针将总量2×2×2mm3的肿瘤快组织于背部两侧刺入,针头走行于皮肤与肌肉间,最终将组织送入前肢肩背部皮下,压迫伤口至无出血。SPF级环境下常规饲养,待肿瘤体积长至平均约100-300mm3时,挑选18只肿瘤生长均一性较好的荷瘤小鼠,根据肿瘤大小和裸鼠体重随机分组给药,分组如下:
第一组:N=6,对照组,灌胃给药,一天一次;
第二组:N=6,埃罗替尼,50mg/kg,灌胃给药,一天一次。
第三组:N=6,AZD9291,5mg/kg,灌胃给药,一天一次。
每组小鼠每天称重给药并观察小鼠健康状况,每周调查2次小鼠肿瘤体积。
结果如图6所示,EGFR 20号外显子T790M突变模型CTC15015对EGFR抑制剂埃罗替尼(Selleck,S1023)不敏感。结果如图7所示,EGFR 20号外显子T790M突变模型CTC15015对EGFR抑制剂AZD9291(Selleck,S7297)敏感。
- 还没有人留言评论。精彩留言会获得点赞!