一种诱导性多能干细胞的制备方法与流程
本技术涉及一种诱导性多能干细胞的制备方法,特别涉及一种利用同时具有四种基因的慢病毒及其激活病毒进行细胞转染以制备诱导性多能干细胞的方法。
背景技术:
诱导性多能干细胞(inducedpluripotentstemcells,ipscs)是2006年日本科学家山中伸弥首次利用逆转录病毒载体将oct4、sox2、klf4和c-myc四个转录因子导入小鼠皮肤成纤维细胞中,使其重编程所获得的一种多能性干细胞。ipscs在形态、基因及蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等均与胚胎干细胞极为相似。2007年山中伸弥和美国汤普森实验室都报道,利用几种特定的转录因子可以诱导人皮肤成纤维细胞成为ipscs。两个实验室采用了不同的诱导方案,山中伸弥实验室使用逆转录病毒引入oct3/4、sox2、c-myc和klf4四种因子组合,而汤普森实验室使用慢病毒载体引入oct4、sox2加nanog和lin28这种因子组合。逆转录病毒只能转导分裂期细胞,而慢病毒载体可以感染非分裂期细胞,容纳外源性目的基因片断大、免疫反应小等特点,因而应用广泛。十年来,尽管新型转染载体不断出现,如腺病毒、脂质体、小分子等,然而慢病毒转染的效率仍然是最高的,大量的基础研究和应用技术研发依然是基于慢病毒转染方法。
由于制备ipscs需要使用多种因子的组合,常规的感染方法是,首先分别构建含有单一基因的质粒,之后分别包装成含有单一基因的慢病毒,接下来将各个含有单一基因的慢病毒进行混合,最后使用混合病毒液感染目的细胞。这种常规慢病毒感染方法需要制备多个含有单一基因的慢病毒,步骤繁琐,耗时长,且多次重复操作造成污染几率增加。
针对上述常规慢病毒制备ipscs方法所存在的关键问题,迫切需要进一步优化ipscs制备技术。本发明开发了一种新的制备诱导性多能干细胞的方法,即构建同时含有四种基因的慢病毒及其激活病毒,使用这两种病毒来感染人外周血单核细胞,从而得到ipscs。此新方法减少了所需病毒的数量,大大简化了慢病毒的制备过程,进一步提高了ipscs制备过程的效率,大大降低了污染的风险。
技术实现要素:
本发明的目的在于提供一种诱导性多能干细胞的制备方法。
为实现上述目的,本发明所采用的技术方案包括下列步骤:
(1)人外周血单核细胞的分离与培养
利用ficoll淋巴细胞分离液分离人外周血单核细胞,使用含有生长因子的外周血单核细胞培养液培养4-7天;
(2)质粒的构建和扩增
构建ⅰ、ⅱ、ⅲ、ⅳ号四种质粒,将所构建好的质粒分别取上清液做转化,用5-alpha大肠杆菌感受态或neb感受态或c2987h感受态进行转化,均使用氨苄青霉素抗性的固体培养基;次日挑取克隆置于氨苄青霉素的液体培养基中扩增,用质粒提取试剂盒提取质粒;
所述ⅰ号质粒为pspax2s质粒,此质粒是第二代慢病毒包装质粒,在原核生物中具有氨苄青霉素抗性;
所述ⅱ号质粒为pmd2.g质粒,此质粒是水泡性口炎病毒包膜质粒,在原核生物中具有氨苄青霉素抗性;
所述ⅲ号质粒为teto-fuw-oskm质粒,此质粒是在teto-fuw质粒中插入了oct4、sox2、klf4与c-myc(oskm)四种小鼠基因,是一种能被反向四环素反式激活因子诱导表达小鼠oct4、sox2、klf4与c-myc蛋白的病毒质粒,此质粒在原核生物中具有氨苄青霉素抗性;
所述ⅳ号质粒为fuw-m2rtta质粒,此质粒是在fuw质粒上插入反向四环素反式激活因子的基因形成的病毒质粒,此质粒在原核生物中具有氨苄青霉素抗性;
(3)慢病毒的构建
使用hek-293t细胞构建a、b两种病毒,每种病毒由三种质粒构成,分别是ⅰ、ⅱ、ⅲ号质粒和ⅰ、ⅱ、ⅳ号质粒;
(4)慢病毒感染人外周血单核细胞以及诱导性多能干细胞(ipscs)的获得
取培养4-7天的人外周血单核细胞,加入a、b两种病毒,之后采用离心法进行病毒感染;第二天将细胞转移至imatrix-511(购自nippi公司)包被的培养板上,使用含有doxycycline(购自stemcell公司)及生长因子的外周血单核细胞培养液进行培养,每天采用新鲜培养液对培养体系进行1/2体积的半量换液;第七天使用ipscs培养液(mtesrtm1completekit,购自stemcell公司)对培养体系进行1/2体积的半量换液,之后每天采用新鲜ipscs培养液对培养体系进行1/2体积的半量换液,直到形成直径1cm的克隆,即获得ipscs;将克隆转移到新的imatrix-511包被的培养板上,每天采用新鲜ipscs培养液对培养体系进行1/2体积的半量换液,每4-7天进行ipscs的传代培养。
所述步骤(1)中含有生长因子的外周血单核细胞培养液为添加下列生长因子的stempro-34(购自theromfisher公司)无血清培养液:
il-320ng/ml
il-620ng/ml
scf100ng/ml
fl-3100ng/ml;每5×105-1×106细胞添加1.5ml培养液。
所述步骤(3)中的所述的构建a、b两种病毒的步骤包括:
第一天:将1×106-2×106个hek-293t细胞分别种在二个10cm培养皿中,使用7ml终体积含量5-15%胎牛血清的无抗生素的dmem培养基进行培养,置于37℃,5%co2(通入含体积浓度5%co2的空气)培养箱中培养;
第二天:在hek-293t细胞长至培养皿面积的60%时,使用15μllipofectamine2000/皿做细胞转染,对应a、b分别使用7.5μgⅰ号质粒、2.5μgⅱ号质粒,以及10μgⅲ号质粒或ⅳ号质粒;置于37℃,5%co2(通入含体积浓度5%co2的空气)培养箱中转染6-8小时;之后,将培养基更换为7ml终体积含量5-15%胎牛血清及终体积含量1%青霉素和链霉素(体积比1:1)的dmem培养基;
第三天:分别将培养皿中含有病毒的7ml培养基收集在无菌ep管内,培养皿再添加7ml同样的新培养基培养24小时;
第四天:分别收集第三天新加入的培养基,再与第三天收集的含有病毒的7ml培养基分别用1500rpm离心5分钟,分别收集上清、混合,得a、b两种病毒;于4℃可进行短期(1周内)保存,-80℃可长期(超过1周)保存。
所述步骤(4)中的所述加入的a、b两种病毒的体积比例为1:1,每3×105细胞加10μl总病毒。
所述步骤(4)中的所述的采用离心法进行病毒感染是指将细胞和病毒混合均匀,放入离心管,2250rmp离心30分钟,之后感染结束,细胞继续培养。
所述步骤(4)中的所述含有doxycycline及生长因子的外周血单核细胞培养液为添加下述doxycycline和生长因子的stempro-34(购自theromfisher公司)无血清培养液:
doxycycline10μg/ml
il-320ng/ml
il-620ng/ml
scf100ng/ml
fl-3100ng/ml;每5×105-1×106细胞添加1ml培养液。
所述该方法构建了含有小鼠oct4、sox2、klf4和c-myc四种基因的慢病毒及其激活慢病毒,并使用这两种慢病毒感染人外周血单核细胞来获得ipscs。
本发明的优点
由于制备ipscs需要使用多种因子的组合,常规的方法是首先分别构建多个含有单一基因的质粒,之后分别包装成多个含有单一基因的慢病毒,接下来将各个含有单一基因的慢病毒进行混合,最后使用混合病毒液感染目的细胞。这种常规慢病毒感染方法需要制备多个含有单一基因的慢病毒,步骤繁琐,耗时长,且多次重复操作造成污染几率增加。
而本发明设计了同时含有小鼠oct4、sox2、klf4和c-myc四种基因的ⅲ号teto-fuw-oskm质粒,此质粒是一种能被反向四环素反式激活因子诱导表达小鼠oct4、sox2、klf4和c-myc蛋白的病毒质粒。在没有反向四环素反式激活因子时,这四种基因不会转录与表达,而在加入反向四环素反式激活因子后,会诱导四种基因都转录与表达,最终诱导形成ips细胞。另外,本发明还设计了ⅳ号fuw-m2rtta质粒,此质粒是在fuw质粒上插入反向四环素反式激活因子的基因形成的病毒质粒,此质粒形成病毒侵染真核细胞后会表达反向四环素反式激活因子,作为激活病毒来诱导ⅲ号质粒中oct4、sox2、klf4和c-myc四种小鼠基因的转录与表达。因此,本发明利用这两种质粒构建了同时含有oct4、sox2、klf4和c-myc四种基因的a慢病毒及其激活慢病毒(b)来感染人外周血单核细胞,从而得到ipscs。本发明的新方法减少了所需病毒的数量,大大简化了慢病毒的制备过程,进一步提高了ipscs制备过程的效率,并大大降低了污染的风险。并且,本发明同时提出了本方法的最优操作条件以获得最高的诱导效率,尤其是病毒转染条件(总病毒量和两种病毒之间的体积比例)以及ipscs培养液的加入时间。
附图说明
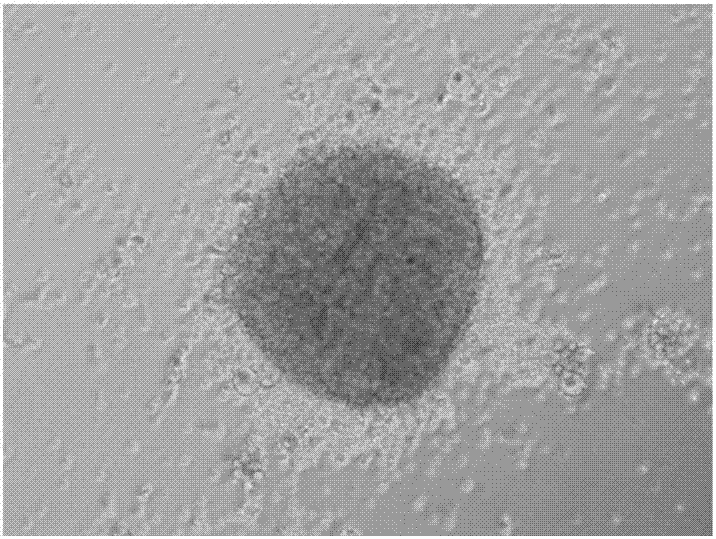
图1是病毒感染7天后细胞的明场照片;
图2是病毒感染22天后克隆的明场照片;
图3是第四代ipscs的明场照片;
图4是第三代ipscs的干性抗体染色照片(a为ssea-1;b为ssea-3;tra-1-60);
图5是ⅰ号pspax2s质粒;
图6是ⅱ号pmd2.g质粒;
图7是ⅲ号teto-fuw-oskm质粒;
图8是ⅳ号fuw-m2rtta质粒。
具体实施方式
下面结合具体实施例对本发明做详细的说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不构成对本发明的任何限制。任何人在本发明权利要求范围内所做的任何形式的修改,仍在本发明权利要求保护范围之内。实施例1人外周血单核细胞来源ipscs的制备
(1)人外周血单核细胞的分离与培养
将肝素抗凝的人外周血和等体积的pbs充分混合均匀,再将混合液沿离心管壁缓慢加到含有两倍外周血体积的ficoll(lsm,购自mpbiomedicals公司)上面,400g离心30min。离心后,用塑料胶头滴管小心吸出单核细胞层至新的离心管,添加pbs,260g离心10min。弃上清,再使用pbs离心洗涤一遍。弃上清,再加入10mlbufferelerythrocytelysisbuffer(购自qiagen公司),260g离心5min,弃上清。使用pbs离心洗涤一遍,弃上清,再使用含有生长因子的外周血单核细胞培养液(购自theromfisher公司的stempro-34无血清培养液补充20ng/ml的il-3和il-6及100ng/ml的scf和fl-3)在37℃,5%co2(通入含体积浓度5%co2的空气)的培养箱中培养5天,每7×105细胞添加1.5ml培养液。
(2)质粒的构建和扩增
构建ⅰ、ⅱ、ⅲ、ⅳ号四种质粒,将这四种质粒分别点在海棉纸的圆形区域内,每种不少于3μg。将圆形区域剪下各置于ep管中,加入100μl无菌水将纸片完全浸没,常温放置20分钟。高速离心后分别收取上清液。各取1μl上清液,使用5-alpha大肠杆菌感受态进行转化,均使用氨苄青霉素抗性的固体培养基。之后,挑取克隆置于氨苄青霉素的液体培养基中扩增,最后用质粒提取试剂盒提取质粒。
(3)慢病毒的构建
在hek-293t细胞中分别构建两种病毒,a病毒由ⅰ号pspax2包装质粒、ⅱ号pmd2.g包膜质粒及ⅲ号teto-fuw-oskm质粒三种质粒构成;b病毒是由ⅰ号pspax2包装质粒、ⅱ号pmd2.g包膜质粒及ⅳ号fuw-m2rtta质粒构成。
第一天,将2×106个hek-293t细胞分别种在二个10cm皿中,使用7ml终体积含量10%胎牛血清的无抗生素的dmem培养基进行培养,置于37℃,5%co2(通入含体积浓度5%co2的空气)培养箱中培养。第二天,在hek-293t细胞长至培养皿面积的60%时,使用15μllipofectamine2000/皿做细胞转染,对应a、b分别使用7.5μgⅰ号质粒、2.5μgⅱ号质粒,以及10μgⅲ号质粒或ⅳ号质粒,置于37℃,5%co2(通入含体积浓度5%co2的空气)培养箱中转染6-8小时。之后,将培养基更换为7ml终体积含量10%胎牛血清及终体积含量1%青霉素和链霉素(体积比1:1)的dmem培养基。第三天,分别将培养皿中含有病毒的7ml培养基收集在无菌ep管内,培养皿再添加7ml同样的新培养基培养24小时。第四天,分别收集第三天新加入的培养基,再与第三天收集的含有病毒的7ml培养基分别用1500rpm离心5分钟,分别收集上清、混合,得a、b两种病毒,-80℃长期保存。
(4)慢病毒感染人外周血单核细胞以及ipscs的获得
取培养5天的人外周血单核细胞,加入a、b两种病毒(两者体积比例为1:1,每3×105细胞加10μl总病毒),将细胞和病毒混合均匀,放入离心管,2250rmp离心30分钟,之后弃上清,细胞用含有生长因子的外周血单核细胞培养液(购自theromfisher公司的stempro-34无血清培养液补充20ng/ml的il-3和il-6及100ng/ml的scf和fl-3)重悬,37℃,5%co2(通入含体积浓度5%co2的空气)孵箱培养。第二天,将细胞转移至imatrix-511(购自nippi公司)包被的培养板上,使用含有doxycycline及生长因子的外周血单核细胞培养液(购自theromfisher公司的stempro-34无血清培养液补充10μg/mldoxycycline,20ng/ml的il-3和il-6及100ng/ml的scf和fl-3)进行培养,每1×106细胞添加1ml培养液,每天采用新鲜培养液对培养体系进行1/2体积的半量换液。第七天使用ipscs培养液(mtesrtm1completekit,购自stemcell公司)对培养体系进行1/2体积的半量换液,之后每天采用新鲜ipscs培养液对培养体系进行1/2体积的半量换液,直到形成直径1cm的克隆,即获得ipscs。将克隆转移到新的imatrix-511包被的培养板上,每天采用新鲜ipscs培养液对培养体系进行1/2体积的半量换液,每6天进行ipscs的传代培养。
实施例2人外周血单核细胞来源ipscs的评价
按照实施例1的方法制备ipscs,在病毒感染人外周血单核细胞7天、22天时,使用显微镜观察细胞形态。在形成ipscs及传代过程中继续使用显微镜观察ipscs形态,并使用免疫荧光对第三代ipscs进行干性标记物的检测。结果发现,病毒感染7天后细胞呈现聚集生长现象(图1),第22天时形成克隆(图2),之后形成ipscs,其具有典型的形貌特征(图3),且表达典型的胚胎干细胞标记物ssea-1、ssea-3和tra-1-60(图4),这些结果说明本发明的方法有效制备出了ipscs。
实施例3病毒转染条件对ipscs诱导效率的影响
利用实施例1的方法制备人外周血单核细胞来源的ipscs,作为实验组。另外,设置4个对照组:
1)对照组1:使用5μl总病毒量进行转染,a、b两种病毒体积比为1:1,其它条件同实施例1;
2)对照组2:使用15μl总病毒量进行转染,a、b两种病毒体积比为1:1,其它条件同实施例1;
3)对照组3:使用10μl总病毒量进行转染,a、b两种病毒体积比为2:1,其它条件同实施例1;
4)对照组4:使用10μl总病毒量进行转染,a、b两种病毒体积比为1:2,其它条件同实施例1;
实验发现上述5个组(实验组、对照组1-4)的ipscs诱导效率分别为20%、7%、11%、13%及12%,结果说明10μl总病毒量,a、b两种病毒体积比为1:1是最优条件,其诱导效率最高。
实施例4ipscs培养液的加入时间对ipscs诱导效率的影响
利用实施例1的方法制备人外周血单核细胞来源的ipscs,作为实验组。另外,设置2个对照组:
1)对照组1:在病毒转染后第四天开始使用ipscs培养液(mtesrtm1completekit,购自stemcell公司)对培养体系进行1/2体积的半量换液,其它条件同实施例1;
2)对照组2:在病毒转染后第十天开始使用ipscs培养液(mtesrtm1completekit,购自stemcell公司)对培养体系进行1/2体积的半量换液,其它条件同实施例1;
实验发现上述3个组(实验组、对照组1-2)的ipscs诱导效率分别为18%、9%及7%,结果说明病毒转染后第七天开始使用ipscs培养液半量换液条件最优,其诱导效率最高。
- 还没有人留言评论。精彩留言会获得点赞!