稳定表达牛胰蛋白酶原的Vero细胞系及其用途的制作方法
本发明涉及生物技术领域,具体地,本发明涉及工程细胞系克隆Vero-S.pro-try及其构建方法,以及所述细胞系在培养流感病毒、制备流感疫苗、抗流感病毒药物筛选、中和抗体测定或者流感其他相关研究等方面的应用。
背景技术:
流感疫苗是目前预防流感发生和传播最为有效的手段。现行市场上人流感疫苗多数以鸡胚为基质进行生产,包含甲型H1N1、H3N2和乙型流感病毒株。传统的鸡胚生产系统已有近70年的历史,疫苗的免疫效果已得到充分证实,但其自身仍存在一些不足之处,比如培养的流感病毒易发生抗原变异,与人群流行株不能完全匹配;残留卵清蛋白易引起过敏反应;尤其当出现大流行时健康鸡胚供应受限不能满足短时间内对疫苗的大量需求等。而哺乳动物细胞培养系统相较鸡胚具有明显的优势,能够避免这些问题,成为未来疫苗生产的发展趋势,1995年WHO建议开展以哺乳动物细胞为生产基质的研究。
目前已探索适用的哺乳动物细胞包括非洲绿猴肾细胞(African green monkey kidney cell,Vero)、犬肾上皮细胞(Madin-Darby canine kidney cells,MDCK)以及人胚胎成视网膜细胞PER.C6。其中Vero细胞是WHO推荐的用于疫苗生产病毒培养的哺乳动物细胞系。现多厂家开展Vero细胞培养流感病毒疫苗相关研究。临床试验表明使用Vero等细胞生产的流感疫苗是安全的并有高免疫原性,然而较低的病毒滴度是其大规模生产的瓶颈之一。在生产体系的复杂环境中造成低滴度原因是多方面的,单从细胞基质的角度来讲,这种细胞本身并不表达裂解HA的蛋白酶类,成为病毒产量低的一种限制因素。
流感病毒血凝素HA是病毒主要表面抗原之一,在识别并结合靶细胞受体、介导膜融合、诱导保护性中和抗体方面发挥重要作用。在病毒复制过程中,HA蛋白首先以前体HA0形式合成,经宿主蛋白酶裂解为成熟的HA1和HA2后,才能够介导病毒囊膜与靶细胞膜融合,起始病毒生命周期,因此HA的裂解是病毒感染细胞的首要前提,而Vero细胞本身并不具备裂解HA的蛋白酶类,研究证明外加一定量的胰蛋白酶能够加速病毒胞间传播,提高病毒滴度,加速病毒多周期生长,现已成为流感病毒细胞培养的常规操作。
胰蛋白酶属于丝氨酸蛋白酶家族,其C端长220aa的丝氨酸肽酶功能域能够特异水解人流感病毒或低致病性禽流感病毒HA0,从而成熟的HA1、HA2发挥作用使病毒基因组释放入细胞内,加速病毒多周期生长,但同时外加的胰酶也加大细胞培养的难度,提高了疫苗生产成本。
技术实现要素:
本发明第一方面,提供了一种稳定分泌表达牛胰蛋白酶原的修饰的Vero细胞系,该细胞系含有整合入其细胞基因组的完整的分泌型牛胰蛋白酶原S.pro-try的编码基因。
在一个具体实施方式中,所述细胞基因组含有分泌型牛胰蛋白酶原编码基因,核苷酸序列(Genbank LOC780933)具体如SEQ ID No.1所示:
ATGAAGACCTTCATCTTTCTGGCTCTCTTGGGAGCCGCTGTTGCTTTCCCCGTGGACGATGATGACAAGATCGTGGGCGGCTACACCTGTGGGGCAAATACTGTCCCCTACCAAGTGTCCCTGAACTCTGGCTACCACTTCTGCGGGGGCTCCCTCATCAACAGCCAGTGGGTGGTGTCTGCGGCTCACTGCTACAAGTCCGGAATCCAAGTGCGTCTGGGAGAAGACAACATTAATGTCGTTGAGGGCAATGAGCAATTCATCAGCGCATCCAAGAGTATCGTCCATCCCAGCTACAACTCAAACACCTTAAACAACGACATCATGCTGATTAAACTGAAATCAGCTGCCAGTCTCAACAGCCGAGTAGCCTCTATCTCTCTGCCAACATCCTGTGCCTCTGCTGGCACCCAGTGTCTCATCTCTGGCTGGGGCAACACCAAAAGCAGTGGCACCAGCTACCCTGATGTCCTGAAGTGTCTGAAGGCTCCCATCCTATCAGACAGCTCTTGCAAAAGTGCCTACCCAGGCCAGATCACCAGCAACATGTTCTGTGCGGGCTACCTGGAGGGCGGAAAGGACTCCTGCCAGGGTGACTCCGGTGGCCCTGTGGTCTGCAGTGGAAAGCTCCAGGGCATTGTCTCCTGGGGCTCTGGCTGCGCTCAGAAAAACAAGCCTGGTGTCTACACCAAGGTCTGCAACTACGTGAGCTGGATTAAGCAGACCATCGCCTCCAACTAA(SEQ ID No.1)。
在一个具体实施方式中,所述细胞系命名为VTY55,保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址在北京市朝阳区北辰西路1号院中科院微生物研究所,其菌种保藏编号为:CGMCC No.12680,保藏日期为2016年7月6日。
本发明第二方面,提供一种构建上述修饰的Vero细胞系的方法,所述方法包括将编码S.pro-try的开放阅读框cDNA序列与真核表达载体连接,再将所述真核表达载体转染到Vero细胞系中,经抗生素加压筛选获得稳定表达的细胞系。
在一个具体实施方式中,所述真核表达载体是pcDNA3.1。
在一个具体实施方式中,将目的序列与真核表达载体连接,并瞬时转染入Vero细胞系中。
在一个优选的实施方式中,将分泌型牛胰蛋白酶原的真核表达载体连续加压筛选,结合有限稀释法获得稳定表达单克隆细胞。更优选的,所述连续加压筛选是在高浓度的G418条件下筛选。
更进一步,所述G418的浓度为600μg/ml。
优选的,所述分泌型牛胰蛋白酶原的核酸编码序列如SEQ ID No.1所示。
更优选的,所述修饰的Vero细胞系为VTY55,保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址在北京市朝阳区北辰西路1号院中科院微生物研究所,其菌种保藏编号为:CGMCC No.12680,保藏日期为2016年7月6日。
本发明第三方面,提供一种上述修饰的Vero细胞系的应用,其中,所述应用包括将上述修饰的Vero细胞系用于培养流感病毒,制备流感疫苗,抗流感药物筛选,中和抗体测定或者流感其他相关研究等领域的应用。
优选的,所述流感为人流感。
本发明的第四方面,提供一种培养流感病毒的方法,其中,所述方法包括利用上述修饰的Vero细胞系对流感病毒进行培养。
在一个具体实施方式中,上述方法中的流感为人流感。
在一个具体实施方式中,上述方法包括,将人流感病毒H1、H3亚型及B型毒株接种于本发明构建的上述的修饰的Vero细胞系中。
在一个具体实施方式中,上述方法包括,病毒在所述细胞上的培养条件为37℃、4%CO2、无血清培养48-72h,收获病毒上清液即得流感病毒液。
优选的,所述方法中的增殖人流感病毒的步骤中不需要添加TPCK-胰酶。
优选的,所述方法中的增殖人流感病毒的步骤中也可以进一步添加TPCK-胰酶。
本发明的第五方面,提供一种制备流感疫苗的方法,其中,所述方法包括利用上述修饰的Vero细胞系来制备流感疫苗。
在一个具体实施方式中,上述方法中的流感为人流感。
在一个具体实施方式中,上述方法包括,将人流感病毒H1、H3亚型及B型毒株接种于本发明构建的上述的修饰的Vero细胞系中。
在一个具体实施方式中,上述方法包括,病毒在所述细胞上的培养条件为37℃、4%CO2、无血清培养48-72h,收获病毒上清液即得流感病毒液。
优选的,所述方法中的增殖人流感病毒的步骤中不需要添加TPCK-胰酶。
优选的,所述方法中的增殖人流感病毒的步骤中也可以进一步添加TPCK-胰酶。
本发明采取基因工程手段,将胰蛋白酶基因导入Vero细胞,接种不同型或亚型人流感病毒,比较病毒产量,并连续加压筛选出能够稳定自主表达的细胞系,一方面用于疫苗规模化生产,简化生产工艺,更加有效地提升病毒产量,为将来大规模流感疫苗生产奠定细胞基础,解决疫苗产能扩大和品质提高的关键问题;另一方面也可以作为实验室有效分离培养和监测流感病毒、抗流感病毒药物的筛选、中和抗体的测定等其他方面的研究工具,具有广泛的应用前景。本发明筛选得到的稳定分泌表达牛胰蛋白酶原的Vero细胞系培养流感病毒生产滴度高,对于各种不同亚型的流感病毒株,本发明修饰的Vero细胞VTY55在无外加TPCK-胰酶的情况下培养的病毒滴度均明显高于普通Vero细胞外加TPCK-胰酶培养的病毒滴度,尤其对于A3/Switzerland/9715293/2013-CDC-LA10A流感病毒的培养滴度,甚至是普通Vero细胞外加TPCK-胰酶培养的病毒滴度的近3倍,而且,本发明修饰的Vero细胞VTY55在外加TPCK-胰酶的情况下培养的病毒滴度会进一步显著提高,甚至会达到普通Vero细胞外加TPCK-胰酶培养的病毒滴度的4倍左右。因此利用本发明修饰的Vero细胞系生产流感病毒不仅可以简化病毒培养工艺,还可以明显提高病毒产量。
附图说明
图1为单克隆细胞株VTY55的间接免疫荧光鉴定。
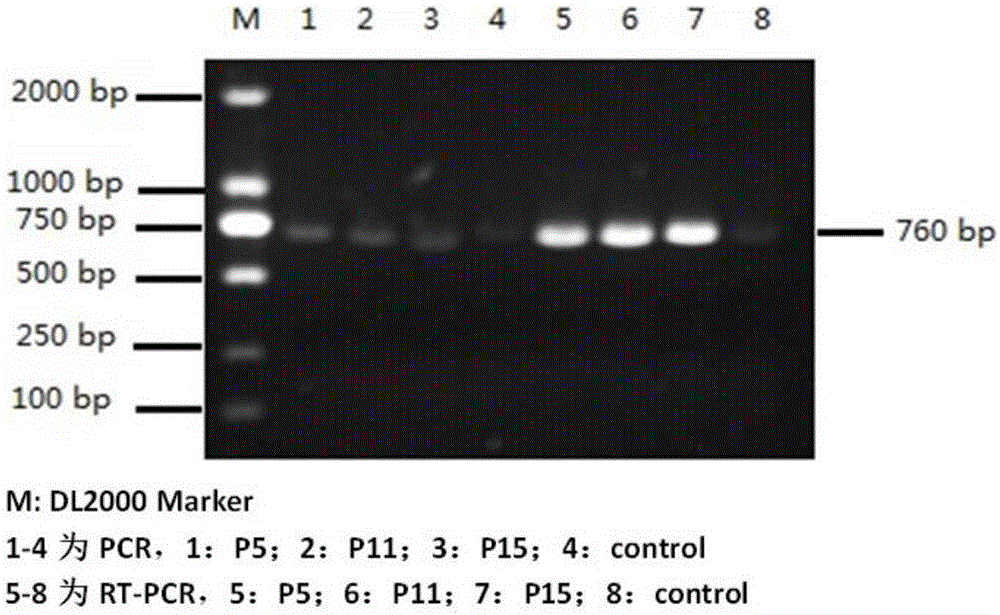
图2为单克隆细胞目的基因的PCR及RT-PCR鉴定。
图3为单克隆细胞目的基因表达的免疫印迹鉴定。
图4为流感病毒株在单克隆细胞的生长情况。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例中所使用到的试剂,除非利用说明,否则为市场上可购得的常规试剂。
本实施例的材料来源:
1、细胞:Vero由中国食品药品检定研究院细胞室保存惠赠。
2、病毒:人流感病毒株H1N1:A1/17/California/2009/38、H3N2:A3/Switzerland/9715293/2013-CDC-LA10A、B型:B/60/Phuket/2013/26由企业惠赠。
实施例1重组优化的牛胰酶基因真核表达载体的构建及鉴定
(1)载体构建:以GenBank提供的牛胰蛋白酶原cDNA序列(Genbank LOC780933,即SEQ ID No.1)为模板,设计特异引物,上游引物CCCGCCACCATGAAGACCTTCATCTTTC(SEQ ID No.2),下游引物CCGTTAGTTGGAGGACATGGTCTGC(SEQ ID No.3),扩增得到分泌型酶原表达序列,同时在上下游分别引入单一酶切位点,上游引物引入EcoR I(斜体下滑线所示)、下游引物引入Xho I(斜体下滑线所示),在上游引物起始密码子ATG的N端添加Kozak序列GCCACC提高表达效率。50μl PCR反应体系中扩增模板5μl、灭菌双蒸水32.8μl,10×PCR缓冲液5μl,dNTP Mix(10mmol/L)1μl,10μmol/L上游引物2μl,10μmol/L下游引物2μl,Taq DNA聚合酶(Invitrogen)0.2μl。PCR扩增条件:94℃预变性1min,94℃变性30s,55℃退火30s,72℃延伸1min,共30个循环,最后72℃保温10min。将扩增片段双酶切方式连接入pcDNA3.1载体中,经转化挑选单克隆菌落进行双酶切和测序鉴定,结果序列大小符合预期,各基因读码框正确。
(2)瞬时转染:对数生长期的Vero细胞,消化后吹打成单细胞悬液,调整浓度为1×105细胞/ml,接种6孔培养板,每孔2ml,放置37℃、4%CO2培养箱24h。按照LP2000转染试剂操作说明,以1:2.5的最优比例制备脂质体-DNA复合物;待细胞达90%汇合度时逐滴加入,37℃、4%CO2培养6h后换无血清SFM培养液,继续培养48h,收集分泌表达酶原的细胞上清液,加入2ml预冷的含0.5%TritonX-100的PBS裂解液,冰浴或4℃作用30min,反复吹打2-3次,5000rpm 4℃低速离心5min去除细胞碎片,吸取上清置于冰上。收集样品使用Millipore 3K超滤管4℃5000×g超滤浓缩20min,-70℃保存。(3)免疫印迹鉴定表达:收集样品进行SDS-PAGE电泳,转PVDF膜后使用PBS(pH7.4)溶解5%脱脂奶37℃低速摇床封闭膜1h,以兔抗牛胰蛋白酶多克隆抗体为一抗、羊抗兔IgG抗体为二抗进行免疫印迹鉴定,结果目的蛋白有特异性亮带,约为24kD。
(4)间接免疫荧光表达定位鉴定:制备Vero细胞爬片,培养达80%汇合时瞬时转染目的质粒;继续培养48h,37℃预热的1×PBS(pH7.4)清洗3次;加4%多聚甲醛室温固定30min;加0.1%TritonX-100,室温通透20min;2%BSA37℃封闭1h;兔抗牛胰蛋白酶多克隆抗体为一抗,37℃孵育1h;FITC标记的鼠抗兔IgG单克隆抗体,37℃避光孵育1h;0.5μg/ml的DAPI室温避光染核5min;避光条件下倒置荧光显微镜观察并拍照。结果:分泌型表达的酶原荧光信号明显,主要集中于DAPI荧光标记的细胞核周围,符合预期。
实施例2稳定表达分泌型胰酶原Vero单克隆细胞的筛选及鉴定
(1)筛选培养基中合适的G418浓度的选择:接种Vero细胞至24孔板中待汇合度70%时加入G418,使浓度依次为0μg/ml、200μg/ml、400μg/ml、600μg/ml、800μg/ml、900μg/ml、1000μg/ml、1100μg/ml,每浓度复孔,置于37℃、5%CO2培养箱中培养,每日观察记录细胞死亡情况,每隔3-4天换液,培养两周后绘制细胞生存曲线确定G418最小致死浓度,确定实验中Vero细胞压力筛选培养基中G418的浓为600μg/ml,维持液浓度为300μg/ml。
(2)G418加压筛选及有限稀释法筛选单克隆细胞:接种Vero细胞至6孔板,培养至细胞密度约为90%时转染目的质粒。24小时后消化细胞,1:10的比例传代至96孔板,每孔加600μg/ml G418的5%胎牛血清MEM培养液继续培养2周后(每3-5天换液),可见有抗性细胞生长。对照细胞在含有G418的培养液中培养至全部死亡时,选择实验组生长状态良好的抗性细胞集落,消化后继续用600μg/ml G418的压力筛选培养液稀释至0.5细胞/100μl于96孔板中。继续筛选2周再次按有限稀释法进行单细胞克隆筛选。筛选出的细胞胰酶消化后依次于96孔、24孔和6孔细胞培养板扩大培养并按常规方法冻存。结果选择了一株表达酶活性最高、细胞状态较好的55-5#细胞株,命名为Vero-S.pro-try(Y55),简称VTY55。
(3)VTY55细胞株的鉴定:将单克隆细胞连续传代,提取不同代次细胞基因组DNA进行分泌型牛胰酶原目的基因PCR鉴定,使用GAPDH基因作为内参;提取细胞RNA进行RT-PCR鉴定。收集各代细胞表达上清及细胞裂解液,分别进行免疫印迹、间接免疫荧光鉴定(方法同实施例1)。结果(图1、2、3):VTY55经鉴定证明分泌型胰酶原基因已成功整合至Vero基因组中,并能正确转录;在普通显微镜下观察VTY55与正常Vero细胞未见明显的形态差异,间接免疫荧光显示VTY55可见明显绿色荧光(参见图1),而对照组细胞呈阴性;Western Blot鉴定VTY55有清晰的特异条带,大小约为24kD(参见图3);单克隆细胞株连续传代至第15代,经PCR及RT-PCR鉴定证实各代细胞间目的基因遗传稳定(参见图2、图3)。
实施例3流感病毒在稳定表达牛胰酶原的Vero细胞上的增殖
单克隆细胞VTY55和正常Vero分别接种6孔细胞培养板至90%汇合度,吸去细胞培养液,使用无菌PBS清洗细胞3遍去除FBS,更换含1%双抗的无血清DMEM 37℃孵箱培养24h,待单克隆细胞酶原表达累积。24h后接种各亚型流感病毒,外加胰酶组同时添加终浓度为0.5μg/mlTPCK-胰酶(TPCK-Trypsin),混匀后置37℃4%CO2孵箱培养。分别于48h,72h,96h时反复冻融细胞2次使病毒释放,4℃5000rpm离心10min去除细胞碎片,收集上清病毒液,检测病毒NA活性。结果:单克隆工程细胞VTY55对流感病毒更加敏感,培养的各亚型病毒产量不仅始终高于普通Vero细胞,而且均明显高于普通Vero细胞外加TPCK-Trypsin,在外加TPCK-trypsin后产量更是得到极大提高。以A3型病毒株(A3/Switzerland/9715293/2013-CDC-LA10A)为例,接毒后72h,单克隆工程细胞VTY55在无外加TPCK-Trypsin(55-5#)情况下培养流感病毒的NA值比普通Vero细胞外加TPCK-Trypsin(Control(+))高近3倍;在外加TPCK-trypsin(55-5#(+))情况下VTY55细胞培养病毒产量显著提升,比普通Vero细胞外加TPCK-Trypsin(Control(+))产量高超过4倍;接毒后96h,单克隆工程细胞VTY55无外加TPCK-Trypsin(55-5#)情况下培养流感病毒的NA值高于普通Vero细胞外加TPCK-Trypsin(Control(+));另外在外加TPCK-trypsin(55-5#(+))情况下VTY55细胞培养病毒产量(NA活性值为950)显著提升,比普通Vero细胞外加TPCK-Trypsin(Control(+))(NA活性值为250)产量高4倍左右(图4),说明我们构建的VTY55细胞系因分泌表达胰蛋白酶原而比Vero细胞更适于流感病毒的增殖,在细胞流感培养及相关疫苗生产上更具有应用价值。同时也使其成为临床或实验研究中分离、培养流感病毒、监测病毒变异、抗病毒药物筛选、中和抗体的测定等的便捷工具,具有广泛应用前景。
序 列 表
<110> 中国食品药品检定研究院
<120> 稳定表达牛胰蛋白酶原的Vero细胞系及其用途
<160> 3
<170> Patent In version 3.3
<210> 1
<211> 741
<212> DNA
<213> 牛(Bos taurus)
<400> 1
atgaagacct tcatctttct ggctctcttg ggagccgctg ttgctttccc cgtggacgat 60
gatgacaaga tcgtgggcgg ctacacctgt ggggcaaata ctgtccccta ccaagtgtcc 120
ctgaactctg gctaccactt ctgcgggggc tccctcatca acagccagtg ggtggtgtct 180
gcggctcact gctacaagtc cggaatccaa gtgcgtctgg gagaagacaa cattaatgtc 240
gttgagggca atgagcaatt catcagcgca tccaagagta tcgtccatcc cagctacaac 300
tcaaacacct taaacaacga catcatgctg attaaactga aatcagctgc cagtctcaac 360
agccgagtag cctctatctc tctgccaaca tcctgtgcct ctgctggcac ccagtgtctc 420
atctctggct ggggcaacac caaaagcagt ggcaccagct accctgatgt cctgaagtgt 480
ctgaaggctc ccatcctatc agacagctct tgcaaaagtg cctacccagg ccagatcacc 540
agcaacatgt tctgtgcggg ctacctggag ggcggaaagg actcctgcca gggtgactcc 600
ggtggccctg tggtctgcag tggaaagctc cagggcattg tctcctgggg ctctggctgc 660
gctcagaaaa acaagcctgg tgtctacacc aaggtctgca actacgtgag ctggattaag 720
cagaccatcg cctccaacta a 741
<210> 2
<211> 34
<212> DNA
<213> 人工序列
<400> 2
cccgaattcg ccaccatgaa gaccttcatc tttc 34
<210> 3
<211> 31
<212> DNA
<213> 人工序列
<400> 3
ccgctcgagt tagttggagg acatggtctg c 31
- 还没有人留言评论。精彩留言会获得点赞!