一种壳聚糖‑海藻酸盐多孔凝胶及其制备和应用方法与流程
本发明属于高分子材料领域,具体来说,涉及一种壳聚糖-海藻酸盐多孔凝胶及其制备和应用方法。
背景技术:
水凝胶是在水中溶胀并保持大量的水分而又不溶解的聚合物。高分子水凝胶是由高分子骨架、水、交联剂组成的三维体系,具有复杂空间网状结构,有着广泛的应用。在医学领域:用作药物释放的载体,水凝胶兼备储存药物、控制释放速度、驱动释放三种功能,既能调节制剂的强度和硬度,又能起到促进分解、赋形的作用,还能遮蔽医药品的苦味和气味,可用于口服、鼻腔、口腔、直肠、眼部、注射等给药途径。用作伤口敷料,水凝胶材料直接用于与人体组织接触,可防止体外微生物的感染,抑制体液的损失,传输氧到伤口可加速上皮细胞生长,加速新微血管增生,隔绝细菌侵犯,抑制细菌繁殖,促进伤口的愈合。水凝胶因具有生物相容性、生物降解性、高含水量和细胞膜粘附性而应用于组织工程。
近年来,随着医学技术的进步,对于由外伤、意外或者癌症所带来的器官或组织的损伤的修复技术得到了极大的提高,然而,器官或组织的移植仍然是被病人广泛接受的治疗方法。由于自体移植会给患者带来二次伤害和痛苦,异体移植有很多诸如排异、器官来源受限等问题,运用组织工程(Tissue engineering)的方法来减少病痛和排异给治疗带来了很大的希望。组织工程的方法主要是用可降解的三维(3-D)人工材料的结构来诱导病人自体细胞的生长,达到器官或组织再生的目的。当新的器官和组织完成再生后,人工材料也随着时间降解完毕。
虽然对于不同的器官或组织需要不同形态特点的材料,但是这些3-D诱导材料却有一些共同的要求:(1)3-D材料要与被替代的组织具有相似性;(2)这些材料需要具备开孔的结构并且孔的尺寸要合适;(3)材料要有合适的机械性能使之可以维持预先设计的组织结构并且可以承受应用于原始组织的装载物;(4)材料需要时可降解的并且要具有合适的降解速率;(5)材料需要不会引起发炎症状或者可以减轻发炎症状。综上,具有可降解性、良好生物相容性和良好的机械性能的多孔水凝胶就是一种十分优良的组织工程3-D诱导材料。
技术实现要素:
技术问题:本发明所要解决的技术问题是:提供一种壳聚糖-海藻酸盐多孔凝胶及其制备和应用方法,该水凝胶具有多重网络的结构,具有良好的机械性能、溶胀性能和降解性能,使得其在组织工程支架中具有很好的应用。
技术方案:为解决上述技术问题,本发明采用的技术方案是:
第一方面,本发明实施例提供一种壳聚糖-海藻酸盐多孔凝胶,该多孔凝胶按照质量份数,包括以下组分:
壳聚糖:1~3份,
海藻酸盐:1~3份,
一价金属盐溶液:94~98份,
壳聚糖的天然交联剂、海藻酸盐的离子交联剂、发泡剂,以及表面活性剂;
一价金属盐溶液的质量浓度为0.01~0.5%;
所述壳聚糖的天然交联剂的质量是所述壳聚糖质量的0.5~5%;
所述海藻酸盐的离子交联剂为二价金属盐,所述二价金属盐质量是所述海藻酸盐质量的2~30%;
所述发泡剂的质量是多孔凝胶总质量的0.1~15%;
所述表面活性剂的质量是多孔凝胶总质量的0.1~15%。
结合第一方面,作为第一种可能实施方案,所述的壳聚糖的天然交联剂为京尼平。
结合第一方面,作为第二种可能实施方案,所述的二价金属盐为钙盐、锶盐或者钡盐,且金属盐具有可溶性或者微溶性。
结合第一方面,作为第三种可能实施方案,所述的发泡剂是碳酸盐或者酸式碳酸盐。
结合第一方面,作为第四种可能实施方案,所述的表面活性剂为阳离子型表面活性剂、阴离子型表面活性剂或者非离子表面活性剂。
结合第一方面,作为第五种可能实施方案,所述的一价金属盐溶液为氯化钠溶液或者氯化钾溶液。
结合第一方面,作为第六种可能实施方案,所述的多孔凝胶中形成三重网络,分别为壳聚糖和壳聚糖的天然交联剂形成的共价交联网络,海藻酸盐和海藻酸盐的离子交联剂之间形成的离子交联网络,以及壳聚糖上的-NH2和海藻酸钠上的-COOH之间的相互作用形成的第三重网路。
第二方面,本发明实施例提供一种壳聚糖-海藻酸盐多孔凝胶的制备方法,该制备方法包括以下步骤:
步骤10)将质量份数为1~3份的壳聚糖加入47~49份的一价金属盐的乙酸溶液中,搅拌均匀,使壳聚糖完全溶解,形成壳聚糖溶液;
将质量份数为1~3份的海藻酸盐加入47~49份的一价金属盐溶液中,搅拌均匀,使海藻酸盐完全溶解,形成海藻酸盐液溶;
步骤20)搅拌海藻酸盐溶液,向海藻酸盐溶液中加入壳聚糖的天然交联剂,表面活性剂,然后加入发泡剂、壳聚糖溶液,最后加入海藻酸钠的离子交联剂,搅拌1~15min,加冰袋冷却超声1~60min,随后用封口膜封装,形成均匀的发泡体系;
步骤30)将步骤20)形成的发泡体系于15~60℃水浴培养4~48h,得到壳聚糖-海藻酸钠多孔凝胶。
结合第二方面,作为第一种可能实施方案,所述一价金属盐溶液的质量浓度为0.01~0.5%;
所述壳聚糖的天然交联剂的质量是所述壳聚糖质量的0.5~5%;
所述海藻酸盐的离子交联剂为二价金属盐,所述二价金属盐质量是所述海藻酸盐质量的2~30%;
所述发泡剂的质量是多孔凝胶总质量的0.1~15%;
所述表面活性剂的质量是多孔凝胶总质量的0.1~15%。
第三方面,本发明实施例提供一种所述的壳聚糖-海藻酸盐多孔凝胶作为生物医用材料的应用。
有益效果:与现有技术相比,本发明所制备出的壳聚糖海藻酸钠的多孔凝胶,具有良好的机械性能。与单一的海藻酸盐的水凝胶或者单独的壳聚糖水凝胶相比,本发明所制备出的多孔凝胶在机械性能上有很大的提高。本发明制备的壳聚糖海藻酸钠多孔凝胶,具有强于壳聚糖水凝胶、海藻酸钠水凝胶的强度,同时又具有多孔结构,此外还具有良好的溶胀和降解性能。因此,本发明的多孔凝胶可以在组织工程支架方面将具有良好的应用。
附图说明
图1是本发明中所制备的多孔凝胶中形成的三重互穿网络的结构图示意图;
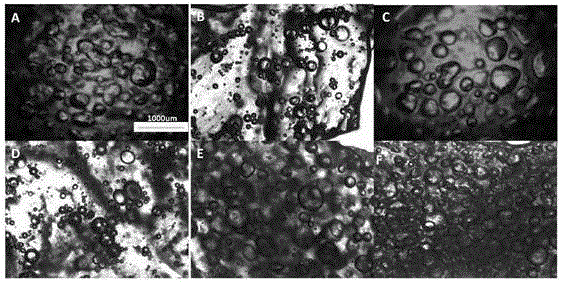
图2是本发明实施例1-6所制备的凝胶的多孔结构显微镜图;
图3是本发明实施例1-6所制备的凝胶进行机械性能测试的线条图;
图4是本发明实施例1以及对比例所制备的多孔凝胶在不同pH下的溶胀性能图;
图5是本发明实施例1以及对比例所制备的多孔凝胶在pH7.4下的降解性能图。
具体实施方式
下面结合具体的实施例对本发明作进一步的描述,以便本领域的技术人员进一步理解本发明,但以下实施例并不以任何形式限制本发明。
本发明实施例的壳聚糖-海藻酸盐多孔凝胶,按照质量份数,包括以下组分:
壳聚糖:1~3份,
海藻酸盐:1~3份,
一价金属盐溶液:94~98份,
壳聚糖的天然交联剂、海藻酸盐的离子交联剂、发泡剂,以及表面活性剂;
一价金属盐溶液的质量浓度为0.01~0.5%;
所述壳聚糖的天然交联剂的质量是所述壳聚糖质量的0.5~5%;
所述海藻酸盐的离子交联剂为二价金属盐,所述二价金属盐质量是所述海藻酸盐质量的2~30%;
所述发泡剂的质量是多孔凝胶总质量的0.1~15%;
所述表面活性剂的质量是多孔凝胶总质量的0.1~15%。
上述实施例中,作为优选,所述的壳聚糖的天然交联剂为京尼平(genipin)。所述的二价金属盐为钙盐、锶盐或者钡盐,且金属盐具有可溶性或者微溶性。可溶性的钙盐、锶盐、钡盐,通过离子交联海藻酸钠结构中的G段或MG段形成交联网络;微溶性的钙盐、锶盐、钡盐,由于已溶解出的部分离子与海藻酸钠发生交联,从而促进微溶性盐在水中的溶解和电离,最终使微溶性盐中的二价离子全部释放出来,参与海藻酸钠的交联过程。所述的发泡剂是碳酸盐或者酸式碳酸盐。所述的表面活性剂为阳离子型表面活性剂、阴离子型表面活性剂或者非离子表面活性剂。所述的一价金属盐溶液为氯化钠溶液或者氯化钾溶液。
上述壳聚糖-海藻酸盐多孔凝胶中形成三重网络,分别为壳聚糖和壳聚糖的天然交联剂形成的共价交联网络,海藻酸盐和海藻酸盐的离子交联剂之间形成的离子交联网络,以及壳聚糖上的-NH2和海藻酸钠上的-COOH之间的相互作用形成的第三重网路。
上述壳聚糖-海藻酸盐多孔凝胶的制备方法,该制备方法包括以下步骤:
步骤10)将质量份数为1~3份的壳聚糖加入47~49份的一价金属盐的乙酸溶液中,搅拌均匀,使壳聚糖完全溶解,形成壳聚糖溶液;将质量份数为1~3份的海藻酸盐加入47~49份的一价金属盐溶液中,搅拌均匀,使海藻酸盐完全溶解,形成海藻酸盐液溶。
步骤20)搅拌海藻酸盐溶液,向海藻酸盐溶液中加入壳聚糖的天然交联剂,表面活性剂,然后加入发泡剂、壳聚糖溶液,最后加入海藻酸钠的离子交联剂,搅拌1~15min,加冰袋冷却超声1~60min,随后用封口膜封装,形成均匀的发泡体系。
步骤30)将步骤20)形成的发泡体系于15~60℃水浴培养4~48h,得到壳聚糖-海藻酸钠多孔凝胶。
上述的壳聚糖-海藻酸盐多孔凝胶可作为生物医用材料。
如图1所示,以Ca2+作为离子交联剂、NaCl作为金属盐为例,按照上述制备方法制备的多孔凝胶内部形成了三重网络结构,包括壳聚糖和京尼平形成的共价交联网络,海藻酸钠和离子交联剂之间形成的离子交联网络以及壳聚糖上的-NH2和海藻酸钠上的-COOH之间的相互作用形成的第三重网络。
在制备过程中,壳聚糖的天然交联剂可以与壳聚糖发生化学交联,形成第一重交联网路,二价金属离子可以与海藻酸盐结构中的G段和MG段交联形成第二重交联网络。同时当将壳聚糖和海藻酸盐混合后,由于二者因静电相互作用在相界面形成聚电解质,而不能使二者形成均匀的交联网络。在该体系中,一价金属盐的加入,减弱了壳聚糖和海藻酸盐的相互作用,使得通过搅拌海藻酸盐和壳聚糖被混合均匀,同时海藻酸盐和壳聚糖之间仍存在离子的相互作用,形成第三重的交联网络。因为三重网络的形成,使得多孔凝胶能够具有优良的多孔结构、溶胀性能和降解性能的同时,也能具有良好的机械性能。
下面通过试验,来具体验证本发明凝胶具有良好的多孔结构、溶胀性能、降解性能以及机械性能。
试验提供六个实施例和三个对比例。六个实施例都是按照本发明的制备方法制备凝胶(CA porous)。各实施例中各物质的用量,单位:mg,如表1所示;各物质采用的具体种类如表2所示。三个对比例分别为对比例1:壳聚糖凝胶(chitosan);对比例2:海藻酸钠凝胶(alginate);对比例3:壳聚糖海藻酸钠复合凝胶(CA)。
表1
表2
对上述6个实施例的多孔凝胶进行显微镜拍摄,如图2所示。在图2中,图A对应实施例1的显微镜图,图B对应实施例2的显微镜图,图C对应实施例3的显微镜图,图D对应实施例4的显微镜图,图E对应实施例5的显微镜图,图F对应实施例6的显微镜图。从图2可以看出:随发泡剂和表面活性剂量的增加,壳聚糖-海藻酸钠多孔水凝胶中的气泡和孔不断的增加。实施例6中,水凝胶体系中的孔最多,孔大小也最均匀。
对上述实施例和对比例,分别进行机械性能、溶胀性能和降解性能测试。
其中,机械性能测试用旋转流变仪,30mm的夹具,在25℃,1Hz的频率下,在0.1rad s-1-110rad s-1下分别测试了所制备的chitosan-genipin的水凝胶、海藻酸钠-Ca2+的水凝胶、chitosan-海藻酸钠复合水凝胶和不同发泡剂用量的多孔凝胶的机械性能。用储存模量(G’)和损耗模量(G”)来表示。结果如图3所示。从图3中的储存模量(G’)曲线中可以明显的看出,实施例1的机械性能最优。
溶胀性能测试按照如下方法进行:将溶胀平衡的所制备水凝胶用刀片切成样品块,每种水凝胶切出12份,冷冻干燥,称重后,分别放入pH1.2的HCl溶液、pH5.6的乙酸-乙酸钠的缓冲溶液、pH7.4的磷酸盐缓冲溶液和pH9.3的硼酸盐缓冲溶液中,每种溶液中放3个平行样。溶胀24h后,用滤纸吸去表面的水分,称重获得水凝胶溶胀后的湿重,每隔2h再称重,直至质量不再增加为止,获得水凝胶的干重。通过式(1)计算水凝胶在不同pH条件下的溶胀性能。
其中:Swellingratio表示水凝胶的溶胀性能;wd表示水凝胶的干重;ws表示水凝胶溶胀后的湿重;
通过式(1)计算每种溶液中的3个平行样的平均溶胀性能作为该水凝胶在该溶液中的溶胀性能。
图4示出了壳聚糖凝胶(chitosan)、海藻酸钠凝胶(algiante)、壳聚糖海藻酸钠复合凝胶(CA)以及本发明实施例1所制备出的多孔凝胶(CA porous)在不同pH值下的溶胀性能。从图4可以看出,本发明实施例提供的多孔凝胶的在不同pH环境下,具有良好的溶胀性能。
降解性能测试按照如下方法进行:将溶胀平衡的水凝胶切出的样品块,每种水凝胶取3份,分别放入到每个孔盛有5mL的1.5ug/mL的溶菌酶溶液的12孔细胞培养板中,每天更换新的溶菌酶溶液,确保酶的活性。定时取出水凝胶样品,用滤纸吸取表面的水分后,称量重量,体外降解率用凝胶失重率(Weightloss%)来表示,如式(2)所示。
其中:w0表示水凝胶的原始质量,wt表示降解时间为t后,水凝胶的质量。
图5提供了壳聚糖凝胶(chitosan)、海藻酸钠凝胶(algiante)、壳聚糖海藻酸钠复合凝胶(CA)以及本发明实施例1所制备出的多孔凝胶(CA porous)在pH7.4的PBS缓冲溶液中的降解性能示意图。从图5可以看出,本发明实施例制备的多孔凝胶既能在前期保持一定的稳定性,又在后期表现出较高的降解性能。
本领域的技术人员应该了解,本发明不受上述具体实施例的限制,上述具体实施例和说明书中的描述只是为了进一步说明本发明的原理及其效果,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护的范围由权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!