骨髓间充质干细胞分化诱导液及诱导为脂肪细胞的方法与流程
本发明属于细胞工程技术领域,更具体的说,涉及到一种骨髓间充质干细胞分化诱导液及将骨髓间充质干细胞诱导为脂肪细胞的方法。
背景技术:
中胚层的成体干细胞是间充质干细胞(mesenchymal stem cells,MSCs)主要的来源场所,骨髓间充质干细胞(hMSCs)作为造血微环境的一种重要组成成分,在体外不同的条件下进行诱导,能够向成骨细胞、软骨细胞、脂肪细胞、神经细胞、肝细胞、成纤维细胞、肌腱细胞等多个方向的组织细胞进行分化。研究发现,骨质疏松症患者骨髓中骨量与脂肪含量成反比例关系,骨量流失,脂肪成分却增多,推测骨质疏松症可能是由于骨髓干细胞失衡的诱导分化出过多的脂肪细胞所致,因此抑制骨髓间充质干细胞过多的向脂肪细胞分化,有可能可以有效的预防并减少骨质疏松症的出现。了解脂肪细胞的增值分化规律和条件是探讨抑制机制及对骨质疏松发病机制的重要基础。
肾上腺皮质激素是一种可以双向调节骨髓基质细胞的分化的一类甾体激素,主要为皮质醇,具有调节糖、脂肪和蛋白质生物合成及代谢的作用。Pereira研究表明,当激素与受体结合,能够激活一种促进脂肪转录的因子(C/EBPS),特异性的与过氧化氢酶增殖体激活受体启动区达到很好的链接,激活基因PPARγ基因的表达,从而有效的诱导骨髓基质干细胞分化为脂肪细胞。此外,还有一种能够促进骨髓间充质干细胞诱导分化为脂肪细胞的药物,即为地塞米松,也是一种肾上腺皮质类激素,能有效降低脂肪细胞分化抑制因子的表达,促进脂肪细胞的分化。在激素与受体结合过程中,低浓度下促进诱导分化为成骨细胞,刘杰等人在研究中发现,以107mol/L浓度为界限,地塞米松浓度小于该值骨髓间充质干细胞分化为成骨细胞,高于该浓度诱导分化为脂肪细胞。而王华松研究还发现,浓度越大脂肪细胞数量增多,成正相关,表明其对地塞米松的浓度具有一定的依赖性。3-异丁基-1-甲基黄嘌呤(IBMX)是磷酸二脂酶的特异性抑制剂,通过抑制剂cAMP的降解而提高胞内cAMP的水平,cAMP是一种非常重要的脂肪诱导剂,通过激活cAMP反应元件结合蛋白(CREB)来调控C/EBPα和C/EBPβ的表达,从而促进脂肪细胞的产生。胰岛素与胰岛素样生长因子1受体结合,通过激素Akt、Ras和ERK1/ERK2等信号来传导途径以及降低核蛋白磷酸酶的活性来激活调节CREB的磷酸化和转录活性,CREB的激活不仅可以促进C/EBP的表达,也能够增加过氧化氢酶增殖体激活受体的表达。此外,还有使用牛血清、马血清作为诱导剂,但诱导时间长达3-4周,此间带来的众多不确定性和潜在的风险。
技术实现要素:
本发明所要解决的技术问题在于:提供一种骨髓间充质干细胞分化诱导液及诱导为脂肪细胞的方法,解决现有技术中尚不存在成品的分化诱导液,可以将骨髓间充质干细胞分化诱导为脂肪细胞的问题。
本发明解决上述问题的技术方案为:提供一种骨髓间充质干细胞分化诱导液,包括如下质量分数的组分:
本发明提供的骨髓间充质干细胞分化诱导液,用于骨髓间充质干细胞诱导分化为脂肪细胞。
本发明提供的骨髓间充质干细胞分化诱导液,使用所述分化诱导液定向诱导骨髓间充质干细胞分化时,骨髓间充质干细胞的融合度高。
本发明提供的骨髓间充质干细胞分化诱导液,抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞;胰蛋白酶对贴壁细胞进行消化,消化时间为5~10min,将消化得到的骨髓间充质干细胞传代培养,传代培养第3代后获得融合度高的骨髓间充质干细胞。
本发明提供的骨髓间充质干细胞分化诱导液,使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
本发明还提供一种骨髓间充质干细胞诱导为脂肪细胞的方法,包括如下步骤:
S100、骨髓间充质干细胞培养:抽取骨髓采用直接贴壁法进行培养,获得融合度高的骨髓间充质干细胞;
S200、诱导培养:向所述融合度高的骨髓间充质干细胞中加入分化诱导液进行诱导培养,诱导培养48~96h之后加入含有胰岛素的培养基进行维持18~36h,然后加入分化诱导液继续进行诱导培养36~60h;所述分化诱导液包括如下质量分数的组分:
在本发明提供的骨髓间充质干细胞诱导为脂肪细胞的方法中,所述步骤S100包括如下步骤:
S101、抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞;
S102、胰蛋白酶对贴壁细胞进行消化,消化时间为5~10min,将消化得到的骨髓间充质干细胞传代培养;
S103、传代培养第3代后获得融合度高的骨髓间充质干细胞。
在本发明提供的骨髓间充质干细胞诱导为脂肪细胞的方法中,所述步骤S102中,采用DMEM/F12间充质干细胞培养液进行直接贴壁法培养,在37℃、5%的CO2培养箱进行培养,24h后进行换液,弃去未贴壁的细胞,以后每2~3天换液一次,期间注意观察细胞的形态和生长状况。
在本发明提供的骨髓间充质干细胞诱导为脂肪细胞的方法中,所述步骤S102中,使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
在本发明提供的骨髓间充质干细胞诱导为脂肪细胞的方法中,所述步骤S200包括如下步骤:
S201、向所述融合度高的骨髓间充质干细胞中加入所述分化诱导液进行诱导培养48~96h;
S202、移除培养瓶中的分化诱导液,并使用含有胰岛素的培养基冲洗3~5次,加入含有胰岛素的培养基进行维持18~36h,所述含有胰岛素的培养基中胰岛素的浓度为10mg/mL,培养基种类为含10%胎牛血清和10U/mL青霉素的DMEM培养基;
S203、移除培养瓶中的培养基,并使用所述分化诱导液冲洗3~5次,加入所述分化诱导液继续进行诱导培养36~60h。
实施本发明,具有如下有益效果:使用本发明骨髓间充质干细胞分化诱导液诱导分化骨髓间充质干细胞,48小时后可见少数细胞质内有折射性较强的脂粒出现,而随着培养时间延长,小脂粒聚集逐渐变大,并形成脂肪滴,脂肪细胞的数量逐渐增多,油红O染剂处理的骨髓间充质干细胞中有大小不等的圆形红色脂肪滴。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明骨髓间充质干细胞诱导为脂肪细胞的方法较佳实施例的流程图;
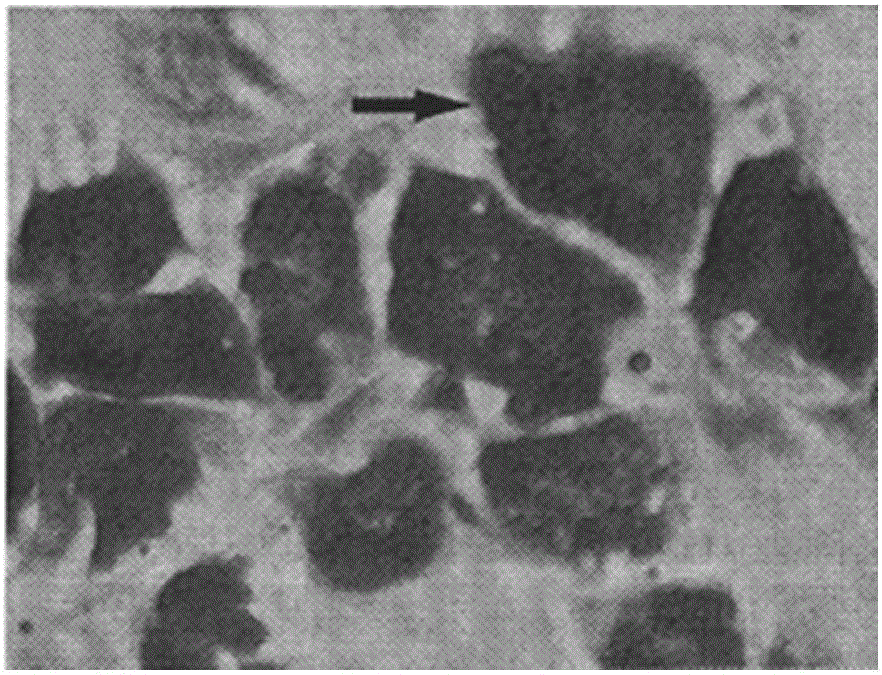
图2为本发明实验组骨髓间充质干细胞诱导后油红O染剂处理下细胞形态图;
图3为本发明阴性对照组骨髓间充质干细胞诱导后油红O染剂处理下细胞形态图。
具体实施方式
下面将结合附图对本发明的实施例进行具体描述。
为了解决骨髓间充质干细胞诱导分化为脂肪细胞的问题,本发明提供了一种骨髓间充质干细胞分化诱导液,包括如下质量分数的组分:
本发明的骨髓间充质干细胞分化诱导液,为了降低胎牛血清在诱导液中的潜在风险性,并不引入胎牛血清,而是药物诱导,3-异丁基-1-甲基黄嘌呤(IBMX)溶液是磷酸二酯酶的特异性抑制剂,通过抑制cAMP的降解而提高细胞内的cAMP水平,进而激活cAMP反应元件结合蛋白来调控C/EBPα和C/EBPβ表达从而促进脂肪细胞的产生。地塞米松溶液可以诱导骨髓间充质干细胞向脂肪细胞方向转化。胰岛素通过调节ERK1/ERK2信号传导途径及降解核蛋白磷酸酶PP2A的活性来调节CREB的磷酸化和转录活性。采用吲哚美辛对骨髓间充质干细胞进行诱导,在浓度选择上,其诱导浓度范围较宽。
使用本发明的骨髓间充质干细胞分化诱导液对骨髓间充质干细胞进行诱导分化时,需要骨髓间充质干细胞的融合度高,例如,可以通过如下方式获得融合度高的骨髓间充质干细胞:抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞;胰蛋白酶对贴壁细胞进行消化,消化时间为5~10min,将消化得到的骨髓间充质干细胞传代培养,传代培养第3代后获得融合度高的骨髓间充质干细胞。使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
对骨髓间充质干细胞进行分化,分化为何种细胞,要对其进行鉴定,细胞鉴定液为油红O染剂,它是一种特异性的脂质结合剂,通过检测脂肪沉积来检测脂肪细胞。
图1为本发明骨髓间充质干细胞诱导为脂肪细胞的方法较佳实施例的流程图,如图1所示,该诱导方法包括如下:
S100、骨髓间充质干细胞培养:抽取骨髓采用直接贴壁法进行培养,获得融合度高的骨髓间充质干细胞;获取并扩增获得的融合度高的骨髓间充质干细胞,在显微镜下观察可见呈梭形;
S200、诱导培养:向所述融合度高的骨髓间充质干细胞中加入分化诱导液进行诱导培养,诱导培养48~96h之后加入含有胰岛素的培养基进行维持18~36h,然后加入分化诱导液继续进行诱导培养36~60h;使用的分化诱导液如前所述。
间充质干细胞诱导完成后,弃去上述脂肪细胞诱导培养液,用固定液多聚甲醛进行固定30~40min,接下来对细胞进行吹打冲洗,冲洗剂选择PBS,加入染色剂油红O染剂孵育15min,进行冲洗,观察分化后的细胞显微镜结构如下:在漩涡状排列的细胞集落中央,可观察到散在充满脂滴的脂肪细胞形成,细胞形态呈短梭形或圆形,实验组骨髓间充质干细胞诱导分化后油红O染剂处理显示细胞内具有红色脂滴(图2所示),而阴性对照组髓间充质干细胞诱导分化后油红O染剂处理显示细胞没有红色脂滴(图3所示)。
实施例1
1)、抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞。
2)、胰蛋白酶对贴壁细胞进行消化,消化时间为5min,将消化得到的骨髓间充质干细胞传代培养;采用DMEM/F12间充质干细胞培养液进行直接贴壁法培养,在37℃、5%的CO2培养箱进行培养,24h后进行换液,弃去未贴壁的细胞,以后每3天换液一次,期间注意观察细胞的形态和生长状况。使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
3)、传代培养第3代后获得融合度高的骨髓间充质干细胞。
4)、向融合度高的骨髓间充质干细胞中加入分化诱导液进行诱导培养48h;分化诱导液包括0.2mmol/L的吲哚美辛、0.5mmol/L的3-异丁基-1-甲基黄嘌呤、10-4mol/L的地塞米松、20mg/L的胰岛素。培养过程中定期观察细胞形态及生长情况。细胞加入诱导液前的的融合度需要很高。
5)、移除培养瓶中的分化诱导液,并使用含有胰岛素的培养基冲洗3次,加入含有胰岛素的培养基进行维持24h,含有胰岛素的培养基中胰岛素的浓度为10mg/mL,培养基种类为含10%胎牛血清和10U/mL青霉素的DMEM培养基。
6)、移除培养瓶中的培养基,并使用分化诱导液冲洗4次,加入分化诱导液继续进行诱导培养48h。培养过程中定期观察细胞形态及生长情况。
细胞鉴定方法:弃去上述脂肪细胞诱导培养液,用固定液多聚甲醛进行固定30~40min,接下来对细胞进行吹打冲洗,冲洗剂选择PBS,加入染色剂油红O染剂孵育15min,进行冲洗,观察分化后的细胞显微镜结构。
观察结果:骨髓间充质干细胞诱导分化48小时后可见少数细胞质内有折射性较强的脂粒出现,而随着培养时间延长,小脂粒聚集逐渐变大,并形成脂肪滴,脂肪细胞的数量逐渐增多,油红O染剂处理的骨髓间充质干细胞中有大小不等的圆形红色脂肪滴。
实施例2
1)、抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞。
2)、胰蛋白酶对贴壁细胞进行消化,消化时间为10min,将消化得到的骨髓间充质干细胞传代培养;采用DMEM/F12间充质干细胞培养液进行直接贴壁法培养,在37℃、5%的CO2培养箱进行培养,24h后进行换液,弃去未贴壁的细胞,以后每2天换液一次,期间注意观察细胞的形态和生长状况。使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
3)、传代培养第3代后获得融合度高的骨髓间充质干细胞。
4)、向融合度高的骨髓间充质干细胞中加入分化诱导液进行诱导培养96h;分化诱导液包括0.05mmol/L的吲哚美辛、0.1mmol/L的3-异丁基-1-甲基黄嘌呤、10-6mol/L的地塞米松、5mg/L的胰岛素。培养过程中定期观察细胞形态及生长情况。细胞加入诱导液前的的融合度需要很高。
5)、移除培养瓶中的分化诱导液,并使用含有胰岛素的培养基冲洗4次,加入含有胰岛素的培养基进行维持24h,含有胰岛素的培养基中胰岛素的浓度为10mg/mL,培养基种类为含10%胎牛血清和10U/mL青霉素的DMEM培养基。
6)、移除培养瓶中的培养基,并使用分化诱导液冲洗4次,加入分化诱导液继续进行诱导培养48h。培养过程中定期观察细胞形态及生长情况。
细胞鉴定方法:弃去上述脂肪细胞诱导培养液,用固定液多聚甲醛进行固定30~40min,接下来对细胞进行吹打冲洗,冲洗剂选择PBS,加入染色剂油红O染剂孵育15min,进行冲洗,观察分化后的细胞显微镜结构。
观察结果:骨髓间充质干细胞诱导分化48小时后可见少数细胞质内有折射性较强的脂粒出现,而随着培养时间延长,小脂粒聚集逐渐变大,并形成脂肪滴,脂肪细胞的数量逐渐增多,油红O染剂处理的骨髓间充质干细胞中有大小不等的圆形红色脂肪滴。
实施例3
1)、抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞。
2)、胰蛋白酶对贴壁细胞进行消化,消化时间为7min,将消化得到的骨髓间充质干细胞传代培养;采用DMEM/F12间充质干细胞培养液进行直接贴壁法培养,在37℃、5%的CO2培养箱进行培养,24h后进行换液,弃去未贴壁的细胞,以后每3天换液一次,期间注意观察细胞的形态和生长状况。使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
3)、传代培养第3代后获得融合度高的骨髓间充质干细胞。
4)、向融合度高的骨髓间充质干细胞中加入分化诱导液进行诱导培养72h;分化诱导液包括0.1mmol/L的吲哚美辛、0.2mmol/L的3-异丁基-1-甲基黄嘌呤、10-5mol/L的地塞米松、10mg/L的胰岛素。培养过程中定期观察细胞形态及生长情况。细胞加入诱导液前的的融合度需要很高。
5)、移除培养瓶中的分化诱导液,并使用含有胰岛素的培养基冲洗5次,加入含有胰岛素的培养基进行维持18h,含有胰岛素的培养基中胰岛素的浓度为10mg/mL,培养基种类为含10%胎牛血清和10U/mL青霉素的DMEM培养基。
6)、移除培养瓶中的培养基,并使用分化诱导液冲洗5次,加入分化诱导液继续进行诱导培养60h。培养过程中定期观察细胞形态及生长情况。
细胞鉴定方法:弃去上述脂肪细胞诱导培养液,用固定液多聚甲醛进行固定30~40min,接下来对细胞进行吹打冲洗,冲洗剂选择PBS,加入染色剂油红O染剂孵育15min,进行冲洗,观察分化后的细胞显微镜结构。
观察结果:骨髓间充质干细胞诱导分化48小时后可见少数细胞质内有折射性较强的脂粒出现,而随着培养时间延长,小脂粒聚集逐渐变大,并形成脂肪滴,脂肪细胞的数量逐渐增多,油红O染剂处理的骨髓间充质干细胞中有大小不等的圆形红色脂肪滴。
实施例4
1)、抽取骨髓采用直接贴壁法进行培养,培养过程中弃去未贴壁的细胞。
2)、胰蛋白酶对贴壁细胞进行消化,消化时间为8min,将消化得到的骨髓间充质干细胞传代培养;采用DMEM/F12间充质干细胞培养液进行直接贴壁法培养,在37℃、5%的CO2培养箱进行培养,24h后进行换液,弃去未贴壁的细胞,以后每2天换液一次,期间注意观察细胞的形态和生长状况。使用胰蛋白酶对贴壁细胞进行消化时,待细胞开始变圆,用培养基结束消化。
3)、传代培养第3代后获得融合度高的骨髓间充质干细胞。
4)、向融合度高的骨髓间充质干细胞中加入分化诱导液进行诱导培养84h;分化诱导液包括0.15mmol/L的吲哚美辛、0.3mmol/L的3-异丁基-1-甲基黄嘌呤、10-5mol/L的地塞米松、15mg/L的胰岛素。培养过程中定期观察细胞形态及生长情况。细胞加入诱导液前的的融合度需要很高。
5)、移除培养瓶中的分化诱导液,并使用含有胰岛素的培养基冲洗3次,加入含有胰岛素的培养基进行维持36h,含有胰岛素的培养基中胰岛素的浓度为10mg/mL,培养基种类为含10%胎牛血清和10U/mL青霉素的DMEM培养基。
6)、移除培养瓶中的培养基,并使用分化诱导液冲洗3次,加入分化诱导液继续进行诱导培养36h。培养过程中定期观察细胞形态及生长情况。
细胞鉴定方法:弃去上述脂肪细胞诱导培养液,用固定液多聚甲醛进行固定30~40min,接下来对细胞进行吹打冲洗,冲洗剂选择PBS,加入染色剂油红O染剂孵育15min,进行冲洗,观察分化后的细胞显微镜结构。
观察结果:骨髓间充质干细胞诱导分化48小时后可见少数细胞质内有折射性较强的脂粒出现,而随着培养时间延长,小脂粒聚集逐渐变大,并形成脂肪滴,脂肪细胞的数量逐渐增多,油红O染剂处理的骨髓间充质干细胞中有大小不等的圆形红色脂肪滴。
上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
- 还没有人留言评论。精彩留言会获得点赞!