一种发酵生产1,3‑丙二醇的微生物混合菌群及发酵方法与流程
本发明属于生物工程技术领域,特别涉及一种以粗甘油为底物经厌氧微生物菌群发酵生产1,3-丙二醇的方法。
背景技术:
1,3-丙二醇是一种重要的化工平台化合物,广泛应用于医药、食品及化妆品等多个行业,同时也是合成聚对苯二甲酸丙二酯(PTT)及聚呋喃二甲酸丙二酯(PTF)的单体。PTT作为新型的聚酯纤维,具有优良的柔软性、回弹性及染色性,在纺织行业具有良好的发展前景。PTF是一种100%可再生的新型聚酯,是代替塑料制品的理想原料,在包装行业具有巨大的应用潜力。因此,1,3-丙二醇具有巨大的市场需求空间。
1,3-丙二醇的主要生产方式有化学法和生物法。化学法包括丙烯醛水合加氢法和环氧乙烷羰基化法,以丙烯或乙烯为起始原料,经多步高温高压催化反应合成1,3-丙二醇;生物法则利用某些天然细菌或基因工程菌株,以甘油或葡萄糖为底物常温发酵生产1,3-丙二醇。相比于化学法,微生物发酵生产1,3-丙二醇具有原料可再生、生产过程绿色环保以及操作简易安全等优势,但由于生产成本较高和研发时间较短等因素,致使发酵法的大规模工业化应用相对迟缓。生物柴油生产过程中副产的廉价粗甘油是降低1,3-丙二醇生产成本的理想原料,而粗甘油中含有的复杂成分(甲醇、盐、游离脂肪酸等)对菌体生长代谢有一定抑制作用,这就需要开发新的技术和方法解决此问题。
自然界中能将甘油转化为1,3-丙二醇的高效菌株主要分为两大类:一类是以肺炎克雷伯氏杆菌(Klesiella penumoniae)为代表的兼性厌氧菌,另一类是以丁酸梭菌(Clostridium butyricum)为代表的严格厌氧菌。其中,肺炎克雷伯氏杆菌与丁酸梭菌以其较高的甘油耐受力和1,3-丙二醇生产能力而受到人们的关注,已有大量研发和应用报道。肺炎克雷伯氏杆菌为兼性厌氧菌,生长迅速,生产强度高,且易于基因改造,但其条件致病菌属性限制了工业化应用。此外,该菌的代谢产物除了1,3-丙二醇外,还有2,3-丁二醇、乙酸、乳酸、琥珀酸等副产物,其中2,3-丁二醇的沸点与目标产物相近,导致后续产物分离困难。丁酸梭菌是严格厌氧菌,属于益生的安全菌,并且其代谢副产物主要为乙酸及丁酸,无2,3-丁二醇。相比于肺炎克雷伯氏杆菌,丁酸梭菌发酵生产1,3-丙二醇最大局限是该菌株生长相对缓慢,导致产物生产强度低。以纯甘油为底物时,典型的丁酸梭菌DSM 5431在间歇发酵中可耐受底物浓度为110g/L,生产56g/L 1,3-丙二醇,生产强度为1.93g/(L·h)(Appl Microbiol Biotechnol,1992,36:592-597)。以粗甘油为底物时,丁酸梭菌VPI 1718在间歇发酵中可耐受底物浓度为80.1g/L,生产41.9g/L 1,3-丙二醇,发酵时间为52h,生产强度为0.81g/(L·h);在批式流加发酵中,该菌株可生产67.9g/L 1,3-丙二醇,生产强度仅为0.78g/(L·h)(Appl Microbiol Biotechnol,2011,91:101-112)。CN 102965323B公开了一种用丁酸梭菌转化粗甘油生产1,3-丙二醇的方法,1,3-丙二醇最终浓度为78.5g/L,生产强度仅为1.49g/(L·h),因此开发一种生物安全性高、生产强度高、成本较低的1,3-丙二醇发酵方法对其工业化生产具有重要的现实意义。
近年来,微生物菌群发酵逐渐引起国内外学者的关注。例如CN 104774879公开了一种微生物混菌发酵生产1,3-丙二醇的方法,混菌可耐受初始甘油浓度高达200g/L(单菌只能耐受100g/L),1,3-丙二醇产量达到81.40g/L,副产物不含2,3-丁二醇,但该发明是以肺炎克雷伯氏杆菌为主的混菌,且用纯甘油作底物,工业应用具有较大局限。也有学者利用从沼气池污泥中筛选得到的混菌发酵粗甘油生产1,3-丙二醇(Bioprocess Biosyst Eng,2014,37:225-233),1,3-丙二醇最终浓度可达70g/L,同时生产强度为2.60g/(L·h),明显高于单菌发酵。但当底物粗甘油浓度达到70g/L时菌体生长代谢会受到明显抑制,同时菌种组成未知,生物安全性有待考证。因此开发一种菌种稳定性强、生物安全性好、耐受粗甘油能力强、1,3-丙二醇生产强度高的微生物混合菌群,高效转化粗甘油生产1,3-丙二醇成为一条工业化发展的新思路。
技术实现要素:
鉴于上述的现有技术中存在的问题,本发明的目的在于提供一种生物安全性高的可高效转化粗甘油为1,3-丙二醇的微生物菌群以及利用该微生物菌群制备1,3-丙二醇的方法。本发明的微生物菌群以丁酸梭菌为主的混菌,其稳定性高,在厌氧条件下高效转化粗甘油为1,3-丙二醇,克服丁酸梭菌纯菌发酵粗甘油耐受性低、生产强度低等局限。
本发明的技术方案如下:
一种用于以甘油为底物发酵制备1,3-丙二醇的微生物混合菌群,所述的微生物混合菌群以丁酸梭菌为优势菌,所述丁酸梭菌的有效活菌数占微生物混合菌群中有效活菌数的95%以上。
进一步地,所述的微生物混合菌群还含有与丁酸梭菌共生的混合共生菌,所述混合共生菌的有效活菌数占所述的微生物混合菌群中有效活菌数的5%以下,所述混合共生菌由梭菌属菌株和乳杆菌属菌株组成,二者的有效活菌数比例为1.50~4.99:0.01~0.05,所述梭菌属菌株不包括丁酸梭菌。
进一步地,所述梭菌属菌株为双酶梭菌和拜氏梭菌中的一种或两种;所述乳杆菌属菌株为乳杆菌Lactobacillus farraginis与乳杆菌Lactobacillus equicursoris中的一种或两种。
进一步地,在上述技术方案中,所述的甘油为粗甘油,更优选地,所述的粗甘油为甘油含量为75~95%的生物柴油副产物或油脂水解产物。
本发明还提供一种1,3-丙二醇的发酵方法,该方法包括将上述的微生物混合菌接入至以甘油为底物的发酵培养基中进行发酵的步骤。
进一步地,在上述的技术方案中,将所述的微生物混合菌接入以甘油为底物的发酵培养基中进行发酵。所述发酵过程可以采用间歇发酵,也可以采用批式流加发酵:采用间歇发酵方式发酵时发酵起始甘油浓度为40~120g/L,优选为100g/L;采用批式流加发酵方式发酵时可以采取两种底物流加策略:连续补料与间歇补料。两种流加策略的发酵起始甘油浓度为40~120g/L,优选80g/L,在连续补料的批式流加发酵过程中甘油浓度维持在10~35g/L,优选维持在10~25g/L,在间歇补料的批式流加发酵过程中,当甘油浓度低于20g/L时,间歇补料至甘油浓度为40~120g/L,优选80g/L。
进一步地,在上述的技术方案中,所述的甘油为纯甘油或粗甘油,所述的粗甘油为甘油含量为75~95%的生物柴油副产物或油脂水解产物。
进一步地,在上述的技术方案中,所述的发酵培养基以g/L为剂量单位含有如下组分:粗甘油40~120,KH2PO4 1.36,(NH4)2SO4 6.61,MgCl2·6H2O 0.26,CaCl2 0.29,柠檬酸0.42,酵母粉2.0,每升发酵培养基中另加入5mL微量元素B溶液,其中微量元素B溶液的组成为:ZnCl2 0.68g/L,MnCl2·4H2O 0.17g/L,H3BO3 60mg/L,CuCl2·2H2O 0.47g/L,Na2MoO4·2H2O 5mg/L,FeCl2·4H2O 3.97g/L,CoCl2·6H2O 0.47g/L,饱和盐酸10mL/L。
本发明所述的微生物混合菌可利用粗甘油发酵生产1,3-丙二醇。该混合菌可在初始甘油浓度40~120g/L条件下发酵生产1,3-丙二醇,最终1,3-丙二醇浓度在20~90g/L,副产物为丁酸和乙酸,生产强度在1.5~4.0g/(L·h)。
本发明相对于现有技术具有以下有益效果:
(1)本发明公开了一种用于甘油发酵制备1,3-丙二醇的微生物混合菌,该混合菌以丁酸梭菌为绝对优势菌,并含有少量梭菌属(非丁酸梭菌)与乳杆菌属菌株,菌群稳定性好,生物安全性高。与传统的丁酸梭菌纯种发酵相比,对复杂底物耐受性强,生产强度高。
(2)本发明微生物混合菌利用廉价非粮原料粗甘油为底物发酵制备1,3-丙二醇,降低生产成本。
(3)利用本发明的微生物混合菌进行发酵,底物流加可采取间歇补料的策略,补料过程操作简便,降低1,3-丙二醇生产人工成本。
(4)利用本发明的微生物混合菌进行发酵,发酵培养基无需灭菌,进一步降低1,3-丙二醇生产成本。
附图说明:
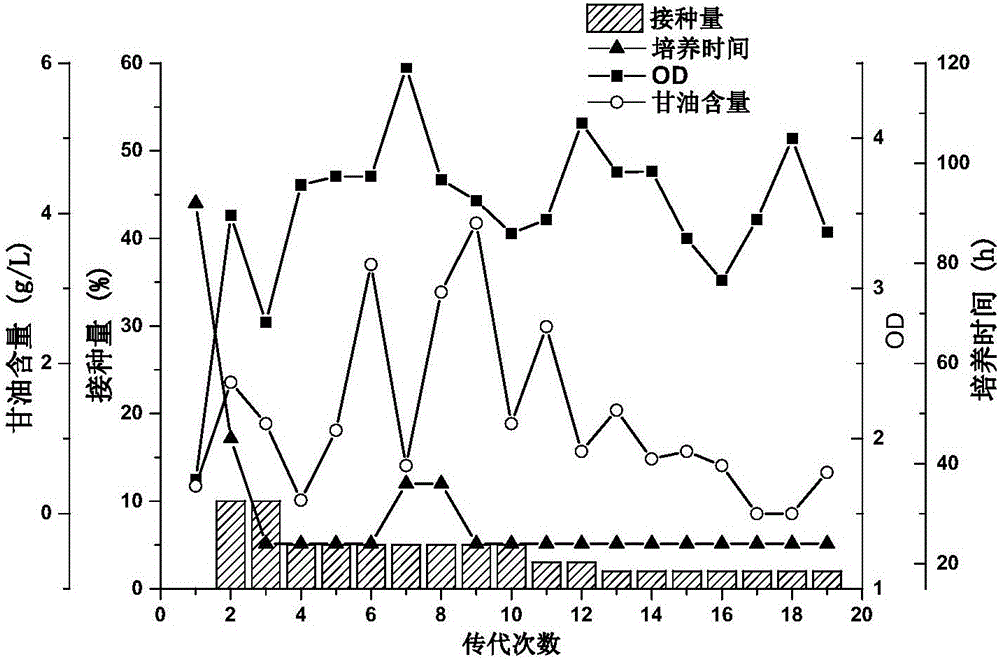
图1为微生物菌群C2-2M传代过程中细胞生长情况;
图2为微生物菌群C2-2M传代过程中代谢产物的变化情况;
图3为微生物菌群C2-2M在不同起始粗甘油浓度下的甘油消耗情况;
图4为微生物菌群C2-2M以底物浓度为100g/L粗甘油的间歇发酵结果;
图5为单菌S1以底物浓度为80g/L粗甘油的间歇发酵结果;
图6为微生物菌群D6以底物浓度为100g/L粗甘油的间歇发酵结果;
图7为微生物菌群C2-2M以纯甘油为底物的连续补料的批式流加发酵结果;
图8为微生物菌群C2-2M以粗甘油为底物的连续补料的批式流加发酵结果;
图9为微生物菌群C2-2M以粗甘油为底物的间歇补料的批式流加发酵结果;
图10为微生物菌群C2-2M以粗甘油为底物不灭菌条件下的批式流加发酵结果。
具体实施方式
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用试剂等均可从化学或生物试剂公司购买。
以下结合技术方案详细叙述本发明的具体实施方式。
1.下述实施例使用的培养基:
种子培养基(g/L):甘油22.0,KH2PO4 1.3,K2HPO4·7H2O 4.5,(NH4)2SO4 2.0,MgSO4·7H2O 0.2,CaCO3 2.0,CaCl2 0.02,L-半胱氨酸盐酸盐0.5,酵母粉1.0。此外,每升培养基中加入2.0mL微量元素A溶液(饱和盐酸0.9mL/L,CuCl2·2H2O 20mg/L,ZnCl2 70mg/L,MnCl2·4H2O 100mg/L,H3BO3 60mg/L,CoCl2·6H2O 200mg/L,NiCl2·6H2O 25mg/L,Na2MoO4·2H2O 35mg/L)和1.0mL Fe2+溶液(饱和盐酸4mL/L,FeSO4·7H2O 5g/L)。
固体培养基(1L):种子培养基中加入琼脂粉15g。
发酵培养基(g/L):甘油40~120,KH2PO4 1.36,(NH4)2SO4 6.61,MgCl2·6H2O 0.26,CaCl2 0.29,柠檬酸0.42,酵母粉2.0,每升培养基中另加入5mL微量元素B溶液(ZnCl20.68g/L,MnCl2·4H2O 0.17g/L,H3BO3 60mg/L,CuCl2·2H2O 0.47g/L,Na2MoO4·2H2O 5mg/L,FeCl2·4H2O 3.97g/L,CoCl2·6H2O 0.47g/L,饱和盐酸10mL/L)。
2.种子培养条件:厌氧培养。采用250mL西林瓶,装液量为100mL。待装入培养基后每瓶持续通3min高纯氮气除氧,之后用丁基胶塞封顶。实验过程中用一次性无菌针管接种及取样,接种量2-10%(v/v),培养温度37℃,摇床转速200r/min,培养时间15~24h。
3.发酵培养条件:采用5L全自动发酵罐,装液量2L,接种量10%(v/v),发酵罐温度37℃,转速250r/min,发酵过程用5M NaOH控制pH为7.0。接种前后1h内通入0.15vvm高纯氮营造罐内厌氧环境。
粗甘油:是油脂水解的产物,组成为(w/w):78%甘油、15~17%水、0.87%灰分、<0.1%游离脂肪酸,pH 6.91。
实施例1 从厌氧活性污泥中筛选驯化产1,3-丙二醇的微生物菌群
取2.0g厌氧活性污泥,接入含22g/L粗甘油的种子培养基中在37℃,200r/min条件下厌氧培养,待培养基甘油消耗殆尽后逐渐减小接种量进行传代培养,经20次传代后菌群生物量与代谢基本达到稳定。自然富集驯化过程如图1和2所示,总体可分为三阶段:初期(2代至4代)、波动期(5代至12代)及稳定期(12代之后)。筛选初期是菌群结构适应培养环境的阶段,可富集到能利用甘油、生长迅速的菌株,淘汰掉不能利用底物、生长缓慢的菌株。随着传代次数的增加,培养时间逐渐由96h下降为24h,OD值由1.7增加至3.5,1,3-丙二醇浓度达到11.5g/L左右。波动期是菌群生长代谢不稳定的阶段,表现为培养时间(延长至36h)、残余甘油量(0.64~3.87g/L)、1,3-丙二醇产量(7.33~11.96g/L)、副产物(乙酸、乳酸、丁酸)产量等均有波动。稳定期是菌群生长代谢趋于稳定的阶段,培养时间重新稳定至24h,残余甘油进一步降低,OD值稳定至3.6上下,1,3-丙二醇产量稳定至12g/L以上,副产物乳酸消失,只剩下少量乙酸和丁酸。第20代菌群被命名为C2-2M。经不断传代C2-2M在种子培养基中可保持稳定生长,发酵时间为24h,OD值稳定至3.6左右,长时间在同一条件下自然富集驯化使微生物菌群组成趋于稳定。在产物分布中,C2-2M以1,3-丙二醇为主要代谢产物,浓度达到12.62g/L,摩尔转化率为0.71mol/mol,已接近理论转化率;副产物种类少,仅为乙酸和丁酸,含量分别为1.15g/L和1.21g/L。
菌群C2-2M 16S rRNA基因经测序及多样性分析,其组成为如下:丁酸梭菌(Clostridium butyricum)97.34%、梭菌属(Clostridium)(非丁酸梭菌)2.64%、乳杆菌属(Lactobacillus)0.02%,其中百分比(%)表示各菌的有效活菌数占微生物菌群C2-2M中总有效活菌数的百分比。所述梭菌属菌株为双酶梭菌(Clostridium bifermentans)与拜氏梭菌(Clostridium beijerinckii)的混合菌,其活菌数比例为0.81:1.83,乳杆菌属菌株为乳杆菌Lactobacillus farraginis与乳杆菌Lactobacillus equicursoris的混合菌,其活菌数比例为0.01:0.01。该混合菌群16S rRNA基因测序得到的原始数据已提交至美国国立生物技术信息中心(National Center of Biotechnology Information,简称NCBI)的Sequence Read Archive(SRA)数据库中,登录号为SRP071045。
经厌氧涂平板从菌群C2-2M中分离得到单菌落S1和S2,经染色镜检,均为革兰氏阳性杆状细菌,单菌落S1和S2的16S rDNA相同,序列经克隆测序及比对后,确定为丁酸梭菌(Clostridium butyricum),其16S rDNA序列见序列表。
以菌群C2-2M为原液,在厌氧环境中用无菌生理盐水进行梯度稀释(10-2~10-7),在稀释至10-6时得到可消耗甘油的含最少菌种种类的微生物菌群D6。经种子培养基培养后进行16S rRNA基因测序及分析,微生物菌群D6由94.92%丁酸梭菌(Clostridium butyricum)及5.08%双酶梭菌(Clostridium bifermentans)组成。
实施例2 厌氧微生物菌群C2-2M对粗甘油的耐受性
将实施例1中获得的混合菌群C2-2M经种子培养基培养后,按10%体积比接种至装有2L发酵培养基的5L发酵罐中培养,每批次发酵的初始甘油浓度由40g/L逐渐提升至140g/L(加入适量粗甘油,配置得到初始甘油浓度为40~140g/L的发酵培养基),如图3所示。发酵结果表明,微生物菌群C2-2M对粗甘油有较强的耐受能力,可在甘油含量为120g/L的粗甘油中生长代谢,1,3-丙二醇浓度达到60.61g/L,摩尔转化率为0.63mol/mol,生产强度为3.79g/(L·h)。相对而言,初始甘油浓度为100g/L时间歇发酵效率较高(如图4所示),此时1,3-丙二醇浓度为51.28g/L,摩尔转化率为0.64mol/mol,生产强度为4.10g/(L·h)。
实施例3 厌氧菌S1以粗甘油为底物的间歇发酵
单菌S1以80g/L粗甘油为底物的发酵结果如图5所示,1,3-丙二醇浓度为44.34g/L,摩尔转化率为0.67mol/mol,生产强度为0.92g/(L·h)。虽然单菌S1发酵粗甘油得到1,3-丙二醇浓度及摩尔转化率与微生物菌群C2-2M发酵水平相近,但发酵时间分别较微生物菌群发酵延长了38h,生产强度仅为微生物菌群发酵的22.4%。这表明微生物菌群C2-2M较单菌具有优良的发酵性能,能耐受较高的甘油浓度,并且发酵时间较短。
实施例4 微生物菌群D6以粗甘油为底物的间歇发酵
将实施例1中所得的厌氧微生物菌群C2-2M在厌氧环境中梯度稀释,稀释至10-6时得到含94.92%丁酸梭菌及5.08%双酶梭菌的微生物菌群D6。经种子培养基培养后,按10%体积比接入至发酵罐中,发酵罐初始粗甘油浓度为100g/L,发酵结果如图6所示。1,3-丙二醇浓度为49.38g/L,摩尔转化率为0.67mol/mol。该水平虽然与初始菌群C2-2M能力相当,但发酵时间较初始菌群C2-2M延长至28h,生产强度降低至1.76g/(L·h)。与原始微生物菌群C2-2M相比,微生物菌群D6发酵粗甘油生产1,3-丙二醇效率明显降低。这表明含有梭菌属(非丁酸梭菌)及乳杆菌属的混合菌A可以提高微生物菌群C2-2M对粗甘油的耐受能力,缩短发酵时间,提高1,3-丙二醇生产强度。
实施例5 厌氧微生物菌群C2-2M以纯甘油为底物的批式流加发酵
将实施例1中获得的混合菌群C2-2M经种子培养基培养后,以10%接种量接入发酵罐中培养,初始纯甘油浓度为80g/L,发酵过程中不断补加纯甘油维持底物浓度为10~25g/L,发酵时间为24h,结果如图7所示。最终1,3-丙二醇浓度为83.71g/L,摩尔转化率为0.65mol/mol,生产强度为3.49g/(L·h)。
实施例6 厌氧微生物菌群C2-2M以粗甘油为底物的连续补料的批式流加发酵
将实施例1中获得的混合菌群C2-2M的种子培养液以10%接种量接入发酵罐中,发酵培养基初始粗甘油浓度为80g/L,发酵过程中不断补加粗甘油维持底物浓度为10~25g/L,发酵时间为24h,发酵结果如图8所示。最终1,3-丙二醇浓度为77.39g/L,摩尔转化率为0.65mol/mol,生产强度为3.22g/(L·h)。这表明微生物菌群C2-2M具有较强的转化粗甘油为1,3-丙二醇的能力。
实施例7 厌氧微生物菌群C2-2M以粗甘油为底物的间歇补料的批式流加发酵
将实施例1中获得的混合菌群C2-2M的种子培养液以10%接种量接入发酵罐中,发酵培养基初始粗甘油浓度为80g/L,发酵过程中当甘油浓度低于15g/L时补充甘油至浓度为80g/L,待甘油浓度再次消耗至20g/L以下时,补充甘油至浓度为40g/L,发酵时间为24h,发酵结果如图9所示。最终1,3-丙二醇浓度为79.78g/L,摩尔转化率为0.65mol/mol,生产强度为3.32g/(L·h)。这表明微生物菌群C2-2M对粗甘油有良好的适应性,其1,3-丙二醇的生产能力不受发酵过程底物浓度剧烈变化影响。
实施例8 厌氧微生物菌群C2-2M以粗甘油为底物在培养基不灭菌条件下批式流加发酵
将实施例1中获得的混合菌群C2-2M种子培养液以10%接种量接入发酵罐中,发酵罐培养基无需灭菌,初始粗甘油浓度为80g/L,发酵过程中不断补入粗甘油维持底物浓度为10~25g/L,发酵时间为24h,发酵结果如图10所示。最终1,3-丙二醇浓度为76.63g/L,摩尔转化率为0.64mol/mol,生产强度为3.19g/(L·h)。这表明不灭菌条件可达到与灭菌条件相同的发酵水平,该过程可节省生产成本。
SEQUENCE LISTING
<110> 大连理工大学
<120> 一种发酵生产1,3-丙二醇的微生物混合菌群及发酵方法
<130> 2011
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 1336
<212> DNA
<213> 丁酸梭菌(Clostridium butyricum)
<400> 1
gagtggatta gcggcggacg ggtgagtaac acgtgggtaa cctgcctcat agaggggaat 60
agcctttcga aaggaagatt aataccgcat atggtagctt tatcgcatgg tagtgctatt 120
aaaggagtaa tccgctatga gatggacccg cgtcgcatta gctagttggt gaggtaacgg 180
ctcaccaagg cgacgatgcg tagccgacct gagagggtga tcggccacat tgggactgag 240
acacggccca gactcctacg ggaggcagca gtggggaata ttgcacaatg ggggaaaccc 300
tgatgcagca acgccgcgtg agtgatgacg gccttcgggt tgtaaaactc tgtctttggg 360
gacgataatg acggtaccca aggaggaagc cacggctaac tacgtgccag cagccgcggt 420
aatacgtagg tggcaagcgt tgtccggatt tactgggcgt aaagggagcg taggtggata 480
tttaagtggg atgtgaaata ctcgggctta acctgggtgc tgcattccaa actggatatc 540
tagagtgcag gagaggaaag gagaattcct agtgtagcgg tgaaatgcgt agagattagg 600
aagaatacca gtggcgaagg cgcctttctg gactgtaact gacactgagg ctcgaaagcg 660
tggggagcaa acaggattag ataccctggt agtccacgcc gtaaacgatg aatactaggt 720
gtaggggttg tcatgacctc tgtgccgccg ctaacgcatt aagtattccg cctggggagt 780
acggtcgcaa gattaaaact caaaggaatt gacgggggcc cgcacaagca gcggagcatg 840
tggtttaatt cgaagcaacg cgaagaacct tacctagact tgacatctcc tgaattactc 900
tgtaatggag gaagccactt cggtggcagg aagacaggtg gtgcatggtt gtcgtcagct 960
cgtgtcgtga gatgttgggt taagtcccgc aacgagcgca acccttattg ttagttgcta 1020
ccatttagtt gagcactcta gcgagactgc ccgggttaac cgggaggaag gtggggatga 1080
cgtcaaatca tcatgcccct tatgtctagg gctacacacg tgctacaatg gtcggtacaa 1140
tgagatgcaa cctcgcgaga gtgagcaaaa ctataaaacc gatctcagtt cggattgtag 1200
gctgaaactc gcctacatga agctggagtt gctagtaatc gcgaatcaga atgtcgcggt 1260
gaatacgttc ccgggccttg tacacaccgc ccgtcacacc atgagagttg gcaataccca 1320
aagttcgtga gctaac 1336
- 还没有人留言评论。精彩留言会获得点赞!