高产白藜芦醇突变体筛选方法的建立与流程
本发明涉及白藜芦醇的生产。具体地,涉及用于白藜芦醇生产的4CL1酶突变体,以及筛选该突变体的调控蛋白TtgR的突变体。
背景技术:
白藜芦醇最初是发现于葡萄、虎杖、花生、桑椹等植物。具有抗菌消炎、抗氧化、抗癌、预防心血管疾病等多种药用价值。目前市场上的白藜芦醇多通过从虎杖中通过化学提取得到。虽然目前已经实现在大肠杆菌及酵母中利用来源于植物的基因合成白藜芦醇。但现有的白藜芦醇检测手段仅限于高效液相色谱,缺乏可视化、高通量的检测筛选方法。无法方便、快捷地将白藜芦醇的产量在微生物细胞的合成中进行产量最大化的优化。
技术实现要素:
本发明通过改造调控蛋白TtgR,使其能够响应白藜芦醇的浓度,从而通过调节lacZ基因的表达,利用蓝白斑的原理,快速高效地筛选出产生白藜芦醇菌株。该方法节省时间,简化了筛选步骤。
一方面,本发明涉及调控蛋白基因ttgR的突变体,其特征在于编码序列如SEQ ID NO:9所示,其编码的氨基酸序列相对于野生型调控蛋白TtgR而言,第38位氨基酸由丙氨酸突变为了苏氨酸,其中所述野生型调控蛋白TtgR由SEQ ID NO:5编码。
在另一方面,本发明涉及4CL1酶的突变体,其特征在于选自由以下各项组成的组:
(1)相对于氨基酸序列由SEQ ID NO:27所示的野生型4CL1而言,第169位氨基酸由Glu突变为Asp,第536位氨基酸由Phe突变为Tyr;
(2)相对于氨基酸序列由SEQ ID NO:27所示的野生型4CL1而言,第48位氨基酸由Ile突变为Ser或Thr,第112位氨基酸由Phe突变为Leu或Ile,Val,Ala,Gly或Trp;
(3)相对于氨基酸序列由SEQ ID NO:27所示的野生型4CL1而言,第250位氨基酸由Ile突变为Leu,Val,Ala或Gly,第404位氨基酸由Asn突变为切s,Arg,Tyr或Phe,第461位氨基酸由Ile突变为Val,Leu,Ala或Gly;
(4)相对于氨基酸序列由SEQ ID NO:27所示的野生型4CL1而言,第31位氨基酸由Asp突变为Thr或Ser,第510位氨基酸由Ser突变为Gln或Asn;
(5)相对于氨基酸序列由SEQ ID NO:27所示的野生型4CL1而言,第221位氨基酸由Met突变为Phe或Tyr;
(6)相对于氮基酸序列由SEQ ID NO:27所示的野生型4CL1而言,第48位氨基酸由Ile突变为Ser或Thr,第112位氨基酸由Phe突变为Leu,Val,Ala或Gly,第169氨基酸由Glu突变为Asp或Glu;第536位氨基酸由Phe突变为Tyr。
在另一个方面,本发明还涉及质粒,其图谱如图1a或图1b所示。
在另一个方面,本发明还涉及上述的调控蛋白基因ttgR的突变体,其在筛选用于提高白藜芦醇产量的4CL1酶突变体或筛选产生白藜芦醇菌株中的应用。
在另一个方面,本发明还涉及一种生产白藜芦醇的方法,其特征在于上
述获得的所述4CL1酶突变体。
在具体的实施方案中,我们在大肠杆菌中利用来自拟南芥(Arabidopsis thaliana)的4CL1(4-coumarate:CoA ligase)基因以及经过优化后的来自酿酒葡萄(Vitis vinifera)的STS(stilbene synthase)基因,以对香豆酸为底物在大肠杆菌BW25113中合成白藜芦醇。再通过改造来源于恶臭假单胞菌(Pseudomonas putida)DOT-TIE的调控蛋白TtgR以及其结合的DNA序列,使其能够当大肠杆菌胞内不生产白藜芦醇时,调控蛋白TtgR结合在相应的DNA序列上,阻遏下游报告基因rfp或者lacZ的表达,而一旦胞内生成了白藜芦醇,白藜芦醇结合到调控蛋白上,使其构象发生改变从结合的DNA上脱落下来,开启了下游报告基因rfp或者lacZ的表达,从而可以转换为肉眼可见的信号。
TtgR调控蛋白为恶臭假单胞菌(Pseudomonas putida)DOT-TIE中调控外排泵基因ttgABC及其自身表达的调控蛋白,其多形成二聚体结合在PttgR以及PttgABC启动子区域,该启动子区域有一部分反向互补。该调控蛋白已被证实可结合四环素、氯霉素等抗生素,以及根皮素、槲皮素等黄酮类化合物。我们首次对其结合的启动子区域PttgABC改造使其能够在大肠杆菌中正常启动下游基因的表达以及对调控蛋白进行改造使其能够灵敏的响应白藜芦醇,且有剂量依赖性。
关于氨基酸,本领域的普通技术人员了解,根据氨基酸的性质和结构,对20种基本氨基酸进行了分类。其中甘氨酸,丙氨酸,缬氨酸,亮氨酸和异亮氨酸同属于含一氨基一羧基的中性氨基酸;丝氨酸和苏氨酸同属于羟基氨基酸;赖氨酸和精氨酸同属于碱性氨基酸。
附图说明
图1:质粒pTtg与pTtgR的图谱。
图2:显示调控蛋白TtgR对报告基因rfp红色荧光蛋白表达的影响,其中图2a显示在没有调控蛋白的情况下,rfp在PttgABC2的调控下表达正常。图2b显示当调控蛋白TtgR连接到质粒上时,TtgR能正常结合到PttgABC2序列上,抑制了rfp的表达,从而菌落为白色。
图3:显示外加不同浓度的白藜芦醇(Resveratrol)分别对于TtgR野生型和TtgRmu3情况下报告基因rfp荧光强度的诱导曲线。
图4:白藜芦醇生产途径。
图5:白藜芦醇生产途径中用到的质粒pGAP-STS-4CL图谱。
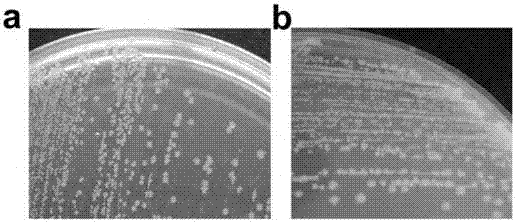
图6:平板上筛选高产白藜芦醇突变体,如图指示最蓝的单克隆为高产白藜芦醇突变体,如箭头所示。
图7:4CL1野生型与突变体白藜芦醇产量
具体实施方式
虽然本发明已对其具体实施方式进行描述,然而某些修改和等同物对于本领域技术人员是显而易见的,并且旨在包括在本发明的范围之内。
通过以下实施例对本发明进行阐述,以下实施例不以任何方式限制本发明。
实施例1.pTtg以及pTtgR质粒的构建。
以DsRed载体(Clontech公司,产品编号632412)为模板,以5’-cacccgcggcagcagtatttacaaacaaccatgaatgtaagtataatccgtgtggaattgtgagcggataa-3’(forward primer,SEQ ID NO:1)和5’-ctgccgcgggtgcctaatgagtgagctaac-3’(reverse primer,SEQ ID NO:2)为引物进行PCR扩增。PCR体系:引物各0.2μM,dNTPs 0.2mM,模板10ng,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,去离子水将体积补至50μL。PCR反应条件为:94℃30s,50℃30s,72℃1min,以上程序30个循环。得到的PCR产物用SacII进行酶切后,用T4DNA连接酶(购自NEB公司)4℃连接4h,连接产物转入大肠杆菌MC1061(全式金公司),获得重组菌。提取重组菌的质粒得到pTtg,质粒图谱如图1a。
按常规方法,提取恶臭假单胞菌(Pseudomonas putida)DOT-TIE(ATCC)基因组作为模板,以5’-gcacatatggtccgtcgaaccaaagaag-3’(forward primer,SEQ ID NO:3)和5’-agagagctctcatttgcgcagagccgggc-3’(reverse primer,SEQ ID NO:4)为引物扩增ttgR基因(SEQ ID NO:5)。得到的PCR产物用NdeI和SacI酶切,用T4DNA连接酶连接到经过相同酶切的pTtg质粒(已有组成型启动子CP6,将ttgR插入到CP6后)。连接产物转入大肠杆菌MC1061,获得重组菌。提取重组菌的质粒得到pTtgR,质粒pTtgR示意图如图1b所示。SEQ ID NO:6为pTtgR的序列,142-181bp为TtgR的结合区域,其中包含调控报告基因的启动子序列PttgABC2,288-979bp为红色荧光蛋白rfp的基因序列,1255-1887bp为调控蛋白TtgR基因的反向互补序列,1924-1983bp为组成型启动子PCP6的反向互补序列。
将pTtg与pTtgR质粒分别转入大肠杆菌BW25113,涂布含有氨苄青霉素抗性的LB平板,37℃培养过夜。如图2a所示的是在没有调控蛋白TtgR的情况下,pTtg质粒中rfp在没有调控蛋白TtgR的情况下组成型表达。当把调控蛋白TtgR连接到质粒上时(即所述pTtgR质粒),TtgR能正常结合到PttgABC2序列上,抑制了RFP的表达,从而菌落为白色,如图2b。
实施例2.ttgR突变体mu3
用引物5’-gcacatatggtccgtcgaaccaaagaag-3’(forward primer,SEQ ID NO:7),5’-agagagctctcatttgcgcagagccgggc-3’(reverase primer,SEQ ID NO:8)对ttgR基因(SEQ ID NO:5)进行易错PCR。易错PCR体系为0.2mM dATP,1mM dCTP,1mM dTTP,0-0.025mM MnCl2,10×PCR Buffer 10μL,rTaq 0.5μL,去离子水将体积补至100μL。易错PCR反应条件为:94℃30s,50℃30s,72℃1min,以上程序30个循环。
得到的PCR产物以pTtgR(SEQ ID NO:6)为模板进行MEGAWHOPE PCR,反应体系为:上述通过易错PCR得到的PCR产物0.2μg,dNTPs 1mM,模板pTtgR 30ng,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,去离子水将体积补至50μL。PCR反应条件为:94℃30s,50℃30s,72℃2min,以上程序30个循环。得到的PCR产物加入DpnI(20U)在37℃酶切2h后,DpnI在80℃失活20min。得到ttgR易错突变体库(突变质粒混合物)。
利用流式细胞分选仪对易错突变体库筛选,我们得到了调控蛋白基因ttgR的突变体TtgRmu3(在本文中有时也表示为突变体mu3,SEQ ID NO:9),经测序该突变体的相对于TtgR而言,第38位氨基酸由丙氨酸(GCC)突变为了苏氨酸(ACC)。
实施例3.构建含有质粒pTtgR或者pTtgRmu3的重组菌BW25113
BW25113(全式金公司)野生型菌株感受态,分别转化pTtgR质粒或者pTtgRmu3(其为实施例2筛选突变体mu3进行的易错PCR过程中得到的质粒,在PCR过程中,pTtgR质粒中的TtgR替换为mu3),得到含有质粒pTtgR或者pTtgRmu3的重组菌BW25113。
实施例4.验证白藜芦醇对突变体mu3的影响
将白藜芦醇溶于二甲基亚砜(DMSO),浓度为0.1mM。
挑取实施例3制备的含有质粒pTtgR或者pTtgRmu3的重组菌BW25113单克隆于含有100μg/mL氨苄青霉素的3mL LB培养基中,37℃摇床培养过夜后作为种子液。
第二天按接种量1%进行转接,终OD600约为0.02,加入诱导物白藜芦醇。37℃摇床中培养12h后分别取200μL用酶标仪读取OD600与报告基因rfp表达的荧光强度(检测条件为激发波长556nm,发射波长586nm)。结果如图3所示。
图3为初始加入不同浓度的白藜芦醇诱导物后,检测报告基因rfp表达的荧光强度曲线。其中突变体mu3本底渗漏低并且最大诱导倍数可达363倍。
由此可知,该突变体TtgRmu3相比于野生型TtgR而言,对白藜芦醇可进行响应。
实施例5.利用突变体mu3筛选4CL1易错突变库
利用引物5’-ccgggtaccaatgaccatgattacggattc-3’(forward primer,SEQ ID NO:10),5’-tggagatctttatttttgacaccagaccaac-3’(reverse primer,SEQ ID NO:11)从大肠杆菌MG1655(全式金公司)基因组中扩增出lacZ基因,PCR体系:引物各0.2μM,dNTPs 0.2mM,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,0.5μL MG1655的菌液(沸水煮5min),去离子水将体积补至50μL。PCR反应条件为:94℃30s,50℃30s,72℃1min,以上程序30个循环。得到的lacZ PCR片段用KpnI,BglII酶切后,用T4DNA连接酶连接到经过相同酶切的pTtgRmu3质粒上。由此将pTtgRmu3中的报告基因rfp换成lacZ,用引物5’-ctctagataaggaggaaaaactcgagagcgcccaatacgc-3’(forward primer,SEQ ID NO:12),5’-ctcggtacccggggatccgctctcgaggtcgacggtatcg-3’(reverse primer,SEQ ID NO:13)对其进行PCR扩增,得到的PCR产物大小为4470bp。
引物5’-cgataccgtcgacctcgagagcggatccccgggtaccgag-3’(forward primer,SEQ ID NO:14)与5’-gcgtattgggcgctctcgagtttttcctccttatctagag-3’reverse primer,SEQ ID NO:15)对pAH1561进行PCR扩增,得到的PCR产物大小为2264bp。
上述两个PCR反应中的PCR体系:引物各0.2μM,模板30ng,dNTPs0.2mM,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,去离子水将体积补至50μL。PCR反应条件为:94℃30s,50℃30s,72℃2min,以上程序30个循环。
上述两个PCR反应得到的两段PCR片段利用Gibbson组装2。由此构建得到的质粒在pAH691质粒的帮助下将PttgABC2-lacZ与CP6-TtgRmu3这一段基因插入到大肠杆菌感受态细胞BW25113(实施例3中所制备的BW25113)中,得到重组菌M3。
采用的白藜芦醇生产途径如图4,以对香豆酸为底物,通过4CL酶催化形成对香豆辅酶A,再在STS的作用下生成白藜芦醇。(白藜芦醇的具体生产过程如下:生产过程与下述的白藜芦醇产量复验相同)
白藜芦醇生产途径:质粒pGAP-STS-4CL转入大肠杆菌感受态细胞重组菌M3(如上所述制备)中,涂布含有硫酸卡那霉素(50μg/mL)的平板,37℃培养过夜后挑取单克隆到LB试管中,37℃摇床培养12h作为种子液。以1%接种量转接到LB培养基(初始加入终浓度10mM的对香豆酸)中,终OD600约为0.01,30℃摇床培养24h后,取500μL加入等体积的无水乙醇,涡旋震荡30s后离心,取上清,用0.22μm膜过滤后,2μL进样高效液相色谱(HPLC)检测。HPLC检测条件:水相C18柱(250×4.6mm,5μm),35%乙腈(含0.1%甲酸)以0.5mL/min流速在柱温35℃的条件下进行分离。对香豆酸与白藜芦醇的检测波长均为305nm。
来源于拟南芥Arabidopsis thaliana的4CL1基因(SEQ ID NO:16),利用引物5’-ctaaaaggagaagcttatggcgccacaagaac-3’(forward primer,SEQ ID NO:17),5’-accgagctctcacaatccatttgctag-3’(reverse primer,SEQ ID NO:18)从拟南芥cDNA中扩增得到。PCR反应体系为:2×KOD Buffer 25μL,dNTPs 0.2mM,引物各0.2μM,cDNA 50ng,KOD Fx 1μL,去离子水将体积补至50μL。反应条件为98℃10s,60℃1.0min,重复30个循环。
图5为白藜芦醇生产途径的质粒pGAP-STS-4CL,相应的序列为SEQ ID NO:19,其中104-440bp为组成型启动子GAP,利用引物5’-caaggtaccttgctcacatctcactttaatc-3’(forward primer,SEQ ID NO:20),5’-cgccatatggttcctcctagctatttgttagtgaataaaag-3’(reverse primer,SEQ ID NO:21)从大肠杆菌MG1655基因组中扩增出来,得到的PCR产物用KpnI与NdeI进行双酶切后连接到同样经过双酶切的表达载体pSB3K53上;447-1625bp为优化后的来源于酿酒葡萄Vitis vinifera的STS基因(苏州金唯智生物科技有限公司合成,SEQ ID NO:22),用5’-aaccatatggcgagcgttgaagagtttcg-3’(forward primer,SEQ ID NO:23),5’-cataagcttctccttttagttggttaccattggg-3’(reverse primer,SEQ ID NO:24)扩增苏州金唯智公司提供的含有STS基因的质粒,PCR体系:引物各0.2μM,模板10ng,dNTPs 0.2mM,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,去离子水将体积补至50μL。PCR反应条件为:94℃30s,50℃30s,72℃1min,以上程序30个循环。
扩增的PCR产物(即STS基因)与之前从拟南芥cDNA中扩增出来的4CL1片段进行重叠扩增,PCR体系:两段PCR产物等摩尔加入,dNTPs 0.2mM,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,去离子水将体积补至50μL。94℃30s,50℃30s,72℃1min,以上程序10个循环后,向PCR体系中补加dNTPs 0.1mM,10×Pyrobest Buffer 5μL,引物5’-aaccatatggcgagcgttgaagagtttcg-3’(forward primer,SEQ ID NO:25),5’-accgagctctcacaatccatttgctag-3’(reverse primer,SEQ ID NO:26)各0.2μM,Pyrobest 0.3μL,去离子水将体积补至100μL。得到的PCR产物用NdeI与SacI进行双酶切,已经插入启动子GAP的pSB3K53质粒同样用NdeI与SacI进行双酶切,酶切后的片段进行酶连得到质粒pGAP-STS-4CL,1638-3323bp为来源于拟南芥Arabidopsis thaliana的4CL1基因(SEQ ID NO:16,其编码的氨基酸序列如SEQ ID NO:27所示)。
用引物5’-ctaaaaggagaagcttatggcgccacaagaac-3’(forward primer,SEQ ID NO:25),5’-accgagctctcacaatccatttgctag-3’(reverse primer,SEQ ID NO:26)对从拟南芥中扩增的4CL1基因进行易错PCR,PCR反应体系为:0.2mM dATP,1mM dCTP,1mM dTTP,0-0.025mM MnCl2,10×PCR Buffer 10μL,rTaq 0.5μL,模板为pGAP-STS-4CL50ng,去离子水将体积补至100μL。易错PCR反应条件为:94℃30s,50℃30s,72℃1min,以上程序30个循环。得到的PCR产物以pGAP-STS-4CL为模板进行MEGAWHOPE PCR。PCR反应体系为:上述通过易错PCR得到的PCR产物0.2μg,dNTPs 1mM,模板pTtgR 30ng,10×Pyrobest Buffer 5μL,Pyrobest 0.3μL,去离子水将体积补至50μL。PCR反应条件为:94℃30s,50℃30s,72℃2min,以上程序30个循环。得到的PCR产物加入DpnI(20U)在37℃酶切2h后,DpnI在80℃失活20min。得到4CL1易错突变体库(突变质粒混合物)。将得到的4CL1突变体库质粒转入大肠杆菌感受态细胞重组菌M3(如上述制备)中,37℃复苏后取适量的体积(保证平板上菌落分散均匀)涂布到筛选平板上,37℃培养箱培养19h后挑取颜色最蓝的菌落复验白藜芦醇的产量,如图6。经过上述实验,分别筛选得到突变体质粒pGAP-STS-4CL11B1,pGAP-STS-4CL12A3,pGAP-STS-4CL12E3,pGAP-STS-4CL12L1,pGAP-STS-4CL13M6,pGAP-STS-4CL14A3,pGAP-STS-4CL14G8,pGAP-STS-4CL14H2,pGAP-STS-4CL15I7,pGAP-STS-4CL1EL。其中筛选平板配方为LB加上1%的琼脂糖,终浓度10mM对香豆酸(阿拉丁公司),50μg/mL硫酸卡那霉素与20μg/mL的X-gal。
白藜芦醇产量复验:突变体质粒pGAP-STS-4CL11B1,pGAP-STS-4CL12A3,pGAP-STS-4CL12E3,pGAP-STS-4CL12L1,pGAP-STS-4CL13M6,pGAP-STS-4CL14A3,pGAP-STS-4CL14G8,pGAP-STS-4CL14H2,pGAP-STS-4CL15I7,pGAP-STS-4CL1EL分别导入大肠杆菌感受态细胞重组菌M3(如上述制备)中,涂布含有硫酸卡那霉素(50μg/mL)的平板,37℃培养过夜后挑取单克隆到LB试管中,37℃摇床培养12h作为种子液。以1%接种量转接到LB培养基(初始加入终浓度10mM的对香豆酸)中,终OD600约为0.01,30℃摇床培养24h后,取500μL加入等体积的无水乙醇,涡旋震荡30s后离心,取上清,用0.22μm膜过滤后,2μL进样高效液相色谱(HPLC)检测。HPLC检测条件:水相C18柱(250×4.6mm,5μm),35%乙腈(含0.1%甲酸)以0.5mL/min流速在柱温35℃的条件下进行分离。对香豆酸与白藜芦醇的检测波长均为305nm。
通过上述实验筛选,得到产量较野生型4CL1高的突变体,例如1B1、2A3、2E3、2L1、3M6、4A3、4G8、4H2、5I7、EL,其对白藜芦醇产量分别如图7所示。相对于野生型4CL1(SEQ ID NO:16,编码的氨基酸序列如SEQ ID NO:27所示)而言,上述4CL1各突变体的突变位点如下:
参考资料:
1.Haldimann,A.;Wanner,B.L.,Conditional-replication,integration,excision,and retrieval plasmid-host systems for gene structure-function studies of bacteria.Journal of bacteriology 2001,183(21),6384-6393.
2.Gibson,D.G;Young,L.;Chuang,R.Y.;Venter,J.C;Hutchison,C.A.;Smith,H.O.,Enzymatic assembly of DNA molecules up to several hundred kilobases.Nature methods 2009,6(5),343-U41.
3.Shetty,R.P;Endy,D.;Knight,T.F.,Jr.,Engineering BioBrick vectors from BioBrick parts.J Biol Eng 2008,2,5.
- 还没有人留言评论。精彩留言会获得点赞!